| Issue |
Med Sci (Paris)
Volume 40, Number 4, Avril 2024
|
|
|---|---|---|
| Page(s) | 351 - 360 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024037 | |
| Published online | 23 April 2024 | |
Vers un diagnostic biologique sanguin de la maladie d’Alzheimer ?
On the road to biological blood diagnosis of Alzheimer’s disease?
1
LBPC-PPC, Université Montpellier, CHU Montpellier, INM Inserm U1298, Montpellier, France
2
Hospital de la Santa Creu i Sant Pau - Biomedical Research Institute Sant Pau - Universitat Autònoma de Barcelona, Barcelone, Espagne
*
s-lehmann@chu-montpellier.fr
Le nombre croissant de personnes atteintes de la maladie d’Alzheimer (MA) représente un problème majeur de santé publique. Le diagnostic de la MA est multidisciplinaire et intègre des marqueurs biologiques dosés dans le liquide cérébrospinal1. Les progrès techniques et analytiques récents permettent de disposer désormais de nouveaux biomarqueurs sanguins prometteurs pour la détection précoce et peu invasive de la MA, mais aussi pour le diagnostic différentiel de la démence et pour le suivi des patients. L’objectif de cette synthèse est de fournir une vue d’ensemble des biomarqueurs sanguins actuels et candidats de la MA, de leur valeur informative et de leur potentiel à être intégrés prochainement à la pratique clinique.
Abstract
The growing number of people suffering from Alzheimer’s disease (AD) represents a major public health problem. The diagnosis of AD is multidisciplinary and involves the use of amyloid and tau biomarkers measured in cerebrospinal fluid. Recent advances in analytical techniques now allow us to measure these biomarkers in blood. Blood biomarkers offer particularly promising potential for early, minimally invasive detection of AD, as well as for differential diagnosis of dementia and patient follow-up. The aim of this review is to provide an overview of current and candidate blood biomarkers for AD, their informative value, and their potential to be integrated into clinical practice in the near future.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Constance Delaby).
La maladie d’Alzheimer (MA) est la cause la plus fréquente de démence dans le monde et devrait toucher plus de 100 millions de personnes d’ici à 2050 [2]. En raison de sa proximité anatomique avec le cerveau et de ses concentrations élevées en protéines d’origine neuronale, le liquide cérébrospinal (LCS) a initialement focalisé les tentatives d’identification de marqueurs liquidiens des maladies neurologiques. La détection de tels biomarqueurs dans ce liquide biologique (tels que les peptides amyloïdes [Ab1-42 et Ab1-40], la protéine tau totale et la protéine phospho-tau [p-tau]) s’est ainsi révélée d’une grande utilité diagnostique, bien que parfois limitée par la nature invasive que représente la ponction lombaire nécessaire. Les protéines ou peptides produits par le cerveau aboutissent dans la circulation sanguine après leur traversée de la barrière hémato-encéphalique (BHE) et par le drainage veineux du LCS. Le développement de nouvelles approches analytiques (telles que les immunodétections ultrasensibles et la spectrométrie de masse quantitative) ont ouvert la voie à la mesure des biomarqueurs protéiques neuronaux dans le sang, surmontant ainsi la limite liée à leur faible concentration dans cette matrice complexe. Bien que parfois très prometteurs, seuls quelques biomarqueurs sanguins ont démontré une valeur prédictive suffisante pour être utilisés en pratique médicale, en particulier dans le contexte de la MA. Ces biomarqueurs, définis comme des indicateurs mesurables d’un état ou d’une condition biologique, peuvent ainsi être classés en quatre groupes (Figure 1) : 1) ceux liés au processus pathologique résultant de l’altération du métabolisme des protéines amyloïdes et tau, et responsable de la présence de plaques séniles et de dégénérescences neurofibrillaires (DNF) dans le parenchyme cérébral ; 2) ceux liés à la perte neuronale et aux phénomènes neurodégénératifs ; 3) ceux résultant de la réaction des cellules impliquées dans le processus pathologique, principalement les cellules microgliales et gliales ; et, enfin, 4) ceux témoins de la tentative de l’organisme de rétablir l’homéostasie. Dans cette revue, nous donnons un aperçu de ces biomarqueurs sanguins, candidats informatifs pour le diagnostic ou le pronostic de la MA.
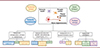 |
Figure 1. Les biomarqueurs sanguins de la maladie d’Alzheimer ont été classés selon deux critères interdépendants. Sont indiqués, leur degré de relation avec le processus pathologique spécifique et leur utilisation dans différents contextes : recherche clinique, en jaune ; recherche translationnelle, en bleu ; essais cliniques, en vert ; pratique clinique, en rose. |
Les biomarqueurs liés au processus pathologique : amyloïdes et tau
Protéine précurseur de l’amyloïde, peptides et oligomères Ab
Le clivage combiné par les γ- et β-sécrétases de la protéine précurseur de l’amyloïde (APP) aboutit à la formation des peptides bêta-amyloïdes (Aβ) et d’un fragment extracellulaire soluble, appelé sAPPβ. Dans un métabolisme alternatif, non amyloïdogène, l’APP est clivé par l’α-sécrétase, libérant ainsi un fragment sAPPα impliqué dans la croissance neuronale et la synaptogenèse [3].
L’accumulation progressive de peptides bêta-amyloïdes dans le cerveau débute, chez les patients, plusieurs décennies avant l’apparition des symptômes cognitifs. La mesure, dans le LCS, de la concentration de ces peptides, en particulier Aβ1-42 et Aβ1-40, fait partie intégrante des nouveaux critères de diagnostic de la MA [4, 5]. Leur taux dans le LCS est en effet corrélé à la charge amyloïde cérébrale (selon l’imagerie TEP [tomographie par émission de positrons]). Le ratio entre Ab1-42 et Ab1-40 permet d’ailleurs d’accroître la confiance dans le diagnostic biologique de la MA [6, 7].
L’évaluation de la présence des peptides Aβ reste plus difficile dans le sang que dans le LCS, en raison de leur concentration qui y est 100 fois plus faible. Cependant, des dosages immunologiques ultrasensibles et la spectrométrie de masse ont permis de surmonter cette limite, et des concentrations sanguines d’Ab1-42 et un ratio Ab1-42/Ab1-40 réduits, en particulier à un stade précoce de la maladie [8], ont pu être mis en évidence. Les peptides amyloïdes sont l’un des trois critères de la signature de l’AT(N) (amyloid, tau, neurodegeneration, N, pour neurodégénérescence), permettant de différencier effectivement les patients présentant des signes physiopathologiques de la MA [9]. L’utilisation du peptide Aβ à des fins cliniques s’est précisée récemment avec l’approbation par la FDA (Food and drug administration) américaine d’un test utilisant la spectrométrie de masse, qui pourrait être le premier test de dépistage sanguin permettant de prédire les résultats de la charge amyloïde cérébrale [10]. Notons que la spectrométrie de masse est une approche dont la précision analytique est plus importante que celle de l’immunodétection. De fait, les faibles différences de concentration de peptides Ab que l’on observe chez les patients par immunodétection risquent d’en limiter l’utilisation clinique de routine. Les peptides amyloïdes sont en effet également produits en périphérie, notamment par les plaquettes sanguines. Les variations de concentration liées à la maladie d’Alzheimer, qui sont importantes au niveau du LCS, seront donc beaucoup moins marquées au niveau sanguin. Ces variations périphériques, non liées à la maladie d’Alzheimer, mais en relation, par exemple, avec l’administration d’un médicament [11], risquent de réduire la spécificité du test sanguin. À l’échelle d’une population importante, les performances diagnostiques ciblant les peptides Ab pourraient donc être moindres. Il est néanmoins possible que des méthodes analytiques très précises (telle que la spectrométrie de masse) permettent de limiter cet écueil. Les peptides Aβ peuvent également être présents dans de nombreux compartiments cytosoliques, et le niveau des peptides Aβ1-42 associés aux exosomes est fortement corrélé à la charge amyloïde cérébrale, en particulier au niveau des régions cingulaires où l’Aβ se dépose au cours des stades précoces de la maladie. La mesure des Ab associés aux exosomes pourrait donc présenter un intérêt diagnostique important, mais la préparation pré-analytique nécessaire à la purification de ces exosomes reste peu envisageable en pratique médicale de routine [12, 13].
Outre les peptides Aβ monomériques, les oligomères Aβ plasmatiques (OAβ) se sont récemment révélés être des marqueurs d’un statut amyloïde anormal, avec une corrélation négative avec le test MMSE (mini-mental state examination) et les concentrations de Aβ1-42 dans le LCS de patients atteints de la MA [14]. Cependant la détection de ces isoformes, qui est plus difficile et plus variable que pour les formes monomériques, n’est pas utilisée actuellement pour des applications cliniques.
Protéine tau totale (t-tau) et protéine tau phosphorylée (p-tau)
Les fonctions physiologiques de la protéine tau sont nombreuses. Elles comprennent la stabilisation et la polymérisation des microtubules, la régulation du transport axonal et la croissance des axones. Dans des conditions physiologiques, la phosphorylation de la protéine tau module son association avec les microtubules, mais une phosphorylation excessive entraîne, au cours du processus de vieillissement physiologique, mais aussi dans des situations pathologiques telles que les tauopathies, l’agrégation de la protéine et la formation d’enchevêtrements neurofibrillaires (ou dégénérescence neurofibrillaire, DNF). Le niveau de protéine tau totale (t-tau) dans le LCS est élevé dans la MA (aux stades prodromique1 et de démence) [15], mais aussi dans d’autres contextes cliniques, ce qui limite la spécificité de ce biomarqueur pour la MA. Les niveaux de t-tau dans le plasma et dans le LCS sont faiblement corrélés. Notons que les tissus périphériques produisent une isoforme de tau (un peu plus grande), et que la détection de la protéine tau totale sanguine est, en conséquence, peu informative. La détection d’une protéine tau totale spécifiquement cérébrale (brain-derived tau) [16] pourrait par contre présenter un intérêt.
Dans le LCS, la concentration de protéine tau phosphorylée en position 181 (ou p-tau(181)) est élevée dans la MA (stades précoces et de démence) et les taux de ce biomarqueur dans le LCS et le plasma sont fortement corrélés entre eux [17]. Les valeurs dans le plasma sont systématiquement associées aux charges amyloïde et de tau cérébrales (révélées par TEP). Ce biomarqueur permet donc de prédire la présence d’un profil pathologique dans le LCS [18]. D’autres sites hyperphosphorylés de tau (en position 217 et 231 en particulier) ont été décrits [19], avec une augmentation de la concentration de p-tau(217) plasmatique plus importante que celle de p-tau(181) chez les patients « amyloïde positifs » [20]. Les taux de l’isoforme p-tau(231) augmentent plus précocement que ceux de l’isoforme p-tau(181), faisant de ce biomarqueur un outil prometteur pour le diagnostic précoce de la MA. La concentration de p-tau est le deuxième critère de la signature AT(N) sanguine, facilitant potentiellement, en particulier pour l’isoforme p-tau(217), le diagnostic précoce et le suivi des patients atteints de MA grâce à une approche aisée et peu invasive. Notons que certains sites de modification post-traductionnelle de tau semblent être associés à la fois à une activité de nucléation accrue de la protéine et à des formes cliniques de la MA d’évolution variable [21]. Les approches analytiques fondées sur la RTQuic (real-time quaking-induced conversion) ou sur l’utilisation d’anticorps reconnaissant des épitopes conformationnels, pourraient permettre, dans un avenir proche, de caractériser et de doser ces isoformes pour le diagnostic ou le pronostic de la MA.
Biomarqueurs de neurodégénérescence
Les neurofilament light chain proteins
Les NfL (neurofilament light chain proteins) sont des protéines spécifiquement produites par les neurones, qui sont libérées dans le LCS et le sang en cas de souffrance axonale. Les concentrations de NfL sont corrélées dans le sang et dans le LCS. Il est donc envisageable de suivre ce biomarqueur de façon peu invasive (par ponction veineuse) dans un large spectre de maladies neuro-dégénératives, dont la MA. Les NfL sanguines représentent par ailleurs le troisième critère de la signature AT(N) pour le diagnostic de la MA. L’utilité de son dosage dans ce contexte clinique est cependant différente de celle des autres paramètres A (amyloid) et T (tau) [9]. Le dosage des NfL semble être particulièrement intéressant dans le contexte des formes génétiques de la MA ou dans d’autres maladies telles que la trisomie 21 pour laquelle les patients ont un risque élevé de développer la MA en raison de la surexpression du gène codant la protéine précurseur des peptides amyloïdes (APP) localisé sur le chromosome 21, afin de prédire le passage vers une forme symptomatique de la maladie [22]. Notons que dans le domaine des démences, une application de ce dosage des NfL existe pour différencier la démence fronto-temporale et le trouble psychiatrique primitif [23].
La S100b et la NSE
L’intérêt clinique des protéines neuronales S100b (S100 calcium-binding protein B) ou NSE (neuron-specific enolase) concerne essentiellement le suivi des traumatismes crâniens. Le niveau de S100b dans le LCS est néanmoins corrélé à l’atrophie cérébrale chez les patients présentant une MA et sa concentration sanguine est réduite chez ces patients, faisant de cette protéine un biomarqueur potentiel de la MA [24]. Son intérêt semble cependant limité par rapport aux autres biomarqueurs existants. En revanche, chez ces patients, les taux sanguins de NSE restent inchangés.
Les biomarqueurs réactionnels
Les biomarqueurs de la neuro-inflammation
GFAP
La GFAP (glial fibrillary acidic protein) est un marqueur d’activation astrocytaire qui est lié à la neuro-inflammation. Bien que ce marqueur ne soit pas spécifiquement lié à la neuropathologie de la MA, son dosage sanguin a révélé une très bonne association avec l’amyloïdopathie cérébrale et avec la MA [25]. Les mécanismes liant une augmentation de la GFAP et une amyloïdopathie restent cependant à préciser. La combinaison de ce marqueur avec l’évaluation de la concentration de p-tau dans le sang apporterait sans doute un plus pour le diagnostic et le pronostic de la MA [26].
TREM2
L’activation des cellules microgliales par les peptides Aβ joue un double rôle dans la MA : elle favorise le processus neuro-inflammatoire à l’origine de la neuro-dégénérescence, et elle promeut la réponse anti-inflammatoire (par phagocytose et dégradation des peptides Aβ) (Figure 2) [27]. La protéine TREM2 (triggering receptor expressed on myeloid cells 2) jouerait un rôle important dans cette activité anti-inflammatoire, et la libération du produit de clivage soluble (sTREM2) dans le LCS et le sang pourrait être informative de l’atteinte microgliale et de la neuro-inflammation, en particulier dans le contexte de la MA [28, 29]. Cependant, les variations de concentrations observées dans le sang des patients ne semblent pas être suffisamment reproductibles et différentielles pour envisager une utilisation clinique.
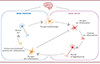 |
Figure 2. La pathogénèse de la maladie d’Alzheimer s’accompagne d’un processus neuro-inflammatoire, dont les effets pour le cerveau peuvent être bénéfiques (anti-inflammatoires) ou néfastes (pro-inflammatoires). |
YKL-40
YKL-40 (ou CHI3L1, aka chitinase 3-L1) est une protéine de phase aiguë. Elle est sécrétée en réponse à la libération de cytokines pro-inflammatoires, telles que le TNF-α (tumor necrosis factor alpha), l’INF(interféron)-g, l’IL(interleukine)-1b ou l’IL-6, et s’accumule dans le cerveau des patients présentant une MA, à proximité des plaques amyloïdes. Le taux sanguin de YKL-40 est corrélé à sa concentration dans le LCS. Il augmente proportionnellement à l’évolution clinique des patients présentant une MA [30]. YKL-40 n’est cependant pas spécifique de la MA, et même si ses performances diagnostiques sont améliorées par la combinaison avec d’autres biomarqueurs (comme Aβ1-42, t-tau et p-tau), sa mesure n’entre pas dans les marqueurs sanguins d’usage clinique.
Les cytokines et les chimiokines
La neuro-inflammation caractéristique de la MA résulte de l’activation microgliale et de la production de cytokines pro-inflammatoires [31]. Cette activation semble avoir des rôles contrastés, en aggravant d’une part la neuropathologie, et en participant d’autre part à la clairance des peptides Aβ (Figure 2). De nombreuses études se sont focalisées sur l’identification de cytokines sériques comme signature de la MA. Parmi les cytokines décrites, le TNF-α et la voie de signalisation TNF-α/récepteur du TNF-α semblent être associés à l’évolution de la MA [32]. Quoi qu’il en soit, à l’heure actuelle, aucun kit qui représenterait une plus-value diagnostique ou pronostique de la MA n’a été validé.
Les autres biomarqueurs réactionnels
α- et β-synucléine
Différentes études suggèrent une implication de la protéine présynaptique α-synucléine (αSyn) dans la physiopathologie de la MA. Mais les résultats sont peu cohérents et restent peu différentiels entre les patients [33].
En revanche, la protéine présynaptique β-synucléine (βSyn) présenterait un intérêt comme biomarqueur sanguin précoce et pronostique de la MA : sa concentration sanguine est en effet significativement plus élevée chez les patients atteints de MA, ou chez les adultes présentant une trisomie 21. La concentration sanguine de βSyn est augmentée dès le stade préclinique de la MA, plus tôt que celle de la p-tau(181), ce qui confirme son intérêt diagnostique et pronostique précoce. Enfin, les taux sanguins de βSyn sont corrélés aux troubles cognitifs et à l’atrophie cérébrale dans la MA, ce qui indique son association avec la sévérité de la maladie [34].
La neurogranine
La neurogranine est une protéine synaptique qui est clivée en peptides, eux-mêmes libérés dans le LCS et dans le plasma (véhiculés par des exosomes). Ce biomarqueur pourrait être informatif dans la MA, y compris au stade précoce, son taux dans les exosomes sanguins étant corrélé au déclin cognitif des patients [35]. Il n’y a cependant pas de démonstration que cette approche représente une plus-value diagnostique ou pronostique de la MA.
L’hepcidine
La pathogenèse de la MA s’accompagne d’une accumulation progressive de fer dans les régions cérébrales associée aux troubles cognitifs. Cette accumulation est causée par plusieurs facteurs, notamment une perméabilité accrue de la BHE et l’inflammation. L’hepcidine, hormone régulatrice du métabolisme du fer, est diminuée dans le tissu cérébral des patients atteints de MA, et ses taux sanguins sont significativement plus élevés chez ces patients, en association positive avec la gravité de la maladie [36].
Les biomarqueurs transcriptionnels
La MA présente une composante génétique forte. Des études d’association génétique à grande échelle (GWAS) ont permis d’identifier plus de 20 locus de risque de la MA et de nombreux polymorphismes nucléotidiques (SNP) associés à des traits de risque qui peuvent contribuer à la pathogenèse de la maladie. La comparaison de l’expression des gènes au stade de la déficience cognitive légère (MCI) et au stade de la démence a permis de révéler le potentiel des biomarqueurs diagnostiques et pronostiques fondés sur l’expression de l’ARN messager (ARNm) ou des micro-ARN (miARN) sanguins. Une signature transcriptomique sanguine a été proposée pour le diagnostic de la MA, mais son utilité pratique et sa robustesse restent à valider [37].
Biomarqueurs métaboliques et de retour à l’homéostasie
Les lipides
Le métabolisme des lipides est perturbé dans le contexte des maladies neurodégénératives, y compris dans la MA, avec des taux anormaux de certains lipides (cholestérol et oxystérols, acides gras et phospholipides) dans le cerveau, le LCS et le plasma. Une telle signature lipidomique dans le sang pourrait fournir une vue d’ensemble dynamique de l’état métabolique d’un individu et permettre d’identifier les différents risques de progression clinique au cours de la MA [38].
L’apolipoprotéine E
L’isoforme E4 de l’apolipoprotéine E (ApoE) est le facteur de risque le mieux établi pour le développement de la MA, en raison de ses effets sur l’agrégation et la clairance de l’Aβ. L’ApoE est le principal transporteur des cholestérols dans le cerveau et son variant ApoE4 peut être à l’origine de déficits synaptiques et d’une altération de la potentialisation à long terme2, de la mémoire et de la cognition [39]. La détermination du statut ApoE du patient est donc un élément majeur de l’évaluation du risque de MA et cette information est souvent prise en considération en combinaison avec les marqueurs sanguins amyloïde ou tau (voir précédemment). Cette détermination est généralement fondée sur une analyse génétique, mais il est également possible d’évaluer le statut ApoE en détectant dans le sang les différentes isoformes de la protéine [40].
Les facteurs neurotrophiques
Le facteur neurotrophique dérivé du cerveau (BDNF, pour brain-derived neurotrophic factor) est une neurotrophine impliquée dans la survie, la fonction et le développement des neurones, la cognition et la mémoire, en favorisant la neurogenèse et la croissance synaptique. Des taux sériques de BDNF élevés pourraient ainsi jouer un rôle préventif contre l’apparition de la démence et de la MA [41].
Le facteur neurotrophique dérivé de la lignée des cellules gliales (GDNF, pour glial cell derived neurotrophic factor) est impliqué dans le développement, la survie et le maintien des interactions neurone-neurone/-tissu cible. Les niveaux sériques de cette protéine sont significativement réduits chez les patients atteints de MA, suggérant son rôle comme biomarqueur sanguin informatif de la maladie [42].
Les biomarqueurs intestinaux et de l’obésité
Les lésions entérocytaires (et la translocation microbienne qui en résulte) participent au mécanisme neuro-inflammatoire de la MA, probablement comme facteurs de risque dû à la réponse inflammatoire anti-microbienne associée.
Les concentrations sériques de protéines de liaison des acides gras (FABP, pour fatty-acid binding protein) de type cérébral (B-FABP, B pour brain) sont élevées chez les patients atteints de diverses maladies neurodégénératives dont la MA. Ce biomarqueur pourrait permettre de stratifier les patients [43].
L’obésité a été décrite comme un facteur de risque associé à la MA. L’adiponectine, l’adipokine3 la plus abondante dans la circulation sanguine, est une hormone produite par le tissu adipeux dont le taux plasmatique est diminué chez les personnes en surpoids ou obèses. Cependant, différentes voies de signalisation sont partagées par l’adiponectine et les protéines impliquées dans la pathogenèse de la MA, et cette adipokine influencerait la formation des agrégats Aβ et tau [44].
Critères principaux pour une implémentation en clinique des biomarqueurs
-
Existence d’une méthode de dosage suffisamment robuste et reproductible (en général avec un coefficient de variation inférieur à 20 %).
-
Performance diagnostique suffisante pour atteindre une sensibilité ou une spécificité suffisante pour une utilisation au niveau individuel (en général, spécificité/sensibilité supérieure à 80 %).
-
Niveau de preuve suffisant obtenu par des études indépendantes, multicentriques, prospectives, sur des populations qui correspondent à celles sur lesquelles le dosage sera effectué.
-
Définition d’un contexte d’utilisation qui réponde à un besoin médical non parfaitement rempli par un autre moyen et/ou qui apporte un plus en termes de performances, de faisabilité ou de coût.
-
Données disponibles sur les valeurs de références dans les populations témoins ainsi que sur les variations indépendantes de la maladie, mais liées à d’autres facteurs (âge, sexe, ethnie, indice de masse corporelle, présence d’une comorbidité comme une insuffisance rénale, etc.).
Diabètes et biomarqueurs glycémiques
Le diabète sucré est une maladie métabolique chronique qui a été associée à l’augmentation du risque de démence, l’insuline influençant la concentration de plusieurs neurotransmetteurs impliqués dans l’acquisition de la mémoire, tels que l’acétylcholine, l’adrénaline et la noradrénaline. L’insuline favorise également la plasticité neuronale et une altération de la signalisation par l’insuline dans le cerveau affecte les fonctions cognitives et neurologiques, conduisant à des troubles cognitifs légers et à la MA. Les patients diabétiques présentant un contenu anormal en glucose dans le cerveau ont ainsi un risque accru de développer une MA, comme en témoigne l’association entre la MA et les niveaux élevés d’hémoglobine glyquée (HbA1c) sérique observés chez les patients [45].
Considérations pratiques et conclusion
Cette revue propose une vue d’ensemble de molécules proposées comme biomarqueurs sanguins diagnostiques ou pronostiques de la MA. Il est assez difficile de comparer tous ces biomarqueurs et d’évaluer leur intérêt respectif, leurs performances ayant été évaluées dans différents contextes d’utilisation (COU, context of use), selon diverses procédures analytiques. Le passage d’un biomarqueur identifié en recherche à un biomarqueur utilisable en pratique médicale est soumis à de nombreux critères (voir Encadré), tels que : les variabilités pré-analytiques, les interférences avec des situations de comorbidité (hyperlipidémie, cancer, maladies inflammatoires chroniques, insuffisance rénale, etc.), la performance analytique (précision, robustesse, etc.) et la compatibilité avec le laboratoire clinique (y compris la certification de diagnostic in vitro [IVD]). Si les seuils définissant la normalité et la pathogénicité des concentrations de biomarqueurs amyloïdes et tau dosées dans le LCS sont maintenant standardisés entre les différents laboratoires (Tableau I), il n’en est pas de même pour le sang dans lequel ces seuils diffèrent en fonction des fournisseurs et des méthodes analytiques utilisées. Cela est d’autant plus important à prendre en considération que ces dosages sanguins sont également influencés par l’âge du patient ou la présence de comorbidités, telles qu’une insuffisance rénale.
Seuils définissant la normalité et la pathogénicité des concentrations de biomarqueurs amyloïdes et tau dosées dans le LCS. HS : hautement sensible ; SD : déviation standard.
Par ailleurs, la spécificité d’un biomarqueur peut être variable, selon qu’il est intimement lié à la pathogenèse de la maladie (comme les isoformes p-tau spécifiques), aux lésions neuronales présentes dans d’autres maladies neurodégénératives (comme les NfL [neurofilament light chain proteins]), ou présent dans d’autres maladies neurologiques à l’origine d’une réponse métabolique/cellulaire similaire, ou à une réponse générale de l’organisme. La transition de l’utilisation d’un biomarqueur en recherche (clinique ou thérapeutique) vers une application en biologie médicale de routine nécessite ainsi une validation prospective multi-centrique dans la population cible selon le contexte d’utilisation de ce biomarqueur (Tableau II). Il est également nécessaire qu’un industriel produise des kits de détection de ces biomarqueurs qui soient de grade clinique. Finalement, seul un très faible nombre de marqueurs atteindront ce niveau d’exigence.
Contextes d’utilisation des biomarqueurs sanguins
Les contextes d’utilisation des biomarqueurs sanguins sont résumés dans le Tableau II. En 2023, en France, seuls les taux sanguins de NfL sont évalués en routine. Dans l’avenir, les biomarqueurs sanguins représenteront vraisemblablement une aide complémentaire aux dosages des biomarqueurs présents dans le LCS et à la neuro-imagerie pour le diagnostic de la MA. Leur utilisation pourra également s’étendre au suivi des patients ou au suivi de populations à risque.
La détection de ces biomarqueurs est précoce, en particulier Ab et p-tau, dont les taux pathologiques peuvent être observés jusqu’à 10 ans avant l’apparition des premiers symptômes cliniques [5]. Seuls les biomarqueurs sanguins Ab (Ab1-40 et Ab1-42) et p-tau(181) ont atteints le stade d’utilisation clinique. Les composantes A et T (amyloid, tau), qu’ils représentent respectivement, sont spécifiques de la MA (le composant N [neurodegeneration] pour les NfL étant commun aux processus neurodégénératifs, donc non spécifique). Une telle signature sanguine AT(N) est particulièrement prometteuse et pourrait faciliter le diagnostic précoce et le suivi des patients atteints de MA grâce à une approche peu invasive. La combinaison de ce profil avec des marqueurs additionnels liés à la perte synaptique ou la neuro-inflammation pourrait encore améliorer les performances de ces marqueurs dont l’utilisation pourrait se développer à terme en soin primaire.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiés dans cet article.
Voir la publication de Cullen et al. [1].
Références
- Cullen NC, Leuzy A, Janelidze S, et al. Plasma biomarkers of Alzheimer’s disease improve prediction of cognitive decline in cognitively unimpaired elderly populations. Nat Commun 2021; 12 : 3555. [CrossRef] [PubMed] [Google Scholar]
- Alzheimer’s Association. Alzheimer’s disease facts and figures. Alzheimer’s & Dementia 2017 ; 2017 : 13325–373. [Google Scholar]
- Zhang H, Ma Q, Zhang Y-Wet al. Proteolytic processing of Alzheimer’s β-amyloid precursor protein. J Neurochem 2012 ; 120 : 9–21. [CrossRef] [PubMed] [Google Scholar]
- Dubois B, Feldman HH, Jacova Cet al. Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria. Lancet Neurol 2014 ; 13 : 614–629. [CrossRef] [PubMed] [Google Scholar]
- Jack CR, Bennett DA, Blennow Ket al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement 2018 ; 14 : 535–562. [CrossRef] [PubMed] [Google Scholar]
- Lehmann S, Delaby C, Boursier G, et al. Relevance of Aβ42/40 Ratio for Detection of Alzheimer Disease Pathology in Clinical Routine: The PLMR Scale. Front Aging Neurosci 2018 ; 10 : 138. [CrossRef] [PubMed] [Google Scholar]
- Delaby C, Estellés T, Zhu N, et al. The Aβ1-42/Aβ1-40 ratio in CSF is more strongly associated to tau markers and clinical progression than Aβ1-42 alone. Alz Res Therapy 2022; 14 : 20. [CrossRef] [Google Scholar]
- Jang H, Kim JS, Lee HJ, et al. Performance of the plasma Aβ42/Aβ40 ratio, measured with a novel HPLC-MS/MS method, as a biomarker of amyloid PET status in a DPUK-KOREAN cohort. Alzheimers Res Ther 2021; 13 : 179. [CrossRef] [PubMed] [Google Scholar]
- Alcolea D, Delaby C, Muñoz L, et al. Use of plasma biomarkers for AT(N) classification of neurodegenerative dementias. J Neurol Neurosurg Psychiatry 2021; 92 : 1206–14. [CrossRef] [PubMed] [Google Scholar]
- Ovod V, Ramsey KN, Mawuenyega KG, et al. Amyloid β concentrations and stable isotope labeling kinetics of human plasma specific to central nervous system amyloidosis. Alzheimers Dement 2017 ; 13 : 841–849. [CrossRef] [PubMed] [Google Scholar]
- Brum WS, Docherty KF, Ashton NJ, et al. Effect of Neprilysin Inhibition on Alzheimer Disease Plasma Biomarkers: A Secondary Analysis of a Randomized Clinical Trial. JAMA Neurol 2023; e234719. [Google Scholar]
- Lim CZJ, Zhang Y, Chen Y, et al. Subtyping of circulating exosome-bound amyloid β reflects brain plaque deposition. Nat Commun 2019 ; 10 : 1144. [CrossRef] [PubMed] [Google Scholar]
- Soares Martins T, Trindade D, Vaz M, et al. Diagnostic and therapeutic potential of exosomes in Alzheimer’s disease. J Neurochem 2021; 156 : 162–81. [CrossRef] [PubMed] [Google Scholar]
- Babapour Mofrad R, Scheltens P, Kim S, et al. Plasma amyloid-β oligomerization assay as a pre-screening test for amyloid status. Alz Res Therapy 2021; 13 : 133. [CrossRef] [Google Scholar]
- Olsson B, Lautner R, Andreasson U, et al. CSF and blood biomarkers for the diagnosis of Alzheimer’s disease: a systematic review and meta-analysis. Lancet Neurol 2016 ; 15 : 673–684. [CrossRef] [PubMed] [Google Scholar]
- Gonzalez-Ortiz F, Turton M, Kac PR, et al. Brain-derived tau: a novel blood-based biomarker for Alzheimer’s disease-type neurodegeneration. Brain 2023; 146 : 1152–65. [CrossRef] [PubMed] [Google Scholar]
- Janelidze S, Mattsson N, Palmqvist S, et al. Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer’s dementia. Nat Med 2020; 26 : 379–86. [CrossRef] [PubMed] [Google Scholar]
- Delaby C, Alcolea D, Hirtz C, et al. Blood amyloid and tau biomarkers as predictors of cerebrospinal fluid profiles. J Neural Transm (Vienna) 2022; 129 : 231–7. [CrossRef] [PubMed] [Google Scholar]
- Ashton NJ, Pascoal TA, Karikari TK, et al. Plasma p-tau231: a new biomarker for incipient Alzheimer’s disease pathology. Acta Neuropathol 2021; 141 : 709–24. [CrossRef] [PubMed] [Google Scholar]
- Barthélemy NR, Horie K, Sato C, et al. Blood plasma phosphorylated-tau isoforms track CNS change in Alzheimer’s disease. J Exp Med 2020; 217 : e20200861. [CrossRef] [PubMed] [Google Scholar]
- Dujardin S, Commins C, Lathuiliere A, et al. Tau molecular diversity contributes to clinical heterogeneity in Alzheimer’s disease. Nat Med 2020; 26 : 1256–63. [CrossRef] [PubMed] [Google Scholar]
- Fortea J, Carmona-Iragui M, Benejam B, et al. Plasma and CSF biomarkers for the diagnosis of Alzheimer’s disease in adults with Down syndrome: a cross-sectional study. Lancet Neurol 2018 ; 17 : 860–869. [CrossRef] [PubMed] [Google Scholar]
- Al Shweiki MR, Steinacker P, Oeckl P, et al. Neurofilament light chain as a blood biomarker to differentiate psychiatric disorders from behavioural variant frontotemporal dementia. J Psychiatr Res 2019 ; 113 : 137–140. [CrossRef] [PubMed] [Google Scholar]
- Chaves ML, Camozzato AL, Ferreira ED, et al. Serum levels of S100B and NSE proteins in Alzheimer’s disease patients. J Neuroinflammation 2010 ; 7 : 6. [CrossRef] [PubMed] [Google Scholar]
- Kim KY, Shin KY, Chang K-A. GFAP as a Potential Biomarker for Alzheimer’s Disease: A Systematic Review and Meta-Analysis. Cells 2023; 12 : 1309. [CrossRef] [PubMed] [Google Scholar]
- Elahi FM, Casaletto KB, La Joie R, et al. Plasma biomarkers of astrocytic and neuronal dysfunction in early- and late-onset Alzheimer’s disease. Alzheimer’s & Dementia 2020; 16 : 681–95. [CrossRef] [PubMed] [Google Scholar]
- Anwar S, Rivest S. Alzheimer’s disease: microglia targets and their modulation to promote amyloid phagocytosis and mitigate neuroinflammation. Expert Opin Ther Targets 2020; 24 : 331–44. [CrossRef] [PubMed] [Google Scholar]
- Ferri E, Rossi PD, Geraci A, et al. The sTREM2 Concentrations in the Blood: A Marker of Neurodegeneration? Front Mol Biosci 2020; 7 : 627931. [Google Scholar]
- Gu L, Shu H, Wang Y. Soluble TREM2 in body fluid in Alzheimer’s disease and Parkinson’s disease. Neurol Sci 2023; 44 : 2743–51. [CrossRef] [PubMed] [Google Scholar]
- Craig-Schapiro R, Perrin RJ, Roe CM, et al. YKL-40: a novel prognostic fluid biomarker for preclinical Alzheimer’s disease. Biol Psychiatry 2010 ; 68 : 903–912. [CrossRef] [PubMed] [Google Scholar]
- Heneka MT, Carson MJ, El Khoury J, et al. Neuroinflammation in Alzheimer’s disease. Lancet Neurol 2015 ; 14 : 388–405. [CrossRef] [PubMed] [Google Scholar]
- Delaby C, Julian A, Page G, et al. NFL strongly correlates with TNF-R1 in the plasma of AD patients, but not with cognitive decline. Sci Rep 2021; 11 : 10283. [CrossRef] [PubMed] [Google Scholar]
- Jellinger KAAlpha-synuclein pathology in Parkinson’s and Alzheimer’s disease brain: incidence and topographic distribution–a pilot study. Acta Neuropathol 2003 ; 106 : 191–201. [CrossRef] [PubMed] [Google Scholar]
- Mohaupt P, Pons M-L, Vialaret J, et al. β-Synuclein as a candidate blood biomarker for synaptic degeneration in Alzheimer’s disease. Alzheimers Res Ther 2022; 14 : 179. [CrossRef] [PubMed] [Google Scholar]
- Liu W, Lin H, He X, et al. Neurogranin as a cognitive biomarker in cerebrospinal fluid and blood exosomes for Alzheimer’s disease and mild cognitive impairment. Transl Psychiatry 2020; 10 : 125. [CrossRef] [PubMed] [Google Scholar]
- Chatterjee P, Mohammadi M, Goozee K, et al. Serum Hepcidin Levels in Cognitively Normal Older Adults with High Neocortical Amyloid-β Load. J Alzheimers Dis 2020; 76 : 291–301. [CrossRef] [PubMed] [Google Scholar]
- Fehlbaum-Beurdeley P, Sol O, Désiré L, et al. Validation of AclarusDxTM, a blood-based transcriptomic signature for the diagnosis of Alzheimer’s disease. J Alzheimers Dis 2012 ; 32 : 169–181. [CrossRef] [PubMed] [Google Scholar]
- Kao Y-C, Ho P-C, Tu Y-K, et al. Lipids and Alzheimer’s Disease. Int J Mol Sci 2020; 21 : 1505. [CrossRef] [PubMed] [Google Scholar]
- Kim J, Yoon H, Basak J, et al. Apolipoprotein E in synaptic plasticity and Alzheimer’s disease: potential cellular and molecular mechanisms. Mol Cells 2014 ; 37 : 767–776. [CrossRef] [PubMed] [Google Scholar]
- Hirtz C, Vialaret J, Nouadje G, et al. Development of new quantitative mass spectrometry and semi-automatic isofocusing methods for the determination of Apolipoprotein E typing. Clinica Chimica Acta 2016 ; 454 : 33–38. [CrossRef] [Google Scholar]
- Weinstein G, Beiser AS, Choi SH, et al. Serum brain-derived neurotrophic factor and the risk for dementia: the Framingham Heart Study. JAMA Neurol 2014 ; 71 : 55–61. [CrossRef] [PubMed] [Google Scholar]
- Sharif M, Noroozian M, Hashemian F. Do serum GDNF levels correlate with severity of Alzheimer’s disease? Neurol Sci 2021; 42 : 2865–72. [CrossRef] [PubMed] [Google Scholar]
- Teunissen CE, Veerhuis R, De Vente J, et al. Brain-specific fatty acid-binding protein is elevated in serum of patients with dementia-related diseases. Eur J Neurol 2011 ; 18 : 865–871. [CrossRef] [PubMed] [Google Scholar]
- Letra L, Rodrigues T, Matafome P, et al. Adiponectin and sporadic Alzheimer’s disease: Clinical and molecular links. Front Neuroendocrinol 2019 ; 52 : 1–11. [CrossRef] [PubMed] [Google Scholar]
- Noguchi-Shinohara M, Yuki-Nozaki S, Abe C, et al. Diabetes Mellitus, Elevated Hemoglobin A1c, and Glycated Albumin Are Associated with the Presence of All-Cause Dementia and Alzheimer’s Disease: The JPSC-AD Study. J Alzheimers Dis 2022; 85 : 235–47. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Seuils définissant la normalité et la pathogénicité des concentrations de biomarqueurs amyloïdes et tau dosées dans le LCS. HS : hautement sensible ; SD : déviation standard.
Liste des figures
 |
Figure 1. Les biomarqueurs sanguins de la maladie d’Alzheimer ont été classés selon deux critères interdépendants. Sont indiqués, leur degré de relation avec le processus pathologique spécifique et leur utilisation dans différents contextes : recherche clinique, en jaune ; recherche translationnelle, en bleu ; essais cliniques, en vert ; pratique clinique, en rose. |
| Dans le texte | |
 |
Figure 2. La pathogénèse de la maladie d’Alzheimer s’accompagne d’un processus neuro-inflammatoire, dont les effets pour le cerveau peuvent être bénéfiques (anti-inflammatoires) ou néfastes (pro-inflammatoires). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




