| Issue |
Med Sci (Paris)
Volume 30, Number 4, Avril 2014
|
|
|---|---|---|
| Page(s) | 422 - 428 | |
| Section | Microenvironnements tumoraux : conflictuels et complémentaires | |
| DOI | https://doi.org/10.1051/medsci/20143004017 | |
| Published online | 05 May 2014 | |
L’hypoxie tumorale
Un déterminant clé de la réactivité stromale et de la réponse antitumorale
Tumor hypoxia: a key player in the regulation of stromal and anti-tumor responses
Inserm U753, institut Gustave Roussy, 114, rue Édouard Vaillant, 94800
Villejuif, France
L’hypoxie est une caractéristique majeure de la plupart des tumeurs solides. Les cellules s’adaptent à la baisse de l’apport en oxygène en stabilisant les facteurs de transcription HIF (hypoxia-inducible factor) qui, à leur tour, activent l’expression de nombreux gènes résultant en la survie et le maintien des fonctions cellulaires. Dans les cellules tumorales, l’exposition au stress hypoxique active, via les facteurs HIF, une série de molécules qui leur permettent de résister à la lyse dépendante des cellules tueuses du système immunitaire. L’hypoxie tissulaire régule également les fonctions des cellules de l’immunité et leur différenciation. Cette revue décrit les mécanismes de résistance tumorale aux effecteurs cytotoxiques induits par l’hypoxie, et les conséquences fonctionnelles de l’hypoxie sur les cellules immunes.
Abstract
Hypoxia is a major feature of most solid tumors. Cells adapt to lower oxygen availability by stabilizing HIF transcription factors, which in turn activate the expression of many genes resulting in the survival and maintenance of cellular functions. In tumor cells, exposure to hypoxic stress results in the activation, via the HIF factors, of a series of genes enabling tumor cells to resist to killing by cytotoxic effectors of the immune system. Tissue hypoxia also controls the functions and differentiation of immune cells. This review describes the hypoxia-induced mechanisms of tumor resistance to killing by cytotoxic effectors, and the functional effects of hypoxia on the immune cells.
© 2014 médecine/sciences – Inserm
L’hypoxie tumorale est une composante majeure du microenvironnement d’un grand nombre de tumeurs solides. Son implication dans la progression tumorale et dans la résistance aux traitements conventionnels du cancer, ainsi que son association à un mauvais pronostic clinique, sont désormais établies [1].
L’évasion tumorale et la résistance à l’immunosurveillance sont, depuis peu, intégrées parmi les caractéristiques principales des cellules cancéreuses [2]. Il devient évident que ces événements sont sous le contrôle du microenvironnement tumoral, de son hétérogénéité, de sa complexité et de sa plasticité. À cet égard, l’hypoxie locale joue un rôle primordial dans le remodelage du microenvironnement tumoral en contrôlant la plasticité immunitaire et tumorale. Élément clé de la régulation de la réactivité stromale, une meilleure connaissance des mécanismes d’action de l’hypoxie sur les cellules tumorales et immunitaires demeure nécessaire pour la compréhension des interactions hôte-tumeur. Son ciblage devrait également être pris en considération dans les nouvelles approches d’immunothérapie, dont les résultats sont encore peu encourageants.
Définition de l’hypoxie et conséquences fonctionnelles
L’hypoxie tumorale est considérée comme une caractéristique majeure du microenvironnement des tumeurs solides. Elle se traduit par une baisse de la pression en oxygène au-dessous de 5 à 10 mm Hg. Les cellules tumorales s’adaptent au stress hypoxique en stabilisant les facteurs de transcription induits par l’hypoxie, essentiellement HIF (hypoxia inducible factor)-1 et HIF-2. Les HIF sont des protéines hétérodimériques, composées d’une sous-unité constitutivement exprimée, HIF-β, et d’une sous-unité régulée par l’oxygène, HIF-α [1]. En présence d’oxygène, HIF-α est hydroxylée sur ses résidus proline 402 et/ou 564 par la prolyl-hydroxylase domain 2 (PHD2), ce qui entraîne son interaction avec la protéine suppressive de tumeur von Hippel-Lindau (pVHL). pVHL recrute l’enzyme E3 ubiquitine ligase responsable de la poly-ubiquitination de HIF-α et de sa dégradation via le protéasome. En conditions hypoxiques, l’hydroxylation par les PHD est inhibée, HIF-α s’accumule et forme un dimère avec la sous-unité HIF-β. Le complexe se lie alors à ses séquences cibles HRE au niveau des régions promotrices de gènes cibles et induit leur transcription en présence de cofacteurs [1]. HIF-1 et HIF-2 activent plusieurs gènes impliqués dans l’angiogenèse tumorale, l’inhibition de l’apoptose, les métastases, la transition épithélio-mésenchymateuse (TEM) et la résistance aux traitements conventionnels, ce qui fait de l’hypoxie tumorale un facteur de mauvais pronostic [1] (Figure 1). Outre cette régulation dépendante de l’oxygène, HIF-1α et HIF-2α peuvent être régulés par d’autres mécanismes indépendants de l’oxygène (mutations des gènes VHL, Raf, Ras, BRAf) [3] (Figure 1). Par exemple, dans les carcinomes du rein à cellules claires, une expression constitutive des facteurs HIF est fréquente ; elle résulte des mutations du gène suppresseur de tumeur VHL, qui prédisposent au développement de tumeurs bénignes et malignes richement vascularisées [1].
 |
Figure 1. Régulation de HIF-1 α par l’oxygène. En normoxie, HIF-1α est hydroxylée par les prolyl-hydroxylases (PHD), ce qui entraîne son interaction avec la protéine suppresseur de tumeur von Hippel-Lindau (pVHL). pVHL recrute à son tour l’ubiquitine ligase E3 qui catalyse la poly-ubiquitination de HIF-1α, entraînant la dégradation de HIF-1α via le protéasome. En hypoxie, l’activité des PHD est inhibée, ce qui stabilise HIF-1α et entraîne sa translocation dans le noyau où, associée à HIF-β, elle exerce son activité transcriptionnelle en se liant aux séquences HRE (hypoxia-response element) présentes dans la région promotrice des gènes cibles. Outre la régulation strictement dépendante de l’oxygène, HIF-1α est également régulée par plusieurs mécanismes activés par des mutations (mutations des gènes fumarate hydratase [FH], succinate hydratase [SH], VHL, Raf et microphtalmia-associated transcription factor [MITF]). IGF : insulin-like growth factor ; EGF, epidermal growth factor ; MAPK : mitogen-activated protein kinase ; PI3K : phosphoinositide 3-kinase. |
Le succès d’une réponse immune nécessite l’activation et la maturation adéquates des cellules présentatrices d’antigènes, qui présentent les antigènes tumoraux aux lymphocytes T et activent ces derniers pour aboutir à la lyse des cellules tumorales. Les cellules de l’immunité innée sont également activées et impliquées dans l’élimination des cellules tumorales. Au sein du microenvironnement tumoral, l’hypoxie est capable d’altérer ces différentes étapes, mais également de moduler la réponse des cellules tumorales aux cellules immunes. L’hypoxie tumorale semble ainsi jouer un rôle central dans les mécanismes d’échappement tumoral au système immunitaire.
Effets de l’hypoxie sur la sensibilité des cellules tumorales aux effecteurs cytotoxiques
L’hypoxie tumorale est capable de diminuer la sensibilité intrinsèque des cellules tumorales aux effecteurs cytotoxiques par des mécanismes dépendant généralement de HIF-1 [3, 4]. L’acquisition de cette résistance est multiparamétrique et complexe. Elle implique plusieurs processus (Figure 2).
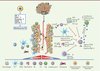 |
Figure 2. Influence de l’hypoxie sur les cellules de l’immunité innée et adaptative. Les tumeurs solides contiennent des zones où la concentration d’oxygène est variable. Les cellules tumorales les plus proches d’un vaisseau sanguin perfusé ont des concentrations d’oxygène relativement élevées (cellule normoxique rouge). Les concentrations d’oxygène diminuent à mesure que la distance par rapport aux vaisseaux sanguins augmente (cellule hypoxique bleue). Sont représentés les divers effets de l’hypoxie sur les cellules tumorales et sur les cellules de l’immunité innée (macrophages, cellules dendritiques, MDSC, NK et neutrophiles) et adaptative (CTL, Treg). DC : cellules dendritiques ; MDSC : cellules myéloïdes suppressives ; NK : cellules tueuses naturelles ; CTL : lymphocytes T cytotoxiques ; Treg : lymphocytes T régulateurs. |
Activation de STAT3 dans les cellules tumorales
Le facteur de transcription STAT3 (signal transducer and activator of transcription 3) est fréquemment activé dans les cancers via l’activation constitutive de récepteurs à activité tyrosine-kinase et de kinases telles que Src [5]. Dans les cellules tumorales, STAT3 exerce des fonctions anti-apoptotiques et promeut la prolifération cellulaire et la résistance aux thérapies anticancéreuses, dont l’immunothérapie [5]. En effet, STAT3, d’une part, inhibe l’expression de cytokines immunostimulatrices et augmente l’expression de cytokines immunosuppressives par les cellules tumorales et, d’autre part, altère les fonctions immunoactivatrices des cellules présentatrices d’antigènes, comme les macrophages et les cellules dendritiques [7]. STAT3 inhibe aussi directement la sensibilité tumorale aux cellules tueuses natural killer (NK) en régulant négativement l’expression de MICA (MHC class I polypeptide-related sequence A), ligand activateur des NK [6].
Dans les cellules tumorales, l’hypoxie est un facteur activateur de STAT3 [3, 4, 7, 8]. STAT3 interagit avec HIF-1 pour activer des gènes cibles de HIF-1, dont celui qui code pour le VEGF (vascular endothelial growth factor) [7, 8]. La sensibilité aux effecteurs cytotoxiques de cellules de carcinome bronchique soumises à un stress hypoxique est diminuée ; cela fait intervenir l’activation de STAT3, ce qui souligne le rôle de ce facteur dans l’échappement tumoral à la lyse spécifique dans des conditions d’hypoxie [3, 4]. Dans ces cellules tumorales, l’autophagie est également induite et contribue à la résistance à la mort induite par les effecteurs cytotoxiques [3, 4]. Un mécanisme potentiel de cette résistance associé à l’autophagie en conditions hypoxiques serait la dégradation du granzyme B dans les autophagosomes, évènement récemment observé au contact des cellules NK [9]. De manière intéressante, l’autophagie est nécessaire à la phosphorylation de STAT3 en hypoxie [3, 4]. Les mécanismes par lesquels STAT3 contrôle la résistance tumorale à la lyse spécifique ne sont pas clairement élucidés, mais la régulation de gènes activant la survie cellulaire est probablement impliquée [10].
Activation de facteurs de transcription embryonnaires
La croissance tumorale dépendrait de la présence d’une sous-population cellulaire tumorale dotée de propriétés de cellules souches (cellules souches cancéreuses, CSC). L’hypoxie a été impliquée dans l’induction d’un phénotype de CSC par les cellules tumorales, entre autres via HIF-1 et HIF-2 qui activent l’expression de gènes tels que POU5F1, SOX2, NANOG. Ces gènes codent pour des facteurs de transcription nécessaires au maintien des cellules souches et de leurs propriétés, et qui contribuent à la progression tumorale et à la résistance aux thérapies [1, 3, 4]. Parmi ces facteurs, seul NANOG a été impliqué dans la réponse tumorale aux effecteurs cytotoxiques. En effet, des cellules de cancer du col de l’utérus surexprimant NANOG sont résistantes à la lyse par les CTL (lymphocyte T cytotoxique) par un mécanisme impliquant la kinase anti-apoptotique Akt [11]. En hypoxie, dans des cellules de cancer bronchique, l’induction de l’expression de NANOG via HIF-1 est associée à la résistance tumorale aux CTL, en contrôlant l’activation de STAT3 et en contribuant à l’adaptation des cellules tumorales au stress hypoxique [3, 4].
Induction de miR-210 dans les cellules tumorales par le stress hypoxique
Les microARN (miARN) sont de plus en plus impliqués dans le développement et la progression des cancers [12]. Certains miARN sont capables de moduler la réponse tumorale aux effecteurs cytotoxiques. Par exemple, dans des cellules de cancer colorectal et de gliomes, les miR-339 et -222 diminuent l’expression d’ICAM-1 (intercellular adhesion molecule 1), résultant en l’inhibition de la lyse par les CTL [13]. Les miR-302c et -520c ciblent l’expression de MICA et d’ULBP2 (UL16 binding protein 2), ligands activateurs des NK, et leur inhibition dans les cellules tumorales augmente la sensibilité de ces cellules aux NK [14].
L’hypoxie est capable de réguler l’expression de plusieurs miR [17]. Elle diminue, par exemple, l’expression de miR anti-oncogéniques, tels que miR-101, et augmente l’expression de miR pro-oncogéniques, tels que miR-21 et miR-210 [15, 16]. Plusieurs arguments soulignent que miR-210 est l’un des principaux miR induits par hypoxie [16]. Ce miR a été récemment impliqué dans la résistance tumorale à la lyse par les lymphocytes T cytotoxiques, via une régulation de l’expression des gènes PTPN1 (protein tyrosine phosphatase, non-receptor type 1), HOXA1 (homeobox A1), et TP53I11 [3, 4].
Induction de la transition épithélio-mésenchymateuse (TEM)
La TEM est un processus moléculaire complexe par lequel les cellules épithéliales perdent leur polarité et acquièrent un phénotype mésenchymateux invasif, qui contribue à la progression tumorale [46–49] (→). Les HIF sont capables d’induire directement l’expression de certains facteurs de transcription de la TEM (Snail, Slug, Twist), établissant le rôle de l’hypoxie dans ce processus [3]. Cependant, la TEM est aussi capable d’induire l’échappement tumoral au système immunitaire. En effet, l’expression de Snail dans des cellules de mélanome inhibe la maturation des cellules dendritiques, induit une expansion des cellules Treg et rend les cellules tumorales résistantes à la lyse par les cellules T cytotoxiques [3]. L’expression de Snail dans des cellules de carcinome mammaire aboutit également à une résistance à la lyse par les CTL [17]. De plus, l’induction de la TEM dans ces cellules s’associe à une activation de l’autophagie impliquée dans la résistance aux cellules T ; le processus autophagique représenterait donc un mécanisme de résistance des cellules tumorales subissant la TEM [17]. L’hypoxie étant capable d’induire la TEM dans les cellules tumorales, le rôle des facteurs induisant la TEM dans la tolérance immune associée à l’hypoxie tumorale mérite d’être exploré.
(→) Voir les Synthèses de S. Provot, de C. Buache et M.C. Rio, de J. Albrengues et al., et de S. Hubert et J.P. Abastado, pages 366, 378, 385 et 391 de ce numéro
Modification des ligands des cellules tueuses naturelles (NK)
Dans des cellules de cancer de la prostate et d’ostéosarcomes, l’hypoxie induit une diminution de l’expression de MICA à la surface cellulaire [18, 19]. MICA étant un ligand du récepteur activateur NKG2D (natural killer group 2D) présent à la surface des cellules NK et des lymphocytes T, cette diminution aboutit à l’échappement des cellules tumorales à la lyse par les NK et CTL [18, 19]. Dans le contexte des mutations VHL observées dans les carcinomes du rein à cellules claires, l’inhibition de HIF-1 dans des cellules tumorales stabilisant HIF-1 et HIF-2 est associée à une résistance aux cellules NK par une diminution de l’expression des molécules du système HLA de classe I [20].
Effets de l’hypoxie sur les cellules immunes
L’hypoxie tumorale influence la composition de l’infiltrat immun intratumoral, ainsi que les fonctions et la différenciation des cellules de l’immunité présentes au sein du stroma tumoral. En particulier, l’hypoxie tumorale inhibe les fonctions cytotoxiques des cellules immunes et promeut une tolérance immunitaire vis-à-vis de la tumeur (Figure 2).
Influence du stress hypoxique sur les cellules myéloïdes
Macrophages
Les macrophages représentent une composante cellulaire importante de l’infiltrat immun intratumoral. Au sein du microenvironnement tumoral, ils se différencient en macrophages associés aux tumeurs ou TAM (tumor associated macrophages) exprimant le marqueur CD206. Dans les tumeurs non progressives ou en régression, le phénotype des TAM est de type I (ou M1) caractérisé par une activité pro-inflammatoire et antitumorale. Dans les tumeurs progressives, les TAM sont de type II (ou M2), dotés de propriétés immunosuppressives et pro-angiogéniques, contribuant à la progression tumorale [21]. Les TAM sont localisés préférentiellement au niveau des zones tumorales hypoxiques où, sous l’effet de l’hypoxie, les facteurs HIF-1 et HIF-2 sont stabilisés, ce qui permet leur activité transcriptionnelle et l’induction de gènes cibles, comme ceux qui codent pour VEGF, bFGF (basic fibroblast growth factor), ANG-1 (angiopoietin-1), IL-8 (interleukine-8), COX2 (cyclooxygenase 2), MMP-7 (matrix metalloproteinase-7) et MMP-9, tous ces facteurs étant impliqués dans l’angiogenèse et la progression tumorales [22]. La contribution relative de HIF-1 et HIF-2 à la régulation de l’expression des gènes dans les macrophages n’est pas encore élucidée. Mais l’induction de HIF-1 dans les macrophages altère leurs fonctions cytotoxiques (par exemple la production d’IFN-γ [interféron-γ]) et promeut la production de iNOS et d’arginase, qui inhibent la prolifération et la survie des cellules T [23]. L’expression de HIF-2 dans les TAM, quant à elle, est corrélée significativement à l’angiogenèse tumorale [24], dont des médiateurs, comme le VEGF, induisent l’échappement tumoral aux effecteurs cytotoxiques [4].
Cellules myéloïdes suppressives ou MDSC (myeloid-derived suppressive cells)
Les MDSC sont un ensemble de cellules myéloïdes constituées par des macrophages, des cellules dendritiques et des granulocytes à des stades immatures, et par des cellules myéloïdes à des stades précoces de différenciation [25, 50] (→). Ce sont des acteurs majeurs de l’immunosuppression ciblant les cellules T au cours des cancers. Leur recrutement dans les tumeurs est principalement dépendant de la production de cytokines et de chémokines inflammatoires par les tumeurs (GM-CSF [granulocyte-macrophage colony-stimulating factor], G-CSF, IL-3). Au sein du microenvironnement tumoral, la production d’arginase et de iNOS par les MDSC aboutit à l’inactivation et l’apoptose des cellules T [26]. La stabilisation de HIF-1 dans les MDSC tumorales entraînerait la différenciation des MDSC en TAM de type M2 immunosuppresseurs [26]. L’hypoxie induit également la sécrétion, par les cellules tumorales, de facteurs qui favorisent la formation de niches prémétastatiques, recrutant préférentiellement des MDSC et des cellules NK inactives [27].
(→) Voir la Synthèse de M. Bruchard et F. Ghiringhelli, page 429 de ce numéro
Cellules dendritiques
La présence de HIF-1α dans les cellules dendritiques semble avoir des effets contradictoires. En effet, de faibles taux d’oxygène entraîneraient une inhibition de la maturation et de la différenciation des cellules dendritiques, mais augmenteraient leurs fonctions inflammatoires. Il en résulterait une suppression de leurs fonctions dans l’immunité adaptative au profit de l’immunité innée. Des analyses du transcriptome montrent ainsi que, dans des progéniteurs hématopoïétiques soumis à un stress hypoxique, l’expression des gènes associés à la maturation et à la différenciation des cellules dendritiques (CD80, CD86, et JAG1 [jagged 1 protein]) est diminuée [28]. Au contraire, d’autres travaux montrent une induction de la maturation et de la différenciation des cellules dendritiques par l’hypoxie [29]. Dans les cellules dendritiques matures, l’hypoxie augmente l’expression de gènes impliqués dans les réponses immunes innée et adaptative, ce qui devrait favoriser l’activation des cellules T [30]. Ainsi, dans les cellules dendritiques matures exposées à l’hypoxie, on observe une augmentation de l’expression de gènes codant pour des chémokines/cytokines et/ou leurs récepteurs impliqués dans le chémotactisme des neutrophiles (CXCL2, CXCL3, CXCL5), des lymphocytes T activés/mémoires et des cellules dendritiques immatures (CCL20 [(C-X-C motif) ligand 2], CCL3 et CCL5), et une diminution des gènes impliqués dans le chémotactisme des lymphocytes T naïfs (CCL18 [(C-C motif) ligand 20], CCL2) [31]. De plus, des cellules dendritiques cultivées en présence de lysats de cellules de glioblastomes hypoxiques activent plus efficacement les cellules T que ces mêmes cellules mises en présence de lysats de cellules normoxiques [32].
Ces résultats contradictoires peuvent être expliqués par des différences d’approche expérimentale concernant la source et la pureté des précurseurs de cellules dendritiques, les protocoles utilisés pour leur maturation et leur différenciation, ou encore le stimulus hypoxique (durée, taux, enceinte hypoxique ou pseudo-hypoxie par COCl2). Des travaux supplémentaires sont encore requis afin de mieux comprendre les conséquences de l’hypoxie et de l’expression des facteurs HIF sur les cellules dendritiques, qui représentent une étape critique pour la compréhension de la réponse immune antitumorale.
Influence du stress hypoxique sur les cellules lymphoïdes
Lymphocytes T
L’hypoxie est rapportée comme induisant l’apoptose des lymphocytes T [33]. D’autres travaux montrent, au contraire, que lorsque les cellules T sont activées, l’hypoxie favorise leur survie en prévenant la mort dite AICD (activation-induced cell death) [34]. L’activation de l’apoptose ou des voies de survie en hypoxie semble donc influencée par l’état d’activation des cellules T.
L’hypoxie réduit également la prolifération des cellules T activées [35] et la production de cytokines (IL-2, IFNγ) [36], mais les fonctions lytiques des cellules T CD8+ seraient augmentées [36]. Les cellules T semblent donc pouvoir être fonctionnelles dans un environnement hypoxique. D’autres travaux décrivent, au contraire, que le ciblage de HIF-1α dans des cellules T activées accroît la réponse T, impliquant que HIF-1α exerce un effet inhibiteur sur les fonctions des T [37]. Ces résultats contradictoires illustrent la controverse actuelle qui entoure le rôle de HIF-1 dans la régulation des fonctions des cellules T.
HIF-1 infuence également la différenciation des lymphocytes T. En effet, cette molécule induit l’expression de Foxp3 dans les cellules T CD4+, aboutissant à une expansion des lymphocytes T régulateurs (Treg) [38]. HIF-1 est également impliquée dans la différenciation des cellules T en cellules Th17 productrices d’IL-17 [39].
Outre les effets directs de l’hypoxie et des facteurs HIF sur les cellules T, des facteurs présents au sein du microenvironnement hypoxique influencent d’une manière extrinsèque les fonctions des cellules T. Par exemple, l’hypoxie augmente la concentration extracellulaire d’adénosine [40] qui, après interaction avec son récepteur A2AR (adenosin A 2A receptor) à la surface des cellules T, entraîne une accumulation d’AMPc et une inhibition des cellules T activées [41]. Dans ce contexte, l’utilisation d’antagonistes des récepteurs A2AR, ou l’inhibition de leur expression, réduisent l’inhibition des lymphocytes T antitumoraux, et ralentissent ou inhibent la croissance tumorale [41]. Dans un modèle de cancer ovarien, l’hypoxie tumorale, via l’expression de CCL28 par les cellules tumorales hypoxiques, promeut le recrutement des Treg [42]. Ces données suggèrent que l’hypoxie protège le tissu des effecteurs cytotoxiques.
Cellules tueuses naturelles (NK)
L’hypoxie est capable d’inhiber les fonctions des NK de manière indirecte. En effet, les facteurs sécrétés par les cellules tumorales hypoxiques inhibent la cytotoxicité et la maturation des cellules NK. Cette inhibition a permis de mettre en évidence le rôle des NK dans la suppression de la formation de métastases [27]. Les cellules NK soumises directement au stress hypoxique s’adaptent en stabilisant les facteurs HIF, ce qui s’associe à une inhibition ou une altération de l’expression des récepteurs activateurs des NK en réponse à l’IL-2 ou l’IL-15, et une perte de leur fonction cytotoxique [14, 43]. Bien que le rôle des facteurs HIF dans l’inhibition des NK ne soit pas clairement démontré, ces effets inhibiteurs de l’hypoxie pourraient être impliqués dans l’efficacité limitée des immunothérapies basées sur l’utilisation de cytokines immunoactivatrices, outre le faible infiltrat intratumoral en cellules immunes cytotoxiques [51] (→).
(→) Voir la Synthèse de J. Galon et al., page 439 de ce numéro
Effets des traitements anti-angiogéniques sur les cellules immunes dans le microenvironnment tumoral
La stabilisation des facteurs HIF en conditions d’hypoxie résulte en l’activation de gènes impliqués dans l’angiogenèse tumorale (VEGF, PDGF [plateled-derived growth factor], mTOR [mammalian target of rapamycin]), évènement primordial dans le développement tumoral. Les protéines codées par ces gènes sont capables d’agir aussi bien sur les cellules tumorales que sur les cellules du système immunitaire. Ainsi, le VEGF est impliqué dans l’activation de STAT3 dans les cellules tumorales hypoxiques et contribue, de ce fait, à leur résistance à la lyse spécifique [10]. Les facteurs proangiogéniques sont également impliqués dans l’inhibition de la maturation des cellules dendritiques ou dans l’augmentation de l’expression de PD-L1 (ligand inhibiteur des cellules T) par les MDSC [4, 50].
L’utilisation de molécules antiangiogéniques dans les traitements anticancéreux, outre qu’elle contrecarre la croissance tumorale et la formation de métastases, permettrait d’améliorer la réponse immune antitumorale. En effet, une diminution des Treg et des MDSC a été observée lors de l’utilisation de molécules antiangiogéniques dans des modèles animaux et chez les patients. Une stimulation de la maturation des cellules dendritiques semble être également observée [4]. Ces traitements s’associent aussi à une augmentation de l’infiltration tumorale en cellules T lors de transferts adoptifs, et à celle du nombre de cellules T CD4+ et CD8+. Cependant, certaines molécules antiangiogéniques, comme le sorafenib (un inhibiteur de tyrosine kinase), semblent inhiber l’activation des lymphocytes T. Les traitements antiangiogéniques peuvent aussi entraîner une hypoxie secondaire qui, à son tour, active de novo les voies pro-angiogéniques et les effets immunosuppresseurs associés [4]. Une meilleure connaissance des mécanismes d’action des traitements antiangiogéniques est nécessaire afin d’améliorer et de maintenir leurs effets bénéfiques dans le cadre des traitements anticancéreux.
Conclusion
Le taux d’oxygène présent dans les tissus représente un facteur microenvironnemental déterminant, aussi bien pour la régulation de la réponse tumorale aux effecteurs cytotoxiques que pour les fonctions de ces effecteurs. La manipulation du stress hypoxique au sein des tumeurs dans le but de sensibiliser les cellules tumorales aux effecteurs cytotoxiques pourrait ainsi avoir des retombées thérapeutiques. Une recherche multidisciplinaire dans le domaine de la biologie des tumeurs constitue ainsi un réel enjeu pour l’élaboration d’une immunothérapie intégrative plus efficace. Nous restons persuadés qu’en tant qu’arme contre la malignité, l’immunothérapie reste un traitement prometteur, comme l’indiquent les derniers essais basés sur l’utilisation des anticorps anti-PD1 et anti-PD-L1 [44, 45, 52].
De nombreuses étapes restent indéniablement à franchir avant que l’approche immunologique ne prenne une vraie place dans l’abord thérapeutique du cancer. Ainsi, une meilleure connaissance du dialogue des effecteurs immuns avec le stroma tumoral dans le contexte de la complexité microenvironnementale et de la plasticité tumorale demeure un enjeu réel.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Keith B, Johnson RS, Simon MC. HIF1alpha and HIF2alpha: sibling rivalry in hypoxic tumour growth and progression. Nat rev Cancer 2011 ; 12 : 9–22. [PubMed] [Google Scholar]
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011 ; 144 : 646–674. [CrossRef] [PubMed] [Google Scholar]
- Noman MZ, Messai Y, Carre T, et al. Microenvironmental hypoxia orchestrating the cell stroma cross talk, tumor progression and antitumor response. Crit Rev Immunol 2011 ; 31 : 357–377. [CrossRef] [PubMed] [Google Scholar]
- Chouaib S, Messai Y, Couve S, et al. Hypoxia promotes tumor growth in linking angiogenesis to immune escape. Front Immunol 2012 ; 3 : 21. [CrossRef] [PubMed] [Google Scholar]
- Kortylewski M, Yu H. Role of Stat3 in suppressing anti-tumor immunity. Curr Opin Immunol 2008 ; 20 : 228–233. [CrossRef] [PubMed] [Google Scholar]
- Fionda C, Malgarini G, Soriani A, et al. Inhibition of glycogen synthase kinase-3 increases NKG2D ligand MICA expression and sensitivity to NK cell-mediated cytotoxicity in multiple myeloma cells: role of STAT3. J Immunol 2013 ; 190 : 6662–6672. [CrossRef] [PubMed] [Google Scholar]
- Gray MJ, Zhang J, Ellis LM, et al. HIF-1alpha, STAT3, CBP/p300 and Ref-1/APE are components of a transcriptional complex that regulates Src-dependent hypoxia-induced expression of VEGF in pancreatic and prostate carcinomas. Oncogene 2005 ; 24 : 3110–3120. [CrossRef] [PubMed] [Google Scholar]
- Carbajo-Pescador S, Ordonez R, Benet M, et al. Inhibition of VEGF expression through blockade of Hif1alpha and STAT3 signalling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells. Br J Cancer 2013 ; 109 : 83–91. [CrossRef] [PubMed] [Google Scholar]
- Baginska J, Viry E, Berchem G, et al. Granzyme B degradation by autophagy decreases tumor cell susceptibility to natural killer-mediated lysis under hypoxia. Proc Natl Acad Sci USA 2013 ; 110 : 17450–17455. [Google Scholar]
- Noman MZ, Buart S, Van Pelt J, et al. The cooperative induction of hypoxia-inducible factor-1 alpha and STAT3 during hypoxia induced an impairment of tumor susceptibility to CTL-mediated cell lysis. J Immunol 2009 ; 182 : 3510–3521. [CrossRef] [PubMed] [Google Scholar]
- Noh KH, Kim BW, Song KH, et al. Nanog signaling in cancer promotes stem-like phenotype and immune evasion. J Clin Invest 2012 ; 122 : 4077–4093. [CrossRef] [PubMed] [Google Scholar]
- Olson P, Lu J, Zhang H, et al. MicroRNA dynamics in the stages of tumorigenesis correlate with hallmark capabilities of cancer. Genes Dev 2009 ; 23 : 2152–2165. [CrossRef] [PubMed] [Google Scholar]
- Imamura T, Kikuchi H, Herraiz MT, et al. HIF-1alpha and HIF-2alpha have divergent roles in colon cancer. Int J Cancer 2009 ; 124 : 763–771. [CrossRef] [PubMed] [Google Scholar]
- Balsamo M, Manzini C, Pietra G, et al. Hypoxia downregulates the expression of activating receptors involved in NK-cell-mediated target cell killing without affecting ADCC. Eur J Immunol 2013 ; 43 : 2756–2764. [CrossRef] [PubMed] [Google Scholar]
- Cao P, Deng Z, Wan M, et al. MicroRNA-101 negatively regulates Ezh2, its expression is modulated by androgen receptor, HIF-1alpha/HIF-1beta. Mol Cancer 2010 ; 9 : 108. [CrossRef] [PubMed] [Google Scholar]
- Chan YC, Banerjee J, Choi SY, Sen CK. miR-210: the master hypoxamir. Microcirculation 2012 ; 19 : 215–223. [CrossRef] [PubMed] [Google Scholar]
- Akalay I, Janji B, Hasmim M, et al. Epithelial-to-mesenchymal transition and autophagy induction in breast carcinoma promote escape from T-cell-mediated lysis. Cancer Res 2013 ; 73 : 2418–2427. [CrossRef] [PubMed] [Google Scholar]
- Siemens DR, Hu N, Sheikhi AK, et al. Hypoxia increases tumor cell shedding of MHC class I chain-related molecule: role of nitric oxide. Cancer Res 2008 ; 68 : 4746–4753. [CrossRef] [PubMed] [Google Scholar]
- Yamada N, Yamanegi K, Ohyama H, et al. Hypoxia downregulates the expression of cell surface MICA without increasing soluble MICA in osteosarcoma cells in a HIF-1alpha-dependent manner. Int J Oncol 2012 ; 41 : 2005–2012. [PubMed] [Google Scholar]
- Perier A, Fregni G, Wittnebel S, et al. Mutations of the von Hippel-Lindau gene confer increased susceptibility to natural killer cells of clear-cell renal cell carcinoma. Oncogene 2011 ; 30 : 2622–2632. [CrossRef] [PubMed] [Google Scholar]
- Mantovani A, Sozzani S, Locati M, et al. Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends Immunol 2002 ; 23 : 549–555. [CrossRef] [PubMed] [Google Scholar]
- Murdoch C, Muthana M, Coffelt SB, Lewis CE. The role of myeloid cells in the promotion of tumour angiogenesis. Nat Rev Cancer 2008 ; 8 : 618–631. [CrossRef] [PubMed] [Google Scholar]
- Doedens AL, Stockmann C, Rubinstein MP, et al. Macrophage expression of hypoxia-inducible factor-1 alpha suppresses T-cell function and promotes tumor progression. Cancer Res 2010 ; 70 : 7465–7475. [CrossRef] [PubMed] [Google Scholar]
- Leek RD, Talks KL, Pezzella F, et al. Relation of hypoxia-inducible factor-2 alpha (HIF-2 alpha) expression in tumor-infiltrative macrophages to tumor angiogenesis and the oxidative thymidine phosphorylase pathway in Human breast cancer. Cancer Res 2002 ; 62 : 1326–1329. [PubMed] [Google Scholar]
- Peranzoni E, Zilio S, Marigo I, et al. Myeloid-derived suppressor cell heterogeneity and subset definition. Curr Opin Immunol 2010 ; 22 : 238–244. [CrossRef] [PubMed] [Google Scholar]
- Corzo CA, Condamine T, Lu L, et al. HIF-1alpha regulates function and differentiation of myeloid-derived suppressor cells in the tumor microenvironment. J Exp Med 2010 ; 207 : 2439–2453. [CrossRef] [PubMed] [Google Scholar]
- Sceneay J, Chow MT, Chen A, et al. Primary tumor hypoxia recruits CD11b+/Ly6Cmed/Ly6G+ immune suppressor cells and compromises NK cell cytotoxicity in the premetastatic niche. Cancer Res 2012 ; 72 : 3906–3911. [CrossRef] [PubMed] [Google Scholar]
- Fan J, Cai H, Li Q, et al. The effects of ROS-mediating oxygen tension on human CD34(+)CD38(-) cells induced into mature dendritic cells. J Biotechnol 2012 ; 158 : 104–111. [CrossRef] [PubMed] [Google Scholar]
- Jantsch J, Chakravortty D, Turza N, et al. Hypoxia and hypoxia-inducible factor-1 alpha modulate lipopolysaccharide-induced dendritic cell activation and function. J Immunol 2008 ; 180 : 4697–4705. [CrossRef] [PubMed] [Google Scholar]
- Bosco MC, Pierobon D, Blengio F, et al. Hypoxia modulates the gene expression profile of immunoregulatory receptors in human mature dendritic cells: identification of TREM-1 as a novel hypoxic marker in vitro and in vivo. Blood 2011 ; 117 : 2625–2639. [CrossRef] [PubMed] [Google Scholar]
- Blengio F, Raggi F, Pierobon D, et al. The hypoxic environment reprograms the cytokine/chemokine expression profile of human mature dendritic cells. Immunobiology 2013 ; 218 : 76–89. [CrossRef] [PubMed] [Google Scholar]
- Olin MR, Andersen BM, Litterman AJ, et al. Oxygen is a master regulator of the immunogenicity of primary human glioma cells. Cancer Res 2011 ; 71 : 6583–6589. [CrossRef] [PubMed] [Google Scholar]
- Sun J, Zhang Y, Yang M, et al. Hypoxia induces T-cell apoptosis by inhibiting chemokine C receptor 7 expression: the role of adenosine receptor A(2). Cell Mol Immunol 2010 ; 7 : 77–82. [CrossRef] [PubMed] [Google Scholar]
- Makino Y, Nakamura H, Ikeda E, et al. Hypoxia-inducible factor regulates survival of antigen receptor-driven T cells. J Immunol 2003 ; 171 : 6534–6540. [CrossRef] [PubMed] [Google Scholar]
- Larbi A, Zelba H, Goldeck D, Pawelec G. Induction of HIF-1alpha and the glycolytic pathway alters apoptotic and differentiation profiles of activated human T cells. J Leukoc Biol 2010 ; 87 : 265–273. [CrossRef] [PubMed] [Google Scholar]
- Caldwell CC, Kojima H, Lukashev D, et al. Differential effects of physiologically relevant hypoxic conditions on T lymphocyte development and effector functions. J Immunol 2001 ; 167 : 6140–6149. [CrossRef] [PubMed] [Google Scholar]
- Lukashev D, Klebanov B, Kojima H, et al. Cutting edge: hypoxia-inducible factor 1alpha and its activation-inducible short isoform I.1 negatively regulate functions of CD4+ and CD8+ T lymphocytes. J Immunol 2006 ; 177 : 4962–4965. [CrossRef] [PubMed] [Google Scholar]
- Clambey ET, McNamee EN, Westrich JA, et al. Hypoxia-inducible factor-1 alpha-dependent induction of FoxP3 drives regulatory T-cell abundance and function during inflammatory hypoxia of the mucosa. Proc Natl Acad Sci USA 2012 ; 109 : E2784–E2793. [CrossRef] [Google Scholar]
- Dang EV, Barbi J, Yang HY, et al. Control of T(H)17/T(reg) balance by hypoxia-inducible factor 1. Cell 2011 ; 146 : 772–784. [CrossRef] [PubMed] [Google Scholar]
- Winn HR, Rubio R, Berne RM. Brain adenosine concentration during hypoxia in rats. Am J Physiol 1981 ; 241 : H235–H242. [PubMed] [Google Scholar]
- Ohta A, Gorelik E, Prasad SJ, et al. A2A adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci USA 2006 ; 103 : 13132–13137. [CrossRef] [Google Scholar]
- Facciabene A, Peng X, Hagemann IS, et al. Tumour hypoxia promotes tolerance and angiogenesis via CCL28 and T(reg) cells. Nature 2011 ; 475 : 226–230. [CrossRef] [PubMed] [Google Scholar]
- Sarkar S, Germeraad WT, Rouschop KM, et al. Hypoxia induced impairment of NK cell cytotoxicity against multiple myeloma can be overcome by IL-2 activation of the NK cells. PLoS One 2013 ; 8 : e64835. [CrossRef] [PubMed] [Google Scholar]
- Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med 2012 ; 366 : 2455–2465. [Google Scholar]
- Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012 ; 366 : 2443–2454. [Google Scholar]
- Provot S. Contrôle de la croissance et de la dissémination tumorales par le microenvironnement : certitudes et hypothèses émergentes. Med Sci (Paris) 2014 ; 30 : 366–371. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Buache E, Rio MC. Le stroma tumoral, un terreau fertile pour la cellule cancéreuse. Med Sci (Paris) 2014 ; 30 : 385–390. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Albrengues J, Meneguzzi G, Gaggioli C. L’invasion des cellules tumorales : quand les fibroblastes s’en mêlent. Med Sci (Paris) 2014 ; 30 : 391–397. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Hubert S, Abastado JP. Les étapes précoces du processus métastatique. Med Sci (Paris) 2014 ; 30 : 378–384. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Bruchard M, Ghiringhelli F. Micro-environnement tumoral : cellules régulatrices et cytokines immunosuppressives. Med Sci (Paris) 2014 ; 30 : 429–435. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Galon J, Bindea G, Mlecnik B, et al. Microenvironnement immunitaire et cancer : intérêt de l'immunoscore pour prédire l'évolution clinique. Med Sci (Paris) 2014 ; 30 : 439–444. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Tartour E, Sandoval F, Bonnefoy JY, Fridman WH. Cancer immunotherapy: recent breakthroughs and perspectives. Med Sci (Paris) 2011 ; 27 : 833–841. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Régulation de HIF-1 α par l’oxygène. En normoxie, HIF-1α est hydroxylée par les prolyl-hydroxylases (PHD), ce qui entraîne son interaction avec la protéine suppresseur de tumeur von Hippel-Lindau (pVHL). pVHL recrute à son tour l’ubiquitine ligase E3 qui catalyse la poly-ubiquitination de HIF-1α, entraînant la dégradation de HIF-1α via le protéasome. En hypoxie, l’activité des PHD est inhibée, ce qui stabilise HIF-1α et entraîne sa translocation dans le noyau où, associée à HIF-β, elle exerce son activité transcriptionnelle en se liant aux séquences HRE (hypoxia-response element) présentes dans la région promotrice des gènes cibles. Outre la régulation strictement dépendante de l’oxygène, HIF-1α est également régulée par plusieurs mécanismes activés par des mutations (mutations des gènes fumarate hydratase [FH], succinate hydratase [SH], VHL, Raf et microphtalmia-associated transcription factor [MITF]). IGF : insulin-like growth factor ; EGF, epidermal growth factor ; MAPK : mitogen-activated protein kinase ; PI3K : phosphoinositide 3-kinase. |
| Dans le texte | |
 |
Figure 2. Influence de l’hypoxie sur les cellules de l’immunité innée et adaptative. Les tumeurs solides contiennent des zones où la concentration d’oxygène est variable. Les cellules tumorales les plus proches d’un vaisseau sanguin perfusé ont des concentrations d’oxygène relativement élevées (cellule normoxique rouge). Les concentrations d’oxygène diminuent à mesure que la distance par rapport aux vaisseaux sanguins augmente (cellule hypoxique bleue). Sont représentés les divers effets de l’hypoxie sur les cellules tumorales et sur les cellules de l’immunité innée (macrophages, cellules dendritiques, MDSC, NK et neutrophiles) et adaptative (CTL, Treg). DC : cellules dendritiques ; MDSC : cellules myéloïdes suppressives ; NK : cellules tueuses naturelles ; CTL : lymphocytes T cytotoxiques ; Treg : lymphocytes T régulateurs. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




