Figure 1.
Télécharger l'image originale
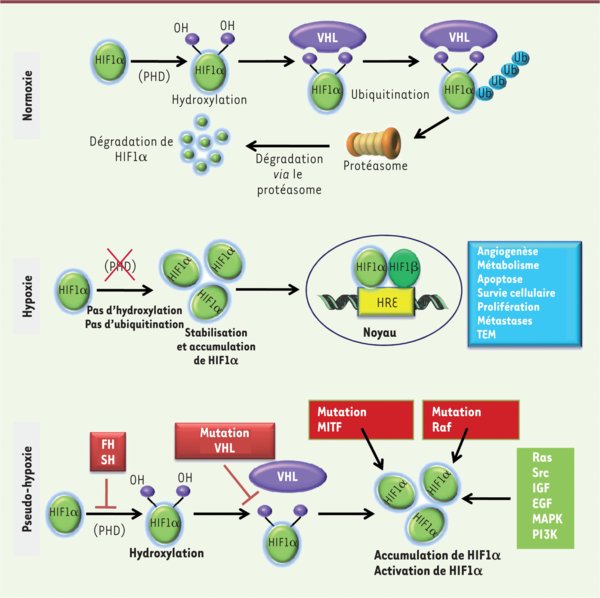
Régulation de HIF-1 α par l’oxygène. En normoxie, HIF-1α est hydroxylée par les prolyl-hydroxylases (PHD), ce qui entraîne son interaction avec la protéine suppresseur de tumeur von Hippel-Lindau (pVHL). pVHL recrute à son tour l’ubiquitine ligase E3 qui catalyse la poly-ubiquitination de HIF-1α, entraînant la dégradation de HIF-1α via le protéasome. En hypoxie, l’activité des PHD est inhibée, ce qui stabilise HIF-1α et entraîne sa translocation dans le noyau où, associée à HIF-β, elle exerce son activité transcriptionnelle en se liant aux séquences HRE (hypoxia-response element) présentes dans la région promotrice des gènes cibles. Outre la régulation strictement dépendante de l’oxygène, HIF-1α est également régulée par plusieurs mécanismes activés par des mutations (mutations des gènes fumarate hydratase [FH], succinate hydratase [SH], VHL, Raf et microphtalmia-associated transcription factor [MITF]). IGF : insulin-like growth factor ; EGF, epidermal growth factor ; MAPK : mitogen-activated protein kinase ; PI3K : phosphoinositide 3-kinase.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




