| Issue |
Med Sci (Paris)
Volume 35, Number 12, Décembre 2019
Anticorps monoclonaux en thérapeutique
|
|
|---|---|---|
| Page(s) | 1043 - 1053 | |
| Section | Les anticorps armés | |
| DOI | https://doi.org/10.1051/medsci/2019228 | |
| Published online | 06 January 2020 | |
Les immunoconjugués en oncologie
Les nouvelles stratégies en développement
Antibody-drug conjugates in oncology. New strategies in development
1
Institut de Recherche Pierre Fabre, Centre d’Immunologie Pierre Fabre, 5 Avenue Napoléon III, 74160 Saint Julien-en-Genevois, France
2
Cancer Research Center of Lyon (CRCL), Inserm 1052/CNRS, 69000 Lyon, France
3
Université de Lyon, 69000 Lyon, France
4
Hospices Civils de Lyon, 69000 Lyon, France
5
GICC EA7501, Université de Tours, équipe IMT, 31 avenue Monge, 37200 Tours, France
* nicolas.joubert@univ-tours.fr
Un anticorps armé (ADC, antibody-drug conjugate en anglais) est une chimiothérapie vectorisée qui résulte du greffage d’un agent cytotoxique sur un anticorps monoclonal par l’intermédiaire d’un bras espaceur judicieusement construit. Les anticorps armés ont fait des progrès considérables en 10 ans. En 2009, seul le gemtuzumab ozogamicine (Mylotarg®) était utilisé en clinique. En 2019, 4 autres ADC ont été approuvés par la Food and Drug Administration et plus de 80 autres sont en études cliniques actives. La seconde partie de cette revue sera focalisée sur les nouvelles stratégies émergentes pour faire face aux limitations des ADC actuels et pour tenter d’élargir leur fenêtre thérapeutique. Enfin, les combinaisons avec la chimiothérapie classique ou les inhibiteurs de points de contrôles seront discutées, pour tenter de faire des anticorps armés la magic bullet dont rêvait Paul Ehrlich.
Abstract
An Antibody-Drug Conjugate (armed antibody) is a vectorized chemotherapy that results from the grafting of a cytotoxic agent on a monoclonal antibody via a judiciously designed spacer arm. ADCs have made considerable progress in 10 years. In 2009, only gemtuzumab ozogamicin (Mylotarg®) was used clinically. In 2019, 4 other ADCs have been approved and more than 80 others are in active clinical trials. The second part of this review will focus on new emerging strategies to address ADCs drawbacks and attempt to broaden their therapeutic window. Finally, combinations with conventional chemotherapy or checkpoint inhibitors will be discussed, in the pursuit to make Antibody-Drug Conjugates the embodiment of Paul Ehrlich’s dream of the magic bullet.
© 2019 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Pour surmonter les limitations des ADC actuels précédemment mentionnées en première partie, cette seconde partie se focalisera sur des ADC innovants conçus et faisant actuellement l’objet d’évaluations précliniques et d’études en phase clinique. Ces nouveaux ADC sont caractérisés par des innovations concernant la chimie de bioconjugaison (menant à des ADC homogènes), la partie ciblage (anticorps ou fragments), l’espaceur (mécanisme de libération) ou le cytotoxique (mécanisme d’action). Enfin, les combinaisons avec la chimiothérapie classique ou les inhibiteurs de points de contrôles seront également discutées.
ADC de troisième génération
ADC homogènes (site-specific ADC)
Chaque ADC approuvé est un mélange hétérogène rendant très difficile son analyse [1] et le contrôle de son procédé de fabrication. Le DAR n’est pas maîtrisé, et le mélange complexe d’une préparation d’ADC influence significativement les profils de pharmacocinétique-pharmacodynamique (PK-PD) de l’ADC: l’anticorps nu pourrait être un inhibiteur compétitif, les conjugués ayant un DAR faible sont peu efficaces et ceux au DAR élevé sont rapidement éliminés, compromettant la fenêtre thérapeutique de l’ADC. Afin d’élargir cette dernière, des méthodologies de bioconjugaison régio-spécifiques ont été développées depuis 2008 [2-4] et peuvent être divisées en trois catégories: (1) la bioconjugaison d’acides aminés naturels ou non, (2) la bioconjugaison à l’aide d’enzymes ou (3) la bioconjugaison à base d’espaceurs.
Une première approche a consisté à introduire des acides aminés spécifiques par ingénierie d’anticorps. Junutula et ses collègues ont été les pionniers en 2008 en démontrant que la bioconjugaison contrôlée (régio-spécifique) d’un cytotoxique sur un AcM améliorait l’indice thérapeutique de l’ADC [5]. Pour permettre la conjugaison spécifique de l’espaceur-cytotoxique de l’Adcetris® à un AcM ciblant l’antigène du cancer de l’ovaire MUC16, ces auteurs ont mis au point deux substitutions par cystéine afin de préserver le repliement de l’immunoglobuline (IgG), son assemblage et la liaison à l’antigène (Ag) (Figure 1A). L’ADC THIOMAB (TDC) résultant a été comparé à un ADC généré à partir d’une méthode de bioconjugaison stochastique (en utilisant des cystéines issues de ponts disulfures inter-chaînes réduits). ADC et TDC étaient également efficaces dans les modèles de xénogreffe de souris, mais le TDC était toléré à des doses plus élevées que l’ADC chez le rat et le singe cynomolgus et présentait une moindre toxicité systémique in vivo. Inspirés par cette stratégie, deux firmes ont mis au point une technologie analogue MAIA, pour la bioconjugaison de leurs dimères pyrrolobenzodiazépines (PBD), en introduisant une mutation sérine-cystéine en position 239 dans la région charnière de l’anticorps (Figure 1A) [6].
 |
Figure 1. A. ADC homogènes générés par ingénierie d’anticorps suivie d’une bio-conjugaison régio-spécifique (DAR 2). B. ADC homogène généré par déglycosylation (position Q295) en présence de PNGase F suivie d’une bioconjugaison par la transglutaminase (position 297) (L’immunoconjugué azoture, en présence de DBCO-espaceur-MMAE, permet la production d’un ADC homogène de DAR 2). C. ADC homogène de DAR 4 obtenu par réduction ménagée (TCEP) des 4 ponts disulfures inter-chaînes suivie d’une réaction de bioconjugaison via un espaceur dibromomaléimide (DBM). |
Une deuxième possibilité est l’utilisation de technologies de bioconjugaison régio-spécifique à l’aide d’une réaction enzymatique. La transglutaminase et les sortases peuvent être utilisées à cette fin [2-4] ; par exemple, la transglutaminase catalyse la formation de liaisons amides entre une chaîne latérale de glutamine et une molécule contenant une amine primaire [7]. Ainsi, Strop et al. ont mis au point une méthodologie en trois étapes utilisant la transglutaminase pour construire un ADC [7]. L’AcM est tout d’abord déglycosylé par l’enzyme PNGase F au niveau de l’asparagine 297. Ensuite, un espaceur hétérobifonctionnel aminé et azoté est bioconjugué à l’AcM sur la glutamine 295 en présence d’une transglutaminase microbienne. Enfin, la MMAE est greffée via une cyclo-addition de Huisgen sans catalyse au cuivre (SPAAC) entre le conjugué azoture et un espaceur portant le dibenzylcyclooctyne (DBCO) et la MMAE, afin de générer un ADC avec un DAR de 2 (Figure 1B).
Enfin, des ADC régiospécifiques peuvent également être générés à partir d’AcM natifs. Dans cette stratégie, des espaceurs hétérobifonctionnels comprenant un maléimide de seconde génération (SGM), par exemple le dibromomaléimide (DBM) [8, 9] ou le dithiophénylmaléimide (DSPh) [10], peuvent générer des ADC plus homogènes et stables par bioconjugaison régiospécifique, avec un DAR de 4 (dans le cas de l’IgG1). Les systèmes de bioconjugaison SGM régiospécifiques offrent l’avantage, par rapport à la bioconjugaison stochastique avec le maléimide classique, de limiter la formation d’espèces à DAR faible et élevé, d’améliorer la stabilité structurelle des anticorps après bioconjugaison ainsi que les propriétés pharmacocinétiques et l’indice thérapeutique de l’ADC résultant (Figure 1C) [10].
Nouveaux formats d’ADC
Malgré leur efficacité, la plupart des ADC ciblant des tumeurs solides n’ont pas progressé au-delà d’essais cliniques de phase II, ce qui suggère qu’il existe des paramètres supplémentaires nécessitant d’être optimisés pour atteindre une mise sur le marché [11, 12]. Le nombre d’ADC pour le traitement des tumeurs solides est limité et un nombre croissant de ces conjugués ont été arrêtés en raison d’une activité insuffisante à des doses répétées, à la DMT. Ceci peut être expliqué par le fait que presque tous les ADC sont fondés sur un format IgG complet. Par conséquent, leur efficacité est limitée par leur taille (150 kDa), associée à une pénétration et une absorption médiocres dans la tumeur [13]. En plus de la taille de l’IgG, il est maintenant considéré que la région Fc de celle-ci est délétère pour l’efficacité de l’ADC [14]. En effet, la longue demi-vie des ADC due à leur recyclage par le récepteur néonatal de la région Fc (FcRn) [15] augmente l’exposition aux tissus sains, et que les récepteurs pour la région Fc des IgG (RFcγ) exprimés sur de nombreuses cellules du système immunitaire peuvent fixer ces ADC, ces deux phénomènes étant associés à une toxicité off-target [16, 17].
Des formats de conjugués de plus petites tailles [14, 18, 19] ont été explorés pour remédier à ces inconvénients, notamment en utilisant peptides [20], fragments d’anticorps à domaine unique (sdAb ou VHH) [21], fragments variables à chaîne unique (scFv) [22], fragments de liaison à l’antigène (Fab) [23] ou de petites immuno-protéines (SIP sous forme de scFv dimérisées à l’aide d’un domaine CHε4) [24]. Étonnamment, seuls quelques exemples de molécules cytotoxiques (appelés ci-après « cytotoxiques ») efficacement vectorisés avec ces nouveaux formats d’anticorps ont été publiés: l’équipe de Janda a décrit plusieurs conjugués scFv-duocarmycine (DAR 1 ou 2), ciblant l’intégrine α3β1, avec une EC50 comprise entre 2,7 et 180,8 nM sur les cellules de carcinome pancréatique SW1990 [25]. L’équipe de Godwin a décrit un conjugué Fab-MMAE site-spécifique (DAR 1), ciblant HER2/neu et présentant une EC50 de 0,2 nM sur des cellules de cancer du sein SK-BR-3 [23]. Quant à l’équipe de Spidel, elle a généré deux conjugués scFv-auristatine F optimisés (DAR 2), ciblant CA9, un antigène associé aux tumeurs du colon, présentant une efficacité similaire, avec une EC50 de 0,57 et 0,81 nM sur des cellules cancéreuses du colon HT116-CA9 [26].
Plus récemment, deux cystéines ont été judicieusement incorporées en position C-terminale d’un scFv anti-HER2/neu afin de permettre la bioconjugaison contrôlée d’un espaceur hétérobifonctionnel, comprenant un maléimide de seconde génération, clivable (pour la MMAE) ou non clivable (pour la MMAF), et de générer deux nouveaux conjugués scFv-cytotoxique (SDC, Figure 2A) [27]. Les deux SDC conservent leur affinité pour HER2/neu et sont capables de tuer efficacement les cellules SK-BR-3 HER2/neu+ in vitro à des concentrations subnanomolaires (EC50 de 0,68 nM et 0,32 nM), sans effet sur les cellules MCF-7 HER2/neu-. Les SDC de DAR 1 ne sont pas encore aussi puissants que les ADC correspondants de DAR 4 [28], mais leur potentiel est prometteur contre les tumeurs solides [29].
Les ADC actuels ciblant HER2 sont inefficaces pour éliminer les cellules cancéreuses exprimant des niveaux faibles de HER2/neu. Par conséquent, environ 20 % seulement des patientes atteintes d’un cancer du sein sont éligibles pour des thérapies ciblées sur HER2/neu. De plus, l’hétérogénéité intra-tumorale de l’expression de HER2/neu est finalement responsable de la rechute des patientes ayant initialement répondu au traitement. Afin d’obtenir une activité anti-tumorale puissante dans les cellules cancéreuses présentant une gamme plus large d’expression de HER2/neu, un ADC biparatopique ciblant HER2/neu a été développé (Figure 2B) [30], visant deux épitopes de HER2/neu distincts (épitopes ciblés individuellement par le trastuzumab et le pertuzumab), induisant un pontage des récepteurs HER2/neu, favorisant une internalisation rapide, ainsi qu’un trafic et une dégradation lysosomale améliorés. Deux résidus cystéine par chaîne lourde (S239C et S442C) ont été introduits par ingénierie, pour produire un ADC biparatopique de DAR 4, via la bioconjugaison régio-spécifique d’un espaceur maléimidocaproyle lié à la tubulysine AZ13599185 (inhibiteur de microtubules). Ce cytotoxique très puissant (IC50 de l’ordre du picomolaire) présente également une très faible affinité pour les MDR (multidrug resistance proteins: protéines transmembranaires assurant l’efflux des xénobiotiques hors des cellules). Par conséquent, l’ADC biparatopique démontre une activité anti-tumorale supérieure à celle du Kadcyla® dans divers modèles de tumeurs représentant diverses sous-populations de patientes. En outre, deux mutations combinées (L234F et S239C) ont réduit la liaison aux RFcg afin de minimiser l’internalisation aspécifique de l’ADC (indépendante de HER2/neu) due aux RFcg des tissus normaux, réduisant ainsi la toxicité non ciblée conduisant par exemple à une thrombocytopénie [31]. Les essais cliniques de cet ADC ont aussi été arrêtés, en 2018.
Nouveaux ciblages et systèmes de libération associés
Le ciblage d’antigènes membranaires exposés à la surface de cellules cancéreuses et qui internalisent une fois fixés par un anticorps spécifique (appelés ci-après internalisants) peut être extrêmement difficile dans les tumeurs solides riches en stroma intercellulaire. Ainsi, une nouvelle approche consiste à cibler le microenvironnement tumoral (stroma ou vaisseaux) au lieu des cellules cancéreuses [32, 33]. Dans cette stratégie, des composants de la matrice extracellulaire (protéases, milieu acide ou glutathion réducteur) pourraient être utilisés pour une libération extracellulaire efficace de cytotoxiques utilisés dans des ADC non-internalisants.
À cette fin, Neri et ses collaborateurs ont décrit des immunoconjugués fondés sur un mutant F8 d’une immunoprotéine SIP (small immunoprotein) ciblant le domaine extracellulaire non internalisé de la fibronectine. La fibronectine est un composant de la matrice extracellulaire sous-endothéliale de la tumeur, facilement accessible aux immunoconjugués par rapport à la surface de la cellule cancéreuse [34]. Le format SIP résulte de la fusion d’un scFv avec le domaine CH4ε d’une IgE humaine [34]. Le SIP(F8) a également été produit avec deux résidus cystéine non appariés en position C-terminale, permettant la bioconjugaison contrôlée de deux molécules de DM1 afin de produire le conjugué SIP(F8)-SS-DM1 avec un DAR 2 (Figure 2C) [24]. Ceci a été comparé à son homologue IgG(F8)-SS-DM1, portant un résidu de cystéine non apparié en position C-terminale de chaque chaîne légère (Figure 2C). Dans ces immunoconjugués, le pont disulfure formé après bioconjugaison est sensible au glutathion extracellulaire tumoral, libérant la DM1 non modifiée sans aucun espaceur résiduel.
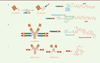 |
Figure 2. A. SDC (scFv-drug conjugate) homogène de DAR 1 obtenu par réduction ménagée (TCEP) du pont disulfure intra-chaîne en C-terminal suivie d’une réaction de bioconjugaison via un linker dithiophénylmaléimide (DSPh). B. ADC homogène de DAR 4 comprenant un anticorps biparatopique anti-HER2 conjugué à une tubulysine via un linker maléimidocaproïque. C. Immunoconjugués IgG(F8)-SS-DM1 et SIP(F8)-SS-DM1 et formule du cytotoxique DM1. |
SIP(F8)-SS-DM1 s’est avéré être un meilleur candidat que son analogue IgG(F8)-SS-DM1 dans des expériences thérapeutiques in vivo. Neri et ses collègues ont démontré que le SIP(F8)-SS-DM1 s’accumulait préférentiellement dans la matrice tumorale extracellulaire sous-endothéliale, présentait une cinétique de libération de DM1 plus rapide et était bien toléré à des doses cliniquement pertinentes [24]. Enfin, l’avantage des ADC non-internalisants est le contournement de certains mécanismes de résistance par rapport aux immunoconjugués internalisants.
Nouveaux agents cytotoxiques
En parallèle, de nouveaux cytotoxiques ont été développés pour cibler les cellules cancéreuses à faible expression d’Ag ou résistantes aux auristatines ou aux maytansinoïdes. À cette fin, des dimères de PBD ont été mis au point, contenant deux fonctions imines alkylantes, capables de former des liaisons covalentes avec l’ADN: ils sont environ 50 à 100 fois plus efficaces que les cytotoxiques classiques utilisés pour les ADC (MMAE ou DM1), présentant une activité picomolaire contre les cellules de nombreuses lignées tumorales humaines (IC50 = 2 - 7 pM) [35]. Les dimères de PBD ont été introduits en tant que cytotoxiques d’ADC à la fin des années 2000. Cela a conduit au développement de SGN-CD33A [6] et de SGN-CD70A [36], deux ADC à base de PBD dont les essais cliniques de phase III ont été récemment arrêtés. Les deux ADC contiennent le même espaceur-cytotoxique clivable appelé talirine ; un espaceur maléimidocaproyle avec une gâchette valine-alanine-PAB sensible à la cathepsine B, capable de conjuguer le dimère de PBD SGN-1882 à deux résidus cystéines incorporés par ingénierie dans la région charnière de l’AcM (mutation S239C), donnant un DAR contrôlé de 2 (Figure 3A). La toxicité élevée de ces ADC permet le ciblage d’Ag moins exprimés, tel que CD33 ou CD70. De plus, les dimères de PBD n’étant pas des substrats des MDR et ne visant pas la tubuline, ils peuvent également être utilisés en tant que cytotoxiques d’ADC contre des tumeurs résistantes aux ADC à base de MMAE ou de DM1.
Si la talirine conjuguée n’a pas donné satisfaction en clinique, son homologue, la tésirine conjuguée, offre un résultat mitigé (Figure 3B): le rovalpituzumab tésirine (Rova-T ou SC16LD6.5) est un ADC anti-DLL3 dont l’essai en phase III dans le cancer du poumon à petites cellules a récemment été arrêté, tandis que le loncastuximab tésirine (ADCT-402) est testé en phase II pivotale contre la leucémie aiguë lymphoblastique à cellules B. La tésirine (SG3249) a été conçue pour combiner une activité anti-tumorale puissante avec des propriétés physico-chimiques souhaitables (e.g. hydrophobie favorable et bioconjugaison améliorée). Une des imines réactives est coiffée d’un espaceur valine-alanine clivable par la cathepsine B.
De manière analogue, en 2009, Ravi Chari et ses collègues ont présenté les indolinobenzodiazépines (IGN) [37]. Leur utilisation en tant que cytotoxiques d’ADC a permis de générer des ADC très puissants contre les cellules cancéreuses même multi-résistantes in vitro (IC50 = 5 - 20 pM) exprimant de faibles niveaux d’Ag (7 000 Ag par cellule).
En parallèle, un nouvel analogue d’anthracycline, nommé PNU-159682, a récemment été développé. Les anthracyclines sont l’une des classes de chimiothérapies les plus largement utilisées. Le très puissant PNU-159682 (IC50 de 20-100 pM) a été utilisé pour générer l’ADC anti-CD22-NMS249, via un espaceur MC-VC-PAB-DEA auto-immolable allongé comprenant en plus du PAB classique une N,N’-diméthyléthylènediamine (DEA) (Figure 3C) [38]. In vivo, cet ADC anti-CD22-NMS249 était au moins aussi efficace qu’un ADC anti-CD22-VC-MMAE dans des modèles tumoraux de xénogreffe, mais conservait son efficacité dans un modèle résistant à l’ADC anti-CD22-VC-MMAE [38].
 |
Figure 3. A. ADC homogène de DAR2 portant la talirine incluant un dérivé dimérique de pyrrolobenzodiazépine (SGN-1882). B. ADC homogènes de DAR2 portant la tésirine incluant un dérivé dimérique de pyrrolobenzodiazépine (SGN-3199). C. ADC homogène incluant un dérivé d’anthracycline (PNU-159682). PBD dimer: dimère de PBD. |
Stratégies combinées au-delà des dogmes: ADC en phase II pivotale ou en phase III
Le développement des ADC a généré de nombreux dogmes. Parmi eux, on peut citer le ciblage d’un Ag non exprimé de manière ubiquitaire, le ciblage d’un Ag fortement surexprimé, un Ag internalisant, un cytotoxique dont le potentiel d’activité devait atteindre celui des auristatines et maytansines, et l’IgG comme seul format pour garantir un temps de demi-vie élevé et éventuellement la conservation de l’activité effectrice de l’anticorps à partir duquel l’ADC était généré. Nous allons voir que parmi les ADC les plus avancés dans les études cliniques, non seulement ces derniers combinent plusieurs innovations (parmi lesquelles la cible, le format, le système de libération, le mécanisme d’action du cytotoxique), mais ils bousculent également un ou plusieurs dogmes avec succès.
Parmi eux, le mirvétuximab soravtansine est un exemple de développement très intéressant [39-41]. Cet ADC est plutôt surprenant car le système de libération en conditions réductrices fut considéré comme trop sensible lors du développement de l’ado-trastuzumab emtansine. Le mirvétuximab soravtansine résulte donc de la bioconjugaison de la ravtansine (DM4) à un anticorps anti-folate R1, via un espaceur clivable en milieu réducteur (glutathion), optimisé par la présence de deux groupements méthyles en position alpha du pont disulfure et par la présence d’un groupement sulfonyle améliorant l’hydrophilie de l’espaceur et donc la bioconjugaison de la DM4 (Figure 4A). Cet ADC est actuellement testé contre le cancer épithélial de l’ovaire dans une étude clinique de phase III.
Etonnamment, malgré le développement de nombreuses technologies permettant une bioconjugaison régiosélective d’un AcM, à l’index thérapeutique amélioré (10 en étude clinique et plus de 40 en pré-clinique), aucune d’entre elles n’a encore été validée par l’approbation d’un ADC homogène. On retrouve d’ailleurs l’espaceur-cytotoxique de seconde génération de l’Adcetris® (mc-VC-MAB-MMAE, Figure 1A) dans l’enfortumab védotine, un ADC résultant d’une bioconjugaison stochastique sur les résidus cystéines d’un anticorps ciblant la Nectine 4, actuellement en étude clinique de phase II pivotale [42]. Le 16 juillet 2019, un BLA (Biologics License Application) pour cet ADC a été soumis à la FDA pour une possible mise sur le marché accélérée pour des patients atteints de cancers urothéliaux métastatiques et préalablement traités par des anticorps anti-PD1/PDL1.
L’EGFR (epithelial growth factor receptor) est exprimé de manière ubiquitaire au niveau des cellules épithéliales en général et la peau en particulier, et ne semblait pas être une cible favorable pour un ADC. Pourtant, l’ADC ABT-414 a été généré en bioconjuguant de manière stochastique la MMAF (auristatine optimisée pour être utilisée avec un espaceur non clivable) via un espaceur maléimide à un AcM ciblant une isoforme particulière de l’EGFR surexprimée dans les tumeurs, l’EGVRvIII (Figure 4B). Le dépatuximab mafodotine était encore récemment testé contre le glioblastome dans des études cliniques de phase III [43] arrêtées en 2019. Par contre, le bélantamab mafodotine, utilisant la même technologie de conjugaison (maléimide + MMAF) sur un anticorps de type IgG1 afucosylé anti-BCMA (B-cell maturation antigen) (Figure 4B), est actuellement en étude clinique de phase II pivotale contre le lymphome diffus à grandes cellules B.
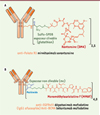 |
Figure 4. A. Formule du mirvétuximab soravtansine, anticorps anti-folate R1 conjugué à la DM4 via un espaceur non clivable. B. Formule des dépatuximab mafodotine et bélantuzumab mafodotine, anticorps conjugués à la MMAF via un espaceur non clivable. |
Malgré le ciblage spécifique d’un antigène, les ADC sont encore associés à une forte toxicité, spécifique ou non à leur cible due à plusieurs mécanismes engendrant la libération anticipée non contrôlée du cytotoxique en dehors de la tumeur. Devant ce constat, certaines sociétés se sont tournées vers l’utilisation de cytotoxiques moins puissants que la MMAE ou la DM1, et au mécanisme d’action original pour lutter contre la résistance aux inhibiteurs de la polymérisation de la tubuline. Ces ADC possèdent également des systèmes de libération pas forcément spécifiques de conditions intracellulaires.
À cette fin, un triple pari a été gagné avec la génération du sacituzumab govitécan (IMMU-132, Figure 5A ), un anticorps anti-Trop-2 (cible peu exprimée) [44] conjugué au SN-38 (métabolite actif de l’irinotécan, moins actif que MMAE et DM1, avec un mécanisme d’action original) via un espaceur maléimide clivable (à pH acide, système de libération mixte intra- et extracellulaire) et pégylé. L’accomplissement est d’autant plus impressionnant que cet ADC est indiqué dans le cancer du sein triple négatif (TNBC) pour lequel il n’existe toujours pas de traitement [45]. Grâce à son espaceur pégylé, cet ADC possède un DAR 8, sans compromettre sa tolérance ni son efficacité. Le DAR 4 a longtemps été idéalisé comme optimal (DM1 ou MMAE). Cet ADC montre que, désormais, le DAR optimal d’un ADC va dépendre de nombreux paramètres, principalement du caractère hydrophile de la combinaison de l’espaceur et du cytotoxique greffé. Enfin, cet ADC est aujourd’hui en instance d’être accepté par la FDA (en statut BLA) après une phase III réalisée avec succès à condition de résoudre certains problèmes de CMC (Chemistry Manufacturing Control).
 |
Figure 5. A. Formule du sacituzumab govitécan, anticorps anti-Trop-2 conjugué au SN-38 via un espaceur clivable (acidité). B. Formule du DS-8201a, trastuzumab conjugué à l’exatécan DX-8951 via un espaceur sensible à la protéolyse. C. Formule du SYD985, trastuzumab anti-HER2/neu conjugué à la seco-DUBA via un espaceur clivable (cathepsine B). |
De manière analogue, un dérivé de l’irinotécan, le DXd (exatécan ou DX-8951), permettant de ne pas utiliser un espaceur particulièrement hydrophile, a été élaboré au Japon ; il s’agit d’un cytotoxique plus actif que le SN-38 in vitro sur des cellules cancéreuses, qui conduit à un effet cytotoxique collatéral sur les cellules tumorales avoisinantes (bystander killing effect). La bioconjugaison du DXd au trastuzumab anti-HER2/neu via un espaceur maléimide sensible à la protéolyse a permis d’obtenir l’ADC trastuzumab deruxtécan (DS-8201a) de DAR 8 (Figure 5B) [46]. Malgré son DAR 8 élevé, le DS-8201a est très bien toléré, et est actuellement testé comparativement au Kadcyla® dans une étude clinique de phase III dans le cancer du sein métastatique HER2/neu+.
En parallèle, un ADC, le trastuzumab duocarmazine (SYD985) a été récemment développé [47]. Cet ADC a un DAR moyen de 2,8 et résulte de la combinaison d’un AcM anti-HER2/neu et d’un précurseur de la duocarmycine (seco-DUBA), relié par un espaceur clivable sensible à la cathepsine B, optimisé grâce à la présence de deux unités pégylées pour assurer une meilleur solubilité (et donc conjugaison) de l’espaceur-cytotoxique (Figure 5C). SYD985 est actuellement testé comparativement au T-DM1 dans une étude clinique de phase III dans le cancer du sein métastatique HER2/neu+.
Indications des ADC
Les résultats prometteurs obtenus en monothérapie en situation de rechute ou réfractaire ont permis l’approbation de plusieurs ADC. Plusieurs questions se posent désormais sur la place que vont occuper les ADC dans les traitements des patients atteints de cancers.
Combinaisons avec la chimiothérapie conventionnelle
De nombreuses études explorent actuellement les combinaisons de l’Adcetris® ou du Kadcyla® avec la chimiothérapie conventionnelle. L’objectif peut être de remplacer un agent anti-tubuline par un ADC couplé à un agent anti-tubuline et susceptible d’entraîner une toxicité moindre, par exemple en remplaçant la vincristine par l’Adcetris® dans le traitement de certains lymphomes (NCT01777152). Un autre objectif peut être de renforcer l’activité d’une combinaison établie et dont les mécanismes d’action sont différents, comme dans la combinaison de l’Adcetris® avec une combinaison de cisplatine, dexaméthasone et cytarabine pour le traitement de la maladie de Hodgkin [48].
Traitements adjuvants, d’entretien ou de consolidation
Un nombre croissant de patients cancéreux sont mis en rémission par un traitement de première ligne, sans pour autant être en rémission complète ou guéris. Plusieurs situations font actuellement appel à un traitement adjuvant (lorsque la maladie n’est pas détectable) ou d’entretien (lorsque les patients ont une réponse partielle). Le Kadcyla® a ainsi montré sa supériorité par rapport au trastuzumab, son équivalent non conjugué, dans l’étude randomisée KATHERINE (NCT01772472) en tant que traitement adjuvant chez des patientes conservant une maladie résiduelle mammaire ou ganglionnaire après un traitement néo-adjuvant, avec une diminution de 50 % du risque de récidive locale ou de décès [49]. Il est probable que d’autres maladies dans lesquelles un traitement d’entretien par des anticorps nus ont déjà fait la preuve de leur efficacité, telles que certains types de lymphomes malins par exemple, bénéficieront également de l’administration d’ADC à la suite d’un traitement de première ligne.
Combinaisons des ADC et des inhibiteurs de points de contrôle immunitaire (immune checkpoints)
L’intérêt de combiner des chimiothérapies cytotoxiques avec des inhibiteurs des points de contrôle immunitaire (IPCI) tels que les AcM anti-PD1 et anti-PDL1 fait actuellement l’objet de très nombreuses études cliniques [50]. Outre des mécanismes d’action complémentaires, la possibilité d’augmenter l’immunogénicité des tumeurs par le biais d’une mort immunogène induite par la chimiothérapie constitue un argument fort pour l’association de certains agents cytotoxiques avec des immunothérapies. La combinaison d’ADC avec des IPCI apparait donc comme une démarche logique, en particulier chez des patients déjà lourdement prétraités et chez qui l’on veut éviter la toxicité systémique de la chimiothérapie. Une étude de phase I/II de combinaison de l’Adcetris® avec le nivolumab, un anticorps dirigé contre PD1, chez des patients atteints de maladie de Hodgkin en rechute ou réfractaire, a montré un taux de réponse de 82 %, dont 61 % de réponses complètes [51]. Ces résultats ont ensuite été confirmés dans l’étude Checkmate 205, avec des réponses chez plus des deux tiers des patients [52].
D’une façon plus générale, les ADC se sont montrés efficaces en situation de rechute et, plus récemment, en situation adjuvante dans le cancer du sein HER2/neu+. Le positionnement de ces agents dans l’avenir va dépendre de plusieurs facteurs, notamment de l’importance des avantages apportés par rapport à la chimiothérapie conventionnelle (soit en termes de toxicité, soit d’activité anti-tumorale), des alternatives thérapeutiques disponibles et du coût de la prise en charge. Les ADC constituent une famille de composés encore récente, dont les agents approuvés sont fondés sur des conjugués fortement toxiques, aux mécanismes d’action similaires à ceux de la chimiothérapie cytotoxique conventionnelle. Le développement de nouveaux ADC, fondés soit sur des agents conventionnels tels que le sacituzumab govitécan, un anticorps dont le conjugué est le métabolite actif de l’irinotécan, soit sur des conjugués ayant des mécanismes d’action originaux, pourrait également avoir un impact important sur l’utilisation en clinique des ADC.
Conclusion et perspectives
Les ADC classiques internalisants actuellement utilisés en clinique sont conçus pour délivrer spécifiquement de puissants agents cytotoxiques aux cellules cancéreuses. Cependant, malgré leur conception assez élaborée, les ADC font l’objet de plusieurs limitations (par exemple, pénétration de tumeurs solides limitée, toxicité) et sont associés à l’apparition de mécanismes de résistance. Pour surmonter ces limitations, de nouveaux formats d’anticorps, de nouveaux systèmes de libération, des cibles antigéniques mieux choisies et non internalisantes, de nouveaux agents cytotoxiques et des méthodes de bioconjugaison régio-spécifiques (ingénierie d’anticorps ou espaceurs originaux), ont été étudiés afin de faire avancer le développement des ADC. Malheureusement, de nombreuses innovations n’ont pas encore été validées par une utilisation dans des protocoles cliniques. Les ADC qui en découlent sont encore en étude préclinique ou clinique, et un petit nombre sont allés jusqu’en phase clinique II pivotale ou phase III. Néanmoins, ce champ de recherche offre de nombreuses perspectives encourageantes, notamment lorsque les ADC seront combinés avec de la chimiothérapie classique ou des inhibiteurs de point de contrôle immunitaire, afin de mieux potentialiser leurs effets. Cela leur permettra peut-être de se rapprocher un peu plus de la magic bullet imaginée par Paul Ehrlich au début du XXe siècle.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Beck A, Terral G, Debaene F, et al. Cutting-edge mass spectrometry methods for the multi-level structural characterization of antibody-drug conjugates. Expert Rev Proteomics 2016 ; 13: 157–183. [PubMed] [Google Scholar]
- Panowski S, Bhakta S, Raab H, et al. Site-specific antibody drug conjugates for cancer therapy. MAbs 2014 ; 6: 34–45. [CrossRef] [PubMed] [Google Scholar]
- Agarwal P, Bertozzi CR. Site-specific antibody-drug conjugates: the nexus of bioorthogonal chemistry, protein engineering, and drug development. Bioconjug Chem 2015 ; 26: 176–192. [CrossRef] [PubMed] [Google Scholar]
- Jackson DY. Processes for constructing homogeneous antibody drug conjugates. Org Process Res Dev 2016 ; 20: 852–866. [Google Scholar]
- Junutula JR, Raab H, Clark S, et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index. Nat Biotechnol 2008 ; 26: 925–932. [CrossRef] [PubMed] [Google Scholar]
- Sutherland MSK, Walter RB, Jeffrey SC, et al. SGN-CD33A: a novel CD33-targeting antibody-drug conjugate using a pyrrolobenzodiazepine dimer is active in models of drug-resistant AML. Blood 2013 ; 122: 1455–1463. [Google Scholar]
- Strop P.. Versatility of microbial transglutaminase versatility of microbial transglutaminase pavel strop. Bioconj Chem 2014 ; 25: 855–862. [CrossRef] [Google Scholar]
- Behrens CR, Ha EH, Chinn LL, et al. Antibody-drug conjugates (ADCs) derived from Interchain cysteine cross-linking demonstrate improved homogeneity and other pharmacological properties over conventional heterogeneous ADCs. Mol Pharm 2015 ; 12: 3986–3998. [CrossRef] [PubMed] [Google Scholar]
- Joubert N, Viaud-Massuard MC, Respaud R. Novel antibody-drug conjugates and the use of same in therapy, WO2015004400. 2015; WO2015004400A1. [Google Scholar]
- Schumacher FF, Nunes JPM, Maruani A, et al. Next generation maleimides enable the controlled assembly of antibody–drug conjugates via native disulfide bond bridging. Org Biomol Chem 2014 ; 12: 7261. [CrossRef] [PubMed] [Google Scholar]
- Govindan S V., Sharkey RM, Goldenberg DM.. Prospects and progress of antibody-drug conjugates in solid tumor therapies. Expert Opin Biol Ther 2016 ; 16: 883–893. [PubMed] [Google Scholar]
- Nagayama A, Ellisen LW, Chabner B, et al. Antibody-drug conjugates for the treatment of solid tumors: clinical experience and latest developments. Target Oncol 2017 ; 12: 719–739. [CrossRef] [PubMed] [Google Scholar]
- Jain RK. Physiological barriers to delivery of monoclonal antibodies and other macromolecules in tumors. Cancer Res 1990 ; 50: s814s–s8149. [Google Scholar]
- Deonarain MP, Yahioglu G, Stamati I, et al. Emerging formats for next-generation antibody drug conjugates. Expert Opin Drug Discov 2015 ; 10: 463–481. [CrossRef] [PubMed] [Google Scholar]
- Brachet G, Respaud R, Arnoult C, et al. Increment in drug loading on an antibody-drug conjugate increases its binding to the human neonatal Fc receptor in vitro. Mol Pharm 2016 ; 13: 1405–1412. [CrossRef] [PubMed] [Google Scholar]
- Litvak-Greenfeld D, Benhar I. Risks and untoward toxicities of antibody-based immunoconjugates. Adv Drug Deliv Rev 2012 ; 64: 1782–1799. [CrossRef] [PubMed] [Google Scholar]
- de Goeij BECG, Lambert JM. New developments for antibody-drug conjugate-based therapeutic approaches. Curr Opin Immunol 2016 ; 40: 14–23. [CrossRef] [PubMed] [Google Scholar]
- Casi G, Neri D. Antibody-dDrug conjugates and small molecule-drug conjugates: opportunities and challenges for the development of selective anticancer cytotoxic agents. J Med Chem 2015 ; 58: 8751–8761. [CrossRef] [PubMed] [Google Scholar]
- Deonarain M, Yahioglu G, Stamati I, et al. Small-format drug conjugates: a viable alternative to ADCs for solid tumours?. Antibodies 2018 ; 7: 16–35. [CrossRef] [Google Scholar]
- You Y, Xu Z, Chen Y. Doxorubicin conjugated with a trastuzumab epitope and an MMP-2 sensitive peptide linker for the treatment of HER2-positive breast cancer. Drug Deliv 2018 ; 25: 448–460. [CrossRef] [PubMed] [Google Scholar]
- Massa S, Xavier C, De Vos J, et al. Site-specific labeling of cysteine-tagged camelid single-domain antibody-fragments for use in molecular imaging. Bioconjug Chem 2014 ; 25: 979–988. [CrossRef] [PubMed] [Google Scholar]
- Albrecht H, Burke PA, Natarajan A, et al. Production of soluble ScFvs with C-terminal-free thiol for. Bioconjug Chem 2004: 16–26. [CrossRef] [PubMed] [Google Scholar]
- Badescu G, Bryant P, Bird M, et al. Bridging disulfides for stable and defined antibody drug conjugates. Bioconjug Chem 2014 ; 25: 1124–1136. [CrossRef] [PubMed] [Google Scholar]
- Gebleux R, Wulhfard S, Casi G, et al. Antibody format and drug release rate determine the therapeutic activity of noninternalizing antibody-drug conjugates. Mol Cancer Ther 2015 ; 14: 2606–2612. [Google Scholar]
- Lillo AM, Sun C, Gao C, et al. A Human single-chain antibody specific for integrin α3β1 capable of cell internalization and delivery of antitumor agents. Chem Biol 2004 ; 11: 897–906. [CrossRef] [PubMed] [Google Scholar]
- Spidel JL, Albone EF, Cheng X, et al. Engineering humanized antibody framework sequences for optimal site-specific conjugation of cytotoxins. MAbs 2017 ; 9: 907–915. [CrossRef] [PubMed] [Google Scholar]
- Aubrey N, Allard-Vannier E, Martin C, et al. Site-specific conjugation of auristatins onto engineered scFv using second generation maleimide to target HER2-positive breast cancer in vitro. Bioconjug Chem 2018 ; 29: 3516–3521. [CrossRef] [PubMed] [Google Scholar]
- Bryden F, Martin C, Letast S, et al. Impact of cathepsin B-sensitive triggers and hydrophilic linkers on in vitro efficacy of novel site-specific antibody-drug conjugates. Org Biomol Chem 2018 ; 16: 1882–1889. [CrossRef] [PubMed] [Google Scholar]
- Adams GP, McCartney JE, Tai MS, et al. Highly specific in vivo tumor targeting by monovalent and divalent forms of 741F8 anti-c-erbB-2 single-chain Fv. Cancer Res 1993 ; 53: 4026–4034. [Google Scholar]
- Li JY, Perry SR, Muniz-Medina V, et al. A Biparatopic HER2-targeting antibody-drug conjugate induces tumor regression in primary models refractory to or ineligible for HER2-targeted therapy. Cancer Cell 2016 ; 29: 117–129. [CrossRef] [PubMed] [Google Scholar]
- Uppal H, Doudement E, Mahapatra K, et al. Potential mechanisms for thrombocytopenia development with trastuzumab emtansine (T-DM1). Clin Cancer Res 2015 ; 21: 123–133. [CrossRef] [PubMed] [Google Scholar]
- Joubert N, Denevault-Sabourin C, Bryden F, et al. Towards antibody-drug conjugates and prodrug strategies with extracellular stimuli-responsive drug delivery in the tumor microenvironment for cancer therapy. Eur J Med Chem 2017 ; 142: 393–415. [CrossRef] [PubMed] [Google Scholar]
- Matsumura Y.. Cancer stromal targeting (CAST) therapy. Adv Drug Deliv Rev 2012 ; 64: 710–719. [CrossRef] [PubMed] [Google Scholar]
- Casi G, Neri D. Noninternalizing targeted cytotoxics for cancer therapy. Mol Pharm 2015 ; 12: 1880–1884. [CrossRef] [PubMed] [Google Scholar]
- Mantaj J, Jackson PJM, Rahman KM, et al. From anthramycin to pyrrolobenzodiazepine (PBD)-containing antibody-drug conjugates (ADCs). Angew Chemie Int Ed 2017 ; 56: 462–488. [CrossRef] [Google Scholar]
- Sandall SL, McCormick R, Miyamoto J, et al. SGN-CD70A, a pyrrolobenzodiazepine (PBD) dimer linked ADC, mediates DNA damage pathway activation and G2 cell cycle arrest leading to cell death. Cancer Res 2015; 75: 946 (abstract 946). [Google Scholar]
- Chari RVJ, Miller ML, Widdison WC. Antibody-drug conjugates: an emerging concept in cancer therapy. Angew. Chemie - Int. Ed. 2014 ; 53: 3796–3827. [CrossRef] [Google Scholar]
- Yu SF, Zheng B, Go M, et al. A novel anti-CD22 anthracycline-based antibody-drug conjugate (ADC) that overcomes resistance to auristatin-based ADCs. Clin Cancer Res 2015 ; 21: 3298–3306. [CrossRef] [PubMed] [Google Scholar]
- Ponte JF, Ab O, Lanieri L, et al. Mirvetuximab soravtansine (IMGN853), a folate receptor alpha targeting antibody-drug conjugate, potentiates the activity of standard of care therapeutics in ovarian cancer models. Neoplasia (United States) 2016 ; 18: 775–784. [CrossRef] [Google Scholar]
- Sun X, Ponte JF, Yoder NC, et al. Effects of drug-antibody ratio on pharmacokinetics, biodistribution, efficacy, and tolerability of antibody-maytansinoid conjugates. Bioconjug Chem 2017 ; 28: 1371–1381. [CrossRef] [PubMed] [Google Scholar]
- Widdison WC, Ponte JF, Coccia JA, et al. Development of anilino-maytansinoid ADCs that efficiently release cytotoxic metabolites in cancer cells and induce high levels of bystander killing. Bioconjug Chem 2015 ; 26: 2261–2278. [CrossRef] [PubMed] [Google Scholar]
- Challita-Eid PM, Satpayev D, Yang P, et al. Enfortumab vedotin antibody-drug conjugate targeting nectin-4 is a highly potent therapeutic agent in multiple preclinical cancer models. Cancer Res 2016 ; 76: 3003–3013. [Google Scholar]
- Goss GD, Vokes EE, Gordon MS, et al. Efficacy and safety results of depatuxizumab mafodotin (ABT-414) in patients with advanced solid tumors likely to overexpress epidermal growth factor receptor. Cancer 2018 ; 124: 2174–2183. [CrossRef] [PubMed] [Google Scholar]
- Goldenberg DM, Cardillo TM, Govindan S V, et al. Trop-2 is a novel target for solid cancer therapy with sacituzumab govitecan (IMMU-132), an antibody-drug conjugate (ADC). Oncotarget 2015 ; 6: 22496–22512. [CrossRef] [PubMed] [Google Scholar]
- Govindan SV, Starodub AN, Juric D, et al. Efficacy and safety of anti-trop-2 antibody drug conjugate sacituzumab govitecan (IMMU-132) in heavily pretreated patients with metastatic triple-negative breast cancer. J Clin Oncol 2018 ; 2017: 2141–2148. [Google Scholar]
- Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with differentiation from T-DM1. Clin Cancer Res 2016 ; 22: 5097–5108. [CrossRef] [PubMed] [Google Scholar]
- Elgersma RC, Coumans RGE, Huijbregts T, et al. Design, synthesis, and evaluation of linker-duocarmycin payloads: toward selection of HER2-targeting antibody-drug conjugate SYD985. Mol Pharm 2015 ; 12: 1813–1835. [CrossRef] [PubMed] [Google Scholar]
- Hagenbeek A, Mooij H, Zijlstra J, et al. Phase I dose-escalation study of brentuximab-vedotin combined with dexamethasone, high-dose cytarabine and cisplatin, as salvage treatment in relapsed/refractory classical Hodgkin lymphoma: the HOVON/LLPC transplant BRaVE study. Haematologica 2019 ; 104: e151–e153. [CrossRef] [PubMed] [Google Scholar]
- von Minckwitz G, Huang C-S, Mano MS, et al. Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019 ; 380: 617–628. [Google Scholar]
- Mahoney KM, Rennert PD, Freeman GJ. Combination cancer immunotherapy and new immunomodulatory targets. Nat Rev Drug Discov 2015 ; 14: 561–584. [CrossRef] [PubMed] [Google Scholar]
- Herrera AF, Moskowitz AJ, Bartlett NL, et al. Interim results of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Blood 2018 ; 131: 1183–1194. [Google Scholar]
- Armand P, Engert A, Younes A, et al. Nivolumab for relapsed/refractory classic Hodgkin lymphoma after failure of autologous hematopoietic cell transplantation: extended follow-up of the multicohort single-arm phase II checkmate 205 trial. J Clin Oncol 2018 ; 36: 1428–1439. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. A. ADC homogènes générés par ingénierie d’anticorps suivie d’une bio-conjugaison régio-spécifique (DAR 2). B. ADC homogène généré par déglycosylation (position Q295) en présence de PNGase F suivie d’une bioconjugaison par la transglutaminase (position 297) (L’immunoconjugué azoture, en présence de DBCO-espaceur-MMAE, permet la production d’un ADC homogène de DAR 2). C. ADC homogène de DAR 4 obtenu par réduction ménagée (TCEP) des 4 ponts disulfures inter-chaînes suivie d’une réaction de bioconjugaison via un espaceur dibromomaléimide (DBM). |
| Dans le texte | |
 |
Figure 2. A. SDC (scFv-drug conjugate) homogène de DAR 1 obtenu par réduction ménagée (TCEP) du pont disulfure intra-chaîne en C-terminal suivie d’une réaction de bioconjugaison via un linker dithiophénylmaléimide (DSPh). B. ADC homogène de DAR 4 comprenant un anticorps biparatopique anti-HER2 conjugué à une tubulysine via un linker maléimidocaproïque. C. Immunoconjugués IgG(F8)-SS-DM1 et SIP(F8)-SS-DM1 et formule du cytotoxique DM1. |
| Dans le texte | |
 |
Figure 3. A. ADC homogène de DAR2 portant la talirine incluant un dérivé dimérique de pyrrolobenzodiazépine (SGN-1882). B. ADC homogènes de DAR2 portant la tésirine incluant un dérivé dimérique de pyrrolobenzodiazépine (SGN-3199). C. ADC homogène incluant un dérivé d’anthracycline (PNU-159682). PBD dimer: dimère de PBD. |
| Dans le texte | |
 |
Figure 4. A. Formule du mirvétuximab soravtansine, anticorps anti-folate R1 conjugué à la DM4 via un espaceur non clivable. B. Formule des dépatuximab mafodotine et bélantuzumab mafodotine, anticorps conjugués à la MMAF via un espaceur non clivable. |
| Dans le texte | |
 |
Figure 5. A. Formule du sacituzumab govitécan, anticorps anti-Trop-2 conjugué au SN-38 via un espaceur clivable (acidité). B. Formule du DS-8201a, trastuzumab conjugué à l’exatécan DX-8951 via un espaceur sensible à la protéolyse. C. Formule du SYD985, trastuzumab anti-HER2/neu conjugué à la seco-DUBA via un espaceur clivable (cathepsine B). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




