| Issue |
Med Sci (Paris)
Volume 36, Number 10, Octobre 2020
Organoïdes
|
|
|---|---|---|
| Page(s) | 879 - 885 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2020129 | |
| Published online | 07 October 2020 | |
Organoïdes sécréteurs d’insuline
Des « super-îlots » comme premier pas vers le pancréas bioartificiel
Insulin-secreting organoids: a first step towards the bioartificial pancreas
1
Laboratoire de transplantation cellulaire, Département de Chirurgie, Centre médical universitaire, Hôpitaux de l’université de Genève et université de Genève, Genève, Suisse
2
Centre facultaire du diabète, Centre médical de l’université de Genève, Genève, Suisse
3
Institute of Medical Research, Ilia State University, Tbilissi, Géorgie
* ekaterine.berishvili@unige.ch
La greffe d’îlots pancréatiques permet de remplacer les cellules β de manière minimalement invasive1, et d’améliorer significativement la qualité de vie des patients présentant un diabète de type 1. Cependant, ces mini-organes endocriniens, lorsqu’ils sont transplantés après une procédure d’extraction enzymatique du pancréas, se retrouvent déconnectés de leur vascularisation et de leur support fonctionnel. Les îlots doivent de plus faire face aux attaques des systèmes immunitaires inné et adaptatif, ainsi qu’à la récidive de l’auto-immunité. L’utilisation et la création d’organoïdes produisant et sécrétant de l’insuline permettent non seulement de contrôler et d’homogénéiser leur taille, mais également leur composition, avec la possibilité d’ajouter des cellules essentielles à leur survie, telles que des cellules endothéliales ou des cellules possédant des propriétés anti-inflammatoires et immuno-modulatrices. Dans cette revue, nous décrivons les obstacles rencontrés dans la greffe d’îlots et détaillons les bénéfices de l’utilisation d’organoïdes pour les surmonter.
Abstract
Pancreatic islet transplantation is a valid cure for selected type-1 diabetic patients. It offers a minimally invasive β-cell replacement approach and has proven its capacity to significantly enhance patients quality of life. However, these insulin-secreting mini-organs suffer from the loss of intrinsic vascularization and extra-cellular matrix occurring during isolation, resulting in hypoxic stress and necrosis. In addition, they have to face inflammatory and immune destruction once transplanted in the liver. Organoid generation represents a strategy to overcome these obstacles by allowing size and shape control as well as composition. It does offer the possibility to add supporting cells such as endothelial cells, in order to facilitate revascularization or cells releasing anti-inflammatory and/or immunomodulatory factors. This review describes the limitations of pancreatic islet transplantation and details the benefits offered by organoids as a cornerstone toward the generation of a bioartificial pancreas.
© 2020 médecine/sciences – Inserm
Vignette (Photo © Inserm – Marie-Anne Le Drévo).
L’îlot de Langerhans, sa composition et sa fonction1
Les îlots de Langerhans sont des agrégats de cellules endocrines représentant moins de 5 % du volume tissulaire pancréatique et mesurant en moyenne 100 μm environ [1]. Chez l’homme, un îlot-équivalent (d’un diamètre de 150 μm par définition) est constitué de 1 560 ± 20 cellules [2] dont environ 60 % de cellules sécrétrices d’insuline (cellules β) et 30 % de cellules sécrétrices de glucagon (cellules α) [3]. Les 10 % de cellules restantes sont composés principalement de cellules sécrétrices de somatostatine (cellules δ), mais également de cellules sécrétrices du polypeptide pancréatique (PP, cellules γ) et de cellules sécrétrices de ghréline (cellules ε) [3]. Plus que des agrégats cellulaires endocriniens, les îlots sont de véritables micro-organes, innervés par le système autonome, possédant de multiples communications intercellulaires à travers des voies autocrines, paracrines et endocrines [4]. Au sein de l’îlot, la vascularisation est 5 fois plus dense que celle du pancréas exocrine, recevant entre 10 et 15 % du flux sanguin total présent dans le pancréas [5]. Un riche réseau de capillaires fenestrés pénètre les îlots, offrant un contact étroit avec le système sanguin, leur permettant de réguler de manière optimale l’homéostasie du glucose. Les principaux acteurs de cette régulation sont (1) les cellules β, répondant à une élévation de la glycémie (hyperglycémie) par la sécrétion d’insuline dans le sang, qui conduit à la consommation du glucose sanguin par différents tissus cibles (cerveau, foie, muscle et tissu adipeux) et (2) les cellules α qui sécrètent du glucagon en réponse à une baisse de la glycémie (hypoglycémie), permettant d’agir comme hormone contre-régulatrice de l’insuline, en recrutant le glucose stocké dans le foie, le muscle et le tissu adipeux en cas de besoin pour les autres organes (le cerveau, en particulier). C’est cet équilibre essentiel pour le maintien de l’homéostasie du glucose qui est altéré dans la maladie diabétique.
Le diabète de type 1
Le diabète est un problème de santé publique au niveau mondial, dont la prévalence est croissante. Le diabète de type 1 résulte de la destruction des cellules β par un processus auto-immun, entraînant la perte totale de production et de sécrétion d’insuline endogène. Le développement de la maladie est le résultat de la combinaison d’un ensemble de facteurs, notamment une prédisposition génétique, des facteurs immunologiques et environnementaux [6, 7]. La maladie se développe à la suite de l’infiltration des îlots pancréatiques par des cellules immunitaires, lymphocytaires et macrophagiques [6]. L’apparition d’autoanticorps dirigés contre les antigènes spécifiques des cellules d’îlots (ICA), l’insuline, la tyrosine phosphatase IA2, l’acide glutamique décarboxylase GAD65 et le transporteur de zinc ZnT8 est également constatée, mais ces autoanticorps sont des marqueurs plutôt que des effecteurs de l’autoimmunité affectant le pancréas [6, 7]. La destruction des cellules β se fait progressivement, initialement de façon latente, puis se traduisant par une altération de la réponse insulinique et un déficit de la tolérance au glucose, qui entraîne une élévation chronique de la glycémie. Cet état hyperglycémique se traduit cliniquement par une polydipsie, une polyurie, une perte de poids et, s’il persiste et n’est pas traité, évoluera vers un coma acido-cétosique.
L’insulinothérapie
La découverte et la purification de l’insuline par les médecins canadiens Frederick Banting et Charles Best en 1921, marque le début du traitement du diabète de type 1 par l’injection quotidienne d’insuline exogène, d’abord d’origine animale (bovine ou porcine) puis recombinante [41] (→).
(→) Voir la Synthèse de D. Verge, m/s n° 11, novembre 2004, page 986
Depuis, d’énormes progrès ont été effectués dans le but de reproduire la sécrétion physiologique d’insuline aussi fidèlement que possible, notamment à l’aide de pompes à insuline. Cependant, même avec un traitement insulinique intensif, le contrôle glycémique n’est pas toujours atteint. Les quantités d’insuline exogène qu’il est nécessaire d’administrer peuvent mettre les patients à risque d’hypoglycémies sévères, pouvant entraîner des pertes de conscience et des convulsions [6, 8]. Cette variabilité chronique de la glycémie, résultat de la dose injectée et de l’observance du patient, est la cause principale de morbidité chez les patients diabétiques. L’insulinothérapie a néanmoins permis d’allonger significativement l’espérance de vie des patients, mais elle a révélé un autre problème, celui du développement des complications chroniques du diabète. Elles sont principalement liées à des épisodes répétés d’hyperglycémie non contrôlée, entraînant une atteinte macrovasculaire (artériosclérose, maladie coronarienne et cérébro-vasculaire) et microvasculaire (néphropathie, rétinopathie et neuropathie). Pour les patients présentant une glycémie très instable ou ceux développant des complications chroniques graves, une autre stratégie thérapeutique est proposée : le remplacement des cellules β par la transplantation pancréatique ou celle d’îlots de Langerhans.
Remplacer les cellules β : la transplantation de pancréas et celle d’îlots de Langerhans
Les thérapies de remplacement des cellules β dépendent de la disponibilité d’organes et nécessitent un traitement immunosuppresseur à vie. Elles sont donc proposées aux patients présentant des hypoglycémies sévères et des glycémies très instables, et ce malgré une thérapie insulinique optimale. Elles sont également proposées, en combinaison avec une transplantation rénale, en cas de développement d’une insuffisance rénale, conséquence du diabète, menant à la dialyse.
Suite aux progrès et aux perfectionnements des techniques chirurgicales ainsi qu’à l’amélioration des traitements immunosuppresseurs, la transplantation pancréatique permet actuellement d’obtenir d’excellents résultats avec un survie des patients de 80 % à 5 ans et une insulino-indépendance de 70 %, également à 5 ans [9]. Cependant, il s’agit d’une chirurgie majeure avec des risques de complications pouvant parfois être mortelles [10]. C’est pourquoi la transplantation pancréatique ne peut être accessible à tous les patients.
Contrairement à la greffe de pancréas, la transplantation d’îlots de Langerhans est une technique très peu invasive qui consiste en l’infusion d’îlots dans le foie, via la veine porte, par un abord percutané, assistée par radiologie interventionnelle. Cette technique comporte peu de risques et est donc accessible à tous les patients. Les îlots sont isolés à partir de pancréas obtenus de donneurs décédés et isolés selon la méthode automatisée décrite par Ricordi et al. [11]. Grâce aux nombreux progrès réalisés dans le domaine, notamment en ce qui concerne la technique d’isolement des îlots, l’enzyme utilisée pour la digestion du pancréas, la sélection des donneurs et les protocoles d’immunosuppression, les résultats à long terme, dans certains centres, s’approchent de ceux de la greffe pancréatique avec une insulino-indépendance de 50 % à 5 ans [12]. Cependant, malgré ces résultats, la greffe d’îlots fait face à de nombreux obstacles. Contrairement à une greffe d’organe solide pour laquelle les vaisseaux qui le nourrissent sont connectés au moment de la transplantation, les îlots perdent leur vascularisation intrinsèque durant le processus d’isolement et ils ne seront revascularisés que plusieurs semaines après leur transplantation dans le foie. Les îlots sont extrêmement vascularisés. La perte de ce réseau capillaire entraîne donc une nécrose du centre des îlots, ce qui peut être observé en culture, principalement dans les plus gros îlots [13]. Durant le processus d’isolement, les îlots sont également déconnectés de leur matrice extracellulaire. Ils perdent donc leur support fonctionnel, qui est essentiel à leur fonctionnement. Enfin, le foie, qui est actuellement le site de transplantation, est en fait un site qui est sous-optimal pour les îlots en raison d’un micro-environnement très inflammatoire. L’injection des îlots dans la veine porte déclenche en effet une réaction inflammatoire importante, ayant pour origine l’activation d’un phénomène de coagulation intra-vasculaire, connue sous le nom de instant blood-mediated inflammatory reaction (IBMIR) [14], qui recrute et active des cellules inflammatoires qui peuvent détruire jusqu’à 50 % des îlots transplantés [15]. Une fois implantés dans le foie, les îlots entrent également en contact avec une multitude de cellules participant à l’inflammation, comme les cellules de Küppfer (les macrophages du foie), les cellules endothéliales sinusoïdales, les cellules stellaires, les lymphocytes résidents et les cellules dendritiques. Dans le foie, les îlots sont, de plus, exposés à de nombreux antigènes et agents toxiques provenant du drainage du système digestif qui peuvent également stimuler les cellules présentatrices d’antigènes, entraînant des réactions inflammatoires locales [14]. Finalement, les îlots sont également la cible du système immunitaire adaptatif et à risque de rejet allogénique, mais également de récidive de l’auto-immunité, initialement à l’origine de la destruction des cellules qui les constituent.
En raison de tous ces obstacles, une importante quantité d’îlots est donc nécessaire pour obtenir des résultats satisfaisants. Plusieurs donneurs seront donc requis pour chaque receveur. Le manque de donneurs et la nécessité d’immunosupprimer les patients sont les plus importants freins au développement de la greffe d’îlots à large échelle. Il est essentiel de pouvoir améliorer la survie des îlots transplantés en permettant une meilleure revascularisation et une protection contre le système immununitaire, et cela, en tentant de trouver une alternative au foie comme site d’implantation. C’est dans ces domaines que la recherche s’est développée récemment. Une approche, utilisée dans de nombreux autres domaines, est le développement et l’utilisation d’organoïdes qui consistent en l’agrégation tridimensionnelle de cellules de types et de fonctionnalités différentes. Considérant la configuration multicellulaire des îlots, cette technique paraît parfaitement appropriée à la greffe d’îlots.
Les pseudo-îlots, organoïdes de cellules endocrines pancréatiques
Les organoïdes sont définis comme des amas tridimensionnels de cellules visant à reproduire in vitro et à l’échelle micro- ou millimétrique, la structure anatomique et la fonction intrinsèque d’organes in vivo. Depuis le début des années 2010, l’utilisation d’organoïdes comme modèle de recherche a connu une importante croissance notamment dans le domaine de la régénération tissulaire [16]. Ces organoïdes sont principalement constitués de cellules souches embryonnaires ou de cellules « adultes ». Dans le domaine de la recherche sur les îlots, l’utilisation d’organoïdes a principalement consisté en la réagrégation de cellules d’îlots isolés puis dissociés afin de reconstituer des amas cellulaires endocrines semblables à des îlots, communément appelés pseudo-îlots (PI) [17].
Diverses méthodes ont été développées pour générer les PI (Figure 1). Les premières études ont montré que des cellules d’îlots dispersées cultivées en suspension avaient la capacité de s’agréger spontanément en amas tridimensionnels, et de restaurer, ensuite, sous cette forme, une sécrétion d’insuline [18] qui, en l’absence de contacts intercellulaires, est altérée. Un système de culture rotationnelle en bioréacteur a été utilisé. Il favorise l’agrégation cellulaire [19]. Les PI générés grâce à ces méthodes sont néanmoins de taille aléatoire et la technique des microgouttes inversées a résolu ce problème : un nombre déterminé de cellules en suspension est ensemencé dans des gouttes de milieu d’un très petit volume, suspendues à un support. Les cellules s’accumulent par gravité au bas de la goutte, favorisant l’agrégation cellulaire sous forme de sphéroïdes, dont la taille est directement déterminée par la quantité de cellules présente dans chaque goutte [20]. Une méthode de sédimentation des cellules dans des micro-puits a ensuite été développée, permettant d’améliorer encore les performances des agrégats générés en termes de sécrétion d’insuline, en réduisant le temps nécessaire à l’ensemencement des cellules et donc la perte de cellules au cours du processus [21, 22].
 |
Figure 1. Les différentes méthodes utilisées pour générer des organoïdes sécréteurs d’insuline. Les organoïdes sécréteurs d’insuline sont obtenus après dissociation enzymatique des îlots de Langerhans isolés. Les cellules obtenues sont ensuite réagrégées. Pour cela, différentes techniques peuvent être employées. A. La réagrégation spontanée de cellules d’îlots en suspension dans un support de culture non adhérent forme des pseudo-îlots de tailles variables. B. Le recours à la culture cellulaire en rotation (CRCT), durant laquelle un mouvement de rotation (symbolisé ici par la flèche verte) est appliqué à la suspension cellulaire tout au long du processus de réagrégation, favorise la réagrégation cellulaire et forme des organoïdes de diamètre plus élevé. C. La technique des microgouttes inversées utilise la tension de surface des gouttes pour concentrer les cellules ensemencées au fond des gouttes. Cette technique permet de contrôler le nombre de cellules désiré dans les organoïdes et donc leur taille. D. La conception de micro-puits dans les supports de culture (soit par utilisation de micro-moules d’agarose, soit des plaques de culture contenant déjà des micro-puits dès leur fabrication) repose sur le même principe que celui des microgouttes inversées en concentrant les cellules dans des puits de petit volume, et permet de maitriser la taille des organoïdes générés. Cependant, cette méthode comporte de multiples avantages par rapport à celle des microgouttes : la possibilité de centrifuger les cellules après ensemencement pour accélérer leur sédimentation au fond des micro-puits et ainsi diminuer le risque de perte cellulaire, la possibilité de renouveler le milieu de culture, ainsi que la facilité de manipulation et le gain de temps de ces supports permettent d’appliquer cette méthode à grande échelle. |
Les pseudo-îlots, ou organoïdes sécréteurs d’insuline, produits grâce à ces méthodes possèdent des propriétés améliorées par rapport aux îlots natifs. En effet, ceux-ci présentent une importante hétérogénéité de taille : le nombre de cellules contenues dans un îlot peut varier d’une dizaine à plus d’un millier, entraînant une disparité en termes de fonction, de viabilité, mais aussi de composition cellulaire des îlots isolés [23]. À l’instar de ce qui est observé pour les îlots natifs [24], les PI de petit diamètre ont une viabilité et une fonction sécrétrice in vitro supérieure aux PI de diamètre plus important [25]. La possibilité de maîtriser le nombre de cellules et donc la taille des PI permet d’éviter le phénomène de nécrose centrale, observé dans les îlots de plus grand diamètre [13]. Les îlots natifs isolés ou les PI ne sont oxygénés que par un processus de diffusion, raison pour laquelle les PI de plus petites tailles possèdent une fonction et une viabilité cellulaire supérieures in vitro et in vivo par rapport à une préparation d’îlots natifs [22, 24]. Une fois transplantés, les PI adaptent leur morphologie pour retrouver une conformation cellulaire similaire à celle des îlots natifs in situ [26]. Ils semblent également avoir une immunogénicité diminuée [27].
L’utilisation de PI offre une plus grande marge de manœuvre pour les études in vitro, notamment en biologie moléculaire, ce qui permet des manipulations géniques des cellules avant leur réagrégation en PI, comme des transductions via des lentivirus afin de modifier l’expression de gènes, notamment pour diminuer l’immunogénicité des cellules transplantées [28]. Une étude récente a montré la possibilité de transfecter de façon homogène les cellules déjà sous forme de PI par la technique de shRNA (short hairpin RNA) [29].
L’utilisation de cellules issues de lignées clonales pour former des PI peut également élargir ces études réalisées in vitro, à des tests de sélection à grande échelle de molécules pharmacologiques [30]. Elles pourraient, aussi, éventuellement servir de source alternative de cellules β pour la transplantation. Par ailleurs, le recours aux PI devrait permettre d’étudier les différentes interactions entre cellules, en modifiant leur composition cellulaire, par exemple en variant le ratio cellules β/non β.
Les organoïdes hybrides combinant cellules d’îlots et cellules de soutien
Au cours du processus d’isolement, les îlots sont grandement fragilisés, déconnectés de leur vascularisation, innervation et matrice extracellulaire intrinsèque. L’utilisation d’organoïdes permet de choisir la quantité et la composition cellulaire qui constitueront le PI. De multiples travaux ont ainsi intégré des cellules de soutien aux organoïdes permettant de leur apporter des propriétés supplémentaires. Différents types cellulaires ont été ajoutés, comme des cellules endothéliales progénitrices, dans le but d’améliorer la revascularisation [31], ou des neurones cholinergiques, permettant une réinnervation et une amélioration de la fonction in vitro [32]. D’autres types cellulaires ont également été explorés pour leur propriété régénératives, angiogéniques et anti-inflammatoires. Les cellules stromales mésenchymateuses (CSM), en particulier, ont été très utilisées en raison de leur potentiel de différenciation en diverses lignées cellulaires et de leur propriétés anti-inflammatoires, angiogéniques et immunomodulatrices [33]. Ces capacités bénéfiques des CSM ont pu être démontrées dans des études de coculture avec des îlots où la revascularisation et la transplantation des îlots greffés étaient améliorées dans des modèles de rongeurs [34, 35]. Les CSM peuvent être obtenues à partir de différents tissus, comme la moelle osseuse, le tissu adipeux, le cordon ombilical, ou encore la membrane amniotique épithéliale du placenta. Cette membrane placentaire, impliquée dans la tolérance materno-fœtale, a rencontré, au cours de la dernière décennie, un intérêt grandissant en médecine régénérative. En effet, elle possède une riche matrice extra-cellulaire et est composée, notamment, de cellules amniotiques épithéliales (CAE) qui possédent des caractéristiques semblables aux CSM en termes de propriétés angiogéniques, anti-oxydantes, anti-apoptotiques, anti-inflammatoires ainsi qu’immunomodulatrices [36], bien que provenant d’un feuillet embryonnaire différent de celui des CSM. Ce tissu est disponible en grande quantité, et peut être obtenu facilement et à faible à coût. Contrairement aux CSM, les CAE ne présentent pas de risque tumoral et sécrètent les facteurs de croissance et les protéines qui sont présents dans la matrice extracellulaire des îlots.
Nous avons réalisé deux études combinant les CAE à des îlots. Dans la première étude, publiée récemment dans la revue American Journal of Transplantation, nous avons co-cultivé des CAE en présence d’îlots natifs afin de former un « bouclier » de CAE autour des îlots [37]. Cette stratégie a permis d’augmenter la viabilité et la fonction des îlots in vitro, dans des conditions hypoxiques et normoxiques. Ces agrégats d’îlots et de CAE ont été transplantés sous la capsule rénale de souris immunodéficientes rendues diabétiques. Les résultats que nous avons obtenus ont montré une normalisation des glycémies des souris, en comparaison à des souris greffées uniquement avec des îlots natifs. Cette correction du diabète dans le groupe de souris transplantées avec des îlots associés à des CAE repose sur une amélioration de la revascularisation permettant une meilleure implantation du greffon. La seconde étude, publiée dans Nature Communications a permis d’élucider certains des mécanismes moléculaires associés aux observations que nous avions réalisées en étudiant des organoïdes hybrides, combinant des cellules d’îlots dissociés et des CAE (Figure 2). Tous comme les îlots entourés de CAE, ces organoïdes hybrides ont montré une meilleure fonction et viabilité in vitro en hypoxie, comparés à des organoïdes constitués de cellules d’îlots uniquement. Les analyses cellulaires et moléculaires ont révélé que cette meilleure fonction et viabilité des organoïdes hybrides était corrélée à une surexpression du gène codant l’HIF-1α (hypoxia-inducible factor 1-alpha), un acteur majeur de la réponse compensatoire en situation d’hypoxie, et de gènes anti-apoptotiques, les gènes pro-apoptotiques étant, quant à eux, sous-exprimés. La transplantation de ces organoïdes hybrides chez la souris diabétique a montré une normalisation de la glycémie, contrairement à celle d’organoïdes de cellules d’îlots seules. L’analyse histologique des greffons a confirmé une meilleure implantation et une meilleure revascularisation, dues à une restauration de la matrice extracellulaire dans les greffons et une augmentation de la sécrétion de VEGF-A (vascular endothelial growth factor-A) par les cellules d’îlots lorsqu’elles sont associées à des CAE [21].
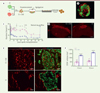 |
Figure 2. Des organoïdes hybrides combinant des cellules d’îlots de rat et des cellules amniotiques épithéliales humaines corrigent le diabète chez la souris diabétique immunodéficiente. A. Représentation schématique de la conception des organoïdes hybrides d’îlots. Les cellules d’îlots de rat (CI) et des cellules amniotiques épithéliales humaines (CAE) ont été mélangées à un ratio de 1:1, ensemencées dans des micropuits d’agarose et incubées pendant 5 jours pour générer des organoïdes. B. Vue en microscopie confocale d’un organoïde hybride montrant une répartition homogène des différents types cellulaires au sein de la construction. Les cellules β des îlots sont marquées en vert avec un anticorps dirigé contre l’insuline, tandis que les CAE sont marquées en rouge avec un anticorps dirigé contre le facteur nucléaire humain. (Barre d’échelle = 50 µm). C. Fonction in vivo des organoïdes d’îlots : la transplantation d’une masse limite de 150 organoïdes hybrides (CI+CAE) sous la capsule rénale de souris immunodéficientes diabétiques permet de rétablir des niveaux sanguins de glucose normaux, contrairement à la transplantation de la même quantité de sphéroïdes composés uniquement de cellules d’îlots (CI). La transplantation de CAE uniquement ne corrige absolument pas l’hyperglycémie, démontrant que les CAE ont ici un rôle support pour les cellules d’îlots. D. Coupes histologiques des greffons après 4 mois, montrant la surface marquée avec un anticorps fluorescent dirigé contre l’insuline, illustrant une meilleure implantation dans le groupe CI+CAE comparé au groupe CI. (Barre d’échelle = 500 µm). E. La revascularisation est augmentée dans le groupe CI+CAE. Les vaisseaux sanguins sont détectés dans les greffons 14 jours après la transplantation en utilisant un anticorps fluorescent dirigé contre CD34 (en rouge) tandis que les cellules d’îlots sont marquées avec un anticorps fluorescent dirigé contre l’insuline (en vert). (Barre d’échelle = 20 µm). F. La quantification des vaisseaux sanguins confirme une meilleure revascularisation dans le groupe CI+CAE 14 jours et 28 jours après la transplantation (figures adaptées de [21]). |
Les résultats que nous avons obtenus ont été observés avec des îlots provenant de rats, mais également avec des îlots isolés de donneurs humains. Plusieurs travaux ont montré ce potentiel immunomodulateur des CAE qui permet de réduire la réponse immunitaire dirigée contre les cellules d’îlots dans des modèles allogéniques in vitro [38] mais également dans des modèles xénogéniques in vivo [39]. Une application à l’homme de ces méthodes pourrait donc être utilisée pour la transplantation d’îlots et le traitement du diabète de type 1.
Conclusion
La génération d’organoïdes offre une perspective prometteuse pour émanciper la transplantation d’îlots de ses contraintes et en améliorer les résultats. Une revascularisation plus rapide ainsi qu’une protection contre les réponses des systèmes immunitaires inné et adaptatif sont essentielles pour garantir une implantation optimale des îlots. Cela permettra, d’une part, de diminuer le nombre d’îlots nécessaire pour subvenir aux besoins de l’organisme en insuline, et donc d’offrir l’accès à cette thérapie à un plus grand nombre de patients ; les îlots disponibles étant restreints, il est en effet nécessaire d’en préserver le plus grand nombre. De telles stratégies devraient permettre, d’autre part, d’identifier de nouveaux sites de transplantation, hors de l’environnement hostile que présente le foie. La modulation de la réponse immunitaire, en intégrant des propriétés immunomodulatrices aux organoïdes transplantés, permettrait non seulement d’améliorer la survie des îlots, mais également d’envisager une réduction, voire une suppression, des traitements immunosuppresseurs, qui représentent un frein majeur au développement à large échelle de la greffe d’îlots. Enfin, le recours aux cellules souches pluripotentes induites [40] pour générer des organoïdes sécréteurs d’insuline ouvre la voie à l’exploration d’autres sources de cellules pour cette thérapie de remplacement cellulaire. Ces progrès offriraient alors la possibilité de résoudre le problème du manque cruel d’organes, en constituant la première étape de la conception d’un pancréas artificiel.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Ionescu-Tirgoviste C, Gagniuc PA, Gubceac E, et al. A 3D map of the islet routes throughout the healthy human pancreas. Sci Rep 2015 ; 5 : 14634. [CrossRef] [PubMed] [Google Scholar]
- Pisania A, Weir GC, O’Neil JJ, et al. Quantitative analysis of cell composition and purity of human pancreatic islet preparations. Lab Invest 2010 ; 90 : 1661–1675. [CrossRef] [PubMed] [Google Scholar]
- Ichii H, Inverardi L, Pileggi A, et al. A novel method for the assessment of cellular composition and beta-cell viability in human islet preparations. Am J Transplant 2005 ; 5 : 1635–1645. [Google Scholar]
- Arrojo e Drigo R, Ali Y, Diez J, et al. New insights into the architecture of the islet of Langerhans: a focused cross-species assessment. Diabetologia 2015; 58 : 2218–28. [CrossRef] [PubMed] [Google Scholar]
- Henderson JR, Moss MC. A morphometric study of the endocrine and exocrine capillaries of the pancreas. Q J Exp Physiol 1985 ; 70 : 347–356. [CrossRef] [PubMed] [Google Scholar]
- Kahaly GJ, Hansen MP. Type 1 diabetes associated autoimmunity. Autoimmun Rev 2016 ; 15 : 644–648. [Google Scholar]
- Ilonen J, Lempainen J, Veijola R. The heterogeneous pathogenesis of type 1 diabetes mellitus. Nat Rev Endocrinol 2019 ; 15 : 635–650. [CrossRef] [PubMed] [Google Scholar]
- Nathan DM, Genuth S, Lachin J, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993 ; 329 : 977–986. [Google Scholar]
- Kandaswamy R, Skeans MA, Gustafson SK, et al. OPTN/SRTR 2013 Annual data report: pancreas. Am J Transplant 2015 ; 15 : (suppl 2) : 1–20. [Google Scholar]
- Niclauss N, Meier R, Bédat B, et al. Beta-cell replacement: pancreas and islet cell transplantation. Endocr Dev 2016 ; 31 : 146–162. [CrossRef] [PubMed] [Google Scholar]
- Ricordi C, Lacy PE, Finke EH, et al. Automated method for isolation of human pancreatic islets. Diabetes 1988 ; 37 : 413–420. [CrossRef] [PubMed] [Google Scholar]
- Lablanche S, Borot S, Wojtusciszyn A, et al. Five-year metabolic, functional, and safety results of patients with type 1 diabetes transplanted with allogenic islets within the Swiss-French GRAGIL network. Diabetes Care 2015 ; 38 : 1714–1722. [CrossRef] [PubMed] [Google Scholar]
- Giuliani M, Moritz W, Bodmer E, et al. Central necrosis in isolated hypoxic human pancreatic islets: evidence for postisolation ischemia. Cell Transplant 2005 ; 14 : 67–76. [CrossRef] [PubMed] [Google Scholar]
- Delaune V, Berney T, Lacotte S, Toso C. Intraportal islet transplantation: the impact of the liver microenvironment. Transpl Int 2017 ; 30 : 227–238. [Google Scholar]
- Onaca N, Takita M, Levy MF, Naziruddin B. Anti-inflammatory approach with early double cytokine blockade (IL-1β and TNF-α) is safe and facilitates engraftment in islet allotransplantation. Transplant Direct 2020; 6 : e530. [CrossRef] [PubMed] [Google Scholar]
- Clevers H. Modeling development and disease with organoids. Cell 2016 ; 165 : 1586–1597. [CrossRef] [PubMed] [Google Scholar]
- Li WH. Functional analysis of islet cells in vitro, in situ, and in vivo. Semin Cell Dev Biol 2020. [PubMed] [Google Scholar]
- Halban PA, Powers SL, George KL, Bonner-Weir S. Spontaneous reassociation of dispersed adult rat pancreatic islet cells into aggregates with three-dimensional architecture typical of native islets. Diabetes 1987 ; 36 : 783–790. [CrossRef] [PubMed] [Google Scholar]
- Matta SG, Wobken JD, Williams FG, Bauer GE. Pancreatic islet cell reaggregation systems: efficiency of cell reassociation and endocrine cell topography of rat islet-like aggregates. Pancreas 1994 ; 9 : 439–449. [CrossRef] [PubMed] [Google Scholar]
- Cavallari G, Zuellig RA, Lehmann R, et al. Rat pancreatic islet size standardization by the hanging drop technique. Transplant Proc 2007 ; 39 : 2018–2020. [CrossRef] [PubMed] [Google Scholar]
- Lebreton F, Lavallard V, Bellofatto K, et al. Insulin-producing organoids engineered from islet- and amniotic epithelial cells to treat diabetes. Nat Commun 2019; 10. [PubMed] [Google Scholar]
- Yu Y, Gamble A, Pawlick R, et al. Bioengineered human pseudoislets form efficiently from donated tissue, compare favourably with native islets in vitro and restore normoglycaemia in mice. Diabetologia 2018 ; 61 : 2016–2029. [CrossRef] [PubMed] [Google Scholar]
- Dybala MP, Hara M. Heterogeneity of the human pancreatic islet. Diabetes 2019 ; 68 : 1230–1239. [CrossRef] [PubMed] [Google Scholar]
- Lehmann R, Zuellig RA, Kugelmeier P, et al. Superiority of small islets in human islet transplantation. Diabetes 2007 ; 56 : 594–603. [CrossRef] [PubMed] [Google Scholar]
- Zuellig RA, Cavallari G, Gerber P, et al. Improved physiological properties of gravity-enforced reassembled rat and human pancreatic pseudo-islets. J Tissue Eng Regen Med 2017 ; 11 : 109–120. [CrossRef] [PubMed] [Google Scholar]
- Lavallard V, Armanet M, Parnaud G, et al. Cell rearrangement in transplanted human islets. FASEB J 2016 ; 30 : 748–760. [CrossRef] [PubMed] [Google Scholar]
- Wolf-Jochim M, Wohrle M, Federlin K, Bretzel RG. Comparison of the survival of fresh or cultured pancreatic islets, pseudoislets and single cells following allotransplantation beneath the kidney capsule in non-immunosuppressed diabetic rats. Exp Clin Endocrinol Diabetes 1995 ; 103(suppl 2): 118–122. [Google Scholar]
- Zaldumbide A, Alkemade G, Carlotti F, et al. Genetically engineered human islets protected from CD8-mediated autoimmune destruction in vivo. Mol Ther 2013 ; 21 : 1592–1601. [CrossRef] [PubMed] [Google Scholar]
- Harata M, Liu S, Promes JA, et al. Delivery of shRNA via lentivirus in human pseudoislets provides a model to test dynamic regulation of insulin secretion and gene function in human islets. Physiol Rep 2018 ; 6 : e13907. [CrossRef] [PubMed] [Google Scholar]
- Teraoku H, Lenzen S. Dynamics of insulin secretion from endoC-betaH1 beta-cell pseudoislets in response to glucose and other nutrient and nonnutrient secretagogues. J Diabetes Res 2017 ; 2017 : 2309630. [CrossRef] [PubMed] [Google Scholar]
- Penko D, Mohanasundaram D, Sen S, et al. Incorporation of endothelial progenitor cells into mosaic pseudoislets. Islets 2011 ; 3 : 73–79. [Google Scholar]
- Jiao A, Li F, Zhang C, et al. Simulated cholinergic reinnervation of beta (INS-1) cells: antidiabetic utility of heterotypic pseudoislets containing beta cell and cholinergic cell. Int J Endocrinol 2018 ; 2018 : 1505307. [CrossRef] [PubMed] [Google Scholar]
- Sakata N, Goto M, Yoshimatsu G, et al. Utility of co-transplanting mesenchymal stem cells in islet transplantation. World J Gastroenterol 2011 ; 17 : 5150–5155. [CrossRef] [PubMed] [Google Scholar]
- Arzouni AA, Vargas-Seymour A, Dhadda PK, et al. Characterization of the effects of mesenchymal stromal cells on mouse and human islet function. Stem Cells Transl Med 2019 ; 8 : 935–944. [PubMed] [Google Scholar]
- Ito T, Itakura S, Todorov I, et al. Mesenchymal stem cell and islet co-transplantation promotes graft revascularization and function. Transplantation 2010 ; 89 : 1438–1445. [CrossRef] [PubMed] [Google Scholar]
- Miki T. Stem cell characteristics and the therapeutic potential of amniotic epithelial cells. Am J Reprod Immunol 2018 ; 80 : e13003. [Google Scholar]
- Lebreton F, Bellofatto K, Wassmer CH, et al. Shielding islets with human amniotic epithelial cells enhances islet engraftment and revascularization in a murine diabetes model. Am J Transplant 2020. [Google Scholar]
- Qureshi KM, Lee J, Paget MB, et al. Low gravity rotational culture and the integration of immunomodulatory stem cells reduce human islet allo-reactivity. Clin Transplant 2015 ; 29 : 90–98. [CrossRef] [PubMed] [Google Scholar]
- Zafar A, Lee J, Yesmin S, et al. Rotational culture and integration with amniotic stem cells reduce porcine islet immunoreactivity in vitro and slow xeno-rejection in a murine model of islet transplantation. Xenotransplantation 2019 ; 26 : e12508. [CrossRef] [PubMed] [Google Scholar]
- Sneddon JB, Tang Q, Stock P, et al. Stem cell therapies for treating diabetes: progress and remaining challenges. Cell Stem Cell 2018 ; 22 : 810–823. [Google Scholar]
- Insulinothérapie Verge D. Nouvelles molécules et voies d’administration. Med Sci (Paris) 2004 ; 20 : 986–998. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Les différentes méthodes utilisées pour générer des organoïdes sécréteurs d’insuline. Les organoïdes sécréteurs d’insuline sont obtenus après dissociation enzymatique des îlots de Langerhans isolés. Les cellules obtenues sont ensuite réagrégées. Pour cela, différentes techniques peuvent être employées. A. La réagrégation spontanée de cellules d’îlots en suspension dans un support de culture non adhérent forme des pseudo-îlots de tailles variables. B. Le recours à la culture cellulaire en rotation (CRCT), durant laquelle un mouvement de rotation (symbolisé ici par la flèche verte) est appliqué à la suspension cellulaire tout au long du processus de réagrégation, favorise la réagrégation cellulaire et forme des organoïdes de diamètre plus élevé. C. La technique des microgouttes inversées utilise la tension de surface des gouttes pour concentrer les cellules ensemencées au fond des gouttes. Cette technique permet de contrôler le nombre de cellules désiré dans les organoïdes et donc leur taille. D. La conception de micro-puits dans les supports de culture (soit par utilisation de micro-moules d’agarose, soit des plaques de culture contenant déjà des micro-puits dès leur fabrication) repose sur le même principe que celui des microgouttes inversées en concentrant les cellules dans des puits de petit volume, et permet de maitriser la taille des organoïdes générés. Cependant, cette méthode comporte de multiples avantages par rapport à celle des microgouttes : la possibilité de centrifuger les cellules après ensemencement pour accélérer leur sédimentation au fond des micro-puits et ainsi diminuer le risque de perte cellulaire, la possibilité de renouveler le milieu de culture, ainsi que la facilité de manipulation et le gain de temps de ces supports permettent d’appliquer cette méthode à grande échelle. |
| Dans le texte | |
 |
Figure 2. Des organoïdes hybrides combinant des cellules d’îlots de rat et des cellules amniotiques épithéliales humaines corrigent le diabète chez la souris diabétique immunodéficiente. A. Représentation schématique de la conception des organoïdes hybrides d’îlots. Les cellules d’îlots de rat (CI) et des cellules amniotiques épithéliales humaines (CAE) ont été mélangées à un ratio de 1:1, ensemencées dans des micropuits d’agarose et incubées pendant 5 jours pour générer des organoïdes. B. Vue en microscopie confocale d’un organoïde hybride montrant une répartition homogène des différents types cellulaires au sein de la construction. Les cellules β des îlots sont marquées en vert avec un anticorps dirigé contre l’insuline, tandis que les CAE sont marquées en rouge avec un anticorps dirigé contre le facteur nucléaire humain. (Barre d’échelle = 50 µm). C. Fonction in vivo des organoïdes d’îlots : la transplantation d’une masse limite de 150 organoïdes hybrides (CI+CAE) sous la capsule rénale de souris immunodéficientes diabétiques permet de rétablir des niveaux sanguins de glucose normaux, contrairement à la transplantation de la même quantité de sphéroïdes composés uniquement de cellules d’îlots (CI). La transplantation de CAE uniquement ne corrige absolument pas l’hyperglycémie, démontrant que les CAE ont ici un rôle support pour les cellules d’îlots. D. Coupes histologiques des greffons après 4 mois, montrant la surface marquée avec un anticorps fluorescent dirigé contre l’insuline, illustrant une meilleure implantation dans le groupe CI+CAE comparé au groupe CI. (Barre d’échelle = 500 µm). E. La revascularisation est augmentée dans le groupe CI+CAE. Les vaisseaux sanguins sont détectés dans les greffons 14 jours après la transplantation en utilisant un anticorps fluorescent dirigé contre CD34 (en rouge) tandis que les cellules d’îlots sont marquées avec un anticorps fluorescent dirigé contre l’insuline (en vert). (Barre d’échelle = 20 µm). F. La quantification des vaisseaux sanguins confirme une meilleure revascularisation dans le groupe CI+CAE 14 jours et 28 jours après la transplantation (figures adaptées de [21]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




