| Issue |
Med Sci (Paris)
Volume 36, Number 10, Octobre 2020
Rétine
|
|
|---|---|---|
| Page(s) | 886 - 892 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2020159 | |
| Published online | 07 October 2020 | |
Sur les origines inflammatoires de la DMLA
On the inflammatory origins of AMD
Sorbonne Université, Inserm, CNRS, Institut de la vision, 17 rue Moreau, F-75012 Paris, France
La dégénérescence maculaire liée à l’âge (DMLA) est une maladie multifactorielle hautement héréditaire qui survient chez le sujet âgé et est causée par une combinaison de facteurs de risques génétiques et environnementaux. Les formes atrophiques de la maladie constituent aujourd’hui une impasse thérapeutique. La physiopathologie de la DMLA est invariablement associée à une accumulation dans l’espace sous-rétinien, de phagocytes mononucléés (PM), une famille de cellules qui inclue des macrophages résidents et inflammatoires. Nous aborderons dans cette revue l’ensemble des mécanismes de cette inflammation spécifique, de l’origine des PM aux conséquences de leur accumulation dans l’espace sous-rétinien. Finalement, nous discuterons de l’impact des facteurs de risques génétiques et environnementaux établis de la DMLA sur le passage d’une inflammation bénéfique aux stades précoces de la maladie à une inflammation délétère aux stades avancés.
Abstract
Age-related macular degeneration (AMD) is a complex, highly heritable, multifactorial disease caused by the interplay of age and genetic and environmental risk factors. No treatment has yet been found to treat the slowly progressing atrophic form of AMD. All forms of AMD are invariably associated with an accumulation of mononuclear phagocytes (MP) in the subretinal space, a family of cells that include inflammatory and resident macrophages. We here present an overview of the inflammatory process occurring in AMD and discuss the origin of MPs and the consequences of their accumulation in the subretinal space. Finally, we will review the role played by the established risk factors for AMD to promote the switch from beneficial inflammation in early stage to a deleterious inflammation in the advanced stage of the disease.
© 2020 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette (Photo © Florian Sennlaub).
L’inflammation dans la DMLA
Définition et épidémiologie de la DMLA
La dégénérescence maculaire liée à l’âge (DMLA) est une maladie multifactorielle complexe causée par l’interaction de facteurs de risques génétiques et environnementaux conduisant à la dégénérescence progressive de la rétine et une perte progressive de la vision. Cette maladie affecte plus de 150 millions de personnes dans le monde, dont 10 millions souffrant d’une DMLA tardive [1]. L’apparition des traitements anti-VEGF (vascular endothelial growth factor) a révolutionné la prise en charge de la DMLA humide (hDMLA) en inhibant la formation des néovaisseaux et la fuite vasculaire, asséchant ainsi les œdèmes rétiniens. Il n’existe à ce jour aucun traitement pour la forme atrophique (ou atrophie géographique, AG) de la pathologie.
Physiopathologie et inflammation
La DMLA se caractérise par des dépôts de débris lipoprotéinés d’une certaine taille (> 65 µm), appelés soft Drusen, sous l’épithélium pigmentaire rétinien (EPR), ou de débris lipoprotéinés au-dessus de l’EPR, appelés Drusen reticulés (dans la DMLA précoce), par des néovascularisations choroïdiennes (NVC) (dans la forme tardive de la hDMLA), ou par une lésion croissante des photorécepteurs et de l’EPR (dans la forme tardive de l’atrophie géographique). Quels que soient le stade et la forme de la maladie, celle-ci est caractérisée par l’accumulation de phagocytes mononucléés (PM) dans l’espace sous-rétinien (ESR) (Figure 1).
 |
Figure 1. Infiltration des phagocytes mononucléés (PM) dans la DMLA. La couche des photorécepteurs et l’espace sous-rétinien sont dépourvus de PM dans la rétine saine. Cependant, ces cellules, dérivées des monocytes circulants (Mo), de macrophages résidents (rMφ) et de cellules microgliales (MC), infiltrent l’espace sous-rétinien autour des zones de néovascularisations choroïdiennes et des zones atrophiques chez les patients respectivement atteints de DMLA néovasculaire (hDMLA) et atrophique (AG). Ils sont également présents du côté apical de l’EPR de la zone de transition des patients avec AG et dans et autour des Drusen. |
Les PM constituent un groupe de cellules qui comprend les monocytes (Mo), les macrophages résidents (rMφ), tels que les cellules microgliales (MC) pour le système nerveux centrale (SNC), et les macrophages inflammatoires dérivés des monocytes (iMφ). Les rMφ sont des cellules sentinelles qui surveillent l’environnement local et phagocytent les cellules apoptotiques pour maintenir l’homéostasie tissulaire. Ils s’activent en cas de lésions tissulaires ou en présence de pathogènes, libérant de nombreux médiateurs et, notamment, des chimiokines. Celles-ci vont permettre le recrutement de Mo inflammatoires circulants qui, en pénétrant dans le tissu lésé, se différencient en iMφ et amplifient la réaction inflammatoire. Une fois la phase d’inflammation aiguë résolue, les macrophages (Mφ) acquièrent une identité qui favorise l’angiogenèse, la réparation puis la fibrose et la cicatrisation du tissu. Lorsque l’homéostasie est rétablie, les Mφ infiltrants sont éliminés par apoptose, et les rMφ se redistribuent dans le tissu. Cependant, dans beaucoup de maladies chroniques, la résolution de l’inflammation n’est pas effective, et une inflammation chronique perdure, ce qui induit des dommages cellulaires collatéraux, notamment pour les tissus à faible pouvoir régénératif. Lors d’un stress chronique, l’inflammation peut néanmoins être bénéfique, permettant au tissu de s’adapter à la chronicité du stress auquel il est exposé. Au stade précoce de la DMLA, par exemple, si les Mφ acquièrent des caractéristiques qui ne les rendent pas trop toxiques pour leur environnement, ils pourraient contrôler l’accumulation de débris lipoprotéinés des Drusen et ainsi éviter la progression vers les formes tardives. Environ la moitié des malades présentant une DMLA précoce ne développent en effet jamais de forme tardive débilitante [2, 3].
Au travers d’une multitude de travaux utilisant des modèles pathologiques variés, l’appréciation d’un rôle important de l’accumulation sous-rétinienne de PM dans la pathogenèse de la DMLA a été établie.
L’œil et l’immunoprivilège
Physiologiquement, la couche des photorécepteurs et l’ESR ne contiennent pas de PM. Contrairement à la plupart des tissus, il n’y a dans cette couche de la rétine ni rMφ ni vaisseaux sanguins ou lymphatiques qui pourraient faciliter leur recrutement et leur régression. Les mécanismes permettant le maintien de cet immunoprivilège sont à la fois « passifs », avec la barrière hémato-rétinienne, et « actifs », assurés par une signalisation anti-inflammatoire et immunosupressive [4].
Signal inhibiteur CX3CL1/CX3CR1
La signalisation de la fractalkine (ou CX3CL1, C-X3-C motif chemokine ligand 1) et de son récepteur CX3CR1 est un signal majeur dans la rétine, qui permet le maintien des cellules microgliales (MC) dans un état peu inflammatoire, adapté à l’environnement neuronal. CX3CR1 est fortement exprimé par les MC et son ligand, exprimé constitutivement par les neurones, réprime leur activation inflammatoire dans la rétine interne. Les souris dont le gène Cx3cr1 a été délété, développent avec l’âge, ou suite à une exposition à des stress non toxiques, une accumulation de PM dans l’ESR, engendrant des dommages tissulaires [5-7]. Dans des modèles de lésions tissulaires (induit pas laser par exemple), la réaction inflammatoire est amplifiée chez les souris Cx3cr1-/-, ce qui provoque une néovascularisations choroïdiennes exagérée comparée aux souris contrôles [5, 7].
Signalisation TSP1/CD47 et Fas/FasL
Chez le sujet sain et chez la souris, deux signalisations immunosupressives majeures induisent physiologiquement l’élimination de tous les PM ou de toutes les cellules endothéliales néovasculaires présents dans l’ESR : les signalisations Fas/FasL et TSP-1 (thrombospondin-1)/CD47 (ou IAP, integrin-associated protein).
Les souris Tsp1-/- présentent avec l’âge, ou après induction de lésions, une accumulation augmentée et prolongée de PM dans l’espace sous-rétinien résultant d’un défaut de clairance, comme le démontre la survie accrue de PM de souris Tsp1-/- et CD47-/- injectés dans l’espace sous-rétinien de souris sauvages [8]. En effet, la signalisation initiée par CD47 sensibilise les PM à l’action pro-apoptotique du ligand de Fas (FasL) [9] exprimé par les cellules de l’EPR. Ces deux signalisations permettent ainsi, ensemble, la clairance des cellules immunitaires infiltrantes ou injectées dans l’ESR [10] (Figure 2) ; la perturbation de l’une de ces voies de signalisation conduit donc à une survie augmentée et à une accumulation des PM dans l’ESR.
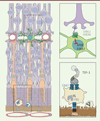 |
Figure 2. Immunosuppression physiologique rétinienne. Physiologiquement, la rétine est un environnement immunosuppresseur. Il existe au niveau rétinien des signaux inhibiteurs via l’expression neuronale de la chimiokine CX3CL1 qui inhibe l’activation microgliale. Dans l’espace sous-rétinien, l’activation de CD47 exprimée par les leucocytes infiltrants par la thrombospondine-1 (TSP-1) sensibilise les cellules inflammatoires à la mort et à l’élimination induites par FasL. |
Médiateurs pro-inflammatoires
Certains défauts des PM, comme la délétion de Cx3cr1 ou l’expression de l’allèle APOE2 (apolipoprotéine E, voir plus loin) induisent la sécrétion de médiateurs pro-inflammatoires, pro-angiogéniques ou encore pro-fibrotiques, qui sont suffisants pour induire la dégénérescence qui caractérise la DMLA.
Les médiateurs pro-inflammatoires particulièrement délétères exprimés par les PM infiltrants sont les interleukines 1b (IL-1b) et 6 (IL-6), le tumor necrosis factors a (TNF-α) et la chimiokine CCL2 (C-C motif chemokine ligand 2).
L’interleukine 1b (IL-1b)
L’IL-1b est une cytokine pro-inflammatoire dont la sécrétion nécessite une double activation : l’induction de l’expression de la pro-IL-1b et un signal qui active l’inflammasome permettant le clivage par la caspase 1 de cette pro-IL-1b en IL-1b mature qui sera sécrétée. Dans l’inflammation sous-rétinienne, c’est l’activation du récepteur purinergique P2X7 par l’ATP qui est à l’origine de ce deuxième signal [11]. L’IL-1b promeut fortement la croissance de la néovascularisations choroïdiennes induite par laser [12]. Cette cytokine est en effet un facteur de survie pour les cellules endothéliales qui est comparable au VEGF [13]. L’IL-1b induit également la mort des bâtonnets [11], en inhibant la résorption du glutamate dans la couche des photorécepteurs, qui atteint alors des taux qui leur sont toxiques [14]. Selon un mécanisme indépendant du glutamate et encore mal compris, l’IL-1b est aussi à l’origine de la perte des segments externes des cônes, comme cela est observé chez les malades atteints d’atrophie géographique [15].
L’interleukine 6 (IL-6)
Comme l’IL-1b, l’IL-6 a des propriétés pro-angiogéniques importantes. En clinique, la concentration intra-oculaire de la cytokine est corrélée à la survenue d’œdèmes maculaires plus étroitement que le VEGF [16]. Expérimentalement, l’IL-6 diminue l’action immunosuppressive de l’ESR, en inhibant l’expression de FasL par l’épithélium pigmentaire. Elle favorise également l’inflammation et les néovascularisations choroïdiennes induites par laser chez la souris [17].
Le TNF-a
Tout comme l’IL-1b et l’IL-6, le TNF-α est impliqué dans le développement des néovascularisations choroïdiennes (NVC). Cliniquement, les patients ayant des Mo exprimant un niveau important de TNF-α ont une prévalence supérieure de développer une NVC [18]. Chez la souris, son inhibition diminue la taille des NVC induites par laser [19]. In vitro, l’expression de TNF-α par les Mo humains réprime l’expression d’un facteur de transcription clé de l’EPR, l’OTX2 (orthodenticle homeobox 2), qui régule l’expression de gènes essentiels pour le cycle visuel du rétinol [20]. Ce mécanisme pourrait expliquer le ralentissement du cycle visuel que l’on observe au stade précoce de la maladie qui se caractérise par une infiltration de PM avant l’apparition de la dégénérescence de l’EPR ou des photorécepteurs. À plus long terme, la diminution d’expression d’OTX2 peut conduire à une dégénérescence progressive des photorécepteurs [21].
La chimiokine CCL2
CCL2 (C-C motif chemokine ligand 2) est la chimiokine majeure pour le recrutement des Mo pro-inflammatoires, qui expriment fortement son récepteur, CCR2, contrairement aux cellules microgliales (MC) [6], qui sont les principales cellules qui produisent la chimiokine en cas de stress au niveau de la rétine [6]. Sa concentration intra-oculaire est augmentée chez les patients atteints de DMLA néovasculaire [22] et atrophique [6], et une infiltration de Mo CCR2+ dans l’ESR est invariablement observée [6]. Dans des modèles murins de DMLA, comme la souris Cx3cr1-/-, ou après lésions induites par laser, environ 50 % des PM qui infiltrent l’ESR sont des Mo CCR2+ provenant de la circulation. L’inhibition du recrutement de ces monocytes (par délétion du gène CCR2 ou du gène CCL2 ou par déplétion des Mo circulants) préserve presque intégralement les photorécepteurs de la mort et diminue fortement la néovascularisation choroïdienne [6,23] (Figure 3). Les Mo CCR2+ exprimant le récepteur de la chimiokine semblent donc impliqués à la fois dans la dégénérescence rétinienne et dans la néovascularisation pathologique.
 |
Figure 3. Rôles des médiateurs inflammatoires dans la pathogenèse de la DMLA. L’activation des phagocytes mononucléés (PM) se traduit par une production augmentée de cytokines inflammatoires qui perturbent l’homéostasie de l’espace sous-rétinien à différents niveaux. |
 |
Figure 4. Implication des facteurs de risques génétiques de la DMLA sur l’inflammation. L’activation physiologique de CD47 exprimée à la surface phagocytes mononucléés (PM) infiltrants par la thrombospondine-1 (TSP-1) sensibilise les cellules à la mort cellulaire et à l’élimination induites par FasL exprimée par l’épithélium pigmentaire rétinien (EPR). Une concentration excessive d’apolipoprotéine E déstabilise les radeaux lipidiques (lipids rafts) à la membrane des PM, ce qui active l’IIRC (innate immunity receptor cluster) et induit l’expression de cytokines inflammatoires, telles que l’IL-6 qui inhibe l’expression de FasL par l’EPR. Le facteur H du complément (CFH) se lie à l’intégrine CD11b et inhibe, par encombrement stérique, l’activation de CD47 par la thrombospondine-1 (TSP-1), nécessaire pour sensibiliser les PM sous-rétiniens à une élimination induite par FasL. |
Les facteurs de risque de la DMLA
La DMLA est une maladie multifactorielle qui est causé par l’accumulation malheureuse de facteurs de risque génétiques et environnementaux. Nous verrons, dans cette partie, que l’ensemble des facteurs majeurs de risque connus pour la DMLA, jouent un rôle dans la promotion de l’inflammation sous-rétinienne.
Facteurs de risques génétiques
La DMLA comporte une forte composante héréditaire puisque les individus ayant un parent atteint de DMLA ont 5 à 10 fois plus de risque de développer la maladie [24].
Un variant du facteur H du complément
Un variant du gène codant le facteur H du complément (CFH) a été identifié comme le facteur génétique majeur qui prédispose à la DMLA. Le CFH est connu pour son rôle inhibiteur de la cascade du complément, mais cette macromolécule présente également un ensemble d’autres activités biologiques. Le variant identifié dans la DMLA (CFH Y402H) est caractérisé par une substitution de l’histidine 402 en tyrosine (Y402H) dans un domaine de la protéine qui assure sa fixation aux surfaces cellulaires. L’hypothèse selon laquelle le variant CFH Y402H est associé à la DMLA parce qu’il mènerait à une suractivation de la cascade du complément est probablement fausse. En effet, rien n’indique que la protéine CFH Y402H est moins efficace pour inhiber la cascade du complément, et un anticorps inhibant cette dernière n’a eu aucun effet sur la DMLA de malades porteurs du variant CFH Y402H [25]. Nous avons récemment montré que le variant CFH Y402H s’accompagnait non pas d’une désinhibition des voies alternes du complément, mais d’une inhibition des signaux immunosuppresseurs qui résultent de la voie de signalisation impliquant TSP1 et CD47 [8]. En effet, le CFH est une protéine capable d’opsoniser des débris cellulaires, ce qui facilite leur phagocytose après que les complexes ainsi formés se soient liés à l’intégrine CD11b exprimée à la surface des PM. Cette fixation de CFH au CD11b bloque, par encombrement stérique, l’activation de CD47, qui est elle-même associée au CD11b, par son ligand TSP1. Le CFH inhibe donc la voie majeure de la résolution de l’inflammation sous-rétinienne impliquant TPS1 et CD47 pour l’élimination des PM. La substitution de l’histidine 402 qui définit le variant à risque exacerbe cet effet, conduisant à une amplification de l’inflammation par défaut d’élimination des cellules inflammatoires. Ce mécanisme pourrait expliquer l’association et l’implication du variant CFH Y402H dans la DMLA [8].
L’isoforme 2 de l’apolipoprotéine E
L’apolipoprotéine E (ApoE) est primordiale dans l’efflux lipidique des Mφ et dans le transport du cholestérol vers le foie. Chez l’homme, l’ApoE est présente sous 3 isoformes différentes : ApoE2, 6 %, ApoE3, 80 %, et ApoE4, 14 %. Les porteurs de l’allèle APOE2, qui est associée à des concentrations d’ApoE plus élevées, présentent un risque accru de développer une DMLA tardive. Au contraire, les porteurs de l’allèle APOE4, associé à des concentrations d’ApoE plus faibles et un transport du cholestérol diminué, sont protégés vis-à-vis de l’isoforme commune ApoE3 [26] (ce qui est inverse de ce qui est observé dans l’athérosclérose et la maladie d’Alzheimer). Il semblerait donc que l’association entre isoformes d’ApoE et DMLA ne résulte pas d’un manque de la protéine ou d’une diminution de sa capacité de transport du cholestérol. Le mécanisme reliant les isoformes d’ApoE à la DMLA pourrait en effet impliquer le groupe de récepteurs d’immunité innée (IIRC), essentiel à l’activation des PM qui l’expriment fortement. En l’absence de stimulation, les différents composants de l’IIRC sont distribués à la surface des PM séparément les uns des autres : certains éléments (comme CD14) se regroupent en domaines membranaires riches en cholestérol, appelés « radeaux lipidiques » ; d’autres (comme les récepteurs de type Toll, toll-like receptors, TLR : TLR2 et TLR4) sont ancrés individuellement dans la membrane plasmique « en dehors des radeaux ». Les ligands de l’IIRC, tels que les lipopolysaccharides bactériens, se lient aux domaines extracellulaires des deux co-récepteurs (CD14 et TLR4), les rapprochant ainsi étroitement. Ceci provoque l’interaction de leurs domaines intracellulaires avec, pour résultat, l’activation des facteurs cytoplasmiques Myd88 (myeloid differentiation primary response 88) et NFkB (nuclear factor-kappa B) et une transcription à l’origine de cytokines inflammatoires. L’excès d’ApoE peut déstabiliser ces radeaux lipidiques en extrayant le cholestérol qui les compose, et ainsi lever la séparation physiologique entre co-récepteurs. Le rapprochement des récepteurs rendu ainsi possible déclenche alors en l’absence de ligands IIRC la signalisation intracellulaire [17]. Chez la souris, les PM des animaux porteurs de l’isoforme APOE2, tout comme ceux d’animaux Cx3cr1-/-, expriment excessivement l’ApoE, ce qui induit la sécrétion d’IL-6 et de CCL2 à l’origine de l’inflammation, de la dégénérescence et d’une NVC excessive [7, 17]. L’allèle APOE2 et la surexpression d’ApoE dans les PM est suffisante pour déclencher une inflammation pathogène. Chez la souris Cx3cr1-/-, qui surexprime l’ApoE, l’introduction de l’allèle APOE4 conduit à une diminution des niveaux d’ApoE et de CCL2 protégeant ainsi contre l’accumulation nocive de phagocytes sous-rétinienne, observée chez les souris Cx3cr1-/- porteuses d’allèles APOE3 [7]. Ces résultats, obtenus chez la souris, sont en parfait accord avec l’association des isoformes d’ApoE observée en clinique.
Ces études montrent donc que le risque génétique de DMLA dû aux isoformes d’ApoE et au variant CFH Y402H, des molécules exprimées par les PM, favorisent directement l’inflammation sous-rétinienne pathogène. Ceci n’est peut-être pas le fruit du hasard. Il se pourrait en effet que ces variants se soient accumulés dans les populations humaines car ils permettent une réponse inflammatoire plus importante et une défense contre les maladies infectieuses plus efficace.
Les facteurs de risques non génétiques
De nombreux facteurs de risques non génétiques ont été associés à la DMLA, tels que l’âge, le tabac et l’obésité. De même que pour les facteurs génétiques, l’étude des mécanismes impliqués dans la pathogénèse de la DMLA met en avant un rôle de plus en plus évident de l’inflammation sous-rétinienne.
Le vieillissement
L’âge est le facteur de risque qui définit la pathologie. L’âge est associé à une augmentation de CCL2 dans l’œil et à une diminution de l’activité immunosuppressive de l’ESR [6]. Les monocytes du sang produisent plus de cytokines pro-inflammatoires avec l’âge et la transplantation de la moelle osseuse, qui produit les monocytes, d’une souris âgée à une souris jeune promeut l’accumulation de PM et une néovascularisation choroïdienne après laser [27].
Le tabac
Le tabac augmente de 1,7 à 3,4 fois le risque de développer une DMLA [24]. Même si l’effet pro-inflammatoire du tabagisme au cours de la DMLA n’a pas encore été examiné, des études montrent clairement qu’il exacerbe l’inflammation dans des pathologies auto-immunes [28].
L’obésité et l’alimentation
De larges études épidémiologiques ont permis d’identifier l’obésité abdominale comme un facteur de risque de la DMLA [29]. Nos études chez la souris suggèrent que la dysbiose intestinale (déséquilibre du microbiote), associée à l’obésité, pourrait expliquer l’association observée en clinique. Cette dysbiose (résultant d’une modification du microbiote chez les personnes obèses) compromet en effet la fonction de la barrière intestinale, conduisant à la diffusion de particules microbiennes dans le flux sanguin. Ces produits microbiens pré-activent les monocytes circulants, exacerbant la neuro-inflammation et la néovascularisation choroïdienne dans l’ESR [30]. Dans le modèle que nous avons étudié, la dysbiose a été induite chez la souris par un régime riche en graisses. Une dysbiose comparable a récemment été signalée chez des patients atteints de DMLA, apparemment sans lien avec l’obésité [31], ce qui suggère que ce mécanisme pathogène n’est pas limité aux patients en surpoids.
Conclusion
Au stade précoce de la maladie, l’infiltration de PM pourrait favoriser le contrôle de l’accumulation excessive de débris sous la rétine, limitant ainsi la progression de la maladie vers des stades de DMLA tardive. Cependant, chez certains patients, la combinaison malheureuse de facteurs de risque de DMLA conduit probablement à l’apparition de monocytes et de PM particulièrement inflammatoires, dont la résistance à l’élimination induite par l’EPR est augmentée, ce qui conduit à leur recrutement excessif. La présence chronique de ces phagocytes activés dans l’ESR et dans la couche des photorécepteurs, participe au maintien de l’inflammation chronique et induit des dommages collatéraux. L’inflammation chronique pourrait ainsi participer à l’évolution de la maladie, mais elle pourrait aussi en constituer le principal mécanisme pathologique chez les patients présentant une sélection particulièrement défavorable de facteurs de risque pro-inflammatoires.
Les thérapies anti-inflammatoires actuelles, telles que les stéroïdes, les anti-inflammatoires non stéroïdiens (AINS) ou les médicaments immunosuppresseurs (telle la ciclosporine) peuvent avoir des effets paradoxaux sur la fonction des PM. Ils augmentent en effet les médiateurs pro-inflammatoires (stéroïdes à haute dose) [32], régulent positivement l’expression des TLR à la surface des macrophages (pour la ciclosporine) [33] et prolongent l’infiltration des macrophages (AINS), ce qui pourrait expliquer l’absence d’effet thérapeutique de ces molécules dans la DMLA [34]. Une meilleure compréhension des mécanismes inflammatoires devrait permettre de développer des agents pharmacologiques ciblant spécifiquement la résolution de l’inflammation sous-rétinienne et – associés aux anti-VEGF pour les DMLA néovasculaires ou seuls pour les formes atrophiques – de stopper la progression des lésions tissulaires et de préserver plus longtemps la vision.
Références
- Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health 2014; 2. [Google Scholar]
- Klein R, Peto T, Bird A, et al. The epidemiology of age-related macular degeneration. Am J Ophthalmol 2004 ; 137 : 486–495. [CrossRef] [PubMed] [Google Scholar]
- Querques G, Merle BMJ, Pumariega NM, et al. Dynamic drusen remodelling in participants of the nutritional AMD treatment-2 (NAT-2) randomized trial. PLoS One 2016 ; 11 : [Google Scholar]
- Streilein JW. Ocular immune privilege: therapeutic opportunities from an experiment of nature. Nat Rev Immunol 2003 ; 3 : 879–889. [PubMed] [Google Scholar]
- Combadière C, Feumi C, Raoul W, et al. CX3CR1-dependent subretinal microglia cell accumulation is associated with cardinal features of age-related macular degeneration. J Clin Invest 2007 ; 117 : 2920–2928. [CrossRef] [PubMed] [Google Scholar]
- Sennlaub F, Auvynet C, Calippe B, et al. CCR2+ monocytes infiltrate atrophic lesions in age-related macular disease and mediate photoreceptor degeneration in experimental subretinal inflammation in Cx3cr1 deficient mice. EMBO Mol Med 2013 ; 5 : 1775–1793. [CrossRef] [PubMed] [Google Scholar]
- Levy O, Lavalette S, Hu SJ, et al. APOE isoforms control pathogenic subretinal inflammation in age-related macular degeneration. J Neurosci 2015 ; 35 : 13568–13576. [CrossRef] [PubMed] [Google Scholar]
- Calippe B, Augustin S, Beguier F, et al. Complement factor H inhibits CD47-mediated resolution of inflammation. Immunity 2017 ; 46 : 261–272. [CrossRef] [PubMed] [Google Scholar]
- Manna PP, Dimitry J, Oldenborg PA, et al. CD47 augments fas/CD95-mediated apoptosis. J Biol Chem 2005 ; 280 : 29637–29644. [CrossRef] [PubMed] [Google Scholar]
- Levy O, Calippe B, Lavalette S, et al. Apolipoprotein E promotes subretinal mononuclear phagocyte survival and chronic inflammation in age-related macular degeneration. EMBO Mol Med 2015 ; 7 : 211–226. [CrossRef] [PubMed] [Google Scholar]
- Hu SJ, Calippe B, Lavalette S, et al. Upregulation of P2RX7 in Cx3cr1-deficient mononuclear phagocytes leads to increased interleukin-1β secretion and photoreceptor neurodegeneration. J Neurosci 2015 ; 35 : [Google Scholar]
- Lavalette S, Raoul W, Houssier M, et al. Interleukin-1 inhibition prevents choroidal neovascularization and does not exacerbate photoreceptor degeneration. Am J Pathol 2011 ; 178 : 2416–2423. [CrossRef] [PubMed] [Google Scholar]
- Schweighofer B, Testori J, Sturtzel C, et al. The VEGF-induced transcriptional response comprises gene clusters at the crossroad of angiogenesis and inflammation. Thromb Haemost 2009 ; 102 : 544–554. [CrossRef] [PubMed] [Google Scholar]
- Charles-Messance H, Blot G, Couturier A, et al. IL-1β induces rod degeneration through the disruption of retinal glutamate homeostasis. J Neuroinflammation 2020; 17 : 1. [CrossRef] [PubMed] [Google Scholar]
- Eandi CM, Messance HC, Augustin S, et al. Subretinal mononuclear phagocytes induce cone segment loss via IL-1β. Elife 2016 ; 5 : 1–16. [Google Scholar]
- Chalam K V., Grover S, Sambhav K, et al. Aqueous interleukin-6 levels are superior to vascular endothelial growth factor in predicting therapeutic response to bevacizumab in age-related macular degeneration. J Ophthalmol 2014; 2014. [Google Scholar]
- Levy O, Calippe B, Lavalette S, et al. Apolipoprotein E promotes subretinal mononuclear phagocyte survival and chronic inflammation in age-related macular degeneration. EMBO Mol Med 2015 ; 7 : 211–227. [CrossRef] [PubMed] [Google Scholar]
- Cousins SW, Espinosa-Heidmann DG, Csaky KG. Monocyte activation in patients with age-related macular degeneration: a biomarker of risk for choroidal neovascularization?. Arch Ophthalmol 2004 ; 122 : 1013–1018. [CrossRef] [PubMed] [Google Scholar]
- Lichtlen P, Lam TT, Michael Nork T, et al. Relative contribution of VEGF and TNF-α in the cynomolgus laser-induced CNV model: comparing the efficacy of bevacizumab, adalimumab, and ESBA105. Invest Ophthalmol Vis Sci 2010 ; 51 : 4738–4745. [CrossRef] [PubMed] [Google Scholar]
- Mathis T, Housset M, Eandi C, et al. Activated monocytes resist elimination by retinal pigment epithelium and downregulate their OTX2 expression via TNF-α. Aging Cell 2017 ; 16 : 173–182. [CrossRef] [PubMed] [Google Scholar]
- Housset M, Samuel A, Ettaiche M, et al. Loss of Otx2 in the adult retina disrupts retinal pigment epithelium function, causing photoreceptor degeneration. J Neurosci 2013 ; 33 : 9890–9904. [CrossRef] [PubMed] [Google Scholar]
- Fauser S, Viebahn U, Muether PS. Intraocular and systemic inflammation-related cytokines during one year of ranibizumab treatment for neovascular age-related macular degeneration. Acta Ophthalmol 2015 ; 93 : 734–738. [CrossRef] [PubMed] [Google Scholar]
- Sakurai E, Anand A, Ambati BK, et al. Macrophage depletion inhibits experimental choroidal neovascularization. Invest Ophthalmol Vis Sci 2003 ; 44 : 3578–3585. [CrossRef] [PubMed] [Google Scholar]
- Chakravarthy U, Wong TY, Fletcher A, et al. Clinical risk factors for age-related macular degeneration: A systematic review and meta-analysis. BMC Ophthalmol 2010 ; 10 : [Google Scholar]
- Holz FG, Sadda SR, Busbee B, et al. Efficacy and safety of lampalizumab for geographic atrophy due to age-related macular degeneration: chroma and spectri phase 3 randomized clinical trials. JAMA Ophthalmol 2018 ; 136 : 666–677. [CrossRef] [PubMed] [Google Scholar]
- Fritsche LG, Igl W, Bailey JNC, et al. A large genome-wide association study of age-related macular degeneration highlights contributions of rare and common variants. Nat Genet 2016 ; 48 : 134–143. [Google Scholar]
- Zhao H, Roychoudhury J, Doggett TA, et al. Age-dependent changes in fasl (CD95L) modulate macrophage function in a model of age-related macular degeneration. Invest Ophthalmol Vis Sci 2013 ; 54 : 5321–5331. [CrossRef] [PubMed] [Google Scholar]
- Arnson Y, Shoenfeld Y, Amital H. Effects of tobacco smoke on immunity, inflammation and autoimmunity. J Autoimmun 2010 ; 34 : 258–265. [Google Scholar]
- Adams MKM, Simpson JA, Aung KZ, et al. Abdominal obesity and age-related macular degeneration. Am J Epidemiol 2011 ; 173 : 1246–1255. [Google Scholar]
- Andriessen EM, Wilson AM, Mawambo G, et al. Gut microbiota influences pathological angiogenesis in obesity-driven choroidal neovascularization. EMBO Mol Med 2016 ; 8 : 1366–1379. [CrossRef] [PubMed] [Google Scholar]
- Zinkernagel MS, Zysset-Burri DC, Keller I, et al. Association of the intestinal microbiome with the development of neovascular age-related macular degeneration. Sci Rep 2017 ; 7 : 1–9. [CrossRef] [PubMed] [Google Scholar]
- Lim HY, Müller N, Herold MJ, et al. Glucocorticoids exert opposing effects on macrophage function dependent on their concentration. Immunology 2007 ; 122 : 47–53. [CrossRef] [PubMed] [Google Scholar]
- Tedesco D, Haragsim L. Cyclosporine: a review. J Transplant 2012 ; 2012 : 1–7. [Google Scholar]
- Gilroy DW, Colville-Nash PR, Willis D, et al. Inducible cyclooxygenase may have anti-inflammatory properties. Nat Med. 1999 ; 5 : 698–701. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Infiltration des phagocytes mononucléés (PM) dans la DMLA. La couche des photorécepteurs et l’espace sous-rétinien sont dépourvus de PM dans la rétine saine. Cependant, ces cellules, dérivées des monocytes circulants (Mo), de macrophages résidents (rMφ) et de cellules microgliales (MC), infiltrent l’espace sous-rétinien autour des zones de néovascularisations choroïdiennes et des zones atrophiques chez les patients respectivement atteints de DMLA néovasculaire (hDMLA) et atrophique (AG). Ils sont également présents du côté apical de l’EPR de la zone de transition des patients avec AG et dans et autour des Drusen. |
| Dans le texte | |
 |
Figure 2. Immunosuppression physiologique rétinienne. Physiologiquement, la rétine est un environnement immunosuppresseur. Il existe au niveau rétinien des signaux inhibiteurs via l’expression neuronale de la chimiokine CX3CL1 qui inhibe l’activation microgliale. Dans l’espace sous-rétinien, l’activation de CD47 exprimée par les leucocytes infiltrants par la thrombospondine-1 (TSP-1) sensibilise les cellules inflammatoires à la mort et à l’élimination induites par FasL. |
| Dans le texte | |
 |
Figure 3. Rôles des médiateurs inflammatoires dans la pathogenèse de la DMLA. L’activation des phagocytes mononucléés (PM) se traduit par une production augmentée de cytokines inflammatoires qui perturbent l’homéostasie de l’espace sous-rétinien à différents niveaux. |
| Dans le texte | |
 |
Figure 4. Implication des facteurs de risques génétiques de la DMLA sur l’inflammation. L’activation physiologique de CD47 exprimée à la surface phagocytes mononucléés (PM) infiltrants par la thrombospondine-1 (TSP-1) sensibilise les cellules à la mort cellulaire et à l’élimination induites par FasL exprimée par l’épithélium pigmentaire rétinien (EPR). Une concentration excessive d’apolipoprotéine E déstabilise les radeaux lipidiques (lipids rafts) à la membrane des PM, ce qui active l’IIRC (innate immunity receptor cluster) et induit l’expression de cytokines inflammatoires, telles que l’IL-6 qui inhibe l’expression de FasL par l’EPR. Le facteur H du complément (CFH) se lie à l’intégrine CD11b et inhibe, par encombrement stérique, l’activation de CD47 par la thrombospondine-1 (TSP-1), nécessaire pour sensibiliser les PM sous-rétiniens à une élimination induite par FasL. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




