| Issue |
Med Sci (Paris)
Volume 30, Number 5, Mai 2014
|
|
|---|---|---|
| Page(s) | 567 - 575 | |
| Section | Forum | |
| DOI | https://doi.org/10.1051/medsci/20143005021 | |
| Published online | 13 June 2014 | |
Biothérapies, immunothérapies, thérapies ciblées, biomédicaments…
De quoi faut-il parler ?
Biotherapies, immunotherapies, targeted therapies, biopharmaceuticals… Which word should be used?
Université François Rabelais, CHRU de Tours, UMR CNRS 7292 équipe « anticorps, récepteurs Fc et réponses cliniques », GDR CNRS 3260 « anticorps et ciblage thérapeutique », Labex MAbImprove, Faculté de médecine de Tours, 10, boulevard Tonnellé, 37032
Tours Cedex, France
Savoir précisément dénommer le progrès médical relève de la rigueur scientifique, mais c’est aussi une exigence pour faire communiquer le monde médical et scientifique et le grand public. Par leurs succès cliniques considérables, les anticorps thérapeutiques sont emblématiques de ce progrès ; si le terme de sérothérapie convenait il y a un siècle, il est devenu obsolète. Sont en revanche apparus récemment les termes de biothérapie, immunothérapie, thérapie ciblée et biomédicament ; ils englobent tous plus ou moins les traitements par anticorps. Quelle signification ont-ils réellement ? Que représentent-ils ? Les conclusions et recommandations tirées de cette analyse visent à simplifier le paysage, en proposant d’abandonner les termes de biothérapie et de thérapie ciblée, de ne pas utiliser le terme d’immunothérapie auprès du grand public, et de promouvoir le terme de biomédicament, en le positionnant bien comme un intermédiaire entre les médicaments chimiques et les médicaments vivants, qui nécessitent, eux aussi, d’être bien redéfinis.
Abstract
The ability to accurately describe and name medical advances is a prerequisite to foster public debates with scientists and physicians, and favour faith over fear among patients and citizens. Therapeutic antibodies are a good example of a medical breakthrough which has met with considerable clinical success, and which terminology has changed over the years. If the appellation serotherapy was appropriate a century ago, it has become obsolete. Recent names such as biotherapy, immunotherapy, targeted therapy, biopharmaceuticals have been introduced and are now commonly used, each of those can apply to therapeutic antibodies. It is thus interesting to question the real meaning of these different appellations. Our goal in this manuscript is to analyse the genesis of these terms but also to suggest how to simplify the terminology: biotherapy or targeted therapy need to be eliminated, as well as immunotherapy when communicating with non scientific public. It is recommended to favour the term biopharmaceuticals (biomédicaments in French), which clearly indicates the origin of these molecules, intermediate between chemical drugs and living biologics, whose borders need to be accurately defined also.
Une annexe contenant les Tableaux Is et IIs est à consulter sur le site de médecine/sciences (www.medecinesciences.org) à cette URL http://www.medecinesciences.org/10.1051/medsci/20143005021/olm
© 2014 médecine/sciences – Inserm
Le progrès médical génère de nouvelles options thérapeutiques qu’il faut savoir correctement nommer, sans céder aux effets de mode ni aux stratégies de communication des grands groupes pharmaceutiques. Se pose ainsi le cas des anticorps monoclonaux recombinants, emblématiques du progrès thérapeutique du xxi e siècle tout en étant les héritiers de la sérothérapie née à la fin du xix e siècle [1]. Alors que le terme sérothérapie est obsolète et impropre, aucun autre ne désigne pourtant l’utilisation de ces nombreux anticorps-médicaments ; anticorps-thérapie, théracorps ou anticorapie ne feraient sans doute pas recette. En revanche, sont apparus ou réapparus les termes de biothérapie(s), d’immunothérapie(s), de thérapie(s) ciblée(s) et, plus récemment, de biomédicament(s), qui tous englobent plus ou moins les anticorps thérapeutiques, sans forcément être bien compris ni bien employés.
Les propositions qui concluront cet article, consécutives à l’analyse dialectique de ces quatre termes, sont destinées à clarifier le paysage et à être débattues au sein des académies, sociétés savantes, agences réglementaires, organismes représentant l’industrie pharmaceutique, associations d’enseignants et associations de patients et d’usagers des systèmes de santé. L’objectif serait de parvenir à un consensus large, sans lequel notre société moderne ne peut percevoir que des messages brouillés, nuisibles à la vulgarisation et à l’acceptation sociale des progrès thérapeutiques, et susceptibles d’égarer le législateur.
Biothérapies, de tout et n’importe quoi !
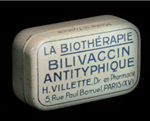
Accoler le préfixe bio à thérapie peut engendrer toutes sortes d’interprétations puisqu’il s’agit de traiter par/avec la vie ou par/avec le vivant. Apparu en 1896, le terme biothérapie désigne alors les soins par les eaux thermales qui puisent leurs forces vitales des entrailles de la terre [2, 3]. Il prend ensuite une connotation plus microbiologique, voire immunologique [4–7], et devient aussi en 1921 le nom d’un établissement pharmaceutique (Figure 1). Biothérapie évoque alors le contrôle du monde vivant microbien par la chimie (antiseptiques) ou par des produits d’origine biologique (sérum, extraits microbiens, etc.). L’explosion des antibiotiques après la seconde guerre mondiale fit temporairement disparaître la biothérapie tout en créant l’antibiothérapie, que certains esprits malicieux pourraient aussi lire anti-biothérapie !
 |
Figure 1. Bilivaccin antityphique des laboratoires « La Biothérapie ». Dans l’entre-deux-guerres, ce laboratoire pharmaceutique a commercialisé des extraits antigéniques tels que ce bilivaccin, mais aussi des antiseptiques et différents anti-infectieux, notamment le dentifrice Sanogyl®. Ce laboratoire est également connu pour avoir eu comme collaborateur, de 1930 à 1937, le Dr Louis-Ferdinand Destouches (1894-1961), plus connu sous le nom de Louis-Ferdinand Céline (Université de Tours, ©Daniel Bourry, objets de la collection Watier). |
Biothérapie conquit alors un nouveau registre, puisqu’une Société médicale de biothérapie (SMB) fut créée à Paris en 1963 pour promouvoir l’homéopathie et ses différentes déclinaisons, telles que la gemmothérapie (tissus embryonnaires végétaux), la micromycothérapie (champignons inférieurs), la lithothérapie (cristaux), et l’organothérapie (extraits d’organes animaux) [8], parfois désignées sous le terme de biothérapiques [9, 10]. La SMB publie depuis 1964 les Cahiers de biothérapie. Biothérapie se trouve aussi en homéopathie vétérinaire [11], tandis que l’ostéopathie et la sophrologie ne sont pas en reste, avec des termes comme ostéo-biothérapie ou psycho-bio-thérapie. Rappelant le vitalisme des sources thermales, biothérapie fait donc écho à certaines modes, en cohérence avec l’usage français du préfixe bio désignant les produits issus de l’agriculture biologique (les Anglais utilisent organic).
En 1988, alors que les Américains parlent plutôt de biologics et de biologic therapy, des Néerlandais choisissent Biotherapy pour dénommer un périodique traitant des biological response modifiers (agents modulant les défenses de l’hôte), des lymphokines, des cytokines et des anticorps monoclonaux [12]. Dénommer ainsi des protéines thérapeutiques issues d’OGM (organisme génétiquement modifié), dont les effets thérapeutiques autant que les effets indésirables sont loin d’en faire des médecines douces, ne manque pas de croustillant si l’on s’en réfère à la situation française ! À l’arrivée des anti-TNF-α (tumor necrosis factor-α) (infliximab, étanercept, etc.) en rhumatologie dix ans plus tard, biotherapies et biologic therapies s’imposèrent en Europe pour désigner ces médicaments issus des biotechnologies et se transformèrent naturellement en biothérapies sur le sol français (Figure 2). Avec l’élargissement des indications des anti-TNF-α et l’arrivée de nouveaux anticorps et protéines de fusion (voir le Tableau Is , listant les médicaments d’origine biologique à activité immunosuppressive sur le site de m/s, www.medecinesciences.org)1, le terme de biothérapie s’est étendu à de nombreuses disciplines prenant en charge les maladies inflammatoires et auto-immunes. Le terme n’a pas connu autant d’engouement en cancérologie, malgré l’approbation de nombreux anticorps monoclonaux (voir sur le Tableau IIs , le classement des anticorps anticancéreux, en ligne sur le site de m/s, www.medecinesciences.org) et autres thérapies ciblées (voir ci-dessous). Le risque persiste néanmoins de voir considérées les biothérapies comme la douce antithèse des chimiothérapies, ou de constater au contraire un amalgame entre les deux termes.
 |
Figure 2. Boîte de recueil de seringues usagées. C’est à domicile que les patients se trouvent confrontés aux biothérapies : cette boîte sert à jeter le matériel ayant servi à pratiquer leurs injections de biomédicaments, quand ceux-ci sont administrés en ambulatoire (ici, des anti-TNF-α). |
Classification des différents types d’immunothérapie.
Classification des biomédicaments substitutifs et « modificatifs », naturels (N) et recombinants (R).
L’histoire des biothérapies ne s’arrête pas là. Au milieu des années 2000, l’Inserm (Institut national de la santé et de la recherche médicale) décide d’employer le terme de biothérapies pour désigner cette fois la thérapie cellulaire et la thérapie génique, et labellise onze CIC (centre d’investigation clinique) intégrés en biothérapies (CIC-BT). Biothérapie connaît depuis un succès certain puisque six unités de recherche de l’Inserm l’affichent dans leur titre, et huit autres le mentionnent en thématique principale. Le point commun de ces nouvelles thérapies est la cellule, soumise ex vivo à sélection, différenciation, transformation (au sens génétique) ou encore à diverses opérations visant à modifier ses propriétés d’immunogénicité dans le but de vacciner ou de « tolériser ». Ces biothérapies académiques rejoignent souvent les problématiques de la greffe et de la médecine régénérative.
Biothérapie n’a donc jamais cessé de conquérir de nouveaux domaines thérapeutiques ; terme commode car difficile à définir, il tend à désigner l’innovation et la rupture thérapeutique. Malgré tout, il est grave que personne ne sache plus dire aujourd’hui s’il désigne l’homéopathie, les protéines thérapeutiques ou la thérapie cellulaire ou génique.
Immunothérapie, une affaire de spécialistes
Immunothérapie apparaît d’abord en Allemagne en 1910 [13–15], puis en France en 1911 [16, 17]. Il désigne une thérapie par l’immunité, qu’on provoque ou qu’on renforce afin de mieux lutter contre les microbes. Comme biothérapie à la même époque, ce terme général recouvre aussi bien l’emploi des sérums que l’utilisation de produits microbiens, vaccins ou stimulants de l’immunité.
Le terme est exhumé dans les années 1960 par Georges Mathé et Jean-Louis Amiel2. Constatant les effets antileucémiques des allogreffes de moelle osseuse, ils forgèrent d’abord le terme d’immunothérapie adoptive [18, 19], puis, réussissant à stimuler l’immunité anticancéreuse par l’injection de produits microbiens, ils créèrent le terme d’immunothérapie active [20–22], qui désigne des traitements ayant pour but d’accroître ou de déclencher une réaction immunitaire contre le cancer. Leur immunothérapie active non spécifique ouvrit cependant la voie à la recherche d’antigènes spécifiques de tumeurs et aux approches d’immunothérapie active spécifique [23], et fit naître en miroir le terme d’immunothérapie passive pour désigner le transfert d’anticorps conférant une immunité antitumorale [24, 25] ou anti-infectieuse [26]. Ces définitions restent toujours valides aujourd’hui, permettant de classer divers agents thérapeutiques (Tableau I).
Avec l’explosion des anticorps (Tableau IIs) 3, cette classification présente tout de même des limites. Alors que les anticorps ciblant la tumeur déterminent une immunothérapie passive spécifique, rares sont en fait ceux qui sont réellement spécifiques des cellules tumorales. Passif apparaît aussi très péjoratif pour des anticorps capables de mobiliser fortement le système immunitaire via leur portion Fc ou leur bispécificité (Tableau IIs) [1]. Quant au bévacizumab (anticorps anti-VEGF [vascular endothelial growth factor]), il n’entre dans aucune des catégories connues d’immunothérapie. Le regain récent de popularité du terme immunothérapie en cancérologie provient d’anticorps ciblant le système immunitaire et déterminant une immunité active antitumorale par désinhibition des lymphocytes effecteurs (par exemple anticorps anti-CTLA4) (Tableaux I et IIs) 3 [27]. Cette immunité n’est hélas pas spécifique de la tumeur, comme en témoignent les effets indésirables auto-immuns [27].
Immunothérapie est aussi utilisée en allergologie depuis les années 1970 pour désigner les désensibilisations par administration répétée de petites doses d’allergènes [28] (Tableau I). Au contraire de l’immunothérapie anti-infectieuse ou antitumorale, cette immunothérapie spécifique d’antigène a pour but de diminuer l’immunité, tout au moins l’état d’hypersensibilité du patient. En revanche, immunothérapie n’a jamais désigné les molécules immunosuppressives (ou immunomodulatrices, dans un sens de régulation négative), qui sont indiquées dans les maladies inflammatoires et auto-immunes et en transplantation. Le terme d’immunosuppresseur s’est imposé pour les composés chimiques, mais aucun terme portant un préfixe immuno ne désigne collectivement les composés protéiques listés dans le Tableau Is .
Le Code de la santé publique (CSP) ne définit pas immunothérapie, mais intègre la notion de médicament immunologique ( Encadré 1 , article L5121.1 alinéa 6) dont la définition est obsolète. Ainsi, les immunoglobulines intraveineuses seraient un médicament immunologique lorsqu’elles sont utilisées en substitution dans les déficits immunitaires, mais non lorsqu’elles sont utilisées comme immunomodulateurs dans les thrombopénies ou les neuropathies autoimmunes. Quant aux anticorps monoclonaux recombinants, ils sortent totalement de cette définition. Si on y ajoute que l’article L5111-1 (Encadré 1) définit « par médicament toute substance ou composition […] exerçant une action pharmacologique, immunologique ou métabolique », on peut aussi s’interroger sur ce que signifie une action immunologique à l’heure où médicaments et cibles sont de mieux en mieux définis sur un plan moléculaire, permettant d’accéder à leurs propriétés pharmacologiques. Seuls les antigènes (et allergènes), qui n’agissent pas sur une cible en particulier, mais sont reconnus par un panel de récepteurs d’antigènes et induisent une réponse immunitaire, devraient avoir une action immunologique. Évidemment, en poussant le raisonnement, ce serait le cas de tout médicament puisqu’aucun n’est dénué de risque allergique. Ni l’action immunologique des médicaments, ni les médicaments immunologiques ne viennent donc éclairer la notion d’immunothérapie, qui reste au final bien peu perceptible par ceux qui maîtrisent mal les concepts de l’immunologie
1 Extraits du Code de la santé publique1
Article L5111-1
On entend par médicament toute substance ou composition […], en vue d’établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique.
Article L5121-1
On entend par : […]
6° Médicament immunologique, tout médicament consistant en :
a) Allergène, défini comme tout produit destiné à identifier ou provoquer une modification spécifique et acquise de la réponse immunologique à un agent allergisant ;
b) Vaccin, toxine ou sérum, définis comme tous agents utilisés en vue de provoquer une immunité active ou passive ou en vue de diagnostiquer l’état d’immunité ; […]
12° Préparation de thérapie génique […]
13° Préparation de thérapie cellulaire xénogénique […]
14° Médicament biologique, tout médicament dont la substance active est produite à partir d’une source biologique ou en est extraite et dont la caractérisation et la détermination de la qualité nécessitent une combinaison d’essais physiques, chimiques et biologiques ainsi que la connaissance de son procédé de fabrication et de son contrôle ;
15° a) Sans préjudice des articles L. 611-2 et suivants du code de la propriété intellectuelle, médicament biologique similaire, tout médicament biologique de même composition qualitative et quantitative en substance active et de même forme pharmaceutique qu’un médicament biologique de référence mais qui ne remplit pas les conditions prévues au a) du 5° du présent article pour être regardé comme une spécialité générique […]
17° (article non encore promulgué) Médicament de thérapie innovante […]
Thérapies ciblées, beaucoup de marketing
Très longtemps, le terme de cible n’a été utilisé en médecine qu’au sens balistique ou comme métaphore séméiologique. Son utilisation en thérapeutique est récente et fait suite à l’identification des mécanismes moléculaires spécifiques de processus pathologiques [29–31]. Apparaît en filigrane le souhait d’éviter de léser les tissus sains ou encore, en restant dans la métaphore guerrière, d’éviter les dégâts collatéraux des médicaments.
Le fait d’avoir un médicament spécifique de cible n’était pas franchement nouveau. Dès l’origine, les antitoxines diphtériques ou tétaniques s’étaient montrées très spécifiques de leur cible antigénique [1]. Mais il est vrai qu’à la différence des anticorps générés vis-à-vis d’un antigène préalablement défini, les molécules chimiques ont longtemps été criblées dans des tests fonctionnels, jusqu’à ce qu’apparaisse le drug design. Avec la mise sur le marché de médicaments conçus par rapport à une cible, la logique aboutit donc à parler de thérapie ciblée. Avec ce sens précis, le terme n’apparaît que dans les années 1990 [32, 33] et s’est beaucoup répandu dans les années 2000, notamment en cancérologie, avec l’arrivée des inhibiteurs de molécules à activité tyrosine kinase (ITK). Les anticorps anticancéreux sont parfois intégrés dans les thérapies ciblées, surtout lorsqu’ils ciblent les mêmes voies que les ITK (EGFR [epidermal growth factor receptor], HER-2 [human EGFR2], VEGF [vascular endothelial growth factor] et son récepteur). Malgré tout, thérapie ciblée tend à se restreindre aux médicaments chimiques, avant tout pour les distinguer des antimitotiques classiques que le grand public connaît sous le nom de chimiothérapies. Thérapie ciblée met en valeur une meilleure spécificité d’action et une meilleure tolérance de l’arsenal anticancéreux moderne, avec une image guerrière prisée des publicistes.
Quoiqu’il en soit, le terme de thérapie ciblée possède ses propres limites. Tous les médicaments ont une cible (sauf peut-être les antigènes ayant une action immunologique, voir ci-dessus), et les molécules de la thérapie ciblée ne sont pas toujours aussi spécifiques qu’on le voudrait. Thérapie ciblée peut aussi prendre d’autres sens, comme celui d’un objectif thérapeutique à atteindre par le biais de stratégies adaptées [34], assez proche de la notion de concentrations-cibles à atteindre dans le cadre d’un suivi thérapeutique pharmacologique. Thérapie ciblée sur une population de patients, en fonction de différents profils [35], est un autre sens qui tend à être abandonné au profit de médecine personnalisée, voire de traitements sur mesure (tailored therapies). Enfin, le troisième sens est celui de médicaments véhiculés plus efficacement vers leur cible par différents moyens de délivrance (drug delivery) grâce à des excipients particuliers des liposomes, etc., ou celui de vectorisation via des molécules porteuses [36–38]. C’est ainsi que la doxorubicine liposomale ou les immunoconjugués (antibody-drug conjugates), récemment mis sur le marché, permettent de mieux cantonner l’action des agents chimiothérapeutiques aux cellules cancéreuses.
Le sens communément attribué à thérapie ciblée n’est d’ailleurs pas exclusif des autres sens, car on pourrait prescrire une thérapie ciblée, qui serait elle-même vectorisée et ciblée, en ciblant la population par une recherche de mutation et en se donnant des concentrations-cibles à atteindre ! Cela fait quand même beaucoup de cibles !
Biomédicaments, le petit dernier
Le terme de biomédicament a fait irruption en 2004 lors d’une campagne visant à sensibiliser les pouvoirs publics au retard pris par la France dans le domaine de la bioproduction pharmaceutique [39]. Mais ce n’est qu’en 2007 que la France introduisit la notion de médicament biologique dans le CSP ( Encadré 1 , article L5121-1, alinéa 14), terme qu’il faut considérer comme synonyme de celui de biomédicament [40]. En pratique, il paraît nécessaire de classer les biomédicaments selon qu’ils sont substitutifs ou « modificatifs » (adjectif inspiré de biological response modifiers). Les premiers permettent de corriger des insuffisances, génétiques ou non ; les seconds agissent en modifiant la physiologie par diverses actions agonistes ou antagonistes, voire en déclenchant des réactions immunitaires (Tableau II). Sont ainsi inclus les vaccins, les hormones, les protéines de l’hémostase, les cytokines et facteurs de croissance, les enzymes et les anticorps thérapeutiques (Tableau IV). L’accent sur ces derniers n’a été mis que secondairement [39], à juste titre du fait de leur énorme potentiel de développement. Même s’ils ne représentent encore que 17 % des spécialités de biomédicaments, ils comptent déjà pour 48 % du chiffre d’affaires de l’industrie pharmaceutique [41], sachant que plus de 350 anticorps sont en phase de développement clinique dans le monde.
Le CSP prévoyant par ailleurs le cas des préparations de thérapie génique, de thérapie cellulaire et de thérapies innovantes (Encadré 1) [45] (→), il y a lieu de considérer, comme d’autres [41, 42], que les cellules vivantes et les virus ne font pas partie des biomédicaments. De même, on distingue les produits sanguins stables (qui sont des biomédicaments) des produits sanguins labiles gérés par l’Établissement français du sang. L’emploi du terme de « préparation » permet d’insister sur le fait que ces autres thérapies sont beaucoup plus difficilement standardisables que ne le sont les biomédicaments produits industriellement (Tableau III) [41, 42].
(→) Voir le Forum/Débat de C. Chabannon et al., page 576 de ce numéro
D’après la définition (Encadré 1), la complexité de caractérisation détermine la frontière entre biomédicaments et médicaments chimiques, en particulier ceux qui sont extraits d’une source biologique (antibiotiques, alcaloïdes, etc.). Même à l’état pur, un biomédicament est une macromolécule issue d’une biosynthèse (glycoprotéine, polysaccharide, etc.), et se trouve constitué d’un mélange d’isoformes ou de glycoformes qui requièrent des techniques sophistiquées pour leur caractérisation structurale, et divers tests fonctionnels pour s’assurer de la régularité de leur activité biologique. Ainsi, à l’expiration des brevets, les copies des biomédicaments ne peuvent être des génériques, car il serait impossible de montrer qu’ils sont une copie conforme du principe actif d’origine. Les copies des biomédicaments relèvent donc de la définition des médicaments d’origine biologique similaires ( Encadré 1 , alinéa 15) ou plus simplement biosimilaires. On peut donc aussi conclure qu’un biomédicament est un médicament dont on ne peut pas fabriquer un générique.
D’autres propriétés permettent aussi de distinguer les petites molécules chimiques des biomédicaments. Ces derniers passent difficilement les barrières physiologiques, sont pratiquement toujours dégradés par voie digestive et sont aussi biodégradables dans l’environnement. Ils présentent également une très forte spécificité d’espèce, ce qui pose des problèmes dans leur développement préclinique et rend plus risqué leur premier passage à l’homme (Tableau III). Enfin, tandis que les composés chimiques se comportent au pire comme des haptènes4, les biomédicaments présentent un risque d’immunogénicité intrinsèque non négligeable (Tableau III).
Critères sociétaux importants permettant de distinguer les médicaments chimiques, les biomédicaments et les médicaments vivants.
En pratique, hormis les héparines et quelques vaccins poly-osidiques, l’immense majorité des biomédicaments sont des (glyco)protéines qu’on peut distinguer en protéines naturelles et protéines recombinantes (Tableau II), ce qui n’est pas qu’une question d’OGM puisque l’usage de ces derniers a permis d’énormes progrès, comme l’accès à des produits humains, de provenance bien mieux maîtrisée et offrant une sécurité supérieure aux produits naturels (Tableau II et III). Vu du grand public, comme pour biothérapie, le préfixe bio de biomédicament peut évidemment toujours évoquer l’agriculture biologique. Malgré tout, il se trouve être largement pondéré par son accolement à médicament, avec ce qu’il représente d’industrie pharmaceutique, de maladie grave ou d’effets indésirables. Les nostalgiques du bio se consoleront en retenant qu’ils sont biodégradables, ce qui n’est déjà pas si mal !
En conclusion, simplifier le paysage
Même si chacun reste libre d’utiliser les termes scientifiques qui lui conviennent, il est préférable de partager les mêmes définitions, a fortiori quand il en va des traitements administrés aux patients. Au-delà de la communication scientifique, la responsabilité sociale des médecins, des pharmaciens ou des chercheurs leur impose de tenir un discours précis et simple en direction du grand public : les patients, parce qu’ils sont particulièrement attentifs au rapport bénéfice/risque ; le législateur, à qui il est demandé d’édicter les nouvelles règles ; les jeunes générations, en quête d’orientation professionnelle, à l’affut des métiers et des débouchés liés aux nouvelles filières ; et les investisseurs, dont la France manque pour renforcer son tissu biotechnologique, parce qu’ils sont intéressés par les retombées économiques. Faute d’un discours cohérent, le fossé se creusera encore plus entre le citoyen et les retombées médicales des biotechnologies, et l’ignorance viendra alimenter les peurs face à l’innovation. L’analyse qui précède nous amène à exclure les termes de biothérapie et de thérapie ciblée, dont les définitions varient beaucoup, avec des sens quasi-diamétralement opposés pour biothérapie. Immunothérapie est mieux défini, mais englobe des réalités très diverses : petites molécules chimiques, allergènes, vaccins vivants ou non, anticorps thérapeutiques, préparations de thérapie cellulaire, etc. S’il est utile de traiter dans le cadre d’un enseignement des différentes options thérapeutiques permettant d’accroître un état d’immunité, les subtilités qui sous-tendent les différents types d’immunothérapie rendent ce terme difficilement accessible à des non-immunologistes. Il ne peut donc définir un groupe de médicaments, pas plus que le terme obsolète de médicament immunologique qui apparaît encore dans le CSP (Encadré 1). Au final, seul reste le terme encore récent de biomédicament, qu’il faudrait inscrire dans le CSP comme synonyme de médicament d’origine biologique, tout comme le terme de biosimilaire qui lui est associé.
Il faut donc faire émerger et populariser la notion de biomédicaments auprès du grand public, comme nous l’avons fait récemment par le biais d’un film [43]. Par expérience, le public est également réceptif au fait de l’afficher comme un intermédiaire entre médicament chimique et médicament vivant (Tableau III). De fait, l’emploi de biomédicament présente de nombreux avantages :
-
c’est un terme récent, peu dévoyé et peu galvaudé, défini par la loi (dès lors qu’on le considère synonyme de médicament d’origine biologique), et qui peut être facilement compris s’il est correctement expliqué ;
-
comme les médicaments chimiques, les biomédicaments sont inertes (non vivants), formulables (galénique) et industrialisables, et constituent une branche particulière de l’industrie pharmaceutique parfois appelée industrie biopharmaceutique, parce qu’elle mobilise des compétences en biologie moléculaire (génie génétique), en biologie cellulaire et en biochimie ;
-
les biotechnologies sont également requises pour préparer les médicaments vivants ou réplicatifs, mais ceux-ci ne sont pas inertes, et sont encore assez difficilement industrialisables. Outre les produits sanguins labiles et les préparations de thérapie cellulaire, cette catégorie inclut tous les vecteurs réplicatifs utilisés pour le transfert de gène, les vaccins vivants inoculables (les seuls faisant l’objet d’une production industrielle) et les bactériophages, si la phagothérapie fait sa réapparition. À la différence des biomédicaments et des médicaments chimiques parfaitement inertes, tous ces médicaments vivants ou réplicatifs posent des problèmes spécifiques en matière d’innocuité, qu’il s’agisse de contamination virale ou par prion, de réactivation virale, voire de transformation ;
-
telles que définies dans le Tableau II , les différentes catégories de biomédicaments permettent d’intégrer des médicaments anciens (anatoxine, vaccins inactivés, produits sanguins stables, etc.), autant que des médicaments innovants, porteurs de nombreux espoirs en vaccination (nouveaux vaccins recombinants, tels que le vaccin contre le méningocoque B), dans le traitement des maladies génétiques (enzymes du métabolisme, hormones, facteurs de la coagulation, etc.), et celui des maladies inflammatoires chroniques (Tableau Is) 5 et du cancer (Tableau IIs)5
Tous les éléments qui précèdent nous amènent donc à formuler six propositions (Encadré 2), dont plusieurs concernent le législateur. Espérons que ces propositions soient débattues et prises en compte avant que la situation ne vienne encore se complexifier, du fait du génie administratif toujours prompt à ajouter de nouvelles strates réglementaires, ou du génie marketing, toujours à l’affut de nouveaux termes et de nouveaux concepts [45] (→).
(→) Voir à ce propos l’article de C. Chabannon et al., page 576 de ce numéro
2 Propositions pour clarifier et simplifier la terminologie
-
Bannir les termes de biothérapie (trop flou et trop vaste), d’immunothérapie (trop complexe) et de thérapie ciblée (trop vaste) du vocabulaire scientifique et officiel.
-
Éliminer la notion devenue obsolète de médicament immunologique du Code de la santé publique.
-
Introduire dans le Code de la santé publique les notions de biomédicament et de biosimilaire comme synonymes, respectivement, de médicament biologique et de médicament biologique similaire.
-
Utiliser le terme de « médicament vivant » pour désigner l’utilisation thérapeutique de cellules vivantes ou de virus, en y incluant les préparations de thérapie cellulaire et de thérapie génique ; les vaccins vivants atténués et les bactériophages rejoignent ce groupe afin d’inclure les médicaments inoculables.
-
N’utiliser le terme de biomédicament que pour des médicaments non vivants et non réplicatifs, dont la production est industrialisable (biopharmacie) et dont les copies à l’extinction des brevets sont des biosimilaires. Ce groupe de macromolécules comprendrait les biomédicaments naturels (extraits d’organismes non génétiquement modifiés) et les biomédicaments recombinants.
-
Utiliser le terme de médicament chimique pour désigner tous les médicaments produits par synthèse chimique, hémisynthèse ou chimie extractive, et dont la taille et les possibilités de caractérisation permettent d’en faire des génériques. Les peptides ou les oligonucléotides de synthèse sont inclus dans les médicaments chimiques.
Liens d’intérêt
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Annexe
Tableaux Is et IIs (PDF 89.9 KB)
Remerciements
Ce texte n’est que l’aboutissement de nombreuses discussions, anciennes ou récentes, avec de nombreux collègues que je tiens ici à remercier très sincèrement ; je les cite dans l’ordre alphabétique : Guillaume Cartron, Benjamin Chaigne, Arnaud Daguet, Valérie Gouilleux-Gruart, Thierry Lecomte, Denis Mulleman, Gilles Paintaud, André Pèlegrin et Gilles Thibault. Merci également à Arnaud Daguet, Edgar Thibault et Daniel Bourry pour leur précieuse aide documentaire.
Références
- Watier H. De la sérothérapie aux anticorps recombinants « nus », plus d’un siècle de succès en thérapie ciblée. Med Sci (Paris) 2009 ; 25 : 999–1009. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Collongues L. Du mode d’action des eaux de Vichy sur la vie de la nutrition entre le côté droit et le côté gauche, d’après la bioscopie, le dynamisme de l’estomac et du foie et la biothérapie thermale. CR Cong internat hydrol climatol 1896, 1897 ; 4 : 287–289. [Google Scholar]
- Trémolières R. Biothérapie ; les eaux minérales en injections hypodermiques, premières expérimentations. Paris : Maloine, 1909 : 24 p. [Google Scholar]
- Jacquet L. Considérations sur le traitement par l’arséno-benzol d’Ehrlich et sur la bio-thérapie de la syphilis. Bull Mem Soc Med Hop Paris 1910 ; 30 : 197–207. [Google Scholar]
- Grimberg A, Uzan M. La biothérapie non-spécifique de la blennorragie. Bull Med 1922 ; 36 : 1035. [Google Scholar]
- Dupuy de Frenelle. Biothérapie des anthrax et des abcès. Bull Soc Med Paris 1933 ; 375–380. [Google Scholar]
- Lamare JP, Larget PMM. Biothérapie chirurgicale anti-infectieuse. Paris, L. Arnette, 1934 : 264 p. [Google Scholar]
- http://www.smb-fr.com/actus/la-smb [Google Scholar]
- Julian OA. Matière médicale des biothérapiques-nosodes. Traité de micro-immunothérapie dynamisée. Marco Pietteur eds, collection Résurgence, 2001, 590 p. [Google Scholar]
- Ferris P. Biothérapiques, l’homéo-turbo ! Belle-Santé 2007 ; 91 : 58–60. [Google Scholar]
- Spielberger U, Schaette R. Biothérapies vétérinaires à l’usage de l’éleveur. Mouvement de l’Agriculture Bio-Dynamique ed. Colmar, 1994, 87 p. [Google Scholar]
- Schellekens H. Editorial. Between clones and clinic. Biotherapy 1988 ; 1 : 3–5. [CrossRef] [PubMed] [Google Scholar]
- Wassermann A. Grundzüge der Immunotherapie. Ztschr ärztl Fortbild 1910 ; 7 : 417–421. [Google Scholar]
- Citron JB. Die methoden der immunodiagnostik und immunotherapie und ihre praktische verwertung. Thieme G. ed. Leipzig, 1910, 232 p. [Google Scholar]
- Much HCR. Die immunitätswissenschaft. Eine kurzgefasste uebersicht über die immunotherapie und diagnostik. Kabitzsch C. eds, Würzburg, 1911, 162 p. [Google Scholar]
- Bossan EA. La pratique de l’immunothérapie antituberculeuse ; du choix et de l’emploi des différents agents d’immunothérapie : tuberculine, sérums, granulations de Much. Gaz Hop 1911 ; 84 : 123–137. [Google Scholar]
- D’Oelsnitz, Colle. Association des sérums et des vaccins, immunothérapie mixte, dans le traitement des affections pulmonaires aiguës. CR Congr Fr Med 1922 ; 16e session : 331–334. [Google Scholar]
- Mathé G, Amiel JL. Réduction de la concentration plasmatique du virus leucémigène de Charlotte Friend par immunothérapie adoptive (greffe de moelle osseuse allogénique). CR Acad Sci 1964 ; 259 : 4408. [Google Scholar]
- Mathé G, Amiel JL, Schwarzenberg L, et al. Adoptive immunotherapy of acute leukemia: experimental and clinical results. Cancer Res 1965 ; 25 : 1525–1531. [PubMed] [Google Scholar]
- Amiel JL. Immunothérapie active non spécifique par le BCG de la leucémie virale E male G2 chez des receveurs isogéniques. Rev Fr Etud Clin Biol 1967 ; 12 : 912–914. [PubMed] [Google Scholar]
- Mathé G. Immunothérapie active de la leucémie L 1210 appliquée après la greffe tumorale. Rev Fr Etud Clin Biol 1968 ; 13 : 881–883. [PubMed] [Google Scholar]
- Mathé G, Amiel JL, Schwarzenberg L, et al. Démonstration de l‘efficacité de l‘immunothérapie active dans la leucémie aiguë lymphoblastique humaine. Rev Fr Etud Clin Biol 1968 ; 13 : 454–459. [PubMed] [Google Scholar]
- Wallack MK, Steplewski Z, Koprowski H, et al. A new approach in specific, active immunotherapy. Cancer 1977 ; 39 : 560–564. [CrossRef] [PubMed] [Google Scholar]
- Motta R. The passive immunotherapy of murine leukaemia. I. The production of antisera against leukaemic antigens. Rev Eur Etud Clin Biol 1970 ; 15 : 161–167. [PubMed] [Google Scholar]
- Lowry WS. Passive immunotherapy for neuroblastoma. Lancet 1970 ; 2 : 1366. [CrossRef] [PubMed] [Google Scholar]
- Gateau P, Opolon P, Nusinovici V, et al. Passive immunotherapy in HBs Ag fulminant hepatitis. Results on antigenaemia and survival. Digestion 1976 ; 14 : 304–310. [CrossRef] [PubMed] [Google Scholar]
- Melero I, Grimaldi AM, Perez-Gracia JL, Ascierto PA. Clinical development of immunostimulatory monoclonal antibodies and opportunities for combination. Clin Cancer Res 2013 ; 19 : 997–1008. [CrossRef] [PubMed] [Google Scholar]
- Levy DA, Lichtenstein LM, Goldstein EO, Ishizaka K. Immunologic and cellular changes accompanying the therapy of pollen allergy. J Clin Invest 1971 ; 50 : 360–369. [CrossRef] [PubMed] [Google Scholar]
- Whitehouse MW. Timely appraisal: ectopic (exocellular) nucleic acid as a drug target, especially in rheumatoid arthritis and certain cancers. Agents Actions 1975 ; 5 : 508–511. [CrossRef] [PubMed] [Google Scholar]
- Stevenson GT, Elliott EV, Stevenson FK. Idiotypic determinants on the surface immunoglobulin of neoplastic lymphocytes: a therapeutic target. Fed Proc 1977 ; 36 : 2268–2271. [PubMed] [Google Scholar]
- Bacchi CJ, Nathan HC, Hutner SH, et al. Polyamine metabolism: a potential therapeutic target in trypanosomes. Science 1980 ; 210 : 332–334. [CrossRef] [PubMed] [Google Scholar]
- Mitsuya H, Yarchoan R, Kageyama S, Broder S. Targeted therapy of human immunodeficiency virus-related disease. FASEB J 1991 ; 5 : 2369–2381. [PubMed] [Google Scholar]
- Gupta D, Naik S. Immunomodulation by interleukin-2 receptor targeted therapy. Natl Med J India 1994 ; 7 : 67–70. [PubMed] [Google Scholar]
- Walsh JK, Mahowald MW. Avoiding the blanket approach to insomnia. Targeted therapy for specific causes. Postgrad Med 1991 ; 90 : 211–214, 217–9, 223–4. [PubMed] [Google Scholar]
- Lauro R, Platania A, Liberatore C, et al. Biochemical profile of essential arterial hypertension. Indications for a targeted therapy: experience with propranolol. Clin Ter 1978 ; 85 : 19–25. [PubMed] [Google Scholar]
- Davis SS, Hunneyball IM, Illum L, et al. Recent advances in the use of microspheres for targeted therapy. Drugs Exp Clin Res 1985 ; 11 : 633–640. [PubMed] [Google Scholar]
- Vaughan A, Chapman C, Dykes PW, et al. Antibody-targeted therapy of cancer. Lancet 1986 ; 2 : 860. [CrossRef] [Google Scholar]
- Novell JR, Parbhoo SP, Dawson K, et al. Targeted therapy for recurrent breast carcinoma with regional Lipiodol/epirubicin infusion. Lancet 1990 ; 336 : 1383. [CrossRef] [Google Scholar]
- LEEM et Comité biotechnologies du LEEM. Biomédicaments en France, état des lieux 2004. Accessible sur http://www.leem.org/sites/default/files/import/presse/dossiers/5_98.pdf, version actualisée 2005 sur http://www.leem.org/sites/default/files/880.pdf [Google Scholar]
- Cavazzana-Calvo M. Les biomédicaments. Que sais-je ?, Paris : PUF, 2011, 128 p. [Google Scholar]
- Steffen L. Biomédicaments en France, état des lieux 2013. Accessible sur http://www.leem.org/sites/default/files/V3%20biom%C3%A9dicament%202013%2023.09.13%20maj%2001.10.13.pdf. [Google Scholar]
- Legrain Y (rapporteur). Les biomédicaments : des opportunités à saisir pour l’industrie pharmaceutique. Rapport au Conseil économique, social et environnemental, juin 2009. Accessible sur http://www.ladocumentationfrancaise.fr/var/storage/rapports-publics/094000280/0000.pdf. [Google Scholar]
- Daguet A. Les biomédicaments, 2013. Édité par le LabEx MAbImprove. http://www.youtube.com/watch?v=GZk30keAywk. [Google Scholar]
- Terme M, Pernot S, Marcheteau E, et al. VEGFA-VEGFR pathway blockade inhibits tumor-induced regulatory T-cell proliferation in colorectal cancer. Cancer Res 2013 ; 73 : 539–549. [CrossRef] [PubMed] [Google Scholar]
- Chabannon C, Sabatier F, Rial-Sebag E, et al. Les unités de thérapie cellulaire a l’épreuve de la réglementation sur les médicaments de thérapie innovante. Med Sci (Paris) 2014 ; 5 : 576–583. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des tableaux
Classification des biomédicaments substitutifs et « modificatifs », naturels (N) et recombinants (R).
Critères sociétaux importants permettant de distinguer les médicaments chimiques, les biomédicaments et les médicaments vivants.
Liste des figures
 |
Figure 1. Bilivaccin antityphique des laboratoires « La Biothérapie ». Dans l’entre-deux-guerres, ce laboratoire pharmaceutique a commercialisé des extraits antigéniques tels que ce bilivaccin, mais aussi des antiseptiques et différents anti-infectieux, notamment le dentifrice Sanogyl®. Ce laboratoire est également connu pour avoir eu comme collaborateur, de 1930 à 1937, le Dr Louis-Ferdinand Destouches (1894-1961), plus connu sous le nom de Louis-Ferdinand Céline (Université de Tours, ©Daniel Bourry, objets de la collection Watier). |
| Dans le texte | |
 |
Figure 2. Boîte de recueil de seringues usagées. C’est à domicile que les patients se trouvent confrontés aux biothérapies : cette boîte sert à jeter le matériel ayant servi à pratiquer leurs injections de biomédicaments, quand ceux-ci sont administrés en ambulatoire (ici, des anti-TNF-α). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




