| Numéro |
Med Sci (Paris)
Volume 41, Numéro 6-7, Juin-Juillet 2025
|
|
|---|---|---|
| Page(s) | 547 - 550 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2025087 | |
| Publié en ligne | 7 juillet 2025 | |
Quand l’horaire d’administration améliore l’efficacité antitumorale des immunothérapies
Administration timing may improve the anti-tumor efficacy of immunotherapies
Inserm U1331, Institut Curie, MINES ParisTech CBIO – Centre de biologie computationnelle, Université Paris-Sciences-Lettres, équipe Pharmacologie des systèmes contre le cancer, Saint-Cloud, France
Depuis leur première autorisation de mise sur le marché (AMM) en 2011, les inhibiteurs de points de contrôle immunitaire, ces anticorps monoclonaux bloquant certaines protéines de surface (e.g., PD1, PDL1, CTL4), ont permis des améliorations majeures dans le traitement de certains cancers en facilitant la destruction des cellules cancéreuses par les cellules immunitaires. Récemment, une dizaine d’études cliniques rétrospectives indépendantes ont montré une association entre l’horaire d’administration de ces molécules et la réponse antitumorale ou la survie des patients atteints de cancers solides à des stades avancés (mélanome métastatique, cancer du poumon non à petites cellules, cancer du rein ou de la vessie, hépatocarcinome, etc.) [1]. Ainsi, une administration le matin ou tôt dans la journée est associée à un meilleur pronostic qu’une administration l’après-midi ou le soir [2, 3]. Ces résultats nous interrogent sur les mécanismes moléculaires de ces probables différences d’efficacité en fonction de l’horaire d’administration, et incitent à l’identification précise des horaires d’administration optimaux en fonction des caractéristiques du patient (âge, sexe, chronotype, indice de performance, etc.), du type de cancer, ainsi que des molécules thérapeutiques administrées.
Système circadien et réponse immunitaire
Notre organisme possède des rythmes biologiques endogènes d’une période d’environ 24 heures, appelés rythmes circadiens, permettant de s’adapter au cycle jour-nuit lié à la rotation de la Terre. Chez les mammifères, le système circadien est coordonné par les noyaux suprachiasmatiques du diencéphale, situés dans l’hypothalamus, dont les cellules sont dotées d’une horloge présentant une période spontanée comprise entre 20 à 28 heures, et synchronisée à exactement 24 heures par des signaux temporels externes tels que les cycles lumière-obscurité (Figure 1A). Ces noyaux suprachiasmatiques produisent en outre des signaux rythmiques physiologiques, comme notamment les cycles hormonaux ou thermiques, qui entraînent les horloges circadiennes des organes périphériques. En effet, chaque cellule est dotée d’une horloge moléculaire composée d’environ 15 gènes interconnectés via des boucles de rétroaction qui produisent des oscillations spontanées dans différents processus intracellulaires. Ces découvertes ont valu le prix Nobel à Hall, Rosbash et Young en 2017 [4] (→) (Figure 1B). Les synchroniseurs externes (e.g., exposition à la lumière, prise alimentaire, interactions sociales, etc.) ou les signaux rythmiques internes qui en résultent synchronisent les cellules individuelles entre elles afin d’assurer un fonctionnement optimal des organes. A contrario, une exposition décalée à ces synchroniseurs (par exemple, en cas de pollution lumineuse nocturne) peut désynchroniser les horloges moléculaires et les signaux physiologiques circadiens, avec des implications néfastes sur l’apparition ou la progression de certaines maladies chroniques. À titre d’exemple, le moment des repas peut réinitialiser l’horloge hépatique en modifiant les sécrétions d’insuline ou de glucagon, tandis que la prise alimentaire rythmique peut elle-même entraîner l’expression circadienne des gènes dans les cellules du foie, indépendamment de leur horloge autonome.
(→) Voir m/s n° 5, 2018, page 480
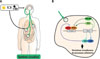 |
Figure 1 Le système circadien. A. Une horloge centrale, située dans les noyaux suprachiasmatiques de l’hypothalamus, a une activité rythmique endogène d’une période proche de 24 heures, et est entraînée à une période d’exactement 24 heures par des signaux externes, tels que le cycle lumière-obscurité. Cette horloge centrale exerce un contrôle sur les horloges cellulaires des organes périphériques par différents mécanismes, notamment la sécrétion rythmique d’hormones ou les cycles de température. B. Chaque cellule nucléée est dotée d’une horloge moléculaire oscillant spontanément avec une période circadienne, et constituée de boucles de rétroaction transcriptionnelle et traductionnelle interconnectées. Plus précisément, les protéines codées par les gènes de l’horloge Clock et Bmal1 forment des dimères qui se lient aux « boîtes E » sur l’ADN pour favoriser la transcription des gènes Per, Cry, Ror, et Rev-erb. Les protéines PER et CRY subissent des modifications post-traductionnelles et s’associent en dimères pour réprimer l’activité transcriptionnelle de Clock et Bmal1, diminuant ainsi leur propre transcription. Après quelques heures, les complexes protéiques PER-CRY se dégradent, ce qui déclenche un nouveau cycle de l’oscillateur. Une autre boucle de rétroaction implique l’effet respectivement activateur et répresseur des protéines REV-ERB et ROR sur la transcription de Bmal1, ce qui augmente la robustesse de l’oscillateur. À l’échelle d’un tissu, les horloges cellulaires sont synchronisées entre elles grâce à des signaux physiologiques rythmiques coordonnés par l’horloge centrale. |
Le système circadien exerce un contrôle sur l’immunité, et joue un rôle essentiel dans la défense de l’hôte contre des agents pathogènes et dans l’immunosurveillance des tumeurs [5]. Des rythmes circadiens de grande amplitude ont été mis en évidence pour différentes composantes du système immunitaire. Par exemple, les lymphocytes totaux, les lymphocytes T (CD3+) ou T naïfs (CD8+) sont presque deux fois plus abondants dans le sang vers 2 heures du matin que vers 14 heures chez le sujet sain. Ces variations temporelles du nombre de cellules circulantes est une conséquence directe du contrôle de leur entrée/sortie dans la circulation sanguine et de leur migration dans les tissus par leur horloge endogène, par l’horloge des cellules endothéliales des vaisseaux sanguins, et par des facteurs pro-migratoires dont l’abondance oscille au cours de la journée. Plus généralement, les cellules immunitaires innées et adaptatives (i.e. monocytes, macrophages, cellules dendritiques, granulocytes neutrophiles, lymphocytes T CD4+ et CD8+, natural killer, et lymphocytes B) sont dotées d’une machinerie circadienne fonctionnelle, et sont soumises à des signaux rythmiques contrôlés par les noyaux suprachiasmatiques du cerveau, notamment via le cortisol et les catécholamines, qui agissent pour synchroniser leur activité. En conséquence de ces multiples contrôles temporels, de nombreuses fonctions immunitaires, telles que la production des cytokines ou la prolifération, la migration et l’activité des lymphocytes T et B, présentent des rythmes d’une période de 24 heures, tant chez les rongeurs que chez l’Homme [5].
Mécanismes impliqués dans la variation d’efficacité des immunothérapies selon l’horaire d’administration
Les variations circadiennes de grande amplitude de différentes fonctions immunitaires peuvent entraîner des différences d’efficacité des molécules qui les ciblent en fonction de leur horaire d’administration. Comme susmentionné, l’efficacité des inhibiteurs de points de contrôle immunitaires dans le traitement du cancer semble dépendre de leur horaire d’administration, avec un meilleur pronostic pour les patients recevant ces molécules le matin ou tôt dans la journée, en comparaison à des perfusions en fin de journée (Figure 2A). Les demi-vies plasmatiques de ces anti-corps étant de deux à trois semaines chez l’homme, on pouvait supposer un rôle mécanistique majeur de leur pharmacodynamie dans la tumeur et les ganglions lymphatiques environnants, une hypothèse étayée par les résultats de plusieurs études expérimentales récentes chez la souris.
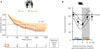 |
Figure 2 Impact de l’horaire d’administration des inhibiteurs de points de contrôle immunitaire sur leur efficacité antitumorale. A. Survie globale de patients atteints de cancers solides avancés (n = 361) recevant des inhibiteurs de points de contrôle immunitaire, combinés ou non à la chimiothérapie. Les participants à cette étude rétrospective monocentrique ont été classés dans les groupes du matin ou de l’après-midi s’ils ont reçu plus de la moitié de leurs perfusions de ces inhibiteurs avant ou après 11 h 37 (valeur seuil optimisée) ; test du log-rank1significatif. Figure adaptée de [3]. B. Volume tumoral chez la souris, 14 jours après implantation de la tumeur et 10 jours après une injection unique du véhicule (Témoin) ou d’anticorps anti-PD-1 à l’horaire spécifié (ZT = Zeitgeber time2 ; ZT0 = début de 12 heures de lumière, phase de repos chez la souris ; ZT12 = début de 12 heures d’obscurité, phase d’activité) ; test du cosinor3 significatif. Figure adaptée de [6]. 1 Test statistique non-paramétrique utilisé pour comparer les distributions de survie de deux groupes de patients. 2 Notation normalisée sur 24 heures de la phase d’un cycle circadien entraîné, dans laquelle ZT0 indique le début du jour (ou de la phase de lumière), et ZT12 le début de la nuit (ou de la phase d’obscurité). 3 Méthode statistique d’analyse des rythmes biologiques par la méthode des moindres carrés, permettant une quantification des valeurs des paramètres caractéristiques de ces rythmes : période, acrophase, amplitude, mésor (i.e., valeur moyenne d’un ensemble de données périodiques sur une période spécifiée). Cette méthode n’est applicable que lorsque le rythme de la variable considérée correspond à une sinusoïde. |
Les études circadiennes chez la souris sont réalisées sur des animaux synchronisés par des cycles de 12 heures de lumière et 12 heures d’obscurité, correspondant respectivement à leur phase de repos et leur phase d’activité, puisque contrairement à l’Homme, la souris est un animal nocturne. Par convention, l’allumage de la lumière définit le temps circadien « zéro » (Zeitgeber time 0, ZT0). Wang et al. ont montré que l’efficacité de la thérapie de blocage des points de contrôle immunitaires varie en fonction de l’horaire d’administration du traitement dans des modèles de cancers murins, avec une meilleure efficacité pour une administration à la transition lumière/obscurité (ZT12), c’est-à-dire à la toute fin de la phase de repos ou au tout début de la phase d’activité, ce qui correspondrait à très tôt le matin chez l’Homme (Figure 2B) [6]. Les auteurs ont ensuite étudié la dynamique des lymphocytes infiltrant les tumeurs, en particulier les lymphocytes cytotoxiques T CD8+, qui sont des acteurs importants du contrôle de la croissance tumorale et de la réponse à l’immunothérapie [6]. Ils ont constaté que l’abondance et le phénotype des populations de leucocytes présentes dans la tumeur suivent des oscillations circadiennes. Celles-ci sont conditionnées à la fois par l’horloge circadienne endogène des leucocytes et par leur infiltration dans la tumeur, qui est elle-même contrôlée par l’horloge circadienne des cellules endothéliales des vaisseaux du microenvironnement tumoral. L’infiltration des lymphocytes T est ainsi maximale à la transition entre phase de repos et phase d’activité (≈ ZT12) et, à l’inverse, minimale dans la seconde moitié de la phase d’activité, ce qui constituerait une explication plausible de l’incapacité des cellules immunitaires circulantes à atteindre la tumeur si elles étaient initialement stimulées par les inhibiteurs de points de contrôle immunitaire à ces moments-là.
De plus, le même groupe a montré que les cellules dendritiques et les lymphocytes T CD8 + exercent des fonctions antitumorales circadiennes qui contrôlent le volume du mélanome chez la souris en absence de traitement [7]. Plus précisément, la migration circadienne des cellules dendritiques vers les ganglions lymphatiques drainant la tumeur régit une réponse circadienne des cellules TCD8+ spécifiques de l’antigène tumoral qui dépend de l’expression circadienne de la molécule co-stimulatrice CD80. Ce mécanisme pourrait contribuer à augmenter l’efficacité des immunothérapies anticancéreuses lorsqu’elles sont administrées au moment du pic d’activité des cellules dendritiques, c’est-à-dire à la toute fin de la phase de repos ou au début de la phase d’activité, ce qui correspondrait à tôt le matin chez l’Homme.
Enfin, Fortin et al. ont montré que l’abondance, dans la tumeur, des cellules immunosuppressives d’origine myéloïde exprimant PD-L1 (e.g., monocytes, macrophages, granulocytes, neutrophiles) présente des variations sur 24 heures, dues à une perturbation de l’horloge des cellules épithéliales du microenvironnement tumoral, engendrant une augmentation de la sécrétion de cytokines inflammatoires et du recrutement des cellules immunosuppressives d’origine myéloïde. Dans ce modèle murin, l’administration d’anticorps anti-PD-L1 est plus efficace lorsqu’elle est synchronisée avec l’abondance de cellules immunosuppressives exprimant PDL1, c’est-à-dire au début de la phase nocturne d’activité des souris [8].
Perspectives
Des études cliniques prospectives randomisées, dans lesquelles les participants atteints d’un cancer et pouvant bénéficier d’une immunothérapie par inhibiteurs de points de contrôle immunitaire sont répartis aléatoirement dans des groupes avec différentes tranches horaires d’administration de ces molécules, sont maintenant nécessaires pour confirmer l’impact de l’horaire d’administration sur l’efficacité de ces thérapies, et pouvoir ainsi envisager un transfert des résultats obtenus chez la souris vers la pratique médicale. Afin de tirer un bénéfice maximal de ces thérapies, il conviendra d’étudier l’association entre horaires optimaux et caractéristiques du patient et de sa maladie. En particulier, un dimorphisme sexuel a récemment été mis en évidence pour le système circadien et pour les horaires de meilleure tolérance de certains médicaments anti-cancéreux, dans des études précliniques et cliniques [2], et l’impact du sexe du patient sur l’horaire optimal de perfusion des immunothérapies reste à étudier. La nécessité de chronothérapies personnalisées invite à une approche de médecine de précision reposant sur l’intégration des données multimodales, issues de mesures dynamiques, de l’hôte et de la maladie, par des méthodes d’intelligence artificielle, afin de tenter d’identifier des biomarqueurs prédictifs des horaires de perfusion de meilleure efficacité pour chacun.
Liens d’intérêt
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Landré T, Karaboué A, Buchwald ZS, et al. Effect of immunotherapy-infusion time of day on survival of patients with advanced cancers: a study-level meta-analysis. ESMO Open 2024 ; 9 : 102220. [CrossRef] [PubMed] [Google Scholar]
- Lévi FA, Okyar A, Hadadi E, et al. Circadian regulation of drug responses: Toward sex-specific and personalized chronotherapy. Annu Rev Pharmacol Toxicol 2024 ; 64 : 89–114. [CrossRef] [Google Scholar]
- Catozzi S, Assaad S, Delrieu L, et al. Early morning immune checkpoint blockade and overall survival of patients with metastatic cancer: An In-depth chronotherapeutic study. Eur J Cancer 2024 ; 199 : 113571. [CrossRef] [PubMed] [Google Scholar]
- Klarsfeld A, Birman S, Rouyer F. L’horloge circadienne à l’heure Nobel. Prix Nobel de physiologie ou médecine 2017: Jeffrey C. Hall, Michael Rosbash and Michael W. Young. Med Sci (Paris) 2018 ; 34 : 480–4. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Pick R, Wang C, Zeng Q, et al. Circadian rhythms in anticancer immunity: Mechanisms and treatment opportunities. Annu Rev Immunol 2024 ; 42 : 83–102. [CrossRef] [Google Scholar]
- Wang C, Zeng Q, Gül ZM, et al. Circadian tumor infiltration and function of CD8+ T cells dictate immunotherapy efficacy. Cell 2024 ; 187 : 2690–702.e17. [CrossRef] [Google Scholar]
- Wang C, Barnoud C, Cenerenti M, et al. Dendritic cells direct circadian anti-tumour immune responses. Nature 2023 ; 614 : 136–43. [CrossRef] [PubMed] [Google Scholar]
- Fortin BM, Pfeiffer SM, Insua-Rodríguez J, et al. Circadian control of tumor immunosuppression affects efficacy of immune checkpoint blockade. Nat Immunol 2024 ; 25 : 1257–69. [CrossRef] [PubMed] [Google Scholar]
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1 Le système circadien. A. Une horloge centrale, située dans les noyaux suprachiasmatiques de l’hypothalamus, a une activité rythmique endogène d’une période proche de 24 heures, et est entraînée à une période d’exactement 24 heures par des signaux externes, tels que le cycle lumière-obscurité. Cette horloge centrale exerce un contrôle sur les horloges cellulaires des organes périphériques par différents mécanismes, notamment la sécrétion rythmique d’hormones ou les cycles de température. B. Chaque cellule nucléée est dotée d’une horloge moléculaire oscillant spontanément avec une période circadienne, et constituée de boucles de rétroaction transcriptionnelle et traductionnelle interconnectées. Plus précisément, les protéines codées par les gènes de l’horloge Clock et Bmal1 forment des dimères qui se lient aux « boîtes E » sur l’ADN pour favoriser la transcription des gènes Per, Cry, Ror, et Rev-erb. Les protéines PER et CRY subissent des modifications post-traductionnelles et s’associent en dimères pour réprimer l’activité transcriptionnelle de Clock et Bmal1, diminuant ainsi leur propre transcription. Après quelques heures, les complexes protéiques PER-CRY se dégradent, ce qui déclenche un nouveau cycle de l’oscillateur. Une autre boucle de rétroaction implique l’effet respectivement activateur et répresseur des protéines REV-ERB et ROR sur la transcription de Bmal1, ce qui augmente la robustesse de l’oscillateur. À l’échelle d’un tissu, les horloges cellulaires sont synchronisées entre elles grâce à des signaux physiologiques rythmiques coordonnés par l’horloge centrale. |
| Dans le texte | |
 |
Figure 2 Impact de l’horaire d’administration des inhibiteurs de points de contrôle immunitaire sur leur efficacité antitumorale. A. Survie globale de patients atteints de cancers solides avancés (n = 361) recevant des inhibiteurs de points de contrôle immunitaire, combinés ou non à la chimiothérapie. Les participants à cette étude rétrospective monocentrique ont été classés dans les groupes du matin ou de l’après-midi s’ils ont reçu plus de la moitié de leurs perfusions de ces inhibiteurs avant ou après 11 h 37 (valeur seuil optimisée) ; test du log-rank1significatif. Figure adaptée de [3]. B. Volume tumoral chez la souris, 14 jours après implantation de la tumeur et 10 jours après une injection unique du véhicule (Témoin) ou d’anticorps anti-PD-1 à l’horaire spécifié (ZT = Zeitgeber time2 ; ZT0 = début de 12 heures de lumière, phase de repos chez la souris ; ZT12 = début de 12 heures d’obscurité, phase d’activité) ; test du cosinor3 significatif. Figure adaptée de [6]. 1 Test statistique non-paramétrique utilisé pour comparer les distributions de survie de deux groupes de patients. 2 Notation normalisée sur 24 heures de la phase d’un cycle circadien entraîné, dans laquelle ZT0 indique le début du jour (ou de la phase de lumière), et ZT12 le début de la nuit (ou de la phase d’obscurité). 3 Méthode statistique d’analyse des rythmes biologiques par la méthode des moindres carrés, permettant une quantification des valeurs des paramètres caractéristiques de ces rythmes : période, acrophase, amplitude, mésor (i.e., valeur moyenne d’un ensemble de données périodiques sur une période spécifiée). Cette méthode n’est applicable que lorsque le rythme de la variable considérée correspond à une sinusoïde. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




