| Numéro |
Med Sci (Paris)
Volume 38, Numéro 8-9, Août-Septembre 2022
|
|
|---|---|---|
| Page(s) | 669 - 678 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2022102 | |
| Publié en ligne | 12 septembre 2022 | |
Récepteurs nucléaires et rythmes circadiens
Implications dans les maladies inflammatoires
Nuclear receptors and circadian clock: Implications for inflammatory diseases
Univ. Lille, Inserm, CHU Lille, Institut Pasteur de Lille, U1011- EGID, F-59000 Lille, France
*
helene.duez@pasteur-lille.fr, helene.duez@inserm.fr
L’horloge circadienne programme l’ensemble des processus physiologiques, dont l’activité du système immunitaire, à des moments précis de la journée. Elle permet d’optimiser les fonctions de l’organisme en anticipant les changements quotidiens tels que les cycles jour/nuit. Nos habitudes de vie comme l’exposition à la lumière artificielle ou une prise alimentaire irrégulière désynchronisent cependant cette horloge et provoquent des maladies, par exemple inflammatoires. Au niveau moléculaire, elle consiste en un réseau de facteurs de transcription dont certains sont des récepteurs nucléaires, activables par des ligands. Une meilleure compréhension des rythmes biologiques et du rôle des récepteurs nucléaires de l’horloge circadienne permettrait d’ouvrir un champ thérapeutique nouveau. La chronothérapie qui consiste en l’administration d’un composé pharmacologique au moment de la journée le plus propice, permettrait, en ciblant ces récepteurs, d’optimiser l’efficacité du traitement et d’en réduire les possibles effets secondaires.
Abstract
The biological clock is a set of evolutionarily conserved “clock proteins” that generate circadian rhythms in behavior and physiological processes. The clock programs these processes at specific times of the day, allowing the organism to optimize its functions by anticipating predictable daily changes such as day/night, hence sleep/wake or feeding/fasting cycles. Modern lifestyle, i.e., exposure to light at night, shift work and irregular eating patterns and sleep schedules desynchronize the clocks residing in each organ. This dissonance is associated with an increased risk of developing various diseases such as cancer, metabolic, cardiovascular and chronic inflammatory diseases.
© 2022 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Hélène Duez).
L’horloge circadienne
L’horloge circadienne est un mécanisme endogène de mesure du temps qui permet à l’organisme d’anticiper l’alternance jour/nuit due à la rotation de la Terre. Le mécanisme moléculaire de l’horloge est fondé sur un réseau de facteurs de transcription dont l’abondance et/ou l’activité oscillent avec une périodicité d’environ un jour (circa diem). L’horloge contrôle des processus tels que la transcription, la traduction et les voies de sécrétion. En conséquence, certaines fonctions auront lieu le jour, d’autres la nuit ou lors des transitions jour/nuit. Cela permet de programmer une fonction au moment où elle sera optimale et de séparer dans le temps des processus incompatibles. Quelques exemples de cette orchestration rythmique des fonctions biologiques sont les cycles veille-sommeil, les variations quotidiennes de sécrétions endocrines (cortisol, mélatonine), les réactions métaboliques, les fonctions immunitaires, la température corporelle et la pression artérielle [1, 2] (→).
(→) Voir la Synthèse de H. Duez, m/s n° 8-9, août-septembre 2013, page 772
Organisation
L’horloge est présente dans toutes les cellules et fonctionne de manière autonome pour générer des rythmes d’environ 24 heures qui sont dits endogènes, c’est-à-dire observés même lorsque l’organisme est placé dans un environnement stable (sans variation de facteurs environnementaux tels que la lumière ou la température). Chez les mammifères, l’horloge dite centrale se situe dans les noyaux suprachiasmatiques (NSC) de l’hypothalamus (Figure 1). L’horloge des NSC est « entrainée », c’est-à-dire remise à l’heure et ajustée à la rotation terrestre, par les cycles jour/nuit en particulier [1]. L’horloge centrale gouverne les cycles veille/sommeil et coordonne des horloges dites périphériques, situées dans tous les organes/tissus en dehors des NSC, grâce à des signaux hormonaux et neuronaux. Cela permet une harmonie des rythmes entre organes, et entre cellules d’un même organe. En plus de la lumière, d’autres ordonnateurs de temps ont été mis en évidence. Parmi eux, la prise de nourriture peut « entraîner » les horloges de la plupart des tissus de manière indépendante de l’horloge centrale, si bien qu’une exposition à la lumière ou la prise de nourriture « au mauvais moment » de la journée (comme c’est le cas lors de décalages horaires répétés ou chez les travailleurs postés) peut créer une dissonance qui contribue au développement de nombreuses maladies. Outre cette dissonance, une prise de nourriture qui n’a pas lieu au pic d’expression des hormones, enzymes et transporteurs impliqués dans son absorption et sa métabolisation, peut concourir au développement de maladies métaboliques.
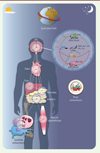 |
Figure 1. Réseaux circadiens et chronobiologie. L’horloge centrale est située dans le système nerveux central (SNC), plus particulièrement au niveau du noyau suprachiasmatique, où elle programme les cycles de veille/sommeil et de prise alimentaire en fonction de la rotation de la Terre sur son axe. Les horloges sont également présentes dans la plupart des tissus périphériques, formant ainsi un réseau d’horloges qui anticipent les changements environnementaux au cours de la journée. BMAL1 : brain and muscle Arnt-like protein 1 ; CLOCK : circadian locomotor output cycles kaput ; CRY : cryptochrome ; PER : period ; ROR : retinoid acid-related orphan receptor ; RORE : ROR response element. |
Composants moléculaires de l’horloge circadienne
Tous les types cellulaires expriment les composants de l’horloge moléculaire (Figure 2). Ces derniers sont des facteurs de transcription organisés en boucles de rétrocontrôle transcriptionnel et traductionnel. Une première boucle constituée de l’hétérodimère formé par BMAL1 (brain and muscle aryl hydrocarbon receptor nuclear translocator-like protein 1) et CLOCK (circadian locomotor output cycles kaput protein) active la transcription des gènes PER (period) et CRY (cryptochrome) via la liaison à des E-box (CACGTG), des séquences particulières situées dans leurs régions promotrices. Cela conduit à l’accumulation progressive des protéines PER et CRY dans le cytoplasme. Une fois en concentration suffisante, PER et CRY s’hétérodimérisent, transloquent dans le noyau et se lient au complexe CLOCK/BMAL1 pour inhiber son activité, réprimant ainsi leur propre transcription. Les protéines PER et CRY sont progressivement phosphorylées et ubiquitinées par des ligases E3 spécifiques, ce qui conduit à leur dégradation par le protéasome, et permet d’entamer un nouveau cycle [3]. Une deuxième boucle est constituée des récepteurs nucléaires ROR (retinoic acid receptor-related orphan receptor) et REV-ERBα/β (ou NR1D1 pour nuclear receptor subfamily 1 group D member 1/NR1D2) qui, respectivement, activent et répriment l’expression de BMAL1 en se fixant sur des éléments de réponse nommés RORE/REVRE. Étant donné que les quantités de REV-ERBα et REV-ERBβ présentent une forte rythmicité circadienne, leur liaison au promoteur de Bmal1 est rythmique et contribue aux oscillations de BMAL1. REV-ERB réprime également la transcription de Cry1, induisant un délai dans l’expression de CRY1. Ainsi, REV-ERB contrôle les deux boucles de l’horloge. Ces différentes protéines subissent des modifications post-traductionnelles, notamment des phosphorylations, des ubiquitinations, des glycosylations, etc., qui permettent, notamment en modifiant leur demi-vie, leur localisation ou leur activité, de maintenir la période des rythmes [3].
 |
Figure 2. La machinerie moléculaire circadienne est régulée par les récepteurs nucléaires. L’horloge moléculaire est composée de boucles transcriptionnelles de rétrocontrôles positif et négatif. Le complexe de transcription Bmal1/Clock induit l’expression de gènes contenant un élément de réponse nommé E-box, comme le complexe régulateur négatif composé des protéines Period (Per) et Cryptochrome (Cry). À son tour, l’hétérodimère Per/Cry inhibe l’activité transcriptionnelle du complexe Bmal1/Clock. Une fois que les niveaux Per et Cry sont suffisamment bas, un nouveau cycle peut commencer. L’hétérodimère Clock/Bmal1 induit également l’expression des récepteurs nucléaires Rev-erbα/β et RORα/β/γ (retinoid acid-related orphan receptor a, b, g). Rev-erb et ROR rentrent alors en compétition pour la liaison des molécules RevRE/RORE au niveau du promoteur de leurs gènes cibles communs pour respectivement réprimer ou activer leur transcription. L’effet global de ces boucles est l’expression rythmique de ces facteurs. D’autres récepteurs nucléaires, qui n’appartiennent pas à l’horloge centrale, sont capables d’activer (flèche verte) ou d’inhiber (flèche rouge) l’expression et/ou l’activité de l’horloge centrale. Cela inclut le récepteur des glucocorticoïdes (GR) activé par le cortisol, les PPAR (peroxisome proliferator-activated receptors) α et γ, dont les ligands naturels sont les acides gras et leurs dérivés, le récepteur des œstrogènes (ER) α, le récepteur X de l’acide 9-cis-rétinoïque (RXR), le récepteur activé par l’acide all-trans-rétinoïque et l’acide 9-cis-rétinoïdes (RAR) et l’ERR (estrogen-related receptor) alpha. |
Ces facteurs de transcription ne contrôlent pas uniquement leur propre transcription mais se lient également à de nombreux gènes codant des enzymes, des transporteurs, des cytokines, etc., générant ainsi des vagues rythmiques dans les programmes géniques impliqués dans les fonctions tissulaires. Chez la souris, au moins 43 % des gènes codant des protéines présentent des oscillations circadiennes dans au moins un organe [4]. Cela génère une rythmicité pour un grand nombre de processus biologiques, tels que la traduction et la sécrétion de molécules (hormones, cytokines et métabolites).
Récepteurs nucléaires et horloge
Les récepteurs nucléaires possèdent un domaine de liaison à l’ADN (DBD pour DNA-binding domain) ainsi qu’un domaine de liaison au ligand (LBD pour ligand-binding domain). Après fixation de leur ligand (hormones stéroïdiennes, lipides, acides biliaires, médiateurs inflammatoires, etc.) sur le LBD, ces récepteurs se lient en tant que monomères, ou sous la forme d’homo- ou d’hétéro-dimères, à un élément de réponse spécifique localisé dans les séquences régulatrices de leurs gènes cibles (Figure 2). REV-ERB et ROR sont des récepteurs nucléaires capables de se fixer sur les mêmes éléments de réponse mais, tandis que les récepteurs REV-ERB répriment la transcription, les ROR l’activent. Ils entrent ainsi en compétition pour la régulation de Bmal1 [5].
Le récepteur des glucocorticoïdes (GR, pour glucocorticoid receptor) est activé par les glucocorticoïdes dont la production endogène est rythmique, maximale en début de phase active (pic de cortisol le matin chez l’homme). Outre ses propriétés anti-inflammatoires et métaboliques, le GR est impliqué dans la régulation de la machinerie de l’horloge. Des éléments de réponse aux glucocorticoïdes ont été identifiés dans le promoteur de Rev-erba, Per1 et Per2 [6, 7] (Figure 2). En retour, REV-ERBα interagit avec GR et diminue sa stabilité et modifie sa localisation subcellulaire sans modifier sa transcription [8]. CRY interagit également avec GR et régule son activité, comme le démontre la réponse accrue à la dexaméthasone chez les souris déficientes pour Cry1 et Cry2 [9]. Enfin, CLOCK est capable de contrôler l’acétylation de GR et de moduler ainsi le recrutement du récepteur nucléaire sur l’ADN [10]. Par ailleurs, l’expression de Rev-erba est augmentée par la liaison de PPARα (peroxisome proliferator-activated receptor) et PPARγ à son promoteur. PPARα augmente également l’expression de Bmal1 dans le foie des rongeurs, ce qui lui permet de moduler finement les deux boucles de l’horloge [5]. De la même manière, les récepteurs nucléaires RARα et RXRα, activés, entre autres, par les acides rétinoïques all-trans 1, peuvent réinitialiser l’horloge de l’appareil vasculaire en inhibant l’activité du complexe CLOCK-BMAL1 (Figure 2) [11].
Dans les glandes mammaires et l’utérus, le récepteur des œstrogènes, ERα, induit directement l’expression du gène Per2 (Figure 2) [12]. Le récepteur orphelin ERRα (estrogen-related receptor alpha) régule, quant à lui, les effets de l’horloge sur le métabolisme en interagissant indirectement avec Bmal1 via le facteur de transcription PROX1 [13] (Figure 2). Inversement, l’expression d’ERRα est aussi contrôlée par l’horloge, montrant ainsi l’existence d’interactions étroites entre ERRα et la machinerie circadienne [14].
Ces récepteurs nucléaires répondent à de nombreux ligands, des hormones stéroïdiennes comme les glucocorticoïdes, ou des métabolites (des acides biliaires, des lipides [acides gras, cholestérol] et des dérivés lipidiques dont certains présentent des activités anti-inflammatoires, comme les leucotriènes). Ils permettent ainsi à l’horloge d’intégrer des signaux locaux sur l’état énergétique et/ou inflammatoire [5].
Immunité circadienne et récepteurs nucléaires
Horloge et trafic des cellules immunitaires
Le système immunitaire est davantage sollicité lors des périodes d’activité au cours desquelles il doit faire face à un risque infectieux accru et participer au contrôle de l’homéostasie tissulaire. L’horloge contrôle donc la réponse inflammatoire/immunitaire, un concept connu sous le terme d’« immunité circadienne » [15]. L’horloge est présente dans les cellules immunitaires (macrophages, lymphocytes, polynucléaires neutrophiles, etc.) ainsi que dans les tissus lymphoïdes (rate, ganglions lymphatiques et moelle osseuse) [16]. Le nombre de leucocytes qui circulent oscille de façon nycthémérale2, en raison des variations circadiennes de la sortie des cellules hématopoïétiques de la moelle osseuse [17]. Les leucocytes tissulaires présentent, quant à eux, des variations circadiennes qui sont principalement dues aux oscillations de leur adhérence à l’endothélium des vaisseaux sanguins et à leur translocation dans les tissus [16, 17] (Figure 3). Par exemple, dans les poumons, le recrutement des polynucléaires neutrophiles suite à un stimulus inflammatoire dépend de la libération rythmique de la chimiokine CXCL5 (C-X-C motif chemokine ligand 5) par les cellules épithéliales pulmonaires [18].
 |
Figure 3. L’immunité circadienne. L’horloge moléculaire contrôle un nombre important de fonctions immunitaires comme la sécrétion des cytokines, la phagocytose, la réponse à des pathogènes (bactéries, parasites) au travers du contrôle de l’expression des Toll-like receptors (TLR), ainsi que la réponse aux molécules de danger, au travers du contrôle de l’inflammasome NLRP3. La mobilisation au niveau de la moelle osseuse, le nombre de leucocytes plasmatiques circulants, ainsi que leur recrutement dans les tissus, varient également de manière circadienne. |
L’horloge module la fonction des leucocytes
Les fonctions des cellules immunitaires, telles que l’expression et l’activation de récepteurs de composants exogènes (les PAMP, pour pathogen-associated molecular patterns) ou endogènes considérés comme des molécules de danger (les DAMP, pour damage-associated molecular patterns), la production de cytokines, de chimiokines et de métalloprotéases, la phagocytose ou la réponse aux agents pathogènes, présentent également des oscillations circadiennes (pour revue, voir [19]) (Figure 3). Cela entraîne des variations circadiennes de la susceptibilité aux infections et au choc septique, et également de la sévérité des symptômes associés [19]. Chez des souris soumises à un choc endotoxique par injection de LPS (lipopolysaccharide), la sécrétion de cytokines pro-inflammatoires par les macrophages, en particulier d’IL(interleukine)-6, varie de manière significative en fonction de l’heure de l’injection, ces variations journalières étant perdues lorsque l’horloge est altérée [20, 21].
Contrôle circadien de l’inflammasome NLRP3
Le système immunitaire inné détecte les PAMP ainsi que les DAMP, qui favorisent l’inflammation stérile3 nécessaire à la résolution des blessures, à la réparation/régénération des tissus et à leur homéostasie. L’inflammasome NLRP3 (NOD-, LRR- and pyrin domain-containing protein 3) est un complexe protéique de signalisation de l’immunité innée dont l’assemblage et l’activation peuvent être déclenchés par divers signaux, allant de molécules microbiennes à l’ATP ou à l’accumulation anormale de cristaux, à l’origine de la maturation et de la sécrétion de l’IL-1β et de l’IL-18 [22] (→).
(→) Voir la Synthèse de M. Groslambert et B.F. Py, m/s n° 1, janvier 2018, page 47
La dérégulation de l’inflammasome est associée à de nombreuses maladies inflammatoires et métaboliques, notamment la polyarthrite rhumatoïde, la goutte, l’athérosclérose ou le diabète de type 2. L’expression des composants de l’inflammasome NLRP3 oscille de manière circadienne sous le contrôle de REV-ERBα dans les macrophages et ces oscillations sont perdues en cas de délétion du gène codant REV-ERBα [23] (Figure 4). REV-ERBα se lie à des éléments de réponse spécifiques situés dans les promoteurs des gènes Nlrp3 et Il1b réprimant ainsi leur expression [23]. REV-ERBα régule également l’expression de Nlrp3, via le contrôle de la voie de signalisation impliquant NF-kB (nuclear factor-kappa B) [24], et son activation, en agissant sur le clivage de la caspase-1, responsable de la maturation et de la sécrétion de l’IL-1β et de l’IL-18 [23]. Dans un modèle de péritonite stérile aiguë induite par la co-administration intrapéritonéale de LPS et d’alum, pour activer spécifiquement la voie de l’inflammasome NLRP3, les concentrations plasmatiques d’IL-1β et d’IL-18 sont plus élevées chez les souris déficientes en REV-ERBα, à la fin de la phase de repos, quand l’expression de REV-ERBα est la plus importante chez les souris contrôles, alors que cette différence est perdue pendant la phase active, lorsque REV-ERBα est naturellement absent [23].
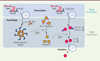 |
Figure 4. Contrôle circadien de l’inflammasome NLRP3. L’inflammasome NLRP3 détecte un large panel de molécules de dangers (DAMP : damage-associated molecular patterns) et de pathogènes (PAMP : pathogen-associated molecular patterns), comme les cristaux de cholestérol qui s’accumulent dans les plaques d’athérosclérose, les cristaux d’urée mono-sodique qui s’accumulent dans les articulations des patients souffrant de goutte, ou les cristaux d’hydroxyapatite à l’origine de la polyarthrite rhumatoïde. L’activation de l’inflammasome se fait en deux étapes, une étape d’initiation qui contrôle l’expression de l’inflammasome NLRP3 et des interleukines IL-1β et IL-18 au niveau transcriptionnel et une étape d’activation qui déclenche la formation du complexe inflammasome composé des protéines NLRP3 et ASC (apoptosis-associated speck-like containing a caspase recruitment domain protein). La première étape (de « priming ») est contrôlée par les composants de l’horloge Rev-erbs et ROR par un mécanisme de liaison directe à l’ADN. |
Dérèglements de l’horloge, récepteurs nucléaires et maladies inflammatoires
Horloge et maladies cardiovasculaires
Horloge et athérosclérose
Des horloges circadiennes sont présentes dans les différents types cellulaires formant la paroi des vaisseaux sanguins. Elles participent à la fonction et au tonus vasculaires. En effet, la pression artérielle présente des oscillations circadiennes : elle commence à augmenter avant la transition sommeil-veille (ce qui coïncide avec l’augmentation de la fréquence d’événements cardiovasculaires thrombotiques aigus que l’on observe aux premières heures du matin [25]) et elle diminue pendant le sommeil. Ainsi, plusieurs études ont mis en évidence une relation entre le travail posté (perturbation chronique) ou entre un décalage circadien aigu et la survenue d’une athérosclérose et d’une inflammation générale élevée, même après ajustement sur l’âge et les facteurs de risque courants [26, 27]. Des perturbations de l’horloge augmentent également les facteurs de risque cardiovasculaire, tels que l’inflammation, la dyslipidémie, le diabète ou l’hypertension [28].
Chez la souris, l’altération génétique de l’horloge moléculaire contribue aussi bien aux altérations métaboliques qu’à une réponse inflammatoire anormale, généralement exacerbée, à l’origine, dans la plupart des cas, du développement de lésions d’athérosclérose. La mutation perte de fonction clockΔ19 ou l’invalidation de Bmal1 ou de Rev-erba entraînent une hyperlipidémie, qui, associée à un profil pro-inflammatoire des macrophages, favorise l’athérogenèse [5]. En effet, l’invalidation de Rev-erba dans les cellules de la lignée myéloïde modifie la polarisation des macrophages vers un profil pro-inflammatoire et augmente la taille des lésions d’athérosclérose [29]. Dans les macrophages présents dans la lésion, les LDL (low density lipoprotein) oxydées et les cristaux de cholestérol sont susceptibles d’activer l’inflammasome NLRP3 qui, en retour, contribue à la réponse inflammatoire vasculaire par une production accrue d’IL-18 et d’IL-1β. L’inhibition de l’inflammasome NLRP3 réduit cette athérogenèse [30].
L’hypothèse d’une perturbation du contrôle circadien de l’activation de l’inflammasome NLRP3 au sein des cellules spumeuses (des macrophages gorgés de lipides) est ainsi plausible et pourrait concourir à l’augmentation des lésions chez les souris déficientes pour Rev-erba dans les cellules de la lignée myéloïde. BMAL1 contrôle la polarisation des macrophages ainsi que les oscillations circadiennes des monocytes circulants pro-inflammatoires (Ly6Chigh), mais les conséquences en termes d’athérosclérose ne sont pas clairement identifiées puisque la délétion de Bmal1, spécifiquement dans le compartiment myéloïde, augmente le recrutement des monocytes et aggrave l’athérosclérose dans une étude [31], tandis qu’elle la diminue dans une autre [32]. Un sommeil fragmenté, de manière chronique, entraîne une production accrue de monocytes Ly6Chigh qui s’infiltrent en plus grande quantité dans les lésions d’athérosclérose, accélérant le développement de cette dernière [33]. De même, une perturbation environnementale des rythmes circadiens, induite par un décalage horaire chronique, favorise le développement de l’athérosclérose et augmente le contenu en macrophages des lésions [34]. Le recrutement des monocytes pro-inflammatoires, par la production de chimiokines comme CCL2 (C-C motif chemokine ligand 2, aussi appelé MCP-1, pour monocyte chemoattractant protein 1) et l’activation de son récepteur, CCR2 (C-C motif chemokine receptor 2), jouent un rôle important dans le développement des plaques d’athérosclérose.
Les cellules myéloïdes sont recrutées dans les lésions de manière circadienne, avec un pic au cours de la transition entre activité et repos, grâce au dépôt rythmique de CCL2 sur l’endothélium artériel par les cellules circulantes [35]. Une approche chrono-pharmacologique ciblant le recrutement des monocytes, via l’inhibition de l’axe CCR2/CCL2 spécifiquement au moment du pic d’infiltration, diminue significativement le développement des lésions d’athérosclérose.
Horloge et infarctus du myocarde
Des perturbations de l’horloge circadienne entraînent des cardiomyopathies, une dysfonction cardiaque, une arythmie et une survie réduite. Par exemple, les variations circadiennes de la pression artérielle et de la fréquence cardiaque sont réduites ou perdues chez les souris portant la mutation ClockΔ19 spécifiquement dans les cardiomyocytes. L’infarctus du myocarde s’accompagne d’une réponse inflammatoire stérile qui permet l’élimination des débris de cardiomyocytes nécrotiques, l’angiogenèse et la cicatrisation. Toutefois, cette réponse inflammatoire favorise également la mort cellulaire, l’expansion de la zone infarcie et entraîne une fibrose et un remodelage ventriculaire qui sont délétères. Une perturbation environnementale de l’horloge a un impact négatif sur le remodelage et la fonction cardiaques. Elle augmente l’infiltration de macrophages et conduit à une hypertrophie cardiaque chez les souris subissant un infarctus [36]. L’influence de l’horloge sur les lésions d’ischémie/reperfusion (I/R) a par ailleurs été évaluée : chez des souris subissant une I/R lors des transitions de la phase de repos vers la phase active, la taille de l’infarctus est plus importante et une fibrose et un remodelage cardiaque défavorable sont observés en comparaison avec des souris ayant subi une I/R lors de la transition de la phase active vers la phase de repos. Il existe donc un rythme circadien dans la tolérance à l’I/R qui est nettement atténué chez les souris porteuses de la mutation ClockΔ19 ciblée spécifiquement dans les cardiomyocytes [37]. Une observation similaire a été faite chez des patients opérés pour remplacer la valve aortique et nécessitant la mise en place d’une circulation extracorporelle. Les complications cardiaques sont en effet moins fréquentes et moins sévères lorsque cette chirurgie est réalisée l’après-midi plutôt que le matin [38]. Chez la souris, dans un modèle de cœur isolé perfusé, le ciblage de l’horloge circadienne, par la modulation pharmacologique de Rev-erbα/β, permet de réduire les lésions d’I/R ex vivo [38]. Il en est de même dans un modèle murin d’infarctus du myocarde in vivo [39].
Dans un modèle d’insuffisance cardiaque induite par constriction trans-aortique, Rev-erbα s’est révélé être une cible intéressante [40]. Dans ce contexte, l’atténuation de l’inflammation et la réduction du recrutement des polynucléaires neutrophiles et des macrophages pro-inflammatoires pourraient en effet, au moins en partie, contribuer au bénéfice du ciblage de REV-ERBα via sa modulation pharmacologique. La taille de l’infarctus est plus importante lorsque l’infarctus est provoqué à ZT13 (zeitgeber time 4, début de la phase active) que lorsqu’il est induit à ZT5 (milieu de la phase de repos), c’est-à-dire lorsque le nombre de monocytes cardiaques Ly6Chigh est le plus élevé, probablement en raison d’un recrutement accru de ces cellules par CCR2 [41]. Ces données, ainsi que l’observation que REV-ERBα contrôle l’activation de l’inflammasome NLRP3 des macrophages, suggèrent un possible rôle de REV-ERBα présent dans les monocytes/macrophages dans la tolérance à l’I/R. D’ailleurs, l’activation de REV-ERBα au moment de la reperfusion chez la souris limite la taille de la zone infarcie, améliore la fonction cardiaque, et réduit le recrutement des polynucléaires neutrophiles et des macrophages [39]. Notons qu’au-delà du contrôle de l’inflammation, la régulation circadienne du métabolisme des cardiomyocytes par REV-ERBα/β pourrait être une cible de chronothérapie pour le traitement de l’insuffisance cardiaque et de la cardiomyopathie dilatée [42].
Le choc septique
Le choc septique est associé à une altération de la réponse immunitaire, à l’origine d’une réponse pro-inflammatoire exacerbée. Chez la souris, en réponse à une charge bactérienne ou à un choc endotoxique par injection de lipopolysaccharide (LPS), la mortalité des animaux par septicémie varie au cours de la journée [19]. Elle est plus élevée lorsque l’injection a lieu au début de la phase active de la souris. Ceci peut être expliqué, entre autres, par les oscillations diurnes observées dans l’abondance de monocytes pro-inflammatoires Ly6Chi, qui sont sous le contrôle de BMAL1 [21]. Une perforation du cæcum, après ligature au cours de la phase active chez la souris, entraîne également un phénotype plus sévère et une mortalité accélérée par rapport à la même intervention pratiquée pendant la phase de repos, alors que cette variation circadienne est perdue dans un modèle murin d’altération de l’horloge biologique. Ceci s’expliquerait par la régulation, par l’horloge, de l’expression du récepteur TLR2 (Toll-like receptor 2) par les macrophages.
Les colites
L’inflammasome NLRP3 a été identifié comme un médiateur central de l’inflammation intestinale dans la colite induite par le DSS (dextran sulfate de sodium), un modèle de colite ulcéreuse (ou rectocolite hémorragique). En accord avec le rôle de l’horloge dans la régulation de l’activation de l’inflammasome NLRP3, la colite induite par le DSS est plus sévère dans les modèles murins de perturbation de l’horloge, environnementale ou génétique [24]. Les souris dont le gène codant REV-ERBα a été invalidé, chez lesquelles l’activation de la voie de l’inflammasome NLRP3 est accrue, présentent un phénotype plus sévère que les souris contrôle. L’activation pharmacologique de Rev-erbα/β atténue au contraire la colite.
L’hépatite fulminante
L’hépatite fulminante est une maladie hépatique à évolution rapide associée à une encéphalopathie, pouvant entraîner le décès du patient. De nombreux facteurs peuvent être à l’origine de cette maladie, dont une infection par un virus (virus de l’hépatite virale A ou B, le plus souvent), des maladies métaboliques et génétiques, ainsi que l’absorption de composés toxiques ou médicamenteux (le surdosage en acétaminophène, ou paracétamol, restant actuellement la principale cause d’hépatite fulminante). L’accumulation d’acétaminophène conduit à la production de grandes quantités de métabolites toxiques provoquant un stress oxydant, une dysfonction mitochondriale et la mort hépatocellulaire, avec la sécrétion de DAMP et l’activation de l’inflammasome NLRP3 associée à l’augmentation de sécrétion d’IL-1β par les macrophages. REV-ERBα contrôlant l’inflammasome NLRP3 dans ce contexte, la susceptibilité à l’hépatite dépend du moment de la journée. Chez la souris, la délétion du gène codant REV-ERBα entraîne une hépatite fulminante plus sévère que celle observée chez les souris contrôle. Les lésions hépatiques sont par contre diminuées par l’activation pharmacologique de REV-ERB, améliorant le taux de survie des animaux (70 % des souris traitées, comparés à 10 % dans le groupe témoin) [23].
Les maladies pulmonaires et l’asthme allergique
Des expériences réalisées chez la souris ont montré le rôle de l’horloge biologique dans la pathogenèse des maladies pulmonaires. La réponse pulmonaire antibactérienne est en effet modulée par l’horloge circadienne, en particulier par BMAL1 dans les cellules épithéliales. En régulant la production de la chimiokine CXCL5 (C-X-C motif chemokine 5), l’horloge induit un recrutement circadien des polynucléaires neutrophiles dans le poumon, un mécanisme qui dépend par ailleurs pour partie, mais pas uniquement, du récepteur des glucocorticoïdes [18, 43]. La délétion des gènes Bmal1 [18] ou Rev-erba [44] dans les cellules bronchiolaires perturbe l’expression rythmique de CXCL5, ce qui entraîne une réponse inflammatoire exacerbée au LPS et une réponse altérée à l’infection par la bactérie Streptococcus pneumoniae.
L’asthme est une autre maladie dont la symptomatologie est circadienne, les crises étant plus fréquentes au cours de la nuit. La dissonance entre les rythmes environnementaux vécus, par exemple par les travailleurs postés et les rythmes endogènes de ces personnes, pourrait augmenter le risque d’asthme [45, 46]. Chez la souris, la délétion de Bmal1 ou une perturbation environnementale de l’horloge provoquée par un décalage horaire, exacerbent la bronchiolite virale aiguë causée par le virus de la grippe A [47]. Les souris qui n’expriment plus Bmal1 présentent d’ailleurs des modifications asthmatiformes qui sont beaucoup plus importantes après l’infection, notamment en ce qui concerne la production de mucus, et une résistance accrue des voies respiratoires5. Dans un modèle d’asthme allergique induit par l’ovalbumine, la délétion de Bmal1, spécifiquement dans les cellules myéloïdes, provoque d’ailleurs une augmentation du nombre de polynucléaires éosinophiles et des concentrations d’IL-5 [48]. L’implication de REV-ERBα a été montrée dans l’asthme allergique [49] et la délétion du gène Rev-erba conduit à une diminution des réponses antivirales et à une augmentation de la réactivité aux allergènes, à l’origine d’un phénotype asthmatique. REV-ERBα agit à la fois dans les cellules épithéliales bronchiques et les cellules myéloïdes dans lesquelles il module l’amplitude de la réponse à une endotoxine inhalée, en contrôlant la réponse inflammatoire et l’activation des chimiokines [20, 44].
Discussion et perspectives : chronothérapie ou ciblage de l’horloge circadienne
La réponse aux agents pathogènes présente des variations circadiennes, notamment en raison du comportement rythmique des cellules du système immunitaire; ces variations affectent tant la quantité de cellules circulantes et leur infiltration dans le site inflammatoire, que leur fonction (Figure 5). Il existe ainsi un rythme de la réponse aux endotoxines et à une infection par des agents pathogènes bactériens et viraux. Les symptômes associés à ces infections présentent également des oscillations orchestrées par l’horloge circadienne. Son dérèglement est à l’origine d’une augmentation du risque de maladies métaboliques, cardiovasculaires et inflammatoires chroniques. L’horloge circadienne se révèle donc être un facteur important à prendre en considération chez le patient. Une meilleure prise en compte des rythmes biologiques, avec la mise en place d’horaires de travail ou d’école adaptés au chronotype de chacun, d’une routine permettant d’améliorer le sommeil, la diminution de l’exposition à la lumière des écrans avant le coucher et une exposition à la lumière naturelle privilégiée par une activité de plein air dans la journée, ou la luminothérapie, sont autant de mesures qui permettraient de resynchroniser cette horloge (Figure 5).
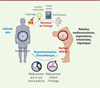 |
Figure 5. Maladies inflammatoires associées à une altération du rythme et chronothérapie. Les altérations du rythme circadien provoquées par le travail posté, l’exposition à la lumière artificielle (des écrans) la nuit, des prises alimentaires la nuit, ainsi que le vieillissement, contribuent au développement de nombreuses maladies, inflammatoires en particulier, comme les maladies cardiovasculaires, respiratoires, intestinales et hépatiques. Par conséquent, de nombreuses pistes thérapeutiques centrées sur le contrôle du rythme circadien sont envisagées, comme la prise d’un médicament à un moment de la journée où il serait plus efficace avec moins d’effets secondaires, ou comme le ciblage direct des composants de l’horloge pour resynchroniser les rythmes. En ce sens, les récepteurs nucléaires qui possèdent un domaine de liaison du ligand et qui sont impliqués dans le contrôle du rythme circadien constituent des cibles thérapeutiques privilégiées. |
Le ciblage de certains composants de l’horloge, en particulier les récepteurs nucléaires, par des composés pharmacologiques administrés au moment optimal de la journée, représente une piste thérapeutique intéressante. L’administration de médicaments à un moment précis de la journée, ou chronothérapie, peut s’avérer bénéfique pour mieux traiter ces maladies, en améliorant l’efficacité des médicaments et en réduisant les effets indésirables [50]. Si la chronothérapie est encore peu considérée dans le traitement des maladies inflammatoires, cette stratégie a pourtant été utilisée avec succès dans des maladies comme les cancers, indiquant la faisabilité et la pertinence d’une telle approche [51–53].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
La recherche effectuée par les auteurs est soutenue par l’Agence nationale de la recherche (ANR) « European Genomic Institute for Diabetes » E.G.I.D., ANR-10-LABX-0046, le programme Investissements d’Avenir I-SITE ULNE / ANR-16-IDEX-0004 ULNE, l’ANR (ANR-19-CE15-0033-01, ANR-20-CE14-0035), la Fondation pour la Recherche Médicale (EQU202003010310 »), la Fondation Française de Cardiologie, la Fondation de France. Ce projet est cofinancé par l’Union européenne dans le cadre du Fonds de développement des régions européennes (FEDER) et par le Conseil régional des Hauts-de-France (contrat 20002842), la Métropole européenne de Lille (MEL) (contrat 2020-ESR-06) et l’État français (contrat 2020-R3-CTRL_IPL_Phase4).
Références
- Bass J, Lazar MA. Circadian time signatures of fitness and disease. Science 2016 ; 354 : 994–999. [CrossRef] [PubMed] [Google Scholar]
- Duez H, Sebti Y, Staels B. Horloges circadiennes et métabolisme : intégration des signaux métaboliques et environnementaux. Med Sci (Paris) 2013 ; 29 : 772–777. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Takahashi JS. Transcriptional architecture of the mammalian circadian clock. Nat Rev Genet 2017 ; 18 : 164–179. [CrossRef] [PubMed] [Google Scholar]
- Zhang R, Lahens NF, Ballance HI, et al. A circadian gene expression atlas in mammals: implications for biology and medicine. Proc Natl Acad Sci USA 2014 ; 111 : 16219–16224. [CrossRef] [PubMed] [Google Scholar]
- Pourcet B, Duez H. Nuclear Receptors and Clock Components in Cardiovascular Diseases. Int J Mol Sci 2021; 22 : 9721. [CrossRef] [PubMed] [Google Scholar]
- Torra IP, Tsibulsky V, Delaunay F, et al. Circadian and glucocorticoid regulation of Rev-erbalpha expression in liver. Endocrinology 2000 ; 141 : 3799–3806. [CrossRef] [PubMed] [Google Scholar]
- Cuesta M, Cermakian N, Boivin DB. Glucocorticoids entrain molecular clock components in human peripheral cells. FASEB J 2015 ; 29 : 1360–1370. [CrossRef] [PubMed] [Google Scholar]
- Okabe T, Chavan R, Fonseca Costa SS, et al. REV-ERBα influences the stability and nuclear localization of the glucocorticoid receptor. J Cell Sci 2016 ; 129 : 4143–4154. [PubMed] [Google Scholar]
- Lamia KA, Papp SJ, Yu RT, et al. Cryptochromes mediate rhythmic repression of the glucocorticoid receptor. Nature 2011 ; 480 : 552–556. [PubMed] [Google Scholar]
- Nader N, Chrousos GP, Kino T. Circadian rhythm transcription factor CLOCK regulates the transcriptional activity of the glucocorticoid receptor by acetylating its hinge region lysine cluster: potential physiological implications. FASEB J 2009 ; 23 : 1572–1583. [CrossRef] [PubMed] [Google Scholar]
- McNamara P, Seo SB, Rudic RD, et al. Regulation of CLOCK and MOP4 by nuclear hormone receptors in the vasculature: a humoral mechanism to reset a peripheral clock. Cell 2001 ; 105 : 877–889. [CrossRef] [PubMed] [Google Scholar]
- Nakamura TJ, Sellix MT, Menaker M, et al. Estrogen directly modulates circadian rhythms of PER2 expression in the uterus. Am J Physiol Endocrinol Metab 2008 ; 295 : E1025–E1031. [CrossRef] [PubMed] [Google Scholar]
- Dufour CR, Levasseur M-P, Pham NHH, et al. Genomic convergence among ERRα, PROX1, and BMAL1 in the control of metabolic clock outputs. PLoS Genet 2011 ; 7 : e1002143. [CrossRef] [PubMed] [Google Scholar]
- Horard B, Rayet B, Triqueneaux G, et al. Expression of the orphan nuclear receptor ERRalpha is under circadian regulation in estrogen-responsive tissues. J Mol Endocrinol 2004 ; 33 : 87–97. [CrossRef] [PubMed] [Google Scholar]
- Curtis AM, Bellet MM, Sassone-Corsi P, et al. Circadian clock proteins and immunity. Immunity 2014 ; 40 : 178–186. [CrossRef] [PubMed] [Google Scholar]
- Pick R, He W, Chen C-S, et al. Time-of-Day-Dependent Trafficking and Function of Leukocyte Subsets. Trends Immunol 2019 ; 40 : 524–537. [CrossRef] [PubMed] [Google Scholar]
- Scheiermann C, Gibbs J, Ince L, et al. Clocking in to immunity. Nat Rev Immunol 2018 ; 18 : 423–437. [CrossRef] [PubMed] [Google Scholar]
- Gibbs J, Ince L, Matthews L, et al. An epithelial circadian clock controls pulmonary inflammation and glucocorticoid action. Nat Med 2014 ; 20 : 919–926. [CrossRef] [PubMed] [Google Scholar]
- Man K, Loudon A, Chawla A. Immunity around the clock. Science 2016 ; 354 : 999–1003. [CrossRef] [PubMed] [Google Scholar]
- Gibbs JE, Blaikley J, Beesley S, et al. The nuclear receptor REV-ERBα mediates circadian regulation of innate immunity through selective regulation of inflammatory cytokines. Proc Natl Acad Sci USA 2012 ; 109 : 582–587. [CrossRef] [PubMed] [Google Scholar]
- Nguyen KD, Fentress SJ, Qiu Y, et al. Circadian gene Bmal1 regulates diurnal oscillations of Ly6C(hi) inflammatory monocytes. Science 2013 ; 341 : 1483–1488. [CrossRef] [PubMed] [Google Scholar]
- Groslambert M, Py BF. NLRP3, un inflammasome sous contrôle. Med Sci (Paris) 2018 ; 34 : 47–53. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Pourcet B, Zecchin M, Ferri L, et al. Nuclear Receptor Subfamily 1 Group D Member 1 Regulates Circadian Activity of NLRP3 Inflammasome to Reduce the Severity of Fulminant Hepatitis in Mice. Gastroenterology 2018 ; 154 : 1449–64e20. [CrossRef] [PubMed] [Google Scholar]
- Wang S, Lin Y, Yuan X, et al. REV-ERBα integrates colon clock with experimental colitis through regulation of NF-κB/NLRP3 axis. Nat Commun 2018 ; 9 : 4246. [CrossRef] [PubMed] [Google Scholar]
- Millar-Craig MW, Bishop CN, Raftery EB. Circadian variation of blood-pressure. Lancet 1978 ; 1 : 795–797. [CrossRef] [Google Scholar]
- Puttonen S, Kivimaki M, Elovainio M, et al. Shift work in young adults and carotid artery intima-media thickness: The Cardiovascular Risk in Young Finns study. Atherosclerosis 2009 ; 205 : 608–613. [CrossRef] [PubMed] [Google Scholar]
- Morris CJ, Purvis TE, Mistretta J, et al. Circadian Misalignment Increases C-Reactive Protein and Blood Pressure in Chronic Shift Workers. J Biol Rhythms 2017 ; 32 : 154–164. [CrossRef] [PubMed] [Google Scholar]
- Bøggild H, Knutsson A. Shift work, risk factors and cardiovascular disease. Scand J Work Environ Health 1999 ; 25 : 85–99. [CrossRef] [PubMed] [Google Scholar]
- Ma H, Zhong W, Jiang Y, et al. Increased atherosclerotic lesions in LDL receptor deficient mice with hematopoietic nuclear receptor Rev-erbα knock- down. J Am Heart Assoc 2013 ; 2 : e000235. [CrossRef] [PubMed] [Google Scholar]
- Duewell P, Kono H, Rayner KJ, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature 2010 ; 464 : 1357–1361. [CrossRef] [PubMed] [Google Scholar]
- Huo M, Huang Y, Qu D, et al. Myeloid Bmal1 deletion increases monocyte recruitment and worsens atherosclerosis. FASEB J 2017 ; 31 : 1097–1106. [CrossRef] [PubMed] [Google Scholar]
- Yang G, Zhang J, Jiang T, et al. Bmal1 Deletion in Myeloid Cells Attenuates Atherosclerotic Lesion Development and Restrains Abdominal Aortic Aneurysm Formation in Hyperlipidemic Mice. Arterioscler Thromb Vasc Biol 2020; 40 : 1523–32. [CrossRef] [PubMed] [Google Scholar]
- McAlpine CS, Kiss MG, Rattik S, et al. Sleep modulates haematopoiesis and protects against atherosclerosis. Nature 2019 ; 566 : 383–387. [PubMed] [Google Scholar]
- Schilperoort M, Berg R van den, Bosmans LA, et al. Disruption of circadian rhythm by alternating light-dark cycles aggravates atherosclerosis development in APOE*3-Leiden.CETP mice. J Pineal Res 2020; 68 : e12614. [CrossRef] [PubMed] [Google Scholar]
- Winter C, Silvestre-Roig C, Ortega-Gomez A, et al. Chrono-pharmacological Targeting of the CCL2-CCR2 Axis Ameliorates Atherosclerosis. Cell Metab 2018 ; 28 : 175–82.e5. [CrossRef] [PubMed] [Google Scholar]
- Alibhai FJ, Tsimakouridze EV, Chinnappareddy N, et al. Short-term disruption of diurnal rhythms after murine myocardial infarction adversely affects long-term myocardial structure and function. Circ Res 2014 ; 114 : 1713–1722. [CrossRef] [PubMed] [Google Scholar]
- Durgan DJ, Pulinilkunnil T, Villegas-Montoya C, et al. Short communication: ischemia/reperfusion tolerance is time-of-day-dependent: mediation by the cardiomyocyte circadian clock. Circ Res 2010 ; 106 : 546–550. [CrossRef] [PubMed] [Google Scholar]
- Montaigne D, Marechal X, Modine T, et al. Daytime variation of perioperative myocardial injury in cardiac surgery and its prevention by Rev-Erbα antagonism: a single-centre propensity-matched cohort study and a randomised study. Lancet 2018 ; 391 : 59–69. [CrossRef] [PubMed] [Google Scholar]
- Reitz CJ, Alibhai FJ, Khatua TN, et al. SR9009 administered for one day after myocardial ischemia-reperfusion prevents heart failure in mice by targeting the cardiac inflammasome. Commun Biol 2019 ; 2 : 353. [CrossRef] [PubMed] [Google Scholar]
- Zhang L, Zhang R, Tien C-L, et al. REV-ERBα ameliorates heart failure through transcription repression. JCI Insight 2017 ; 2 : 95177. [CrossRef] [PubMed] [Google Scholar]
- Schloss MJ, Hilby M, Nitz K, et al. Ly6Chigh Monocytes Oscillate in the Heart During Homeostasis and After Myocardial Infarction-Brief Report. Arterioscler Throm Vasc Biol 2017 ; 37 : 1640–1645. [CrossRef] [PubMed] [Google Scholar]
- Song S, Tien C-L, Cui H, et al. Myocardial Rev-erb-Mediated Diurnal Metabolic Rhythm and Obesity Paradox. Circulation 2022; 145 : 448–64. [CrossRef] [PubMed] [Google Scholar]
- Ince LM, Zhang Z, Beesley S, et al. Circadian variation in pulmonary inflammatory responses is independent of rhythmic glucocorticoid signaling in airway epithelial cells. FASEB J 2019 ; 33 : 126–139. [CrossRef] [PubMed] [Google Scholar]
- Pariollaud M, Gibbs JE, Hopwood TW, et al. Circadian clock component REV-ERBα controls homeostatic regulation of pulmonary inflammation. J Clin Invest 2018 ; 128 : 2281–2296. [CrossRef] [PubMed] [Google Scholar]
- Maidstone RJ, Turner J, Vetter C, et al. Night shift work is associated with an increased risk of asthma. Thorax 2021; 76 : 53–60. [CrossRef] [PubMed] [Google Scholar]
- Scheer FAJL, Hilton MF, Evoniuk HL, et al. The endogenous circadian system worsens asthma at night independent of sleep and other daily behavioral or environmental cycles. Proc Natl Acad Sci USA 2021; 118 : e2018486118. [CrossRef] [PubMed] [Google Scholar]
- Ehlers A, Xie W, Agapov E, et al. BMAL1 links the circadian clock to viral airway pathology and asthma phenotypes. Mucosal Immunol 2018 ; 11 : 97–111. [CrossRef] [PubMed] [Google Scholar]
- Zasłona Z, Case S, Early JO, et al. The circadian protein BMAL1 in myeloid cells is a negative regulator of allergic asthma. Am J Physiol Lung Cell Mol Physiol 2017 ; 312 : L855–L860. [CrossRef] [PubMed] [Google Scholar]
- Durrington HJ, Krakowiak K, Meijer P, et al. Circadian asthma airway responses are gated by REV-ERBα. Eur Respir J 2020; 56 : 1902407. [CrossRef] [PubMed] [Google Scholar]
- Cederroth CR, Albrecht U, Bass J, et al. Medicine in the Fourth Dimension. Cell Metab 2019 ; 30 : 238–250. [CrossRef] [PubMed] [Google Scholar]
- Printezi MI, Kilgallen AB, Bond MJG, et al. Toxicity and efficacy of chronomodulated chemotherapy: a systematic review. Lancet Oncol 2022; 23 : e129–43. [CrossRef] [PubMed] [Google Scholar]
- Lévi F. Daytime versus evening infusions of immune checkpoint inhibitors. Lancet Oncol 2021; 22 : 1648–50. [CrossRef] [PubMed] [Google Scholar]
- Lévi F, Okyar A, Dulong S, et al. Circadian timing in cancer treatments. Annu Rev Pharmacol Toxicol 2010 ; 50 : 377–421. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Réseaux circadiens et chronobiologie. L’horloge centrale est située dans le système nerveux central (SNC), plus particulièrement au niveau du noyau suprachiasmatique, où elle programme les cycles de veille/sommeil et de prise alimentaire en fonction de la rotation de la Terre sur son axe. Les horloges sont également présentes dans la plupart des tissus périphériques, formant ainsi un réseau d’horloges qui anticipent les changements environnementaux au cours de la journée. BMAL1 : brain and muscle Arnt-like protein 1 ; CLOCK : circadian locomotor output cycles kaput ; CRY : cryptochrome ; PER : period ; ROR : retinoid acid-related orphan receptor ; RORE : ROR response element. |
| Dans le texte | |
 |
Figure 2. La machinerie moléculaire circadienne est régulée par les récepteurs nucléaires. L’horloge moléculaire est composée de boucles transcriptionnelles de rétrocontrôles positif et négatif. Le complexe de transcription Bmal1/Clock induit l’expression de gènes contenant un élément de réponse nommé E-box, comme le complexe régulateur négatif composé des protéines Period (Per) et Cryptochrome (Cry). À son tour, l’hétérodimère Per/Cry inhibe l’activité transcriptionnelle du complexe Bmal1/Clock. Une fois que les niveaux Per et Cry sont suffisamment bas, un nouveau cycle peut commencer. L’hétérodimère Clock/Bmal1 induit également l’expression des récepteurs nucléaires Rev-erbα/β et RORα/β/γ (retinoid acid-related orphan receptor a, b, g). Rev-erb et ROR rentrent alors en compétition pour la liaison des molécules RevRE/RORE au niveau du promoteur de leurs gènes cibles communs pour respectivement réprimer ou activer leur transcription. L’effet global de ces boucles est l’expression rythmique de ces facteurs. D’autres récepteurs nucléaires, qui n’appartiennent pas à l’horloge centrale, sont capables d’activer (flèche verte) ou d’inhiber (flèche rouge) l’expression et/ou l’activité de l’horloge centrale. Cela inclut le récepteur des glucocorticoïdes (GR) activé par le cortisol, les PPAR (peroxisome proliferator-activated receptors) α et γ, dont les ligands naturels sont les acides gras et leurs dérivés, le récepteur des œstrogènes (ER) α, le récepteur X de l’acide 9-cis-rétinoïque (RXR), le récepteur activé par l’acide all-trans-rétinoïque et l’acide 9-cis-rétinoïdes (RAR) et l’ERR (estrogen-related receptor) alpha. |
| Dans le texte | |
 |
Figure 3. L’immunité circadienne. L’horloge moléculaire contrôle un nombre important de fonctions immunitaires comme la sécrétion des cytokines, la phagocytose, la réponse à des pathogènes (bactéries, parasites) au travers du contrôle de l’expression des Toll-like receptors (TLR), ainsi que la réponse aux molécules de danger, au travers du contrôle de l’inflammasome NLRP3. La mobilisation au niveau de la moelle osseuse, le nombre de leucocytes plasmatiques circulants, ainsi que leur recrutement dans les tissus, varient également de manière circadienne. |
| Dans le texte | |
 |
Figure 4. Contrôle circadien de l’inflammasome NLRP3. L’inflammasome NLRP3 détecte un large panel de molécules de dangers (DAMP : damage-associated molecular patterns) et de pathogènes (PAMP : pathogen-associated molecular patterns), comme les cristaux de cholestérol qui s’accumulent dans les plaques d’athérosclérose, les cristaux d’urée mono-sodique qui s’accumulent dans les articulations des patients souffrant de goutte, ou les cristaux d’hydroxyapatite à l’origine de la polyarthrite rhumatoïde. L’activation de l’inflammasome se fait en deux étapes, une étape d’initiation qui contrôle l’expression de l’inflammasome NLRP3 et des interleukines IL-1β et IL-18 au niveau transcriptionnel et une étape d’activation qui déclenche la formation du complexe inflammasome composé des protéines NLRP3 et ASC (apoptosis-associated speck-like containing a caspase recruitment domain protein). La première étape (de « priming ») est contrôlée par les composants de l’horloge Rev-erbs et ROR par un mécanisme de liaison directe à l’ADN. |
| Dans le texte | |
 |
Figure 5. Maladies inflammatoires associées à une altération du rythme et chronothérapie. Les altérations du rythme circadien provoquées par le travail posté, l’exposition à la lumière artificielle (des écrans) la nuit, des prises alimentaires la nuit, ainsi que le vieillissement, contribuent au développement de nombreuses maladies, inflammatoires en particulier, comme les maladies cardiovasculaires, respiratoires, intestinales et hépatiques. Par conséquent, de nombreuses pistes thérapeutiques centrées sur le contrôle du rythme circadien sont envisagées, comme la prise d’un médicament à un moment de la journée où il serait plus efficace avec moins d’effets secondaires, ou comme le ciblage direct des composants de l’horloge pour resynchroniser les rythmes. En ce sens, les récepteurs nucléaires qui possèdent un domaine de liaison du ligand et qui sont impliqués dans le contrôle du rythme circadien constituent des cibles thérapeutiques privilégiées. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




