| Issue |
Med Sci (Paris)
Volume 41, Number 5, Mai 2025
Enjeux et objectifs de la psychiatrie de précision
|
|
|---|---|---|
| Page(s) | 416 - 424 | |
| Section | La psychiatrie de précision (PEPR PROPSY) : hypothèses et outils | |
| DOI | https://doi.org/10.1051/medsci/2025072 | |
| Published online | 26 May 2025 | |
Construire la psychiatrie de précision : pourquoi et comment ?
Building precision psychiatry: why and how?
1
Université Paris Cité, Institut de psychiatrie et neurosciences de Paris (IPNP), Inserm U1266, Paris, France
2
Génétique humaine et fonctions cogniti ves, Institut Pasteur, CNRS UMR3571, Université Paris Cité, Paris, France
3
GHU-Paris Psychiatrie et Neurosciences, Hôpital Sainte-Anne, Paris, France
4
Department of Psychiatry, McGill University, Montréal, Canada
5
Fondation Fondamental, Créteil, France
6
Service de psychiatrie et de psychologie médicale, Centre expert dépression résistante et trouble bipolaire, CHU de Toulouse, Hôpital Purpan, ToNIC centre de neuroimagerie, Université de Toulouse, Inserm, UPS, UMR1214, Toulouse, France
7
Université Paris-Est Créteil, Inserm U955, IMRB, Neuropsychiatrie translationnelle, Créteil, France
8
CEReSS-Centre de recherche sur les services de santé et la qualité de vie, Université d’Aix-Marseille, France
9
Université de Clermont Auvergne, CHU Clermont-Ferrand, CNRS, IP, UMR 6602, Clermont-Ferrand, France
10
Hôpital Henri Mondor, Créteil, France
La psychiatrie de précision ambitionne d’identifier des sous-groupes homogènes de patients grâce à des biomarqueurs. Elle promet de révolutionner les classifications actuelles et génère l’espoir de personnaliser les traitements. Des exemples en neuropsychiatrie montrent que cette approche est réaliste, qu’il s’agisse de la reclassification des démences en neurologie ou des succès récents dans le champ des troubles du neurodéveloppement. Les défis incluent le développement de grandes cohortes transnosographiques, l’intégration de données multimodales et l’utilisation de méthodes statistiques avancées. Cette stratégie promet des soins adaptés et efficaces, tout en questionnant les classifications établies.
Abstract
Precision psychiatry aims to identify homogeneous subgroups of patients using biomarkers, which could revolutionize current diagnostic frameworks and raise hopes for personalized treatments. Early examples in neuropsychiatry demonstrate the feasibility of this approach, such as the reclassification of dementias in neurology based on biomarkers such as amyloid plaques and tau proteins, and significant advances in neurodevelopmental disorders such as autism, where genetic heterogeneity has reshaped diagnostic perspectives. To achieve this vision, major challenges must be overcome, including the establishment of large transdiagnostic cohorts, the integration of multimodal data such as imaging, genomics, or digital phenotyping, and the application of advanced statistical methods such as clustering, normative modeling and digital twins. While this strategy promises more precise and effective care tailored to individual needs, it also challenges traditional classifications and forces the psychiatric community to rethink its foundational paradigms in light of biological knowledge.
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© AdobeStock).
Dès le IIe siècle après JC, Galien1 déclarait dans sa « Méthode Thérapeutique » « qu’il faut examiner la nature de la personne souffrante et que pour chaque individu il existe une thérapie particulière (…). Mais s’imaginer qu’il existe un traitement commun à tout le monde est la pire des sottises. ». La même vision se retrouve chez Claude Bernard2 pour qui, « le médecin n’est point le médecin des êtres vivants en général, pas même le médecin du genre humain, mais bien le médecin de l’individu humain, et de plus le médecin d’un individu dans certaines conditions morbides qui lui sont spéciales et qui constituent ce que l’on a appelé son idiosyncrasie3 ». Dès le début, la médecine, basée sur le colloque singulier entre le médecin et le malade, s’inscrit intimement dans la singularité. C’est au début du XXe siècle que la notion de médecine de précision est théorisée par Archibald Garrod4, médecin chercheur travaillant dans le domaine des maladies héréditaires et métaboliques [1]. Selon sa formule, « les cas individuels d’une maladie donnée ne sont pas exactement semblables ; ils ressemblent plutôt aux dessins réalisés à partir du même modèle ».
Mais c’est en 2015 que la médecine de précision prend réellement son envol lorsque le Président américain Barack Obama lance une large initiative dont l’objectif est « d’améliorer la santé en adaptant la prévention et le traitement des maladies aux différences génétiques, environnementales et de mode de vie entre les individus ». La stratégie est centrée initialement sur la cancérologie où l’identification des mutations génétiques des tumeurs promet de personnaliser les soins. À partir d’une biopsie, le profil génétique de certaines tumeurs permet, en effet, d’identifier le traitement le plus adéquat. Aujourd’hui, plus d’une centaine de traitements ciblés existent en oncologie. Par exemple, certaines molécules peuvent cibler des tumeurs avec des mutations du gène EGFR (epithelial growth factor receptor), quel que soit l’organe atteint. Si la cancérologie ouvre la voie, les autres spécialités sont bien inspirées de lui embrayer le pas, et en particulier la psychiatrie [2] (→).
(→) Voir m/s n° 4, 2022, page 381
Dans cette spécialité, qui repose sur l’unicité du soin entre le clinicien et le patient, cette approche ouvre des perspectives prometteuses [3]. Le terme « psychiatrie de précision » peut renvoyer à deux sens qui ne sont pas exactement identiques. Tout d’abord, précision peut évoquer la qualité de la mesure (« mesurer avec précision »). Cette acceptation renvoie à la nécessité de quantifier le psychisme, dans son état normal comme pathologique. Il s’agit initialement du terrain de la psychométrie, c’est-à-dire de l’élaboration d’échelles mesurant les symptômes et le fonctionnement psychique. Cependant, ces mesures peuvent également correspondre à des paramètres biologiques également appelés biomarqueurs. Selon le groupe de travail international sur les biomarqueurs, ceux-ci sont définis comme des « indicateurs de processus biologiques normaux, de processus pathologiques ou de réponses à une exposition ou à une intervention, y compris à des interventions thérapeutiques » [4]. Ces biomarqueurs peuvent inclure l’imagerie cérébrale, la neurophysiologie, les données de type « omiques » (génomique, transcriptomique, protéomique ), c’est-àdire des données à grande échelle, générées à partir des fluides corporels (sang, urine, salive, liquide céphalo-rachidien, etc).
Ces nouvelles investigations promettent d’identifier des signatures des comportements et des troubles psychiatriques. Toutefois, comme les troubles psychiatriques sont hétérogènes, il est hautement improbable qu’un unique biomarqueur puisse correspondre à une catégorie diagnostique établie a priori. Cette limite conduit au deuxième sens derrière le terme de « psychiatrie de précision ». Si chaque entité diagnostique en psychiatrie recouvre des réalités différentes, il convient donc de les démembrer en différents sousgroupes homogènes. Les mesures et les biomarqueurs devraient donc aboutir à identifier des individus qui se regrouperaient ensemble selon leurs similarités biologiques ou symptomatiques. Le corollaire est la remise en cause des catégories diagnostiques actuelles par cette nouvelle approche.
La vision actuelle des troubles psychiatriques
Histoire de la nosographie psychiatrique
La psychiatrie s’est construite à partir de la nosographie5. La description de cas emblématiques est à l’origine de la naissance d’entités cliniques : syndrome d’Asperger6, démence précoce de Kraepelin7, schizophrénie de Bleuler8, hystérie de Charcot9… Avec Freud, la psychanalyse s’érige comme tentative d’explication de ces entités par des conflits intrapsychiques et leur modalité de résolution, faisant naître les concepts de névrose et de psychose. Après la seconde guerre mondiale, l’Organisation mondiale de la santé inclut une section dédiée aux troubles mentaux (catégorie F) dans sa sixième révision du manuel de la classification internationale des maladies (CIM). Elle est suivie par l’association américaine de psychiatrie (APA) qui donne naissance au manuel diagnostique et statistique des troubles mentaux (diagnostic and statistical manual of mental disorders, DSM) à partir des statistiques collectées depuis des hôpitaux psychiatriques et d’un manuel militaire. Le DSM fera très rapidement office d’ouvrage de référence. La première et la deuxième édition restent influencées par la psychopathologie analytique, mais la troisième édition de 1980, sous l’impulsion de Robert Spitzer10, se donne pour ambition de décrire les syndromes psychiatriques de manière empirique, athéorique et unificatrice. La création du manuel diagnostique et statistique des troubles mentaux visait à rendre reproductibles les diagnostics psychiatriques, sans recourir à l’étiologie qui reste inconnue. Le terme de maladie est délaissé au profit de l’appellation « troubles » qui ne présuppose pas de connaissance étiologique. Ainsi, ces catégories nosographiques sont définies par des consensus d’experts et ne sont pas basées sur les connaissances physiopathologiques. Elles ont été créées pour maximiser la fidélité inter-cotateur11 et fournir un langage commun à la communauté.
Si le langage du manuel diagnostique et statistique des troubles mentaux s’impose progressivement, ses frontières sont artificielles et ne reposent pas sur des validateurs biologiques externes. Dès lors que les entités cliniques font l’impasse sur les connaissances biologiques des troubles, les efforts pour comprendre leur physiopathologie se heurtent à l’obstacle de la définition du sujet de la recherche. Cet écueil peut expliquer le manque de succès de nombreuses recherches scientifiques et essais cliniques. En effet, si les psychotropes ont tous été découverts par empirisme, il y a aujourd’hui une certaine incohérence à vouloir développer un traitement pour améliorer un trouble qui repose sur une construction artificielle et non sur des mécanismes physiopathologiques clairs. En outre, certains symptômes sont partagés entre différents troubles. Ainsi, les symptômes psychotiques, comme les hallucinations ou le délire, sont communs à la schizophrénie, à certaines formes de trouble bipolaire ou de dépression. Les traitements existants sont essentiellement symptomatiques et sont volontiers donnés dans plusieurs troubles. Un effort a donc été fait pour développer une approche dimensionnelle. Ainsi, l’objectif n’est plus de traiter la schizophrénie mais plutôt de déterminer un traitement des symptômes psychotiques quelle que soit la pathologie sous-jacente.
L’essor et les limites des critères du domaine de recherche (RDoC)
Le paroxysme de cette approche dimensionnelle s’incarne dans le projet research domain criteria (RDOC) lancé en 2009 par le National Institute of Mental Health (NIMH) [5] (→).
(→) Voir m/s n° 8-9, 2015, page 792
La force des RDoC réside dans le fait qu’ils forment un cadre dynamique de principes directeurs destinés à évoluer continuellement avec les développements scientifiques [6]. Les RDoC reposent sur 7 piliers : l’approche dimensionnelle de la psychopathologie qui va de l’état sain à l’état pathologique, des mesures quantifiables de la psychopathologie, un design méthodologique qui répond à la question scientifique, l’incorporation de la recherche translationnelle, un modèle intégratif allant du comportement au circuit cérébral, un focus sur les concepts éprouvés scientifiquement, une approche flexible de la psychopathologie et une définition souple des troubles [7].
Les RDoC ont été construit à partir d’un groupe de travail composé de chercheurs en recherche fondamentale et translationnelle [8]. Plusieurs domaines principaux du fonctionnement psychiques ont été retenus : les systèmes de valence négative (c’est-à-dire, ceux qui répondent à des situations aversives), les systèmes de valence positive, les systèmes cognitifs, les systèmes des processus sociaux et les systèmes d’éveil/régulation. Ultérieurement, un 6e domaine a été ajouté pour inclure les systèmes sensorimoteurs [9]. Les trajectoires neurodéveloppementales et les interactions avec l’environnement ont également été listées comme des éléments importants à intégrer dans les RDoC.
Chaque domaine de la matrice RDoC contient des dimensions également appelées « construits » pour rappeler leur caractère arbitraire et la possibilité de les faire évoluer en fonction des nouvelles données collectées [10]. Ces dimensions s’entrecroisent avec des unités d’analyse : gènes, molécules, cellules, circuits cérébraux, physiologie, comportement, auto-mesure et paradigmes. Ces unités d’analyse ont vocation à fournir des données pour justifier chaque dimension préétablie [11]. Depuis mai 2017, les références à des gènes spécifiques ont disparu de la matrice RDoC en raison d’un manque de preuves scientifiques solides d’association avec les dimensions. Ce revirement souligne le caractère arbitraire des dimensions qui s’appuient sur des données parcellaires. Si ce cadre a un intérêt heuristique, il peine à être adopté largement en raison de son absence de validité [12]. Enfin, la flexibilité des RDoC en fait un outil intéressant pour la recherche mais plus difficilement implémentable en pratique clinique.
Les écueils thérapeutiques actuels
La psychiatrie regorge de traitements et ceux-ci ne sont pas moins efficaces que dans les autres disciplines médicales [13]. Cependant, force est de constater qu’un nombre significatif de patients ne répond pas aux molécules usuelles. On estime que la résistance thérapeutique concernerait un tiers des individus souffrant de schizophrénie [14] et de ceux souffrant de dépression [15]. Le développement de nouvelles molécules reste faible, et la plupart du temps les médicaments commercialisés sont des améliorations incrémentales à partir de molécules déjà connues, à l’exception notable de la xanoméline qui vient d’être approuvée par la FDA pour le traitement de la schizophrénie et qui repose sur un mécanisme inédit (antagoniste muscarinique). Ces échecs des essais thérapeutiques dans les troubles psychiatriques peuvent venir de l’absence de précision [16]. En psychiatrie, les essais randomisés contrôlés portent sur des populations hétérogènes qui n’ont pas toutes les mêmes taux de réponse aux médicaments testés. Ainsi, l’absence de stratification peut conduire à ignorer l’effet bénéfique pour un sous-groupe de patients. En outre, les difficultés à mesurer avec précision les symptômes peuvent conduire à mésestimer l’effet thérapeutique réel.
En psychiatrie, la démarche thérapeutique actuelle repose sur une approche empirique de type « essais et erreurs ». En conséquence, les patients reçoivent plusieurs traitements séquentiels, et plusieurs mois voire plusieurs années sont souvent nécessaires avant de trouver le schéma thérapeutique adéquat. Dans cet intervalle, les troubles psychiatriques entraînent un retentissement social important et les patients reçoivent inutilement des traitements inefficaces pourvoyeurs d’effets secondaires. L’un des défis actuels en psychiatrie est de prédire la réponse thérapeutique ainsi que le risque d’effets secondaires des traitements [17]. Ainsi, il deviendrait possible de mieux rationaliser la prescription d’un psychotrope avant de pouvoir en tester l’efficacité sur le patient.
Enfin, il est de plus en plus évident que les traitements psychotropes sont à adapter à la phase du trouble psychique [18]. Bien que recommandés en première ligne dans la schizophrénie, l’usage des antipsychotiques dans les phases débutantes d’un trouble psychotique pourrait même être délétère et des approches psychothérapeutiques seraient à privilégier [19].
Les conceptions catégorielles et dimensionnelles reposent sur des généralisations et ne permettent pas d’appréhender avec finesse la physiopathologie. Elles peuvent même représenter un frein dans la découverte de nouveaux traitements, en ne prenant pas en compte l’hétérogénéité et la complexité des troubles. À l’inverse, la promesse de la psychiatrie de précision est de pouvoir identifier des sous-groupes homogènes, reposant sur des biomarqueurs, afin de fournir le traitement adéquat au bon moment, à la personne qui en bénéficiera le mieux.
Le début d’une neuropsychiatrie de précision
Les premiers exemples d’une médecine de précision en neuropsychiatrie
En neurologie, l’essor des biomarqueurs a conduit à une reconceptualisation des démences. La maladie d’Alzheimer a été décrite en 1907. L’identification d’une physiopathologie claire (plaques amyloïdes et phosphorylation de la protéine tau), a permis de développer des biomarqueurs dans le liquide céphalo-rachidien et très prochainement dans le sang [20] (→).
(→) Voir m/s n° 4, 2024, page 351
Ce mouvement s’est accompagné d’une redéfinition des catégories diagnostiques. Certains tableaux de démence fronto-temporale, définis historiquement par des troubles comportementaux, ont été requalifiés en maladie d’Alzheimer en raison de la présence de biomarqueurs compatibles. Un nouveau continuum entre démences vasculaires et maladie d’Alzheimer a été décrit devant l’existence d’une maladie amyloïde qui favorisait les saignements cérébraux. Les espoirs thérapeutiques portent aujourd’hui sur l’immunothérapie pour cibler les plaques amyloïdes avec la possibilité de suivre l’évolution des biomarqueurs chez les patients qui reçoivent ce traitement innovant.
Dans le champ du neurodéveloppement, l’autisme a ouvert la voie à la médecine de précision. Historiquement, plusieurs définitions se sont construites sur la base d’oppositions : syndrome de Kanner ou syndrome d’Asperger, autisme syndromique ou non syndromique, autisme avec ou sans déficience intellectuelle, etc. Cependant, ces distinctions ne tiennent plus. La dernière version du manuel diagnostique et statistique des troubles mentaux a regroupé ces entités sous le terme de trouble du spectre de l’autisme car ces distinctions ne correspondaient pas aux nouvelles connaissances. L’autisme est fortement lié à des facteurs génétiques et ceux-ci sont extrêmement hétérogènes avec plusieurs centaines de causes génétiques identifiées [21]. L’autisme est désormais vu comme un patchwork d’entités rares. Il est devenu évident que des entités biologiques similaires pouvaient conduire à des tableaux différents. Ainsi, des mutations du gène MECP2 (methyl CpG binding protein 2) peuvent être responsables du syndrome de Rett12, qui s’exprime par des régressions comportementales chez les filles mais aussi par des formes d’autisme moins sévère. En outre, des mutations dans des gènes différents peuvent être à l’origine de manifestations phénotypiques similaires (Figure 1). Ainsi, l’hétérogénéité diagnostique ou symptomatique ne recoupe pas l’hétérogénéité biologique. Cela peut notamment s’expliquer par la notion de pléiotropie [22] (→).
(→) Voir m/s n° 4, 2025, page 68
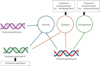 |
Figure 1 Une même anomalie génétique peut être associée à plusieurs troubles différents et un même trouble peut être lié à plusieurs anomalies distinctes. Les traitements actuels sont essentiellement symptomatiques mais la connaissance de la physiopathologie pourrait aboutir à développer des traitements spécifiques, par exemple centrés sur l’anomalie. |
En effet, les gènes ne remplissent pas une seule fonction au sein de l’organisme mais peuvent avoir une palette d’expression différente. Par exemple, le gène ATP1A3 (sodium/potassium-transporting ATPase alpha-3 chain) a été associé à des maladies neuromotrices, à des troubles du neurodéveloppement, à la schizophrénie [23], mais aussi à des troubles du rythme cardiaque [24]. Aujourd’hui, certains gènes ont été associés simultanément à l’autisme, à l’épilepsie, aux troubles des apprentissages, et à la déficience intellectuelle. Par conséquent, les barrières entre ces différents troubles tombent, et on parle désormais volontiers de troubles du neurodéveloppement pour les englober [25]. Ces mêmes gènes ont également été associés à certaines maladies psychiatriques. En effet, des patients porteurs de la même mutation peuvent présenter un trouble neurodéveloppemental mais aussi une schizophrénie ou un trouble bipolaire. Ce recoupement étiologique explique pourquoi les comorbidités psychiatriques sont la règle plutôt que l’exception. En outre, il permet de comprendre pourquoi, alors que les maladies psychiatriques s’agrègent au sein des familles, les tableaux sont variables d’un membre de la famille à un autre.
Les implications cliniques prévisibles
Ces premiers exemples permettent d’anticiper plusieurs évolutions. L’exemple de la maladie d’Alzheimer montre que la détermination des biomarqueurs à partir des données physiopathologiques conduira à un bouleversement des frontières diagnostiques. Il faudra probablement apprendre à reclasser des patients non plus selon leur présentation clinique mais en fonction de la présence de biomarqueurs, même si leurs symptômes sont différents. Le consortium B-SNIP (bipolar and schizophrenia network for intermediate phenotypes) a initié ce travail en définissant des biotypes à partir de mesures cognitives, d’analyses oculométriques13 et de mesures neurophysiologiques [26]. Cette approche a révélé que certains individus souffrant de schizophrénie étaient plus proches de patients souffrant de troubles bipolaires que d’autres atteints de schizophrénie.
Les troubles neurologiques et psychiatriques diffèrent par notre compréhension de leur physiopathologie. Dans la maladie d’Alzheimer, les composants des plaques amyloïdes et la protéine tau responsables de la neurodégénérescence fibrillaire ont été identifiées il y a plus de 40 ans. Une fois la physiopathologie élucidée, l’identification de biomarqueurs a été facilitée. En l’absence de physiopathologie claire pour la majorité des troubles psychiatriques, les recherches explorent de nombreuses pistes. Cependant, l’association de biomarqueurs à la physiopathologie pourrait garantir leur robustesse, leur reproductibilité et leur utilité comme indicateurs de l’évolution de la maladie.
Par ailleurs, comprendre l’origine des troubles pourrait permettre de faire évoluer les prises en charge symptomatiques vers des traitements ciblés voire étiologiques (Figure 1). Par exemple, des essais thérapeutiques sont menés dans le syndrome de Phelan McDermid à l’origine d’une forme d’autisme avec déficience intellectuelle [27]. Dans le cadre du syndrome de Prader Willi, maladie rare associant troubles du neurodéveloppement et symptômes psychiatriques, le topiramate14 a montré des effets bénéfiques sur les troubles alimentaires et l’impulsivité [28]. Son efficacité et sa tolérance étaient meilleures dans les formes liées à une délétion chromosomique suggérant que le type d’anomalie génétique pourrait influencer le repositionnement de cette molécule. D’autres essais cliniques sont en cours pour certaines maladies génétiques, à l’instar du syndrome du X fragile où une douzaine de molécules ont été essayées en 15 ans [29]. Des essais de thérapie génique à l’aide d’oligonucléotides antisens sont également évalués dans le syndrome d’Angelman, une forme génétique rare d’autisme [30]. Enfin, les traitements immunomodulateurs ont prouvé leur efficacité pour un sous-groupe de patients présentant des troubles psychiatriques liés à des facteurs auto-immuns [31].
Les outils pour construire la psychiatrie de précision
La constitution de grandes cohortes transnosographiques longitudinales
Afin de relever le défi d’une psychiatrie de précision, il est nécessaire d’établir de larges cohortes pour disposer de données suffisantes et ainsi conduire les analyses statistiques nécessaires. Ces cohortes ne doivent pas être centrées sur un trouble défini mais doivent être transnosographiques. En effet, il est prévisible que des va-et-vient entre identification de biomarqueurs et délimitation diagnostique seront nécessaires. Partir avec des a priori basés sur les classifications internationales comporte le risque de négliger des sous-groupes communs à plusieurs troubles. Ces cohortes doivent également inclure des individus indemnes de troubles psychiatriques. En effet, sans comparateur, il est possible que les sous-groupes identifiés dans les cohortes de malades ne fassent que refléter une hétérogénéité existante dans la population générale, sans lien avec le processus physiopathologique.
Idéalement, ces cohortes devraient être longitudinales pour vérifier la stabilité des sous-groupes au cours du temps. Il est en effet possible que la stratification soit liée à des facteurs présents à un instant donné mais amenés à disparaître avec l’évolution des symptômes ou avec l’âge des individus. Ainsi, dans une cohorte d’individus ayant récemment développé une psychose, quatre sous-groupes ont été identifiés [32]. Cependant, la stabilité de ces sous-groupes dans le temps était modérée, ce qui questionne leur validité. Historiquement, on distingue les marqueurs de trait, constants quel que soit le moment de la maladie, et les marqueurs d’état, qui varient en fonction de la présentation clinique. La distinction entre ces deux types de marqueurs est utile : les marqueurs de trait permettraient le diagnostic précoce et le pronostic, alors que les marqueurs d’état aideraient à identifier des cibles thérapeutiques [33].
Les approches multimodales
En l’absence de biomarqueur validé, ces cohortes devraient être multimodales pour capturer un grand nombre de paramètres. Le phénotypage profond est une approche intéressante [34] qui peut s’appuyer sur des hétéro-questionnaires, des auto-questionnaires ou des mesures digitales. Ces mesures digitales peuvent passer par des outils numériques comme des téléphones portables, des montres, des bracelets ou des bagues connectés. L’intérêt de ces outils est qu’ils fournissent des données écologiques, au plus près de la vie de l’individu. Les méthodes d’imagerie sont actuellement très développées qu’il s’agisse de mesures électrophysiologiques ou d’imagerie par résonance magnétique. Dans les grandes cohortes, l’enjeu est d’harmoniser le recrutement et la mesure entre patients pour éviter les effets de sites.
Enfin, les données biologiques constituent une part importante de la caractérisation d’une cohorte. La seule limite est la disponibilité du matériel et les conditions de prélèvement qui doivent être anticipées dès le démarrage de la cohorte. La collecte de fluides biologiques et leur stockage doivent aussi être harmonisés entre les différents sites. L’enjeu est de constituer des biobanques qui centralisent et stockent ces échantillons afin de les analyser ultérieurement. En effet, il est possible de faire des hypothèses a posteriori, c’est-à-dire après que le fluide ait été collecté. Cela permet une souplesse dans l’analyse des marqueurs, pour suivre les évolutions technologiques par exemple. Les méthodes actuelles permettent d’analyser simultanément un grand nombre de variables biologiques : c’est par exemple le cas du séquençage du génome qui étudie l’ensemble du patrimoine génétique, des puces pour étudier la méthylation de l’ADN, et des tests multiplexes pour investiguer un large panel de cytokines. Ces techniques évoluent régulièrement pour permettre de capturer de plus en plus de facteurs avec une résolution de plus en plus fine.
Cette large collecte d’informations, sans hypothèse a priori, doit permettre de faire émerger des sousgroupes à condition de réaliser des analyses statistiques appropriées. L’acquisition de données multimodales pourrait aussi permettre de mieux appréhender la complexité des phénomènes et de mieux comprendre les trajectoires individuelles. Ainsi, cette stratégie pourrait rendre compte de la diversité des expressions symptomatiques à partir d’étiologies identiques.
Les méthodes statistiques
A partir de ces jeux de données reposant sur des cohortes multimodales et transnosographiques, différentes analyses statistiques peuvent être conduites. La méthode la plus courante repose sur une stratification par des analyses en groupes (clusters). Ces méthodes statistiques permettent d’organiser les individus à partir des variables considérées en les regroupant selon leur degré de similitude (Figure 2). L’intérêt de cette approche est qu’il est aisé d’intégrer des données multimodales. En revanche, cela peut rendre la stratification non intelligible pour l’esprit humain. Une revue de la littérature a montré la diversité des données utilisées pour stratifier des individus en vue de développer la médecine de précision [35]. Les troubles neuropsychiatriques étaient parmi les plus étudiés par cette approche, juste derrière la cancérologie. Les données moléculaires étaient les plus utilisées, juste devant des approches intégratives ou cliniques.
 |
Figure 2 À partir d’une population hétérogène (à gauche), les biomarqueurs (données omiques, EEG, IRM, digitales) peuvent permettre d’identifier des ressemblances entre certains patients (au centre). À partir de ces données, il devient alors possible de regrouper les individus selon ces mesures pour créer des sous-groupes homogènes sur le plan biologique (à droite). |
L’un des écueils de ces analyses de groupes est qu’il n’existe pas de moyen infaillible pour déterminer le nombre approprié de sous-groupes. En outre, il est possible que l’organisation en sous-groupe soit valable uniquement dans le jeu de données considéré. Il est donc nécessaire de répliquer les résultats dans une cohorte indépendante ayant mesuré les mêmes paramètres. Cela implique que les différentes cohortes recrutées sur le plan international soient comparables et donc relativement harmonisées entre elles. Une alternative est de réaliser des analyses de type « leave-one-out » qui explorent une partie des patients de la cohorte et testent la réplicabilité des résultats sur le reste de la cohorte.
Plus récemment, des approches nouvelles ont été développées, comme les modèles normatifs. Cette méthode statistique permet de quantifier à quel point une mesure individuelle s’écarte du modèle observé dans une population de référence. Elle s’illustre parfaitement dans les courbes de croissance présentes dans les carnets de santé des enfants. Ainsi, en connaissant la trajectoire normale de la population, il devient possible de repérer les individus qui s’en éloignent et de prédire l’apparition d’une maladie à l’échelle individuelle. Cette stratégie a, par exemple, été appliquée pour prédire le développement d’une maladie d’Alzheimer bien avant le début du trouble [36]. Les modèles normatifs sont particulièrement adaptés pour l’analyse de données multivariées, car ils permettent d’intégrer et d’interpréter des ensembles de données complexes tout en tenant compte de la variabilité interindividuelle et des interactions entre différents niveaux d’organisation biologique [37].
Enfin, des méthodes liées à l’intelligence artificielle sont en plein essor. Le développement des jumeaux numériques est une voie prometteuse [38] (→).
(→) Voir m/s n° 12, 2023, page 953
À partir de données de grandes dimensions, ces algorithmes modélisent un individu [39]. Il devient alors possible de tester l’effet d’un « perturbateur du modèle » (par exemple, un médicament) pour vérifier son comportement [40]. Avec cette approche, la médecine de précision fait un pas supplémentaire vers la personnalisation, c’est-à-dire vers la modélisation d’un individu unique et non plus d’un sous-groupe.
Les barrières à lever pour l’implémentation
Il convient également de lister les difficultés actuelles pour mettre en place une médecine de précision dans le système de soins. En effet, cette approche repose sur la génération de données massives, augmentant le coût des examens complémentaires. Cependant, il convient de nuancer ce risque en prenant en considération la réduction de l’errance diagnostique, la diminution des examens et des prescriptions inutiles, la réduction des effets secondaires et des hospitalisations, qui devraient réduire les dépenses inutiles et optimiser le parcours de soins. Des analyses coût-efficacité et coût-bénéfice seront nécessaires pour répondre à cette objection financière.
En outre, il convient de mesurer l’ampleur des infrastructures à mettre en place pour le stockage et le traitement des données massives ainsi générées. Ces infrastructures devront s’appuyer sur de nouveaux métiers autour de la gestion des données de santé, être sécurisées face aux attaques informatiques et tenir compte des contraintes réglementaires relatives à l’anonymisation et au partage des données issues du soin. La problématique de la conservation des données sur la vie entière de l’individu et leur obsolescence doit également être prise en compte. À ce sujet, des réflexions ont émergé concernant la pharmacogénétique. Il a été proposé que les données génétiques servent à l’établissement d’un passeport individuel qui permettrait de préciser les molécules et les dosages recommandés. Ce passeport pourrait être stocké dans le dossier médical partagé de chaque patient. Or, les connaissances étant en constante évolution, il est probable qu’au fur et à mesure des années, les résultats devront être réanalysés et qu’il faudra alors générer de nouvelles versions du passeport. Une absence de mise à jour pourrait même se traduire par des informations erronées [41].
Enfin, un enjeu éthique émerge concernant l’égalité d’accès à la médecine de précision. Outre la question évidente de l’accessibilité à des technologies avancées dans les différents territoires, certaines analyses permettant la personnalisation des soins n’existent que pour une catégorie de la population. Ce phénomène représente même l’essence d’une médecine de précision qui ambitionne d’identifier des sous-groupes homogènes. Le corollaire est que certains groupes ne bénéficieront pas, au moins dans les premiers temps, de cette amélioration des soins. Cela est particulièrement vrai en génétique, où la plupart des analyses ont jusqu’à présent été réalisées chez des individus d’origine européenne, et où les variants génétiques associés aux différents troubles psychiatriques dans d’autres populations restent largement inconnus [42]. Il faudra garantir que la psychiatrie de précision ne creuse pas les inégalités sanitaires.
Conclusion
Initialement développée pour la cancérologie, la médecine de précision est une voie prometteuse en psychiatrie. De nombreux efforts sont en cours pour permettre le recrutement de larges cohortes transnosographiques avec des explorations multimodales. Avec le PEPR PROPSY, la France y prend sa part [43]. La cohorte French Minds, qui sera recrutée au cours des prochaines années, va fournir un jeu de données essentiel pour rechercher des biomarqueurs et identifier des sous-groupes homogènes de patients.
L’espoir de cette médecine de précision est de pouvoir développer de futures stratégies thérapeutiques. Il est clair que l’approche actuelle, où les patients reçoivent des traitements symptomatiques à l’aveugle, est inefficace dans un nombre significatif de cas. La mise en évidence de sous-groupes est un espoir pour adapter les soins. Au vu de la richesse des paramètres collectés, il pourrait devenir possible d’appréhender chaque individu dans son unicité, aboutissant à une médecine personnalisée, forme extrême de la médecine de précision.
Mais plusieurs questions restent à résoudre. L’exemple de la maladie d’Alzheimer montre que les catégories diagnostiques peuvent être mises à mal par les biomarqueurs. La communauté psychiatrique estelle prête à remettre en cause ses paradigmes à l’aune de la biologie ? Les entités psychiatriques resteront-elles définies par des regroupements symptomatiques ou se définiront-elles dorénavant par des paramètres biologiques ? Si les maladies psychiatriques sont extrêmement hétérogènes, sommes-nous prêts à assumer cette complexité et à démembrer les différents troubles en centaines de maladies différentes ? Accepterons-nous que les biomarqueurs n’expliquent qu’une fraction des cas, laissant cohabiter plusieurs nomenclatures ? Ces questions sont devant nous, mais elles sont peut-être la contrepartie de l’amélioration des soins.
Remerciements
Nous tenons à remercier le groupe des « French Minders » qui enrichit la discussion sur la psychiatrie de précision et aide à construire la future cohorte du PEPR PROPSY. Ce travail a bénéficié d’une aide de l’État gérée par l’Agence nationale de la recherche au titre de France 2030 portant la référence ANR-22-EXPR-0001 (France 2030).
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
Références
- Perlman RL, Govindaraju DR, Garrod AE. The father of precision medicine. Genet Med 2016 ; 18 : 1088–9. [CrossRef] [PubMed] [Google Scholar]
- Giroux E, Gansel Y, Basbous L, et al. Oncologie et psychiatrie : pour une relation réciproque féconde. Med Sci (Paris) 2022 ; 38 : 381–6. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Fernandes B, Williams L, Steiner J, et al. The new field of precision psychiatry. BMC Med 2017 ; 15 : 80. [CrossRef] [PubMed] [Google Scholar]
- Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther 2001 ; 69 : 89–95. [CrossRef] [PubMed] [Google Scholar]
- Demazeux S, Pidoux V. Le projet RDoC : la classification psychiatrique de demain ? Med Sci (Paris) 2015 ; 31 : 792–6. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Williams L, Carpenter W, Carretta C, et al. Precision psychiatry and research domain criteria: implications for clinical trials and future practice. CNS Spectr 2024 ; 29 : 26–39. [CrossRef] [PubMed] [Google Scholar]
- Cuthbert Bruce, Thomas Insel. Toward the future of psychiatric diagnosis: the seven pillars of RDoC ». BMC Med 2013 ; 11 : 126. [CrossRef] [PubMed] [Google Scholar]
- Sanislow Charles, Daniel Pine, Kevin Quinn, et al. Developing constructs for psychopathology research: research domain criteria ». J Abnorm Psychol 2010 ; 119 : 631–9. [CrossRef] [PubMed] [Google Scholar]
- Sensorimotor Domain Added to the RDoC Framework - National Institute of Mental Health (NIMH). 2019. https://www.nimh.nih.gov/news/science-news/2019/sensorimotor-domain-added-to-the-rdoc-framework [Google Scholar]
- Cuthbert B. Le cadre de travail des RDoC : faciliter la transition de la CIM et du DSM vers des approches dimensionnelles qui intègrent les neurosciences et la psychopathologie. Ann Med-Psychol 2021 ; 179 : 75–85. [Google Scholar]
- RDoC Matrix. National Institute of Mental Health (NIMH). s.d. Consulté le 27 décembre 2024. https://www.nimh.nih.gov/research/research-funded-by-nimh/rdoc/constructs/rdoc-matrix [Google Scholar]
- Hakak-Zargar B, Tamrakar A, Voth T, et al. The utility of research domain criteria in diagnosis and management of dual disorders: a mini-review. Front Psychiatry 2022 ; 13 : 805163. [CrossRef] [PubMed] [Google Scholar]
- Leucht S, Hierl S, Kissling W, et al. Putting the efficacy of psychiatric and general medicine medication into perspective: review of meta-analyses. Br J Psychiatry 2012 ; 200 : 97–106. [CrossRef] [PubMed] [Google Scholar]
- Siskind D, Orr S, Sinha S, et al. Rates of treatment-resistant schizophrenia from first-episode cohorts: systematic review and meta-analysis. Br J Psychiatry 2022 ; 220 : 115–20. [CrossRef] [PubMed] [Google Scholar]
- McIntyre R, Alsuwaidan M, Bernhard T, et al. Treatment resistant depression: definition, prevalence, detection, management, and investigational interventions. World Psychiatry 2023 ; 22 : 394–412. [CrossRef] [PubMed] [Google Scholar]
- Lenze E, Nicol G, Barbour D, et al. Precision clinical trials: a framework for getting to precision medicine for neurobehavioural disorders. J Psychiatry Neurosci 2021 ; 46 : E97–110. [CrossRef] [PubMed] [Google Scholar]
- Salazar de Pablo G, Studerus E, Vaquerizo-Serrano J, et al. Implementing precision psychiatry: a systematic review of individualized prediction models for clinical practice. Schizophr Bull 2021 ; 47 : 284–97. [CrossRef] [PubMed] [Google Scholar]
- Mcgorry P. Stage-specific treatment of psychotic disorders. Psychiatric Times 2020 ; 37 : 6. [Google Scholar]
- Di Lisi A, Pupo S, Menchetti M, et al. Antipsychotic treatment in people at clinical high risk for psychosis. J Clin Psychopharmacol 2024 ; 44 : 502–8. [CrossRef] [PubMed] [Google Scholar]
- Delaby C, Lehmann S. Vers un diagnostic biologique sanguin de la maladie d’Alzheimer ? Med Sci (Paris) 2024 ; 40 : 351–60. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Leblond C, Rolland T, Barthome E, et al. A genetic bridge between medicine and neurodiversity for autism. Annu Rev Genet 2024 ; 58 : 487–512. [CrossRef] [PubMed] [Google Scholar]
- Gilgenkrantz H. La pléiotropie antagoniste et le paradoxe de la sénescence. Med Sci (Paris) 2025 ; 41 : 68. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Chaumette B, Ferrafiat V, Ambalavanan A, et al. Missense variants in ATP1A3 and FXYD gene family are associated with childhood-onset schizophrenia. Mol Psychiatry 2020 ; 25 : 821–30. [CrossRef] [PubMed] [Google Scholar]
- Balestrini S, Mikati M, Álvarez-García-Rovés R, et al. Cardiac phenotype in ATP1A3-related syndromes: a multicenter cohort study. Neurology 2020 ; 95 : e2866–79. [CrossRef] [PubMed] [Google Scholar]
- Louveau C, Ellul P, Iftimovici A, et al. Neurodevelopmental disorders (NDD) without boundaries: research and interventions beyond classifications. J Neural Transm (Vienna) 2023 ; 130 : 473–9. [CrossRef] [PubMed] [Google Scholar]
- Tamminga CA, Pearlson G, Keshavan M, et al. Bipolar and schizophrenia network for intermediate phenotypes: outcomes across the psychosis continuum. Schizophr Bull 2014 ; 40 : S131–7. [CrossRef] [PubMed] [Google Scholar]
- Dyar B, Meaddough E, Sarasua S, et al. Genetic findings as the potential basis of personalized pharmacotherapy in phelan-McDermid syndrome. Genes 2021 ; 12 : 1192. [CrossRef] [PubMed] [Google Scholar]
- Louveau C, Turtuluci MC, Consoli A, et al. Prader-Willi syndrome: symptoms and topiramate response in light of genetics. Front Neurosci 2023 ; 17 : 1126970. [CrossRef] [PubMed] [Google Scholar]
- Berry-Kravis E, Lindemann L, Jønch A, et al. Drug development for neurodevelopmental disorders: lessons learned from fragile X syndrome. Nat Rev Drug Discov 2018 ; 17 : 280–99. [CrossRef] [PubMed] [Google Scholar]
- Keary C, McDougle C. Current and emerging treatment options for Angelman syndrome. Expert Rev Neurother 2023 ; 23 : 835–44. [CrossRef] [PubMed] [Google Scholar]
- Pollak T, Lennox B, Müller S, et al. Autoimmune psychosis: an international consensus on an approach to the diagnosis and management of psychosis of suspected autoimmune origin. Lancet Psychiatry 2020 ; 7 : 93–108. [CrossRef] [PubMed] [Google Scholar]
- Koutsouleris N, Buciuman MO, Vetter CS, et al. Distinct multimodal biological and functional profiles of symptom-based subgroups in recent-onset psychosis. Research Square 2024 ; mars, rs.3.rs-3949072 (preprint). [PubMed] [Google Scholar]
- Lema Y, Gamo N, Yang K, Ishizuka K. Trait and state biomarkers for psychiatric disorders: importance of infrastructure to bridge the gap between basic and clinical research and industry. Psychiatry Clin Neurosci 2018 ; 72 : 482–9. [CrossRef] [PubMed] [Google Scholar]
- Passos IC, Ballester B, Rabelo-da-Ponte FD, et al. Precision psychiatry: the future is now. Can J Psychiatry 2022 ; 67 : 21–5. [CrossRef] [PubMed] [Google Scholar]
- Parimbelli E, Sacchi M, Bellazzi R. Patient similarity for precision medicine: a systematic review. J Biomed Inform 2018 ; 83 : 87–96. [CrossRef] [PubMed] [Google Scholar]
- Koval I, Bône A, Louis M, et al. AD course map charts Alzheimer’s disease progression. Sci Rep 2021 ; 11 : 8020. [CrossRef] [PubMed] [Google Scholar]
- Marquand A, Rezek I, Buitelaar J, al. Understanding heterogeneity in clinical cohorts using normative models: beyond case-control studies. Biol Psychiatry 2016 ; 80 : 552–61. [CrossRef] [PubMed] [Google Scholar]
- Dumas M, Fay AF, Charpentier E, et al. Le jumeau numérique en santé : état des lieux et perspectives d’application à l’hôpital. Med Sci (Paris) 2023 ; 39 : 953–57. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Spitzer M, Dattner I, Zilcha-Mano S. Digital twins and the future of precision mental health. Front Psychiatry 2023 ; 14 : 1082598. [CrossRef] [PubMed] [Google Scholar]
- Wickramasinghe N, Ulapane N, Sloane E, et al. Digital twins for more precise and personalized treatment. Stud Health Technol Inform 2024 ; 310 : 229–33. [PubMed] [Google Scholar]
- Verstuyft C, Dewolf D, Blin O, et al. How to facilitate the wider use of pharmacogenetic tests? Therapie 2024 ; décembre, S0040-5957(24)00215-4. [Google Scholar]
- Lewis C, Vassos E. Polygenic risk scores: from research tools to clinical instruments. Genome Med 2020 ; 12 : 44. [CrossRef] [PubMed] [Google Scholar]
- PROPSY - Programme-Projet en Psychiatrie de Précision. s. d. Agence Nationale de la Recherche. Consulté le 27 décembre 2024. https://anr.fr/en/france-2030/programmes-et-equipements-prioritaires-de-recherchepepr/propsy-psychiatrie-de-precision/ [Google Scholar]
Liste des figures
 |
Figure 1 Une même anomalie génétique peut être associée à plusieurs troubles différents et un même trouble peut être lié à plusieurs anomalies distinctes. Les traitements actuels sont essentiellement symptomatiques mais la connaissance de la physiopathologie pourrait aboutir à développer des traitements spécifiques, par exemple centrés sur l’anomalie. |
| Dans le texte | |
 |
Figure 2 À partir d’une population hétérogène (à gauche), les biomarqueurs (données omiques, EEG, IRM, digitales) peuvent permettre d’identifier des ressemblances entre certains patients (au centre). À partir de ces données, il devient alors possible de regrouper les individus selon ces mesures pour créer des sous-groupes homogènes sur le plan biologique (à droite). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




