| Issue |
Med Sci (Paris)
Volume 41, Number 5, Mai 2025
Enjeux et objectifs de la psychiatrie de précision
|
|
|---|---|---|
| Page(s) | 500 - 507 | |
| Section | La psychiatrie de précision (PEPR PROPSY) : premiers succès | |
| DOI | https://doi.org/10.1051/medsci/2025061 | |
| Published online | 26 May 2025 | |
Imagerie cérébrale et premiers succès de la psychiatrie de précision
Brain imaging and the first success of precision psychiatry
1
Université Paris Est Créteil, Institut Mondor de la Recherche Biomédicale, Assistance Publique des Hôpitaux de Paris, France
2
Fondation FondaMental, France
3
Unité de Neuromodulation, Pôle Universitaire 93G03, EPS Ville Evrard, Neuilly-sur-Marne, France
4
Université de Franche-Comté, Inserm UMR 1322 LINC, service de psychiatrie de l’adulte, CIC-1431 CHU de Besançon, France
5
Institut de neuromodulation, GHU Paris, psychiatrie et neurosciences, centre hospitalier Sainte-Anne, pôle hospitalo-universitaire 15, Université Paris Cité, Paris, France
6
Université Paris Saclay, Centre Neurospin CEA Paris-Saclay, UMR 992, France
7
Centre de recherche en neuroscience de Lyon (CRNL), Inserm U1028, CNRS UMR 5292, Université Lyon 1, Université Jean Monnet St-Étienne et CHU Saint-Étienne, France
8
Université Paris Cité, Institut de psychiatre et neuroscience de Paris (IPNP), Inserm U1266, Paris, France . GHU-Paris Psychiatrie et Neurosciences, Hôpital Sainte-Anne, Paris, France
9
Pôle de Psychiatrie, Assistance Publique Hôpitaux de Marseille, Marseille, France, Institut de Neurosciences de la Timone, Université d’Aix-Marseille, UMR 7289 CNRS, France
10
Université de Grenoble Alpes, Inserm U1216, CHU Grenoble Alpes, Institut Neurosciences de Grenoble, France
11
Centre de Recherche en Neurosciences de Lyon (CRNL), Inserm U1028, CNRS UMR5292, Université Claude-Bernard Lyon 1, Bron, France
12
Université de Nantes, CHU Nantes, motricité-interactions-performance (MIP), UR 4334, Nantes, France
13
Université de Lille, Inserm U1172, CHU Lille, centre de recherche Lille Neurosciences et Cognition, plateforme CURE, hôpital Fontan, Lille, France
14
Université Paris-Saclay, Neurospin, CEA, UNIACT Lab, PsyBrain Team, F-91191 Gif-sur-Yvette, France
L’imagerie par rés onance magnétique (IRM) permet d’étudier les bases neurobiologiques de maladies psychiatriques comme la schizophrénie, les troubles bipolaires, les troubles du spectre autistique ou encore les dépressions résistantes. Si des différences d’épaisseur corticale entre les patients souffrant de ces maladies et les personnes témoins ont pu être mises en évidence de façon robuste, il n’existe actuellement pas de biomarqueur des maladies psychiatriques reposant sur l’IRM. Un des enjeux de la psychiatrie de précision est de valider de tels biomarqueurs, propres à une maladie ou à une dimension clinique donnée, mais également capables de prédire l’évolution clinique ou la réponse à un traitement pour transformer la prise en charge des patients. L’IRM fonctionnelle pourrait également constituer un outil prometteur pour le ciblage individualisé de stimulations non-invasives dans les dépressions ou les hallucinations résistantes, ainsi que pour l’entraînement par neurofeedback.
Abstract
Magnetic resonance imaging (MRI) can be used to investigate the neurobiological basis of psychiatric disorders such as schizophrenia, bipolar disorders, autism spectrum disorders and resistant depression. Although differences in cortical thickness between patients and controls have been well demonstrated, there is currently no valid MRI-based biomarker for psychiatric disorders. The challenge of precision psychiatry is to develop biomarkers, that are specific for a given pathology or clinical dimension, but also capable of predicting clinical evolution or response to treatment, to transform patient management. Functional magnetic resonance imaging could also be a promising tool for the individualized targeting of non-invasive neuromodulation in depression or resistant hallucinations, as well as for functional magnetic resonance imaging-based neurofeedback.
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© AdobeStock)
En France, neurologie et psychiatrie ont longtemps été considérées comme une seule et même spécialité, la neuropsychiatrie. La scission entre les deux disciplines n’a eu lieu qu’en 1968 et elle reposait sur l’absence de substrat organique dans les maladies psychiatriques [1]. Si la réunion de ces deux spécialités n’est pas à l’ordre du jour, les travaux d’imagerie cérébrale en psychiatrie remettent largement en cause le dogme de l’absence de substrat biologique dans les maladies mentales. L’imagerie cérébrale en psychiatrie est encore aujourd’hui principalement utilisée pour exclure un diagnostic différentiel1 ou détecter une cause non-psychiatrique associée à l’émergence de manifestations psychiatriques [2], telles qu’un processus expansif intracrânien ou neuro-inflammatoire par exemple (voir à ce sujet, le bilan PREDIPSY2 réalisé dans le premier épisode psychotique), mais désormais, elle constitue aussi un outil de recherche à même de mieux comprendre et traiter les troubles mentaux. La compréhension des maladies psychiatriques par l’imagerie cérébrale permet de changer le regard porté par la société, des patients et de leurs familles, sur des manifestations subjectives jusque-là extrêmement difficiles à objectiver. C’est par exemple le cas des expériences hallucinatoires désormais visualisables en imagerie par résonance magnétique fonctionnelle (IRMf)3 [3], ce qui permet d’amorcer un travail d’éducation sur l’origine des voix perçues et ultérieurement de réviser certaines croyances associées dans le cadre d’un processus psychothérapeutique [4]. L’absence de mise en évidence de substrat organique a longtemps été un argument pour considérer que les maladies psychiatriques n’étaient pas tout à fait des maladies comme les autres. L’imagerie cérébrale contribue donc à déstigmatiser ces expériences souvent présentées dans les médias de masse comme irrationnelles et ainsi à lutter contre de nombreuses idées reçues entourant la santé mentale et la psychiatrie en général.
Si, à ce jour, il n’existe pas de biomarqueur pour les maladies psychiatriques (et cela constitue l’un des objectifs majeurs de la psychiatrie de précision), de nombreux traitements pharmacologiques et psychothérapeutiques ont démontré leur efficacité, malgré un certain effet de plafonnement [5]. La prescription de ces traitements repose sur des recommandations de bonnes pratiques peu individualisées, et il reste difficile de déterminer a priori le(s) traitement(s) et la(les) stratégie(s) thérapeutique(s) qui s’avérera(ront) le plus efficaces pour un individu donné sur la simple base de son phénotype clinique. L’approche séquentielle (en essai/erreur) de différentes interventions thérapeutiques prend souvent du temps, puisqu’il est nécessaire d’attendre plusieurs semaines afin de pouvoir correctement évaluer la réponse aux traitements antipsychotiques ou antidépresseurs. L’imagerie cérébrale pourrait constituer un outil de choix dans la personnalisation de ces algorithmes thérapeutiques [6], mais aussi dans le développement de nouveaux outils de détermination de cibles d’action pour des traitements par neuromodulation, comme la stimulation cérébrale non-invasive ou le neurofeedback.
Enjeux et limites des approches populationnelles en imagerie psychiatrique
Les vingt dernières années ont été marquées par la publication de nombreuses études de comparaison de cas-témoins dans les maladies psychiatriques. La taille des échantillons, initialement faible, a progressivement été augmentée permettant une meilleure reproductibilité des résultats. Les études du consortium international ENIGMA4 (enhancing neuroimaging genetics through meta-analysis) [7], piloté par Paul Thompson (Université de Californie du Sud, États-Unis), ont ainsi permis de réaliser des méga-analyses de données d’imagerie cérébrale regroupant plusieurs centaines de patients et de témoins. Ces études ont permis de mettre en évidence des modifications de l’épaisseur corticale dans diverses maladies psychiatriques (Figure 1). Par exemple, les individus souffrant de schizophrénie présentent une diminution diffuse de l’épaisseur corticale, plus marquée dans les cortex associatifs. Les patients souffrant d’un trouble bipolaire présentent le même motif de diminution de l’épaisseur corticale, mais de façon moins marquée que dans la schizophrénie, ce qui pourrait laisser supposer l’existence d’une continuité entre schizophrénie et trouble bipolaire. À l’inverse, les individus présentant un trouble du spectre de l’autisme (TSA) présentent une augmentation de l’épaisseur corticale prédominante au niveau préfrontal.
 |
Figure 1 Épaisseur corticale mesurée au sein de neuf populations de patients en comparaison à des populations témoins. Les tailles d’effets négatives indiquent une diminution de l’épaisseur corticale chez les patients par rapport aux sujets témoins, les tailles d’effets positives indiquent une augmentation de l’épaisseur corticale chez les patients par rapport aux sujets témoins. MDD : épisode dépressif majeur ; OCD: trouble obsessionnel compulsif ; BD : trouble bipolaire ; ADHD : trouble déficitaire de l’attention avec hyperactivité ; Schizophrenia : schizophrénie ; ASD : trouble du spectre de l’autisme ; Alcohol Use Disorder : trouble de l’usage de l’alcool ; Epilepsy : épilepsie ; 22q11DS : microdélétion 22q11 ; Cohen’s d : taille d’effet de Cohen (reproduction de [7] — © CC-BY 4.0). |
Ces méga-analyses ont également concerné d’autres maladies fréquemment associées à des phénotypes psychiatriques. Par exemple, c’est le cas du syndrome de microdélétion 22q11.2, une maladie multisystémique rare touchant 1 enfant sur 4 000 naissances (survenant de novo dans 90 % des cas). La zone de délétion peut porter sur 35 à 60 gènes, dont plusieurs sont fréquemment retrouvés associés à la psychose (e.g., COMT [catechol-O-méthyltransférase], PRODH [proline dehydrogenase], DGCR8 [DiGeorge syndrome critical region 8]), faisant de cette maladie le deuxième facteur de risque de schizophrénie après le degré de parenté [8]. 30 % à 40 % de ces patients porteurs du 22q11DS vont en effet présenter un tableau de transition psychotique à l’adolescence [9]. Dans une étude du consortium ENIGMA-CNV (copy number variant) ayant colligé les données IRM et génétiques de 474 patients porteurs du 22q11DS + et 375 témoins appariés, une réduction de l’épaisseur corticale temporale et cingulaire a été mise en évidence dans le groupe clinique, et la réduction de surface fronto-temporale, également mise en évidence, était similaire aux résultats obtenus à partir des données ENIGMA-schizophrénie. La surface mesurée dans ces régions cérébrales était inversement proportionnelle à la taille de la microdélétion [10].
Malgré des données de plus en plus robustes, le transfert de ces résultats, obtenus à l’échelle des populations, vers des applications cliniques à l’échelle de l’individu, peine à émerger. La taille d’effet des modifications de l’épaisseur corticale reste modeste dans plusieurs maladies. Si la prédiction du diagnostic (patients vs témoins) en utilisant l’intelligence artificielle (et plus précisément des outils d’apprentissage automatisé)5 semble prometteuse, notamment pour l’étude de la schizophrénie [11], à ce jour, il n’est toujours pas possible de discriminer différentes maladies psychiatriques ou d’en prédire l’évolution. Nous pouvons regrouper les freins actuels en la matière en trois catégories principales : 1) des limites liées à la nosographie psychiatrique6 actuelle, 2) des limites propres aux techniques d’imagerie utilisées, et enfin 3) des limites inhérentes aux outils d’analyse disponibles.
La nosographie7 actuelle, basée par exemple sur les versions successives du manuel diagnostique et statistique des troubles mentaux américain (DSM, diagnostic and statistical manual of mental disorders), est catégorielle. En pratique clinique, les comorbidités psychiatriques sont très fréquentes, ce qui limite la portée des études catégorielles en imagerie puisqu’un individu donné peut présenter les critères de plusieurs catégories diagnostiques. Ces limites ont conduit à l’élaboration du modèle des RDoC (research domain criteria) dont l’objectif était d’étudier les bases neurobiologiques de dimensions trans-diagnostiques, mais dont l’implémentation reste aujourd’hui encore limitée et parfois critiquée [12] (→).
(→) Voir m/s n° 8-9, 2015, page 792
La collecte et l’analyse de données d’IRM cérébrale, notamment d’IRM fonctionnelle, restent techniquement difficiles et sujettes à de nombreux biais. Par exemple, les mouvements de la tête d’un individu durant l’acquisition constituent un facteur confondant [46] (→) important en imagerie cérébrale et la manière optimale de les prendre en compte ne fait toujours pas l’objet d’un consensus clair. De même, la durée d’une acquisition en IRM fonctionnelle, à même de fournir des données fiables permettant d’extraire des cartes de connectivité stables et reproductibles, est souvent sous-estimée et le temps d’examen recommandé tend à augmenter au fil des années [13]. Enfin, les méthodes d’analyses statistiques linéaires classiquement utilisées pour comparer des groupes de patients à des sujets témoins ne semblent pas capter de façon optimale l’hétérogénéité des maladies psychiatriques. Ces modèles linéaires généralisés reposent sur des hypothèses statistiques précises pour garantir leur validité. Parmi ces hypothèses, celle d’une variance homogène dans les échantillons de patients et de témoins permet de tracer une frontière de séparation optimale entre les groupes. Cependant, cette hypothèse est souvent mise en défaut en psychiatrie du fait des différences structurelles et/ou fonctionnelles complexes pouvant exister entre les populations étudiées. L’avènement plus récent des méthodes multivariées a permis d’affiner les performances de détection de motifs fonctionnels d’intérêt en imagerie psychiatrique, notamment en permettant de s’affranchir de l’ajustement des valeurs-p (p values) pour corriger le problème de comparaisons multiples inhérent aux modèles linéaires massivement univariés. Des modèles normatifs ont également été conçus pour identifier les déviations individuelles par rapport à une normale attendue au sein d’un groupe cible (pouvant par exemple être défini par l’âge), plutôt que de comparer les patients à des témoins [14].
(→) Voir m/s n° 4, 2024, page 381
Quels biomarqueurs en imagerie psychiatrique ? L’exemple du ciblage thérapeutique par IRM fonctionnelle
Un biomarqueur se définit classiquement comme une mesure objective et reproductible, pouvant être caractéristique et/ou prédictive : 1) du fonctionnement biologique ou physiologique normal, mais aussi, 2) d’un processus pathogène (de manière diagnostique ou pronostique), ou 3) d’une réponse thérapeutique [15]. La validité d’un biomarqueur doit pouvoir se mesurer à sa forte sensibilité et à sa spécificité (avec, entre autres, une valeur prédictive positive > 80 % pour envisager une application en clinique), mais idéalement, il devrait aussi pouvoir être utilisable de manière simple et être peu coûteux. Les premières tentatives de développement de biomarqueurs en imagerie psychiatrique se sont basées sur des mesures anatomiques, reflétant la plasticité (e.g., épaisseur corticale) ou la vulnérabilité développementale (e.g., motifs de sillons corticaux, malrotation hippocampique8). L’avènement des méthodes d’apprentissage statistique appliquées aux données massives a progressivement permis de développer des outils de prédiction diagnostique à partir de données anatomiques [11, 16], dont la généralisation reste encore aujourd’hui un enjeu majeur de la recherche. Cependant, récemment, cela a également permis de montrer des performances raisonnables de prédiction du risque de conversion psychotique à 1 an chez des sujets à haut-risque grâce à des mesures de connectivité fonctionnelle de repos [17]. Cette recherche a récemment aussi été revigorée par la possibilité de définir des entités clinico-biologiques plus homogènes par l’utilisation de méthodes guidées par les données (i.e., stratification basée sur les biotypes9) [18]. Dans ce cas, les méthodes d’apprentissage automatisé permettent de découvrir de nouveaux sous-groupes de patients en se basant, par exemple, sur l’imagerie cérébrale. Dans cet article, nous avons fait le choix de nous focaliser sur le développement de biomarqueurs thérapeutiques en psychiatrie. Le champ de la prédiction de la réponse aux traitements médicamenteux est également prometteur [19], mais nous développerons ici surtout les biomarqueurs de ciblage d’une zone à traiter, à travers deux exemples utilisant la neuromodulation guidée par imagerie par résonance magnétique fonctionnelle : 1) la dépression résistante, et 2) la schizophrénie avec hallucinations pharmaco-résistantes.
La stimulation magnétique transcrânienne (TMS — transcranial magnetic stimulation) est une méthode de neuromodulation non-invasive qui présente un intérêt dans le traitement de la dépression résistante ou des hallucinations résistantes [20]. Une variation du courant électrique dans la bobine de la stimulation magnétique transcrânienne permet de délivrer une impulsion magnétique qui entraîne une impulsion électromagnétique à même de traverser les différentes couches tissulaires depuis le scalp, pour se transformer en courant électrique au contact du cerveau (qui est un tissu polarisé). Appliquée de manière focale et répétitive, cette stimulation permet de modifier de manière durable le taux de décharges neuronales au niveau de la cible corticale sous-jacente [21]. Ce phénomène de potentialisation ou de dépression à long-terme (i.e., activation ou inhibition respectivement) semble être à l’origine de l’effet thérapeutique de la stimulation magnétique transcrânienne répétitive [22]. L’avènement des méthodes de neuronavigation s’appuyant sur l’utilisation de différents marqueurs d’imagerie par résonance magnétique a permis de progressivement améliorer le ciblage en stimulation magnétique transcrânienne, en visualisant précisément la zone stimulée au cours des séances [23], et par là-même a permis d’améliorer le niveau de réponse thérapeutique obtenu dans la dépression et les hallucinations résistantes. Mais comment ces cibles corticales sont-elles définies ?
Cible cérébrale personnalisée dans le traitement de la dépression
De nombreux travaux d’imagerie cérébrale (qu’ils soient en tomographie par émission de positons [TEP] ou en imagerie par résonance magnétique fonctionnelle — IRMf) ont conduit à l’hypothèse d’un hypométabolisme du cortex préfrontal dorsolatéral gauche (DLPFC — dorsolateral prefrontal cortex) dans la dépression. En appliquant de la stimulation magnétique transcrânienne répétitive sur le cortex préfrontal dorsolatéral gauche, délivrée à haute fréquence (10 Hz ou plus), c’est-à-dire, avec un effet activateur, il serait possible de corriger partiellement cet hypométabolisme et d’améliorer les symptômes de dépression. Mais comme le cortex préfrontal dorsolatéral gauche représente environ 25 % de la surface du cortex préfrontal, il existe en réalité une multitude de cibles potentielles, la stimulation magnétique transcrânienne répétitive (rTMS) ne permettant de moduler l’excitabilité corticale que sur quelques cm². Plusieurs études rétrospectives internationales [24–27], ainsi que des travaux réalisés par des équipes françaises (Figure 2), ont mis en évidence une association entre la connectivité fonctionnelle de repos du cortex préfrontal dorsolatéral gauche10 et l’efficacité de la stimulation magnétique transcrânienne répétitive dans la dépression résistante. C’est plus précisément la connectivité fonctionnelle entre le cortex cingulaire antérieur subgénual (SgACC) — une région plus profonde impliquée dans la dépression résistante — et le cortex préfrontal dorsolatéral gauche qui semble jouer un rôle dans la réponse au traitement par neuromodulation. Plus la région ciblée au sein du cortex préfrontal dorsolatéral gauche était anti-corrélée avec le cortex cingulaire antérieur subgénual, plus le traitement par stimulation magnétique transcrânienne semblait efficace. Ces travaux rétrospectifs ont ainsi ouvert la voie à un ciblage personnalisé à même de définir la zone du cortex préfrontal dorsolatéral gauche la plus anti-corrélée avec le cortex cingulaire antérieur subgénual afin d’améliorer la réponse à la stimulation magnétique transcrânienne répétitive dans le traitement de la dépression résistante.
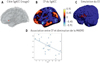 |
Figure 2 A. Position du cortex cingulaire antérieur subgénual (SgACC). B. Connectivité fonctionnelle (CF) du cortex cingulaire antérieur subgénual. Le code couleur représente l’intensité de la connectivité fonctionnelle, positive (couleurs chaudes), ou négative (couleurs froides). C. Simulation du champ électrique induit (CE) par stimulation magnétique transcrânienne répétitive (rTMS) au niveau du cortex préfrontal dorsolatéral gauche (DLPFC). Le code couleur représente la diffusion corticale de l’effet neuromodulateur autour de la cible. D. Rôle de la connectivité SgACC — DLPFC dans l’efficacité de la rTMS sur la dépression mesurée par l’échelle Montgomery-Åsberg Depression Rating Scale (MADRS). Plus la connectivité fonctionnelle entre la cible stimulée et le SgACC est importante, plus le score de dépression diminue après traitement. |
Ce ciblage personnalisé a récemment été utilisé par l’équipe de Williams [28, 29] et semble avoir permis d’améliorer significativement l’efficacité de la stimulation magnétique transcrânienne répétitive dans le traitement de la dépression résistante (essai SNT — Stanford neuromodulation therapy). Les auteurs rapportent, d’abord dans une étude ouverte [28], puis dans un essai randomisé contre placebo [29], les résultats d’une cure de stimulation haute fréquence ciblant de façon individualisée la zone du cortex préfrontal dorsolatéral gauche la plus anti-corrélée avec le cortex cingulaire antérieur subgénual. Cette innovation en terme de ciblage était par ailleurs combinée avec une intensification du nombre de séances quotidiennes de stimulation magnétique transcrânienne (10 séances, contre une ou deux séance(s) dans les protocoles classiques), si bien qu’il reste encore difficile à ce jour de savoir si le taux de rémission particulièrement élevé dans l’étude randomisée (57 % de rémission après 5 jours de traitement pour 84 % de répondeurs [29]) est lié au ciblage personnalisé, à l’augmentation du nombre de séances par jour, voire même à d’autres facteurs (sélection des patients ou adaptation individuelle de la dose de stimulation magnétique transcrânienne).
La reproductibilité de la méthode de ciblage est également difficile à évaluer puisque l’algorithme de ciblage n’a pas été publié. Dans un souci de science ouverte, un algorithme libre de droit et permettant de déterminer cette cible optimale de stimulation a récemment été publié par une autre équipe [30]. Un essai randomisé indépendant comparant l’effet d’une méthode de ciblage personnalisé comparée à la méthode conventionnelle pourrait permettre de confirmer l’intérêt d’un ciblage basé sur la connectivité fonctionnelle de repos entre le cortex préfrontal dorsolatéral gauche et le cortex cingulaire antérieur subgénual. Une telle approche a été récemment utilisée pour évaluer la supériorité d’un autre ciblage personnalisé qui utilisait cette fois-ci la connectivité entre l’insula et le cortex préfrontal [31], mais cet essai s’est avéré négatif.
Cible cérébrale personnalisée dans le traitement des hallucinations
Depuis l’étude princeps de Ralph Hoffman [32] qui pr opose une stimulation magnétique transcrânienne répétitive à basse fréquence de la jonction temporopariétale gauche via un repérage, au niveau du scalp, utilisant le positionnement des électrodes d’un électro-encéphalogramme11 (i.e., la cible « T3-P3 », en regard de l’aire de Wernicke12), pour réduire la sévérité des hallucinations acoustico-verbales (HAV), plusieurs essais ont tenté de répliquer ce résultat, avec plus ou moins de succès. La taille d’effet composite (le résultat d’une méta-analyse) initialement surestimée de la stimulation magnétique transcrânienne répétitive à 1 Hz de la cible T3-P3 dans le traitement des hallucinations acoustico-verbales est aujourd’hui calculée à 0,4 [33, 34], soit un effet faible, laissant la place à des améliorations possibles, notamment en termes de personnalisation de la cible corticale à stimuler. Le substratum anatomo-fonctionnel des hallucinations est peu réductible à une aire anatomique, fût-elle impliquée dans la perception de la parole. La jonction temporo-pariétale gauche présente bien des modifications structurales en lien avec la sévérité des symptômes psychotiques, notamment hallucinatoires [35], mais la variabilité individuelle observée lors de la sollicitation du réseau du langage reste importante, que ce soit en conditions physiologiques [36], comme lors des mesures d’imagerie par résonance magnétique fonctionnelle per-hallucinatoires reflétant souvent le contenu phénoménologique variable de l’expérience [37]. Ces illustrations laissent entrevoir les limites d’une neuronavigation purement anatomique (c’est-à-dire un ciblage basé sur l’imagerie par résonance magnétique structurale), qui certes présente l’avantage de prendre en compte les caractéristiques morphologiques temporo-pariétales propres au sujet, et de surveiller le ciblage pendant la séance, mais qui ne constitue qu’une piètre personnalisation du traitement des hallucinations acoustico-verbales, les aires activées variant fortement d’un participant à un autre. Les progrès récents de l’imagerie fonctionnelle de capture hallucinatoire ouvrent de ce point de vue une alternative intéressante de ciblage par neuronavigation.
Il est en effet possible de déterminer les régions activées lors de la survenue d’une hallucination acoustico-verbale en imagerie par résonance magnétique fonctionnelle grâce aux paradigmes de capture de symptômes (pour une méta-analyse, voir [38]). Une première méthode se base sur la participation active du sujet halluciné, qui doit appuyer sur un bouton au début de l’hallucination et le relâcher à l’extinction de cette expérience pendant l’acquisition [39]. Ces méthodes, dites « directes », ont été critiquées du fait de l’implication trop forte (voire exclusive) de la dynamique motrice parmi les réseaux identifiés [40]. Une alternative repose sur le rapport différé des expériences hallucinatoires survenues pendant l’acquisition en imagerie par résonance magnétique fonctionnelle. Cette méthode « indirecte » (en deux temps), s’appuie sur une analyse guidée par les données, couplée à un entretien immédiat post-imagerie par résonance magnétique fonctionnelle avec la personne hallucinée, permettant de sélectionner les composantes d’intérêts partageant des propriétés spatio-temporelles communes avec la description des hallucinations acoustico-verbales [41]. Ces méthodes de capture ont récemment pu être automatisées par apprentissage supervisé et répliquées sur des échantillons indépendants tout en garantissant de bonnes performances de détection [42], ouvrant ainsi la voie à une utilisation en pratique courante (notamment en temps-réel) pour déterminer des cibles à neuromoduler (Figure 3). Après quelques preuves de concept issues de séries de cas [43], un essai contrôlé randomisé bi-centrique a été lancé en France pour tester la supériorité de la stimulation magnétique transcrânienne répétitive à 1 Hz guidée par l’imagerie par résonance magnétique fonctionnelle de capture par rapport à un ciblage au scalp en regard de la zone T3P3, considérée ici comme la méthode de référence. L’essai MULTIMODHAL13 vient de se terminer et a montré des résultats positifs en intention de traiter14 à 1 mois post-traitement (en cours de publication).
 |
Figure 3 Détection de l’émergence d’hallucinations en imagerie par résonance magnétique fonctionnelle. A. Motif fonctionnel des voxels cérébraux contribuant à la détection des épisodes hallucinatoires en imagerie par résonance magnétique fonctionnelle (IRMf), localisés au niveau de l’aire de Broca (iFG) et du cortex cingulaire antérieur (dACC). B. Performance de détection des hallucinations en imagerie par résonance magnétique fonctionnelle (vraies détections/fausses détections). La courbe noire correspond au décodeur validé (88 %). Si l’on modifie aléatoirement le motif fonctionnel utilisé pour cette détection, soit dans l’aire de Broca (courbe bleue), soit dans le cortex cingulaire antérieur (courbe rose), soit dans les deux (courbe en pointillés), les performances s’effondrent, démontrant la spécificité de ce motif pour une détection des épisodes hallucinatoires (adapté de [42] — © CC-BY 4.0). |
Conclusion et perspectives
De manière générale, la psychiatrie de précision et la validation de biomarqueurs en imagerie psychiatrique n’échappent pas aux contraintes actuelles de la recherche, telles que la nécessité de collecter de manière multicentrique de larges échantillons de données de qualité (le plus souvent multi-omiques), comprenant une dimension longitudinale et couvrant les périodes développementales critiques des maladies étudiées. Cet objectif sera notamment atteint de manière collective et harmonisée à l’échelle nationale avec la cohorte French MINDS15, mise en place dans le cadre du programme de recherche exploratoire PROPSY. Deux études de ce PEPR porteront plus particulièrement sur la validation de biomarqueurs de ciblage tels qu’évoqués précédemment. Dans la dépression, l’étude STIMaiTDEP16 portera spécifiquement sur l’intérêt d’une thérapie personnalisée adaptée du protocole SNT (Stanford neuromodulation therapy) pour une future application en routine en France, utilisant 5 séances de stimulation accélérée intermittente par impulsions theta (TBS pour theta-bursts)17, couplée à un guidage fonctionnel sur le cortex préfrontal dorsolatéral gauche. Dans le champ des hallucinations, l’essai UNREHAL18 explorera la possibilité de se détacher d’un système de stimulation externe en utilisant le décodage en imagerie par résonance magnétique fonctionnelle temps-réel des hallucinations précédemment décrit pour entraîner des participants à moduler leur propre activité cérébrale afin de réduire ces expériences envahissantes. Cette approche par neurofeedback guidée par imagerie par résonance magnétique fonctionnelle [44] devrait permettre de mieux circonscrire les stratégies cognitives à même d’avoir un effet neurophysiologique direct sur les hallucinations grâce au retour d’information visuel renvoyé au participant pendant l’acquisition [45]. Ces deux approches en psychiatrie de précision constituent une étape cruciale de validation dans l’établissement de thérapies fondées sur les preuves pour nos patients les plus invalidés.
Remerciements
Ce travail a bénéficié d’une aide de l’État gérée par l’Agence nationale de la recherche au titre de France 2030 portant la référence ANR-22-EXPR-0006 (France 2030).
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Cette approche vise à regrouper des individus en sous-groupes plus homogènes en fonction de caractéristiques biologiques présentes dans les données. Au lieu de regrouper les patients en fonction de leur diagnostic, cette stratification est censée les regrouper sur la base de mécanismes neurophysiologiques possiblement communs.
Il s’agit d’un type d’analyse statistique dans les essais thérapeutiques. Une analyse « en intention de traiter » signifie que tous les sujets inclus et répartis dans un groupe thérapeutique seront conservés dans l’analyse, quelle que soit leur évolution et/ou le traitement finalement reçu (même en cas d’arrêt par exemple).
Références
- Schneckenburger R. La distinction entre neurologie et psychiatrie en France entre 1940 et 1968 : le point de vue de quelques neuropsychiatres. Les Cahiers du Centre Georges Canguilhem 2018 ; 7 : 33–54. [CrossRef] [Google Scholar]
- Blackman G, Neri G, Al-Doori O, et al. Prevalence of neuroradiological abnormalities in first-episode psychosis: a systematic review and meta-analysis. JAMA Psychiatry 2023 ; 80 : 1047–54. [CrossRef] [PubMed] [Google Scholar]
- Allen P, Modinos G, Hubl D, et al. Neuroimaging auditory hallucinations in schizophrenia: from neuroanatomy to neurochemistry and beyond. Schizophr Bull 2012 ; 38 : 695–703. [CrossRef] [PubMed] [Google Scholar]
- Jardri R, Favrod J, Laroi F. Psychothérapies des hallucinations. Issy-les-Moulineaux : Elsevier Masson SAS, 2016 : 352 p. [Google Scholar]
- Leichsenring F, Steinert C, Rabung S, et al. The efficacy of psychotherapies and pharmacotherapies for mental disorders in adults : an umbrella review and meta-analytic evaluation of recent meta-analyses. World Psychiatry 2022 ; 21 : 133–45. [CrossRef] [PubMed] [Google Scholar]
- Dhamala E, Yeo BTT, Holmes AJ. One size does not fit all: methodological considerations for brain-based predictive modeling in psychiatry. Biol Psychiatry 2023 ; 93 : 717–28. [CrossRef] [PubMed] [Google Scholar]
- Larivière S, Paquola C, Park B, et al. The ENIGMA Toolbox: multiscale neural contextualization of multisite neuroimaging datasets. Nat Methods 2021 ; 18 : 698–700. [CrossRef] [PubMed] [Google Scholar]
- Zinkstok JR, Boot E, Bassett AS, et al. Neurobiological perspective of 22q11.2 deletion syndrome. Lancet Psychiatry 2019 ; 6 : 951–60. [CrossRef] [PubMed] [Google Scholar]
- Schneider M, Debbané M, Bassett AS, et al. Psychiatric disorders from childhood to adulthood in 22q11.2 deletion syndrome: results from the international consortium on brain and behavior in 22q11.2 deletion syndrome. AJP 2014 ; 171 : 627–39. [CrossRef] [PubMed] [Google Scholar]
- Sun D, Ching CRK, Lin A, et al. Large-scale mapping of cortical alterations in 22q11.2 deletion syndrome: convergence with idiopathic psychosis and effects of deletion size. Mol Psychiatry 2020 ; 25 : 1822–34. [CrossRef] [PubMed] [Google Scholar]
- Pierrefeu A de, Löfstedt T, Laidi C, et al. Identifying a neuroanatomical signature of schizophrenia, reproducible across sites and stages, using machine learning with structured sparsity. Acta Psychiatr Scand 2018 ; 138 : 571–80. [CrossRef] [PubMed] [Google Scholar]
- Demazeux S, Pidoux V. Le projet RDoC — La classification psychiatrique de demain ? Med Sci (Paris) 2015 ; 31 : 792–6. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Noble S, Spann MN, Tokoglu F, et al. Influences on the test-retest reliability of functional connectivity MRI and its relationship with behavioral utility. Cereb Cortex 2017 ; 27 : 5415–29. [CrossRef] [PubMed] [Google Scholar]
- Rutherford S, Barkema P, Tso IF, et al. Evidence for embracing normative modeling. Elife 2023 ; 12 : e85082. [CrossRef] [PubMed] [Google Scholar]
- Abi-Dargham A, Moeller SJ, Ali F, et al. Candidate biomarkers in psychiatric disorders: state of the field. World Psychiatry 2023 ; 22 : 236–62. [CrossRef] [PubMed] [Google Scholar]
- Nunes A, Schnack HG, Ching CRK, et al. Using structural MRI to identify bipolar disorders — 13 site machine learning study in 3020 individuals from the ENIGMA bipolar disorders working group. Mol Psychiatry 2020 ; 25 : 2130–43. [CrossRef] [PubMed] [Google Scholar]
- Collin G, Seidman LJ, Keshavan MS, et al. Functional connectome organization predicts conversion to psychosis in clinical high-risk youth from the SHARP program. Mol Psychiatry 2020 ; 25 : 2431–40. [CrossRef] [PubMed] [Google Scholar]
- Brucar LR, Feczko E, Fair DA, et al. Current approaches in computational psychiatry for the data-driven identification of brain-based subtypes. Biol Psychiatry 2022 ; 93 : 704–16. [Google Scholar]
- Scott J, Hidalgo-Mazzei D, Strawbridge R, et al. Prospective cohort study of early biosignatures of response to lithium in bipolar-I-disorders: overview of the H2020-funded R-LiNK initiative. Int J Bipolar Disord 2019 ; 7 : 20. [CrossRef] [PubMed] [Google Scholar]
- Poulet E, Bubrovszky M, Bulteau S, et al. Stimulation magnétique transcrânienne répétitive : Applications en psychiatrie. Tours : PUFR, 2019 : 390. [Google Scholar]
- Boyer M, Baudin P, Stengel C, et al. In vivo low-intensity magnetic pulses durably alter neocortical neuron excitability and spontaneous activity. J Physiol 2022 ; 600 : 4019–37. [CrossRef] [PubMed] [Google Scholar]
- Bradley C, Nydam AS, Dux PE, et al. State-dependent effects of neural stimulation on brain function and cognition. Nat Rev Neurosci 2022 ; 23 : 459–75. [CrossRef] [PubMed] [Google Scholar]
- Caulfield KA, Fleischmann HH, Cox CE, et al. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation 2022 ; 15 : 1192–205. [CrossRef] [PubMed] [Google Scholar]
- Fox MD, Buckner RL, White MP, et al. Efficacy of transcranial magnetic stimulation targets for depression is related to intrinsic functional connectivity with the subgenual cingulate. Biol Psychiatry 2012 ; 72 : 595–603. [CrossRef] [PubMed] [Google Scholar]
- Cash RFH, Cocchi L, Lv J, et al. Functional magnetic resonance imaging-guided personalization of transcranial magnetic stimulation treatment for depression. JAMA Psychiatry 2021 ; 78 : 337–9. [CrossRef] [PubMed] [Google Scholar]
- Siddiqi SH, Weigand A, Pascual-Leone A, et al. Identification of personalized transcranial magnetic stimulation targets based on subgenual cingulate connectivity: an independent replication. Biol Psychiatry 2021 ; 90 : e55–e56. [CrossRef] [PubMed] [Google Scholar]
- Elbau IG, Lynch CJ, Downar J, et al. Functional connectivity mapping for rTMS target selection in depression. Am J Psychiatry 2023 ; 180 : 230–40. [CrossRef] [PubMed] [Google Scholar]
- Cole EJ, Stimpson KH, Bentzley BS, et al. Stanford accelerated intelligent neuromodulation therapy for treatment-resistant depression. AJP 2020 ; 177 : 716–26. [CrossRef] [PubMed] [Google Scholar]
- Cole EJ, Phillips AL, Bentzley BS, et al. Stanford neuromodulation therapy (SNT): a double-blind randomized controlled trial. AJP 2022 ; 179 : 132–41. [CrossRef] [PubMed] [Google Scholar]
- Talou J, Sayous R, Bouaziz N, et al. Mondor-stim: an open-source pipeline to optimize the target for transcranial magnetic stimulation, based on fMRI Functional connectivity. 2024 ; 10.5281/zenodo.13170889. [Google Scholar]
- Morriss R, Briley PM, Webster L, et al. Connectivity-guided intermittent theta burst versus repetitive transcranial magnetic stimulation for treatment-resistant depression: a randomized controlled trial. Nat Med 2024 ; 30 : 403–13. [CrossRef] [PubMed] [Google Scholar]
- Hoffman RE, Boutros NN, Hu S, et al. Transcranial magnetic stimulation and auditory hallucinations in schizophrenia. Lancet 2000 ; 355 : 1073–5. [CrossRef] [PubMed] [Google Scholar]
- Demeulemeester M, Amad A, Bubrovszky M, et al. What is the real effect of 1-Hz repetitive transcranial magnetic stimulation on hallucinations? Controlling for publication bias in neuromodulation trials. Biol Psychiatry 2012 ; 71 : e15–6. [CrossRef] [PubMed] [Google Scholar]
- Amad A, Jardri R, Rousseau C, et al. Excess significance sias in repetitive transcranial magnetic stimulation literature for neuropsychiatric disorders. Psychother Psychosom 2019 ; 1–8. [Google Scholar]
- Plaze M, Paillère-Martinot ML, Penttilä J, et al. “Where do auditory hallucinations come from?” - A brain morphometry study of schizophrenia patients with inner or outer space hallucinations. Schizophr Bull 2011 ; 37 : 212–21. [CrossRef] [PubMed] [Google Scholar]
- Saxe R, Brett M, Kanwisher N. Divide and conquer: a defense of functional localizers. Neuroimage 2006 ; 30 : 1088–1096 ; discussion 1097-9. [CrossRef] [PubMed] [Google Scholar]
- Jardri R, Thomas P, Delmaire C, et al. The neurodynamic organization of modality-dependent hallucinations. Cereb Cortex 2013 ; 23 : 1108–17. [CrossRef] [PubMed] [Google Scholar]
- Jardri R, Pouchet A, Pins D, et al. Cortical activations during auditory verbal hallucinations in schizophrenia: a coordinate-based meta-analysis. Am J Psychiatry 2011 ; 168 : 73–81. [CrossRef] [PubMed] [Google Scholar]
- Sommer IEC, Diederen KMJ, Blom JD, et al. Auditory verbal hallucinations predominantly activate the right inferior frontal area. Brain 2008 ; 131 : 3169–77. [CrossRef] [PubMed] [Google Scholar]
- Gill K, Percival C, Roes M, et al. Real-time symptom capture of hallucinations in schizophrenia with fMRI: absence of duration-dependent activity. Schizophr Bull Open 2022 ; sgac050. [CrossRef] [PubMed] [Google Scholar]
- Leroy A, Foucher JR, Pins D, et al. fMRI capture of auditory hallucinations: validation of the two-steps method. Hum Brain Mapp 2017 ; 38 : 4966–79. [CrossRef] [PubMed] [Google Scholar]
- Fovet T, Yger P, Lopes R, et al. Decoding activity in Broca’s area predicts the occurrence of auditory hallucinations across subjects. Biol Psychiatry 2022 ; 91 : 194–201. [CrossRef] [PubMed] [Google Scholar]
- Jardri R, Lucas B, Delevoye-Turrell Y, et al. An 11-year-old boy with drug-resistant schizophrenia treated with temporo-parietal rTMS. Mol Psychiatry 2007 ; 12 : 320. [CrossRef] [PubMed] [Google Scholar]
- Pindi P, Houenou J, Piguet C, et al. Real-time fMRI neurofeedback as a new treatment for psychiatric disorders: A meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry 2022 ; 119 : 110605. [CrossRef] [PubMed] [Google Scholar]
- Donantueno C, Yger P, Cabestaing F, et al. fMRI-based neurofeedback strategies and the way forward to treating phasic psychiatric symptoms. Front Neurosci 2023 ; 17 : 1275229. [CrossRef] [PubMed] [Google Scholar]
- Hardelin JP. Facteur « confondant » ou de confusion. Med Sci (Paris) 2024 ; 40 : 381. [CrossRef] [EDP Sciences] [Google Scholar]
Liste des figures
 |
Figure 1 Épaisseur corticale mesurée au sein de neuf populations de patients en comparaison à des populations témoins. Les tailles d’effets négatives indiquent une diminution de l’épaisseur corticale chez les patients par rapport aux sujets témoins, les tailles d’effets positives indiquent une augmentation de l’épaisseur corticale chez les patients par rapport aux sujets témoins. MDD : épisode dépressif majeur ; OCD: trouble obsessionnel compulsif ; BD : trouble bipolaire ; ADHD : trouble déficitaire de l’attention avec hyperactivité ; Schizophrenia : schizophrénie ; ASD : trouble du spectre de l’autisme ; Alcohol Use Disorder : trouble de l’usage de l’alcool ; Epilepsy : épilepsie ; 22q11DS : microdélétion 22q11 ; Cohen’s d : taille d’effet de Cohen (reproduction de [7] — © CC-BY 4.0). |
| Dans le texte | |
 |
Figure 2 A. Position du cortex cingulaire antérieur subgénual (SgACC). B. Connectivité fonctionnelle (CF) du cortex cingulaire antérieur subgénual. Le code couleur représente l’intensité de la connectivité fonctionnelle, positive (couleurs chaudes), ou négative (couleurs froides). C. Simulation du champ électrique induit (CE) par stimulation magnétique transcrânienne répétitive (rTMS) au niveau du cortex préfrontal dorsolatéral gauche (DLPFC). Le code couleur représente la diffusion corticale de l’effet neuromodulateur autour de la cible. D. Rôle de la connectivité SgACC — DLPFC dans l’efficacité de la rTMS sur la dépression mesurée par l’échelle Montgomery-Åsberg Depression Rating Scale (MADRS). Plus la connectivité fonctionnelle entre la cible stimulée et le SgACC est importante, plus le score de dépression diminue après traitement. |
| Dans le texte | |
 |
Figure 3 Détection de l’émergence d’hallucinations en imagerie par résonance magnétique fonctionnelle. A. Motif fonctionnel des voxels cérébraux contribuant à la détection des épisodes hallucinatoires en imagerie par résonance magnétique fonctionnelle (IRMf), localisés au niveau de l’aire de Broca (iFG) et du cortex cingulaire antérieur (dACC). B. Performance de détection des hallucinations en imagerie par résonance magnétique fonctionnelle (vraies détections/fausses détections). La courbe noire correspond au décodeur validé (88 %). Si l’on modifie aléatoirement le motif fonctionnel utilisé pour cette détection, soit dans l’aire de Broca (courbe bleue), soit dans le cortex cingulaire antérieur (courbe rose), soit dans les deux (courbe en pointillés), les performances s’effondrent, démontrant la spécificité de ce motif pour une détection des épisodes hallucinatoires (adapté de [42] — © CC-BY 4.0). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




