| Issue |
Med Sci (Paris)
Volume 40, Number 12, Décembre 2024
Épigénétique : développement et destin cellulaire
|
|
|---|---|---|
| Page(s) | 935 - 946 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024179 | |
| Published online | 20 December 2024 | |
Régulation du chromosome X et spécificités fonctionnelles des cellules femelles
Deux X valent-ils mieux qu’un ?
X chromosome regulation and female functional specificities: Are two Xs better than one?
1
Université Paris Cité, CNRS, Inserm, Institut Cochin, Paris, France
2
UMR7216 – Épigénétique et destin cellulaire, CNRS, Université Paris Cité, Paris, France
*
julie.chaumeil@inserm.fr
**
celine.morey@inserm.fr
Et si posséder deux chromosomes X conférait aux cellules femelles des spécificités exclusives et expliquait les différences de susceptibilité des hommes et des femmes à certaines maladies ? Pourtant, l’un des chromosomes X est réprimé aléatoirement dans chaque cellule femelle dès le stade embryonnaire, ce qui, théoriquement, remet les sexes à égalité. Cette inactivation du chromosome X est un processus épigénétique unique : elle agit à l’échelle d’un chromosome entier et aboutit à un mosaïcisme d’expression des gènes du chromosome X au niveau de l’organisme. Cependant certains gènes échappent au processus et cette inactivation semble être plus labile dans certains types cellulaires. Quelles en sont les conséquences physiologiques ? Cette question commence à être explorée, notamment dans les systèmes immunitaires et nerveux qui présentent différentes maladies à biais de sexe.
Abstract
What if the presence of two X chromosomes confers functional specificities on female cells and contributes to the different susceptibilites of men and women to certain diseases? One of the X chromosomes is randomly silenced in each female cell from the embryonic stage, theoretically making the sexes equal. This silencing of the X chromosome is a unique epigenetic process, affecting an entire chromosome and resulting in mosaic expression of X-linked genes throughout the body. However, some genes escape this process and X-inactivation appears to be somewhat labile in certain cell types. What are the physiological implications of these observations? This question is beginning to be explored, particularly in the immune and nervous systems, where several pathologies have sexual bias.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Biorender.com).
Chez les mammifères, il existe des différences physiologiques constitutives entre individus mâles et femelles qui ne sont pas directement liées aux fonctions reproductives ou aux caractères sexuels secondaires. Ces dimorphismes sont souvent révélés lorsque l’organisme subit un stress ou par des différences dans l’incidence, les manifestations ou la gravité de certaines maladies. Par exemple, les femmes sont plus résistantes à la plupart des infections bactériennes ou virales et répondent généralement mieux aux vaccins (comme pour la grippe ou comme illustré récemment dans le cas de la pandémie de la COVID-19 [coronavirus disease 2019]), ce qui témoigne d’une immunité innée et adaptative plus performante [1]. En contrepartie, les femmes sont préférentiellement touchées par les maladies auto-immunes [2]. Si certains de ces dimorphismes sexuels sont bien étayés au niveau épidémiologique, d’autres, comme la dépression unipolaire, qui toucherait deux fois plus les femmes que les hommes, sont sujets à caution et pourraient dépendre des contextes sociétaux et culturels des études, qui peuvent induire des biais comportementaux ou d’interprétation [3]. Il paraît donc crucial d’identifier les mécanismes moléculaires qui sous-tendent ces différences physiologiques, d’abord pour développer des outils diagnostiques affranchis de biais humains, mais surtout afin de proposer des traitements adaptés à chaque sexe. Dans cette revue, nous nous attacherons à décrire des études portées sur le sexe génétique et non sur le genre. Sauf mention spéciale de caryotypes, les termes femelles/femmes et mâles/hommes se référeront respectivement aux individus 46,XX et 46,XY.
Une partie importante des recherches se concentre sur l’effet des hormones gonadiques (androgènes, œstrogènes et progestatifs), qui ont une action endocrine sur les cellules cibles de l’organisme. Ces hormones participent significativement à de nombreux dimorphismes sexuels mais ne les expliquent qu’en partie (voir [4–6]). Contrairement à l’effet des hormones, le contenu chromosomique de chaque cellule (46,XX ou 46,XY) constitue une identité sexuelle intrinsèque avec potentiellement des effets dans tous les types cellulaires. Des différences entre mâles et femelles liées à ce système de chromosomes hétéromorphes se manifestent dès le développement embryonnaire précoce, bien avant le déterminisme sexuel et la production des hormones gonadiques ; notamment, les embryons mâles se développent plus vite [7] et les profils d’expression des gènes sont distincts [8]. Chez l’adulte, l’effet des hormones sur le fonctionnement des cellules devient difficile à dissocier de l’impact du contenu chromosomique XX ou XY, ce qui a longtemps entravé l’avancement des recherches [9]. Cette revue s’attache à décrire les spécificités que le statut XX confère aux cellules femelles et les conséquences fonctionnelles sur le système immunitaire et sur le compartiment neural.
Les hauts et les bas de l’expression du chromosome X
Contrairement au chromosome Y, qui est de taille très réduite, riche en séquences répétées et pauvre en gènes codants, le chromosome X est l’un des plus grands chromosomes du caryotype humain, trois fois plus grand que le Y et portant près de 10 fois plus de gènes. Si de nombreux gènes du chromosome X ont une expression ubiquitaire et assurent des fonctions de ménage essentielles à toutes les cellules, d’autres gènes ont, quant à eux, des fonctions spécifiques et ne sont donc exprimés que dans certains types cellulaires. Notamment, le chromosome X est enrichi en gènes impliqués dans la régulation des fonctions cognitives, ce qui se traduit par la présence de 3,5 fois plus de variants génétiques (polymorphismes ou mutations) associés à des déficits intellectuels, comparé aux autosomes [10,11]. Ce chromosome porte également de nombreux gènes intervenant dans le système immunitaire [12]. Par ailleurs, l’utilisation de modèles murins de même sexe gonadique mais de sexe génétique XX ou XY (modèles dits des « quatre génotypes principaux » - QGP1 [9,13–15]), complétée par la comparaison de femelles XO et XX ou de mâles XY et XXY, a permis l’identification de traits phénotypiques directement liés à la présence de deux chromosomes X, indépendamment de l’effet des hormones gonadiques. Le sexe chromosomique XX a ainsi pu être associé au risque de développement de maladies auto-immunes, métaboliques, neurodégénératives ou cardiovasculaires [16]. Ces modèles murins doivent cependant être utilisés avec précaution puisque l’existence de translocation chromosomique X-Y a été rapportée [15].
L’enrichissement du chromosome X en fonctions particulières suggère un modelage progressif de son contenu génique au cours de l’évolution. La perte de la capacité de recombinaison avec le chromosome Y, associée à la dégénérescence de ce chromosome, ont déclenché un changement radical du régime de sélection exercé sur les gènes du chromosome X : certains gènes ancestraux ont acquis des profils d’expression différents en fonction des espèces de mammifères, alors que des évènements de translocations ont conduit à l’adjonction de nouveaux gènes [17]. Ces modifications pourraient expliquer la présence de nombreux gènes aux fonctions immunitaires sur le chromosome X humain, qui garantiraient aux femelles une meilleure résistance aux infections, augmentant ainsi leur compétence reproductive. L’accumulation de gènes impliqués dans les fonctions neurales serait, quant à elle, liée au choix de partenaires mâles dotés des meilleures facultés cognitives [10]. Du point de vue de la régulation des gènes, l’absence d’homologues sur le chromosome Y conduit théoriquement, dans les cellules mâles, à un niveau d’expression des gènes du chromosome X réduit de moitié par rapport aux cellules femelles et par rapport aux gènes autosomaux (Figure 1A). Selon l’hypothèse de Susumu Ohno, ces déséquilibres auraient provoqué l’apparition de deux systèmes de compensation de la dose des produits des gènes du chromosome X : 1) la surexpression des gènes du chromosome X dans les 2 sexes pour répondre au risque d’haploinsuffisance dans les cellules mâles et restaurer l’équilibre d’expression par rapport aux paires d’autosomes, et 2) l’inactivation transcriptionnelle de l’un des deux chromosomes X dans les cellules femelles qui permet de rééquilibrer le niveau d’expression par rapport aux cellules mâles [18–20] (Figure 1A). Il est possible que la nécessité de contrôler la dose du produit des gènes codés par le chromosome X concerne particulièrement les facteurs qui font partie de complexes protéiques incluant aussi des acteurs autosomaux et dont la stœchiométrie doit donc être respectée [18]. De ce point de vue, les mammifères auraient fait évoluer deux processus régulateurs aux effets opposés, qui agissent à l’échelle d’un chromosome entier et non au niveau génique (cette affirmation est encore débattue dans le cas de la surexpression du chromosome X et pourrait ne s’appliquer qu’à certains gènes [18]). De plus, chez les femelles, l’expression du chromosome X ne nécessite pas, a priori, de compensation ce qui suggère un scenario évolutif où surexpression d’un chromosome et inactivation de l’autre ont un effet neutre ou positif sur la compétence reproductive des femelles.
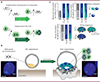 |
Figure 1 Processus de compensation de dose et conséquences sur l’expression des gènes du chromosome X. A. Selon l’hypothèse de Susumu Ohno, une pression de sélection s’applique au niveau de l’individu et induit le rééquilibrage du niveau d’expression des gènes du chromosome X par rapport aux gènes des autosomes par surexpression des gènes du X chez le mâle et la femelle [20]. La compensation de dose du chromosome X entre les sexes est ensuite réalisée par l’inactivation aléatoire de l’un des deux chromosomes X dans les cellules femelles. B. Dans l’espèce humaine, les cellules de l’épiblaste pré-implantatoire de l’embryon femelle se caractérisent par une expression atténuée des gènes de chaque chromosome X. En hybridation in situ sur ARN, les molécules d’ARN XIST sont accumulées au niveau des deux chromosomes X ; les gènes du chromosome sont toujours transcrits (image de gauche). L’inactivation aléatoire du chromosome X est mise en place au moment de l’implantation et conduit à un épiblaste post-implantatoire mosaïque pour l’expression des gènes du chromosome X. l’ARN XIST ne décore plus qu’un seul chromosome et les gènes de ce chromosome sont éteints (image de droite) (ARN XIST en vert, gène du chromosome X en rouge, ADN du noyau marqué au DAPI en bleu, échelle = 5 μm). C. Au niveau cellulaire, ces systèmes de compensation conduisent, théoriquement, à une transcription de chaque allèle deux fois supérieure par rapport aux allèles autosomiques (graphique en haut à gauche). Le produit des gènes du chromosome X (ARN matures et protéines) provient soit des allèles maternels soit des allèles paternels chez les femelles et seulement des allèles maternels chez les mâles (graphique en haut à droite). Les produits autosomiques sont, quant à eux constitués d’un mélange de protéines paternelles et maternelles (graphique en haut à droite). Le niveau de chaque produit est le même dans toutes les configurations. Le mosaïcisme d’expression spécifique aux femelles peut varier selon les organes, et le niveau d’expression des gènes du chromosome X maternel ou paternel peut théoriquement être biaisé (graphique du bas). Chez les mâles, la présence de variant ou de mutation sur le chromosome X s’exprime donc forcément au niveau phénotypique. Chez les femelles, néanmoins, l’inactivation du chromosome X et le mosaïsme qui en résulte, complique la prédiction phénotypique. |
Ces processus de compensation de dose et, notamment, l’inactivation du chromosome X, qui caractérise les cellules femelles, sont mis en place tôt au cours du développement [21]. Dans l’espèce humaine, avant l’implantation, les deux chromosomes X des cellules de l’embryon femelle sont actifs mais le niveau d’expression des gènes est atténué par un mécanisme de modération transcriptionnelle (Figure 1B) [22,23] (→).
(→) Voir la Synthèse de M. Moscatelli et C. Rougeulle, m/s n° 2, février 2021, page 152
Lorsque l’épiblaste se développe, l’un des deux chromosomes est réprimé, aléatoirement, dans chaque cellule, alors que l’autre voit la transcription de ses gènes augmenter [24,25]. Le statut actif ou inactif de chaque chromosome X est ensuite transmis de manière stable au cours des divisions cellulaires, aboutissant à des individus femelles mosaïques pour l’expression des gènes du chromosome X (mécanisme épigénétique) (Figure 1B). Cette inactivation n’est complètement révertée, de manière physiologique, que dans les cellules de la lignée germinale. Le choix du chromosome X à inactiver est théoriquement aléatoire : les individus femelles sont donc des organismes mosaïques composés, a priori, d’environ 50 % de cellules surexprimant le chromosome X d’origine maternelle et environ 50 % de cellules surexprimant le chromosome X d’origine paternelle. Ainsi, l’expression d’allèles aux effets phénotypiques positifs ou négatifs a des conséquences exacerbées chez les mâles par rapport aux femelles : par exemple, la présence d’une mutation dans un gène du chromosome X chez les mâles a des conséquences phénotypiques drastiques, tandis qu’elles sont le plus souvent atténuées chez les femelles grâce à l’effet tampon du mosaïcisme (Figure 1C) [26]. Il existe également des cas d’inactivation biaisée, où l’un des deux chromosomes X est plus souvent inactivé que l’autre au niveau d’un organe ou d’un individu (Figure 1C). Ce biais peut être primaire : un plus grand nombre de cellules embryonnaires a inactivé le chromosome de même origine parentale ; ou secondaire : l’inactivation d’un chromosome X en particulier confère, par exemple, un avantage prolifératif à la cellule. Ainsi, les cellules exprimant l’haplotype le plus favorable peuvent potentiellement être sélectionnées – notamment dans des contextes de renouvellement et de différenciation cellulaires actifs, comme l’hématopoïèse ou la neurogenèse – ce qui participerait aux changements de profils d’inactivation observés au niveau des organes de certaines femmes [27]. La compensation de l’expression du chromosome X confère donc aux cellules et aux individus femelles des spécificités inhérentes qui sont, en partie, héritées des cellules de l’embryon.
Un chromosome X pas si inactif que ça…
Au niveau moléculaire, l’inactivation du chromosome X est coordonnée par XIST (X-inactive specific transcript), un long ARN non codant produit par le chromosome X inactif des cellules femelles. Lors de la mise en place de l’inactivation du chromosome X, une centaine de molécules d’ARN XIST viennent décorer le chromosome X choisi pour être inactivé. L’ARN XIST contient six domaines structuraux, composés de différentes séquences répétées, qui permettent de recruter un ensemble de partenaires pour former un large complexe ribonucléoprotéique (XIST-RNP) constitué d’activités enzymatiques et/ou de cofacteurs impliqués dans les différentes étapes cruciales pour la mise en place et le maintien de l’inactivation du chromosome X (voir [28]) (Figure 2A). L’association progressive de complexes XIST-RNP à des sites de nucléation, répartis le long du chromosome X [29], permettrait l’agrégation locale et l’accumulation de facteurs répressifs permettant l’extinction transcriptionnelle des gènes du chromosome X, et de facteurs architecturaux facilitant la formation de l’hétérochromatine facultative du chromosome X inactif, sa compaction et sa réorganisation tridimensionnelle [28]. En particulier, XIST recrute directement le facteur SPEN (Split ends chez la drosophile, appelé également SHARP chez l’homme pour SMRT and HDAC associated repressor), indispensable à la répression transcriptionnelle des gènes du chromosome X lors de la mise en place de l’inactivation du chromosome X (voir les revues [21,28]) (Figure 2A). Une partie au moins de ces interacteurs protéiques sont nécessaires à l’atténuation de l’expression du chromosome X dans les cellules embryonnaires humaines précoces [24]. Une augmentation de la concentration de molécules de XIST, ou un changement de partenaires protéiques, pourraient être nécessaires au déclenchement de l’inactivation [25,30]. L’accumulation de XIST-RNP au niveau du futur chromosome X inactif induit une série de modifications chromatiniennes séquentielles, à commencer par la déplétion en ARN polymérases et la perte des marques actives d’histone (H3K4me3, H3K27ac, H4Kac)2, puis le gain de marques répressives (H2AK119ub, H3K27me3, H3K9me2/3)3 (Figure 2B), le recrutement du variant d’histone macroH2A, et la perte de l’architecture tridimensionnelle (voir les revues [21,28]). Enfin, l’état inactif est verrouillé par la méthylation des îlots CpG aux promoteurs des gènes. Si cette cinétique est bien définie chez la souris, et est étroitement liée à la progression développementale [21], l’ordre de ces changements, dans l’espèce humaine, s’appuie sur différentes études menées sur des embryons et des cellules embryonnaires humaines et reste à confirmer [23,31]. De plus, les cinétiques de remodelage du chromosome X inactif et de répression de chaque gène semblent varier en fonction des lignages cellulaires chez les primates [32].
 |
Figure 2 Mécanisme d’inactivation du chromosome X. A. L’inactivation du chromosome X est provoquée par l’accumulation de l’ARN XIST au niveau du futur chromosome X inactif (Xi) visualisée par hybridation in situ à l’aide de sondes spécifiques fluorescentes (image de gauche : ARN XIST en rouge, ADN du noyau marqué au DAPI en bleu ; échelle = 5 mm). L’ARN XIST permet le recrutement, via ses régions répétées A, B, C et E, et la concentration locale de nombreux facteurs protéiques (complexe ribonucléoprotéique XIST-RNP, décrit sur le panneau de droite). Les complexes XIST-RNP sont impliqués dans des étapes cruciales pour la mise en place et le maintien de l’inactivation du chromosome X : 1) localisation en cis des XIST-RNP le long du chromosome X ; 2) la répression transcriptionnelle des gènes du chromosome X ; 3) les changements conformationnels et chromatiniens aboutissant à l’hétérochromatinisation et à la formation du compartiment répressif du chromosome X inactif ; et 4) le maintien de l’état inactif au cours de la différenciation et des divisions cellulaires. Ces agrégations de complexes XIST-RNP jalonnent le territoire du chromosome X inactif (halo jaune) dans environ 50 sites distincts [28]. Les gènes qui échappent à l’inactivation du chromosome X sont délocalisés en dehors du territoire du chromosome X inactif et restent ainsi accessibles aux machineries transcriptionnelles. B. L’accumulation de XIST-RNP est associée à l’apposition de marques de chromatine répressives H3K27me3 et H2AK119ub, ici visualisées par immunofluorescence (respectivement en vert et en rouge) dans le même noyau (ADN du noyau marqué au DAPI en bleu ; échelle = 5 mm). C. Carte du chromosome X humain montrant les gènes soumis à l’inactivation et ceux y échappant spécifiquement dans chaque tissu ou de façon plus ubiquitaire (panneau de gauche ; adapté de [46]). Les gènes échappant à l’inactivation (exemple de KDM6A) montrent des couvertures inférieures en ARN XIST (RAP [RNA antisense purification]-seq) et des niveaux plus faibles de marques répressives d’histone (CUT&RUN [cleavage under targets and release using nuclease]) par rapport aux gènes sujets à inactivation (exemple de POLA1 [DNA polymerase alpha 1]) (panneau central, d’après [24]). Ces gènes sont transcrits à partir des deux chromosomes X comparés aux gènes soumis à l’inactivation, ici illustré par les images d’hybridation in situ sur ARN à droite (transcrits naissants de KDM6A ou POLA1 en vert, ARN XIST en rouge, ADN du noyau marqué au DAPI en bleu ; échelle = 5 μm). |
Chez la souris, un défaut d’inactivation du chromosome X au tout début du développement embryonnaire conduit à une létalité causée par des défauts des annexes extra-embryonnaires [33,34]. Chez l’être humain, les conséquences fonctionnelles de l’absence de XIST au cours du développement embryonnaire restent encore à être formellement établies. Cependant, chez la souris femelle et dans les cellules humaines adultes où l’inactivation du chromosome X est déjà établie, la perte de Xist/XIST et la réactivation de certains gènes du chromosome X inactif a des effets contrastés en fonction des types cellulaires, allant de l’absence de phénotype à des effets tumorigènes dramatiques [35–40]. Des perturbations moins drastiques de l’inactivation du chromosome X engendre des manifestations phénotypiques à certains stades développementaux ou seulement dans certains types cellulaires, notamment dans les cellules immunitaires et dans le compartiment neural [35,36,41–45]. Par ailleurs, la composition des complexes XIST-RNP semble modulable en fonction des types cellulaires : par exemple, les cofacteurs associés à XIST ne sont pas les mêmes dans les cellules embryonnaires humaines, dans les lymphocytes B ou dans les cellules myéloïdes [42]. Enfin, bien que l’inactivation du chromosome X soit un mécanisme global, environ 15 à 20 % des gènes humains liés au chromosome X y échappent, certains de manière systématique (dits constitutifs), d’autres de manière variable (dits facultatifs) dans certaines cellules, certains tissus ou chez certaines femmes, et sont donc exprimés, à la fois à partir du chromosome X actif et du chromosome X inactif [46,47] (Figure 2C). La proportion de gènes à échappement constitutif et de gènes à échappement facultatif varie en fonction des études ; le pourcentage global d’échappement a de plus été revisité dans une récente étude, suggérant qu’il pourrait s’agir d’un phénomène beaucoup plus rare [48]. Ces gènes à échappement sont répartis le long de tout le chromosome X humain mais sont particulièrement abondants sur le bras court (dont certains possèdent des paralogues sur le chromosome Y) et dans les régions pseudo-autosomales (ces derniers ont donc des homologues sur le chromosome Y, ce qui pourrait expliquer leur expression à partir des deux chromosomes X dans les cellules femelles) (Figure 2C). Ces gènes se caractérisent par des profils chromatiniens particuliers par rapport aux gènes soumis à l’inactivation : une déplétion en marques répressives d’histones, un enrichissement en marques actives et une couverture plus faible en complexes XIST-RNP (Figure 2C). Il semble donc qu’un remodelage local de la chromatine du chromosome X inactif au niveau de ces gènes puisse être établi indépendamment dans chaque cellule ou tissu. En l’absence de régulation post-transcriptionnelle, le produit de ces gènes est donc théoriquement plus abondant dans les cellules femelles que dans les cellules mâles. L’échappement de certains de ces gènes à l’inactivation du chromosome X constitue donc un mécanisme très probable de dimorphisme sexuel. Par ailleurs, très peu d’orthologues murins échappent à l’inactivation du chromosome X, indiquant un remodelage de l’échappement au cours de l’évolution.
Ce faisceau d’observations suggère que les modalités de maintenance de l’inactivation du chromosome X et l’identité des gènes sensibles au dosage sont modulables en fonction des types cellulaires, et cela malgré les différentes couches de modifications de la chromatine du chromosome X inactif établies au cours des stades embryonnaires. Il semble que certains contextes cellulaires, comme les compartiments hématopoïétiques et neuraux, qui se caractérisent par une grande capacité d’auto-renouvellement et de différenciation cellulaire, soient particulièrement concernés.
Biais de sexe dans la réponse immunitaire : pour le meilleur et pour le pire ?
Le système immunitaire est un exemple remarquable de différence fonctionnelle entre les sexes. En effet, les femmes sont capables de développer des réponses immunitaires innées et adaptatives plus vigoureuses face aux infections et présentent une meilleure réponse vaccinale [1,49]. Ce biais de sexe a notamment été montré dans la réponse immunitaire antivirale face au SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2), le virus responsable de la COVID-19, avec un risque plus faible de gravité pour les femmes infectées [50,51]. Par contre, les femmes sont plus touchées que les hommes par les maladies auto-immunes, telles que le lupus érythémateux systémique, le syndrome de Sjögren, la sclérose en plaques, la polyarthrite rhumatoïde ou la sclérodermie [52]. Si les hormones sexuelles féminines, en particulier les œstrogènes, contribuent clairement à la prédominance de ces maladies chez les femmes, elles n’en sont pas la seule cause [1,53]. En effet, ce biais de sexe est déjà notable avant la puberté, alors que les hormones sexuelles ne sont pas encore produites, et continue après la ménopause, lorsque leur taux décroît [54]. De plus, les hommes portant deux chromosomes X (XXY ; syndrome de Klinefelter) présentent une prédisposition accrue au lupus érythémateux systémique par rapport aux hommes XY [55]. Enfin, tandis que les femmes XO semblent être protégées [56], les femmes XXX présentent, quant à elles, une prédisposition supérieure au lupus érythémateux systémique par rapport aux femmes XX [57] (Figure 3A). Ainsi, la présence d’au moins deux chromosomes X semble être un facteur majeur dans la susceptibilité aux maladies auto-immunes.
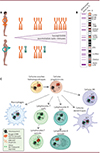 |
Figure 3 Chromosome X et biais de sexe dans la réponse immunitaire. A. La susceptibilité aux maladies auto-immunes (notamment le lupus érythémateux systémique) augmente avec le nombre de chromosomes X présents dans les cellules des individus. B. Principaux gènes du système immunitaire (SI) portés par le chromosome X humain et décrits comme échappant à l’inactivation du chromosome X chez l’Homme ou la souris. La position du gène XIST est montrée en vert. A gauche, gènes du chromosome X associés à une maladie touchant le système immunitaire (informations extraites de la base de données OMIM [Online Mendelian Inheritance in Man]). C. La régulation dynamique de l’inactivation du chromosome X dans le compartiment immunitaire pourrait permettre l’expression de gènes du système immunitaire (tels que TLR7) à partir du/des chromosome(s) X inactif(s), induisant une réponse immunitaire plus efficace chez les femmes XX, XXX ainsi que chez les hommes XXY, mais également une susceptibilité accrue aux maladies auto-immunes. Tandis que les cellules progénitrices hématopoïétiques présentent un chromosome X inactif recouvert par un nuage compact d’ARN XIST et les marques chromatiniennes répressives associées (H3K27me3, H2AK119ub, macroH2A), ces caractéristiques sont perdues au cours de leur différenciation et reviennent lors de l’activation des lymphocytes B et des lymphocytes T. chr. : chromosome ; Xi : chromosome X inactif ; Xa : chromosome X actif ; NK : natural killer (Figure réalisée avec l’aide de Biorender). |
Le chromosome X porte de nombreux gènes liés aux fonctions immunitaires, en particulier ceux codant des récepteurs de type Toll (TLR [Toll-like receptors] 7 et 8), des récepteurs de cytokines, et des facteurs de transcription [58,59] (Figure 3B). Certains de ces gènes échappent à l’inactivation du chromosome X dans différents types de cellules immunitaires chez des femmes saines et/ou atteintes de lupus érythémateux systémique [2,42,60–65]. Ils sont donc plus fortement exprimés chez les individus XX que chez les individus XY et pourraient donc contribuer au dimorphisme sexuel des fonctions immunitaires (Figure 3B). Notamment, le gène TLR7 est exprimé de manière biallélique dans une proportion de lymphocytes B, de monocytes et de cellules dendritiques chez les femmes XX et les hommes Klinefelter XXY [66]. De manière frappante, les lymphocytes B exprimant TLR7 de manière biallélique sont plus réactifs aux ligands de TLR7, avec une activation et une prolifération accrues [66]. TLR7 étant un récepteur des ARN monocaténaires, il constitue une ligne de défense essentielle contre les virus à ARN, mais peut également répondre à des ARN endogènes et ainsi potentiellement conduire à l’auto-immunité ou à l’inflammation s’il n’est pas correctement contrôlé. Il a été montré, en utilisant des souris transgéniques, que l’expression de deux copies du gène Tlr7 est suffisante pour induire le lupus érythémateux systémique [67,68]. Bien que cette surexpression de TLR7 confère aux femmes un avantage direct, avec une plus grande immunité contre des agents pathogènes contenant des ARN, elle peut également expliquer la plus grande sensibilité des femmes aux maladies auto-immunes induites par TLR7, en particulier le lupus érythémateux systémique [2]. D’autres gènes de l’immunité, tels que TLR8, CXCR3 (C-X-C motif chemokine receptor 3) et TASL/CXorf21 (TLR adaptor interacting with endolysosomal SLC15A4), échappent à l’inactivation du chromosome X et ont été associés au développement de maladies auto-immunes [59,64].
Cet échappement pourrait être lié à des mécanismes particuliers de maintenance de l’inactivation du chromosome X dans les cellules immunitaires. En effet, la distribution de XIST le long du chromosome X varie en fonction des types de cellules immunitaires (Figure 3C). Tandis que l’ARN XIST forme un nuage compact couvrant le chromosome X inactif dans les cellules souches hématopoïétiques, les molécules d’ARN XIST sont dispersées ou absentes dans les noyaux des cellules NK (natural killer), des cellules dendritiques, et des cellules alvéolaires pulmonaires [69]. De plus, les marques répressives d’histone associées au chromosome X inactif montrent des profils changeants au cours de la différenciation des lymphocytes B et T : elles sont absentes dans les progéniteurs et les cellules naïves, mais sont rétablies lors de leur activation [61]. Par ailleurs, perturber l’expression de XIST a des conséquences marquées sur les cellules du système immunitaire. Chez les souris femelles, une réduction sensible de l’expression de Xist induit la perturbation de la mise en place de l’inactivation du chromosome X aux stades embryonnaires et se traduit par un échappement à l’inactivation exacerbé de certains gènes, dont Tlr7, dans les cellules immunitaires. En conséquence, la voie de signalisation induite par TLR7 est augmentée dans les macrophages, et les souris développent spontanément des signes inflammatoires typiques du lupus érythémateux systémique [41]. De plus, une délétion de Xist induite dans les précurseurs des lymphocytes B suffit à déclencher des manifestations auto-immunes chez certaines souris femelles, dont les profils d’échappement à l’inactivation du chromosome X diffèrent en fonction des types de lymphocytes B [70]. Ceci suggère que les profils d’échappement sont remodelés de façon spécifique dans chaque souspopulation de cellules immunitaires. Cependant, l’invalidation de Xist dans les cellules souches hématopoïétiques, alors qu’elles viennent d’être spécifiées dans l’embryon murin à 10,5 jours de développement, ne conduit pas à un phénotype auto-immun mais induit le développement de cancers hématologiques agressifs chez l’adulte, avec une pénétrance de 100 % [37]. Ces souris montrent une hyper-prolifération des progéniteurs hématopoïétiques dans lesquels l’échappement des gènes à l’inactivation du chromosome X est accru, et un biais de différenciation des progéniteurs en faveur de la voie lymphocytaire [43]. Une régulation particulière de l’inactivation du chromosome X est donc clairement établie dans le compartiment hématopoïétique et les cellules immunitaires. Son altération s’accompagne de changements marqués dans les profils d’échappement à l’inactivation qui varient suivant les lignages hématopoïétiques et peuvent déboucher sur un phénotype hyper-prolifératif ou auto-immun, en fonction du stade développemental de la perturbation.
Une étude récente suggère que les complexes XIST-RNP seraient euxmêmes des auto-antigènes qui déclencheraient l’auto-immunité [71]. En effet, l’induction forcée de Xist, à partir d’un transgène, chez des souris mâles conduit à la formation de complexes XIST-RNP et à la production d’auto-anticorps. De plus, dans un modèle de lupus érythémateux systémique induit, ces souris transgéniques développent une maladie plus grave que les mâles non-transgéniques. Ainsi, XIST, avec ses partenaires, aurait un rôle immunogénique qui pourrait aussi contribuer à la prévalence des maladies auto-immunes chez les femmes.
L’échappement à l’inactivation des gènes immunitaires portés par le chromosome X induisant une dose accrue d’effecteurs-clefs, comme le récepteur TLR7, ce phénomène peut donc expliquer la plus grande efficacité du système immunitaire des femmes, tout en augmentant le risque de maladies auto-immunes. Un excès de XIST-RNP pourrait encore favoriser le développement de lupus érythémateux systémique. Il semble donc que la régulation du niveau d’expression de XIST et de la localisation des complexes XIST-RNP soit particulièrement cruciale et ait un impact sur le ratio bénéfices/risques d’une plasticité de la maintenance de l’inactivation du chromosome X. L’immunité innée plus efficace des femmes pourrait aussi permettre la transmission d’anticorps contre les virus à ARN à travers le placenta et dans le lait maternel, afin de protéger la progéniture in utero et au début de la vie lorsqu’elle est plus sensible aux maladies infectieuses [49]. La dissection des mécanismes contrôlant l’expression des gènes immunitaires à partir du chromosome X inactif de la femme pourrait permettre de découvrir des cibles thérapeutiques potentielles pour traiter les maladies auto-immunes, ou de concevoir de nouveaux vaccins contre les virus à ARN, tels que le SARS-CoV-2 ou la grippe.
L’inactivation du chromosome X présente-elle aussi des spécificités dans le compartiment neural ?
Le sexe génétique est une variable significative dans la prévalence et l’incidence des maladies neurologiques. Il existe des différences marquées dans l’âge d’apparition, dans la vitesse de progression, dans la sévérité des affections, et dans la réponse aux traitements, entre individus XX et individus XY. Dans l’espèce humaine, de telles différences sont notamment observées dans le cas de maladies neurodégénératives, comme les maladies de Parkinson ou d’Alzheimer [72–74]. La maladie de Parkinson est 1,5 fois plus fréquente chez les hommes et la diminution des fonctions motrices et cognitives est plus rapide que chez les femmes [74]. Dans le cas de la maladie d’Alzheimer, deux tiers des patients sont des femmes, qui présentent un déclin cognitif et une dégénérescence neuronale plus lents que les hommes, mais souffrent plus souvent de démence [72]. Il est cependant à noter que l’espérance de vie plus longue des femmes pourrait contribuer à leur surreprésentation. Par ailleurs, les femmes sont plus fréquemment touchées par la dépression et les troubles anxieux pathologiques alors que les hommes sont plus souvent atteints de troubles de l’attention avec hyperactivité ou d’autisme [75] (Figure 4A). Dans le cas de ces dernières affections, le diagnostic peut être subjectif.
 |
Figure 4 Biais de sexe dans le compartiment neural. A. De nombreuses maladies neurodégénératives et déficits mentaux montrent des biais entre les sexes (* plus de femmes sont touchées par la maladie d’Alzheimer, leur mortalité plus tardive peut contribuer à ce biais). B. Les cerveaux humains mâles et femelles montrent des différences dans le volume de certaines aires (mesures obtenues par imagerie par résonance magnétique [IRM] [78]). Les zones en orange ou vert correspondent respectivement aux zones plus volumineuses dans le cerveau femelle ou mâle. C. Carte du chromosome X humain montrant les gènes associés à un phénotype dans le système nerveux central (informations issues de la base de données OMIM), associés à un retard mental (XLID [87]) ou échappant à l’inactivation du chromosome X dans le compartiment neural (d’après [46]). TDAH : trouble de déficit de l’attention avec/sans hyperactivité ; SNC : système nerveux central ; XLID : X-linked intellectual disability. |
Des dimorphismes sexuels apparaissent dès le développement précoce. Le cerveau embryonnaire de rat femelle à 14 jours de développement – avant la période d’influence des hormones gonadiques sur l’organisation cérébrale – est, par exemple, constitué d’un plus grand nombre de neurones dopaminergiques comparé au cerveau de rat mâle [76]. Chez la souris, les neurones hypothalamiques embryonnaires XX présentent une arborisation névritique plus complexe et des axones plus longs que les neurones XY [77]. Ainsi, des dimorphismes sexuels d’anatomie régionale du cerveau sont établis au cours du développement. Ils s’illustrent, à l’âge adulte, par des variations de volume de matière grise des différentes aires cérébrales [78] (Figure 4B). L’utilisation de souris modèle QGP a également révélé des différences de stratégies d’apprentissage et de niveau d’impulsivité liées au sexe génétique [79]. Des écarts comportementaux entre individus XX et XY dans les domaines de l’addiction, de la résistance à la souffrance, de l’alimentation, du sommeil ou des interactions sociales ont également été documentés en étudiant ces modèles murins [80]. Du point de vue moléculaire, le développement des techniques de séquençage à haut-débit de l’ARN a permis l’analyse des profils d’expression des gènes sur des régions spécifiques du cerveau, ou sur cellules cérébrales uniques, et la comparaison des signatures moléculaires entre patients XX et XY atteints de maladie neurodégénérative. Ces études révèlent des différences profondes non seulement au niveau des populations cellulaires perturbées ou des processus biologiques dérégulés, mais aussi des différences structurelles d’activité transcriptionnelle globale des gènes dans certains types cellulaires. L’ensemble de ces observations suggère que 1) des dimorphismes sexuels intrinsèques aux cellules neurales sont établis au cours du développement et pourraient contribuer à des fonctionnements cérébraux différents entre mâles et femelles, 2) les cellules cérébrales XX et XY ont des propriétés sensiblement distinctes qui sont, en partie, définies par leurs chromosomes sexuels, et 3) ces dimorphismes agissent probablement sur les processus physiopathologiques. Il est cependant à préciser que la façon dont ces différences moléculaires et cellulaires modifient – ou non – les fonctions cérébrales reste à déterminer.
Le chromosome X possède la caractéristique unique de la plus grande proportion en gènes participant aux fonctions neurophysiologiques de tout le caryotype humain (six fois plus que sur les autosomes). Comme corollaire, de nombreuses mutations associées à des phénotypes de retards mentaux touchent des gènes du chromosome X (Figure 4C). De plus, les niveaux d’ARN messagers issus de gènes du chromosome X sont plus élevés dans le système nerveux que dans les autres tissus, une particularité conservée au cours de l’évolution des mammifères, qui suggère que le niveau d’expression contribue particulièrement au bon fonctionnement des cellules du compartiment neural [81]. En ce sens, la perturbation de l’inactivation du chromosome X induit des défauts de formation du tube neural chez la souris femelle [44] alors que son érosion altère la capacité de différenciation des cellules souches pluripotentes humaines en cellules neurales [82]. L’identité des gènes du chromosome X dont la dose nécessite une régulation stringente au cours du développement neural n’est pas encore connue.
De nombreux gènes du chromosome X aux fonctions neurales échappent à l’inactivation du chromosome X dans plusieurs types cellulaires et interviennent dans des mécanismes régulateurs généraux de l’expression des gènes (Figure 4C). Il s’agit notamment de régulateurs de la traduction ou de la stabilité des protéines, via le contrôle de leur ubiquitination, ou de remodeleurs de la chromatine. Entre autres, KDM6A (lysine demethylase 6A), une H3K27 déméthylase qui joue un rôle clé dans la régulation de la transcription du génome, constitue l’un des rares cas où l’effet protecteur d’une plus forte dose sur la neurotoxicité a été avéré in vitro et dans un modèle murin d’Alzheimer en l’absence d’influence hormonale [83]. Cependant, dans la plupart des cas, les effets multiples de ces gènes, conjointement aux hormones sexuelles, entravent la mesure précise de l’impact de la dose. Par ailleurs, ces gènes à échappement constitutif sont généralement plus fortement exprimés que ceux dont l’échappement facultatif ne se produit que dans certaines cellules du cerveau et leur perturbation provoque des phénotypes marqués plus faciles à détecter. Une approche plus systématique associée au développement de modèles cellulaires qui récapitulent la complexité des interactions entre cellules du cerveau en l’absence d’hormone sexuelle semble donc cruciale à l’identification des acteurs du chromosome X responsables de dimorphismes fonctionnels.
Conclusion
L’élucidation des fondements moléculaires à l’origine des différences physiologiques entre sexes représente un enjeu important de la recherche actuelle. L’un des défis à venir concerne l’identification des gènes du chromosome X inactif conférant des spécificités aux cellules femelles. Il s’agira ensuite de comprendre comment ces gènes sont régulés dans chaque type cellulaire, depuis un chromosome globalement verrouillé au niveau chromatinien, puis comment le traitement différentiel de ces gènes est mis en place au moment de la spécification des cellules au cours du développement ou bien aux sites de différenciation active (hématopoïèse, neurogenèse) dans les organes adultes. D’un point de vue évolutif, il est tentant de spéculer que ce système de compensation de dose pourrait avoir été maintenu chez les mammifères pour les avantages que procure la possibilité de jouer sur la dose de produits de certains gènes du chromosome X, en les déréprimant sur le chromosome X inactif dans des situations précises, une sous-population cellulaire particulière, en réaction à des changements métaboliques, ou au cours du vieillissement. La possibilité de moduler le degré de mosaïcisme de l’inactivation du chromosome X dans certains contextes pourrait également être avantageuse [48,84]. La plasticité de l’inactivation du chromosome X semble particulière dans les cellules du système immunitaire et potentiellement dans le compartiment neural mais pourrait s’étendre, peut-être sous d’autres formes de régulation, à d’autres systèmes cellulaires intégrés tels que la crypte intestinale, le système pileux, etc. Par ailleurs, l’étude des modèles murins permettant de distinguer l’effet du sexe chromosomique de l’influence des hormones gonadiques suggère une contribution du deuxième chromosome X dans d’autres types d’affections, comme les maladies métaboliques ou les maladies cardiovasculaires [85]. Il est nécessaire de développer des systèmes cellulaires modèles pour décrypter les mécanismes dans l’espèce humaine. L’utilisation d’organoïdes cérébraux ou la reconstitution du système immunitaire à partir de cellules souches embryonnaires pourrait permettre d’étudier ces questions dans un contexte isogénique affranchi d’influences hormonales. Ces modèles cellulaires pourraient aussi permettre de recréer in vitro les interactions entre cellules immunitaires et neurones qui pourraient participer aux réponses inflammatoires spécifiquement observées dans le cerveau des femmes atteintes de maladie d’Alzheimer ou au niveau des lésions des cellules nerveuses chez les patientes atteintes de sclérose en plaques, une maladie autoimmune à fort biais féminin [86].
Du point de vue thérapeutique, il apparaît que des dérégulations des processus biologiques similaires chez les individus XX et XY peuvent avoir des causes moléculaires différentes et donc nécessiter un traitement adapté à chaque sexe. On peut en effet imaginer que certains traitements peuvent avoir des conséquences bénéfiques sur un sexe et nulles ou néfastes sur l’autre. Dans les cas où un effet protecteur lié au niveau d’expression de gènes spécifiques du chromosome X a été démontré, une piste thérapeutique pourrait être de modifier la dose du produit de ces gènes dans l’autre sexe pour lui conférer les mêmes avantages. De façon plus générale, une meilleure compréhension des mécanismes moléculaires de dimorphismes sexuels apporte un éclairage scientifique objectif sur les différences – ou l’absence de différence – entre les sexes.
Remerciements
Merci à Charbel Alfeghaly pour les profils H3K27me3 et RAP-seq de XIST présentés dans la Figure 2C et à l’ensemble des membres de l’équipe « ARN non-codants, différenciation et développement » (UMR7216) pour les discussions régulières. Merci à Katia Ancelin pour la relecture et les discussions régulières ainsi qu’à toute l’équipe « Épigénétique et organisation nucléaire dans la recombinaison et le développement » (Institut Cochin, U1016, UMR8104).
Liens d’intérêt
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Le modèle de souris QGP (à « quatre génotypes principaux », FCG en anglais) permet d’étudier la contribution des chromosomes sexuels X et Y dans la physiologie et physiopathologie des mammifères en s’affranchissant de la contribution des hormones sexuelles produites par les ovaires ou les testicules. Pour cela, le gène Sry, déterminant testiculaire normalement localisé sur le chromosome Y, a été déplacé sur un autosome. Ainsi, quatre génotypes de souris peuvent être générés : des souris XX et XY porteuses du gène Sry et possédant donc des testicules (appelées respectivement souris XXT et XYT), et des souris XX et XY ne portant pas le gène Sry et possédant donc des ovaires (appelées respectivement souris XXO et XYO).
Références
- Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol 2016 ; 16 : 626–38. [CrossRef] [PubMed] [Google Scholar]
- Souyris M, Mejía JE, Chaumeil J, et al. Female predisposition to TLR7-driven autoimmunity: gene dosage and the escape from X chromosome inactivation. Semin Immunopathol 2019 ; 41 : 153–64. [CrossRef] [PubMed] [Google Scholar]
- Mauvais-Jarvis F, Bairey Merz N, Barnes PJ, et al. Sex and gender: modifiers of health, disease, and medicine. Lancet 2020 ; 396 : 565–82. [CrossRef] [PubMed] [Google Scholar]
- Anesi N, Miquel C-H, Laffont S, et al. The Influence of Sex Hormones and X Chromosome in Immune Responses. In : Klein SL, Roberts CW, editors. Sex and Gender Differences in Infection and Treatments for Infectious Diseases. Current Topics in Microbiology and Immunology. Cham : Springer International Publishing, 2023 : pp. 21–59. [Google Scholar]
- Li F, Xing X, Jin Q, et al. Sex differences orchestrated by androgens at single-cell resolution. Nature 2024 ; 629 : 193–200. [CrossRef] [PubMed] [Google Scholar]
- Chi L, Liu C, Gribonika I, et al. Sexual dimorphism in skin immunity is mediated by an androgen-ILC2-dendritic cell axis. Science 2024 ; 384 : eadk6200. [CrossRef] [PubMed] [Google Scholar]
- Gardner DK, Larman MG, Thouas GA. Sex-related physiology of the preimplantation embryo. Mol Hum Reprod 2010 ; 16 : 539–47. [CrossRef] [PubMed] [Google Scholar]
- Werner RJ, Schultz BM, Huhn JM, et al. Sex chromosomes drive gene expression and regulatory dimorphisms in mouse embryonic stem cells. Biol Sex Differ 2017 ; 8 : 28. [CrossRef] [PubMed] [Google Scholar]
- De Vries GJ, Rissman EF, Simerly RB, et al. A model system for study of sex chromosome effects on sexually dimorphic neural and behavioral traits. J Neurosci 2002 ; 22 : 9005–14. [CrossRef] [PubMed] [Google Scholar]
- Raznahan A, Disteche CM. X-chromosome regulation and sex differences in brain anatomy. Neurosci Biobehav Rev 2021 ; 120 : 28–47. [CrossRef] [PubMed] [Google Scholar]
- Leitão E, Schröder C, Parenti I, et al. Systematic analysis and prediction of genes associated with monogenic disorders on human chromosome X. Nat Commun 2022 ; 13 : 6570. [CrossRef] [PubMed] [Google Scholar]
- Libert C, Dejager L, Pinheiro I. The X chromosome in immune functions: when a chromosome makes the difference. Nat Rev Immunol 2010 ; 10 : 594–604. [CrossRef] [PubMed] [Google Scholar]
- Burgoyne PS, Arnold AP. A primer on the use of mouse models for identifying direct sex chromosome effects that cause sex differences in non-gonadal tissues. Biol Sex Differ 2016 ; 7 : 68. [CrossRef] [PubMed] [Google Scholar]
- Mahadevaiah S. Mouse homologues of the human AZF candidate gene RBM are expressed in spermatogonia and spermatids, and map to a Y chromosome deletion interval associated with a high incidence of sperm abnormalities. Hum Mol Genet 1998 ; 7 : 715–27. [CrossRef] [PubMed] [Google Scholar]
- Panten J, Prete SD, Cleland JP, et al. Four-Core Genotypes mice harbour a 3.2MB X-Y translocation that perturbs Tlr7 dosage. bioRxiv 2023 ; 2023.12.04.569933. [Google Scholar]
- Arnold AP. X chromosome agents of sexual differentiation. Nat Rev Endocrinol 2022 ; 18 : 574–83. [CrossRef] [PubMed] [Google Scholar]
- Pessia E, Engelstädter J, Marais GAB. The evolution of X chromosome inactivation in mammals: the demise of Ohno’s hypothesis? Cell Mol Life Sci 2014 ; 71 : 1383–94. [CrossRef] [PubMed] [Google Scholar]
- Pessia E, Makino T, Bailly-Bechet M, et al. Mammalian X chromosome inactivation evolved as a dosage-compensation mechanism for dosage-sensitive genes on the X chromosome. Proc Natl Acad Sci USA 2012 ; 109 : 5346–51. [CrossRef] [PubMed] [Google Scholar]
- Deng X, Hiatt JB, Nguyen DK, et al. Evidence for compensatory upregulation of expressed X-linked genes in mammals, Caenorhabditis elegans and Drosophila melanogaster. Nat Genet 2011 ; 43 : 1179–85. [CrossRef] [PubMed] [Google Scholar]
- Ohno S, Kaplan WD, Kinosita R. Formation of the sex chromatin by a single X-chromosome in liver cells of Rattus norvegicus. Exp Cell Res 1959 ; 18 : 415–18. [CrossRef] [PubMed] [Google Scholar]
- Loda A, Collombet S, Heard E. Gene regulation in time and space during X-chromosome inactivation. Nat Rev Mol Cell Biol 2022 ; 23 : 231–49. [CrossRef] [PubMed] [Google Scholar]
- Petropoulos S, Edsgärd D, Reinius B, et al. Single-Cell RNA-Seq Reveals Lineage and X Chromosome Dynamics in Human Preimplantation Embryos. Cell 2016 ; 165 : 1012–26. [CrossRef] [PubMed] [Google Scholar]
- Moscatelli M, Rougeulle C. Dernières nouvelles du chromosome X – Des principes généraux nuancés. Med Sci (Paris) 2021 ; 37 : 152–8. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Alfeghaly C, Castel G, Cazottes E, et al. XIST dampens X chromosome activity in a SPEN-dependent manner during early human development. Nat Struct Mol Biol 2024. doi: 10.1038/s41594-024-01325-3. [PubMed] [Google Scholar]
- Dror I, Chitiashvili T, Tan SYX, et al. XIST directly regulates X-linked and autosomal genes in naive human pluripotent cells. Cell 2024 ; 187 : 110–29.e31. [CrossRef] [PubMed] [Google Scholar]
- Pereira G, Dória S. X-chromosome inactivation: implications in human disease. J Genet 2021 ; 100 : 63. [CrossRef] [PubMed] [Google Scholar]
- Werner JM, Ballouz S, Hover J, et al. Variability of cross-tissue X-chromosome inactivation characterizes timing of human embryonic lineage specification events. Dev Cell 2022 ; 57 : 1995–2008.e5. [CrossRef] [PubMed] [Google Scholar]
- Jacobson EC, Pandya-Jones A, Plath K. A lifelong duty: how Xist maintains the inactive X chromosome. Curr Opin Genet Dev 2022 ; 75 : 101927. [CrossRef] [PubMed] [Google Scholar]
- Engreitz JM, Pandya-Jones A, McDonel P, et al. The Xist lncRNA exploits three-dimensional genome architecture to spread across the X chromosome. Science 2013 ; 341 : 1237973. [CrossRef] [PubMed] [Google Scholar]
- Hauth A, Panten J, Kneuss E, et al. Escape from X inactivation is directly modulated by levels of Xist non-coding RNA. bioRxiv 2024 ; 2024.02.22.581559. [PubMed] [Google Scholar]
- Patrat C, Ouimette J-F, Rougeulle C. X chromosome inactivation in human development. Development 2020 ; 147 : dev183095. [CrossRef] [PubMed] [Google Scholar]
- Okamoto I, Nakamura T, Sasaki K, et al. The X chromosome dosage compensation program during the development of cynomolgus monkeys. Science 2021 ; 374 : eabd8887. [CrossRef] [PubMed] [Google Scholar]
- Marahrens Y, Panning B, Dausman J, et al. Xist-deficient mice are defective in dosage compensation but not spermatogenesis. Genes Dev 1997 ; 11 : 156–66. [CrossRef] [PubMed] [Google Scholar]
- Borensztein M, Syx L, Ancelin K, et al. Xist-dependent imprinted X inactivation and the early developmental consequences of its failure. Nat Struct Mol Biol 2017 ; 24 : 226–33. [CrossRef] [PubMed] [Google Scholar]
- Yang L, Yildirim E, Kirby JE, et al. Widespread organ tolerance to Xist loss and X reactivation except under chronic stress in the gut. Proc Natl Acad Sci USA 2020 ; 117 : 4262–72. [CrossRef] [PubMed] [Google Scholar]
- Adrianse RL, Smith K, Gatbonton-Schwager T, et al. Perturbed maintenance of transcriptional repression on the inactive X-chromosome in the mouse brain after Xist deletion. Epigenetics & Chromatin 2018 ; 11 : 50. [CrossRef] [PubMed] [Google Scholar]
- Yildirim E, Kirby JE, Brown DE, et al. Xist RNA is a potent suppressor of hematologic cancer in mice. Cell 2013 ; 152 : 727–42. [CrossRef] [PubMed] [Google Scholar]
- Vallot C, Ouimette J-F, Makhlouf M, et al. Erosion of X Chromosome Inactivation in Human Pluripotent Cells Initiates with XACT Coating and Depends on a Specific Heterochromatin Landscape. Cell Stem Cell 2015 ; 16 : 533–46. [CrossRef] [PubMed] [Google Scholar]
- Anguera MC, Sadreyev R, Zhang Z, et al. Molecular Signatures of Human Induced Pluripotent Stem Cells Highlight Sex Differences and Cancer Genes. Cell Stem Cell 2012 ; 11 : 75–90. [CrossRef] [PubMed] [Google Scholar]
- Richart L, Picod-Chedotel M-L, Wassef M, et al. XIST loss impairs mammary stem cell differentiation and increases tumorigenicity through Mediator hyperactivation. Cell 2022 ; 185 : 2164–83.e25. [CrossRef] [PubMed] [Google Scholar]
- Huret C, Ferrayé L, David A, et al. Altered X-chromosome inactivation predisposes to autoimmunity. Sci Adv 2024 ; 10 : eadn6537. [CrossRef] [PubMed] [Google Scholar]
- Yu B, Qi Y, Li R, et al. B cell-specific XIST complex enforces X-inactivation and restrains atypical B cells. Cell 2021 ; 184 : 1790–803.e17. [CrossRef] [PubMed] [Google Scholar]
- Yang T, Ou J, Yildirim E. Xist exerts gene-specific silencing during XCI maintenance and impacts lineage-specific cell differentiation and proliferation during hematopoiesis. Nat Commun 2022 ; 13 : 4464. [CrossRef] [PubMed] [Google Scholar]
- Delbridge ARD, Kueh AJ, Ke F, et al. Loss of p53 Causes Stochastic Aberrant X-Chromosome Inactivation and Female-Specific Neural Tube Defects. Cell Rep 2019 ; 27 : 442–54.e5. [CrossRef] [PubMed] [Google Scholar]
- Hosoi Y, Soma M, Shiura H, et al. Female mice lacking Ftx lncRNA exhibit impaired X-chromosome inactivation and a microphthalmia-like phenotype. Nat Commun 2018 ; 9 : 3829. [CrossRef] [PubMed] [Google Scholar]
- Tukiainen T, Villani A-C, Yen A, et al. Landscape of X chromosome inactivation across human tissues. Nature 2017 ; 550 : 244–8. [CrossRef] [PubMed] [Google Scholar]
- Fang H, Disteche CM, Berletch JB. X Inactivation and Escape: Epigenetic and Structural Features. Front Cell Dev Biol 2019 ; 7 : 219. [CrossRef] [PubMed] [Google Scholar]
- Gylemo B, Bensberg M, Nestor CE. A whole-organism landscape of X-inactivation in humans. bioRxiv 2023 ; 2023.06.26.546519. [Google Scholar]
- Fink AL, Engle K, Ursin RL, et al. Biological sex affects vaccine efficacy and protection against influenza in mice. Proc Natl Acad Sci USA 2018 ; 115 : 12477–82. [CrossRef] [PubMed] [Google Scholar]
- Scully EP, Haverfield J, Ursin RL, et al. Considering how biological sex impacts immune responses and COVID-19 outcomes. Nat Rev Immunol 2020 ; 20 : 442–7. [CrossRef] [PubMed] [Google Scholar]
- Takahashi T, Iwasaki A. Sex differences in immune responses. Science 2021 ; 371 : 347–8. [CrossRef] [PubMed] [Google Scholar]
- Billi AC, Kahlenberg JM, Gudjonsson JE. Sex bias in autoimmunity. Curr Opin Rheumatol 2019 ; 31 : 53–61. [CrossRef] [PubMed] [Google Scholar]
- Laffont S, Guéry J-C. Deconstructing the sex bias in allergy and autoimmunity: From sex hormones and beyond. Adv Immunol 2019 ; 142 : 35–64. [CrossRef] [PubMed] [Google Scholar]
- Smith EMD, Lythgoe H, Midgley A, et al. Juvenile-onset systemic lupus erythematosus: Update on clinical presentation, pathophysiology and treatment options. Clin Immunol 2019 ; 209 : 108274. [CrossRef] [PubMed] [Google Scholar]
- Scofield RH, Bruner GR, Namjou B, et al. Klinefelter’s syndrome (47,XXY) in male systemic lupus erythematosus patients: support for the notion of a gene-dose effect from the X chromosome. Arthritis Rheum 2008 ; 58 : 2511–7. [CrossRef] [PubMed] [Google Scholar]
- Bai J, Qiao J, Wu Y, et al. Systemic lupus erythematosus in a patient with Turner syndrome. An Bras Dermatol 2015 ; 90 : 600–1. [CrossRef] [PubMed] [Google Scholar]
- Liu K, Kurien BT, Zimmerman SL, et al. X Chromosome Dose and Sex Bias in Autoimmune Diseases: Increased Prevalence of 47,XXX in Systemic Lupus Erythematosus and Sjögren’s Syndrome. Arthritis Rheumatol 2016 ; 68 : 1290–300. [CrossRef] [PubMed] [Google Scholar]
- Syrett CM, Anguera MC. When the balance is broken: X-linked gene dosage from two X chromosomes and female-biased autoimmunity. J Leukoc Biol 2019 ; 106 : 919–32. [CrossRef] [PubMed] [Google Scholar]
- Youness A, Miquel C-H, Guéry J-C. Escape from X Chromosome Inactivation and the Female Predominance in Autoimmune Diseases. Int J Mol Sci 2021 ; 22 : 1114. [CrossRef] [PubMed] [Google Scholar]
- Hewagama A, Gorelik G, Patel D, et al. Overexpression of X-linked genes in T cells from women with lupus. J Autoimmun 2013 ; 41 : 60–71. [CrossRef] [PubMed] [Google Scholar]
- Wang J, Syrett CM, Kramer MC, et al. Unusual maintenance of X chromosome inactivation predisposes female lymphocytes for increased expression from the inactive X. Proc Natl Acad Sci USA 2016 ; 113 : E2029–38. [CrossRef] [PubMed] [Google Scholar]
- Syrett CM, Paneru B, Sandoval-Heglund D, et al. Altered X-chromosome inactivation in T cells may promote sex-biased autoimmune diseases. JCI Insight 2019 ; 4 : 126751. [CrossRef] [PubMed] [Google Scholar]
- Pyfrom S, Paneru B, Knox JJ, et al. The dynamic epigenetic regulation of the inactive X chromosome in healthy human B cells is dysregulated in lupus patients. Proc Natl Acad Sci USA 2021 ; 118 : e2024624118. [CrossRef] [PubMed] [Google Scholar]
- Youness A, Cenac C, Faz-López B, et al. TLR8 escapes X chromosome inactivation in human monocytes and CD4+ T cells. Biol Sex Differ 2023 ; 14 : 60. [CrossRef] [PubMed] [Google Scholar]
- Sierra I, Pyfrom S, Weiner A, et al. Unusual X chromosome inactivation maintenance in female alveolar type 2 cells is correlated with increased numbers of X-linked escape genes and sex-biased gene expression. Stem Cell Reports 2023 ; 18 : 489–502. [CrossRef] [PubMed] [Google Scholar]
- Souyris M, Cenac C, Azar P, et al. TLR7 escapes X chromosome inactivation in immune cells. Sci Immunol 2018 ; 3 : eaap8855. [CrossRef] [PubMed] [Google Scholar]
- Deane JA, Pisitkun P, Barrett RS, et al. Control of toll-like receptor 7 expression is essential to restrict autoimmunity and dendritic cell proliferation. Immunity 2007 ; 27 : 801–10. [CrossRef] [PubMed] [Google Scholar]
- Pisitkun P, Deane JA, Difilippantonio MJ, et al. Autoreactive B cell responses to RNA-related antigens due to TLR7 gene duplication. Science 2006 ; 312 : 1669–72. [CrossRef] [PubMed] [Google Scholar]
- Syrett CM, Sindhava V, Sierra I, et al. Diversity of Epigenetic Features of the Inactive X-Chromosome in NK Cells, Dendritic Cells, and Macrophages. Front Immunol 2018 ; 9 : 3087. [Google Scholar]
- Lovell CD, Jiwrajka N, Amerman HK, et al. Xist Deletion in B Cells Results in Systemic Lupus Erythematosus Phenotypes. bioRxiv 2024 ; 2024.05.15.594175. [PubMed] [Google Scholar]
- Dou DR, Zhao Y, Belk JA, et al. Xist ribonucleoproteins promote female sex-biased autoimmunity. Cell 2024 ; 187 : 733–49.e16. [CrossRef] [PubMed] [Google Scholar]
- Guo L, Zhong MB, Zhang L, et al. Sex Differences in Alzheimer’s Disease: Insights From the Multiomics Landscape. Biological Psychiatry 2022 ; 91 : 61–71. [CrossRef] [PubMed] [Google Scholar]
- López-Cerdán A, Andreu Z, Hidalgo MR, et al. Unveiling sex-based differences in Parkinson’s disease: a comprehensive meta-analysis of transcriptomic studies. Biol Sex Differ 2022 ; 13 : 68. [CrossRef] [PubMed] [Google Scholar]
- Reekes TH, Higginson CI, Ledbetter CR, et al. Sex specific cognitive differences in Parkinson disease. NPJ Parkinsons Dis 2020 ; 6 : 7. [CrossRef] [PubMed] [Google Scholar]
- Pinares-Garcia P, Stratikopoulos M, Zagato A, et al. Sex: A Significant Risk Factor for Neurodevelopmental and Neurodegenerative Disorders. Brain Sci 2018 ; 8 : E154. [CrossRef] [PubMed] [Google Scholar]
- Beyer C, Pilgrim C, Reisert I. Dopamine content and metabolism in mesencephalic and diencephalic cell cultures: sex differences and effects of sex steroids. J Neurosci 1991 ; 11 : 1325–33. [CrossRef] [PubMed] [Google Scholar]
- Cabrera Zapata LE, Garcia-Segura LM, Cambiasso MJ, et al. Genetics and Epigenetics of the X and Y Chromosomes in the Sexual Differentiation of the Brain. Int J Mol Sci 2022 ; 23 : 12288. [CrossRef] [PubMed] [Google Scholar]
- Liu S, Seidlitz J, Blumenthal JD, et al. Integrative structural, functional, and transcriptomic analyses of sex-biased brain organization in humans. Proc Natl Acad Sci USA 2020 ; 117 : 18788–98. [CrossRef] [PubMed] [Google Scholar]
- Aarde SM, Genner RM, Hrncir H, et al. Sex chromosome complement affects multiple aspects of reversal-learning task performance in mice. Genes Brain Behav 2021 ; 20 : e12685. [CrossRef] [PubMed] [Google Scholar]
- Arnold AP. Four Core Genotypes and XY* mouse models: Update on impact on SABV research. Neurosci Biobehav Rev 2020 ; 119 : 1–8. [CrossRef] [PubMed] [Google Scholar]
- Zechner U, Wilda M, Kehrer-Sawatzki H, et al. A high density of X-linked genes for general cognitive ability: a run-away process shaping human evolution? Trends Genet 2001 ; 17 : 697–701. [CrossRef] [PubMed] [Google Scholar]
- Motosugi N, Sugiyama A, Okada C, et al. De-erosion of X chromosome dosage compensation by the editing of XIST regulatory regions restores the differentiation potential in hPSCs. Cell Rep Methods 2022 ; 2 : 100352. [CrossRef] [PubMed] [Google Scholar]
- Davis EJ, Broestl L, Abdulai-Saiku S, et al. A second X chromosome contributes to resilience in a mouse model of Alzheimer’s disease. Sci Transl Med 2020 ; 12 : eaaz5677. [CrossRef] [PubMed] [Google Scholar]
- Sun Y, Luo Y, Qian Y, et al. Heterozygous Deletion of the SHOX Gene Enhancer in two Females With Clinical Heterogeneity Associating With Skewed XCI and Escaping XCI. Front Genet 2019 ; 10 : 1086. [CrossRef] [PubMed] [Google Scholar]
- Wiese CB, Avetisyan R, Reue K. The impact of chromosomal sex on cardiometabolic health and disease. Trends Endocrinol Metab 2023 ; 34 : 652–65. [CrossRef] [PubMed] [Google Scholar]
- Kodama L, Gan L. Do Microglial Sex Differences Contribute to Sex Differences in Neurodegenerative Diseases? Trends Mol Med 2019 ; 25 : 741–9. [CrossRef] [PubMed] [Google Scholar]
- Neri G, Schwartz CE, Lubs HA, et al. X-linked intellectual disability update 2017. Am J Med Genet 2018 ; 176 : 1375–88. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 Processus de compensation de dose et conséquences sur l’expression des gènes du chromosome X. A. Selon l’hypothèse de Susumu Ohno, une pression de sélection s’applique au niveau de l’individu et induit le rééquilibrage du niveau d’expression des gènes du chromosome X par rapport aux gènes des autosomes par surexpression des gènes du X chez le mâle et la femelle [20]. La compensation de dose du chromosome X entre les sexes est ensuite réalisée par l’inactivation aléatoire de l’un des deux chromosomes X dans les cellules femelles. B. Dans l’espèce humaine, les cellules de l’épiblaste pré-implantatoire de l’embryon femelle se caractérisent par une expression atténuée des gènes de chaque chromosome X. En hybridation in situ sur ARN, les molécules d’ARN XIST sont accumulées au niveau des deux chromosomes X ; les gènes du chromosome sont toujours transcrits (image de gauche). L’inactivation aléatoire du chromosome X est mise en place au moment de l’implantation et conduit à un épiblaste post-implantatoire mosaïque pour l’expression des gènes du chromosome X. l’ARN XIST ne décore plus qu’un seul chromosome et les gènes de ce chromosome sont éteints (image de droite) (ARN XIST en vert, gène du chromosome X en rouge, ADN du noyau marqué au DAPI en bleu, échelle = 5 μm). C. Au niveau cellulaire, ces systèmes de compensation conduisent, théoriquement, à une transcription de chaque allèle deux fois supérieure par rapport aux allèles autosomiques (graphique en haut à gauche). Le produit des gènes du chromosome X (ARN matures et protéines) provient soit des allèles maternels soit des allèles paternels chez les femelles et seulement des allèles maternels chez les mâles (graphique en haut à droite). Les produits autosomiques sont, quant à eux constitués d’un mélange de protéines paternelles et maternelles (graphique en haut à droite). Le niveau de chaque produit est le même dans toutes les configurations. Le mosaïcisme d’expression spécifique aux femelles peut varier selon les organes, et le niveau d’expression des gènes du chromosome X maternel ou paternel peut théoriquement être biaisé (graphique du bas). Chez les mâles, la présence de variant ou de mutation sur le chromosome X s’exprime donc forcément au niveau phénotypique. Chez les femelles, néanmoins, l’inactivation du chromosome X et le mosaïsme qui en résulte, complique la prédiction phénotypique. |
| Dans le texte | |
 |
Figure 2 Mécanisme d’inactivation du chromosome X. A. L’inactivation du chromosome X est provoquée par l’accumulation de l’ARN XIST au niveau du futur chromosome X inactif (Xi) visualisée par hybridation in situ à l’aide de sondes spécifiques fluorescentes (image de gauche : ARN XIST en rouge, ADN du noyau marqué au DAPI en bleu ; échelle = 5 mm). L’ARN XIST permet le recrutement, via ses régions répétées A, B, C et E, et la concentration locale de nombreux facteurs protéiques (complexe ribonucléoprotéique XIST-RNP, décrit sur le panneau de droite). Les complexes XIST-RNP sont impliqués dans des étapes cruciales pour la mise en place et le maintien de l’inactivation du chromosome X : 1) localisation en cis des XIST-RNP le long du chromosome X ; 2) la répression transcriptionnelle des gènes du chromosome X ; 3) les changements conformationnels et chromatiniens aboutissant à l’hétérochromatinisation et à la formation du compartiment répressif du chromosome X inactif ; et 4) le maintien de l’état inactif au cours de la différenciation et des divisions cellulaires. Ces agrégations de complexes XIST-RNP jalonnent le territoire du chromosome X inactif (halo jaune) dans environ 50 sites distincts [28]. Les gènes qui échappent à l’inactivation du chromosome X sont délocalisés en dehors du territoire du chromosome X inactif et restent ainsi accessibles aux machineries transcriptionnelles. B. L’accumulation de XIST-RNP est associée à l’apposition de marques de chromatine répressives H3K27me3 et H2AK119ub, ici visualisées par immunofluorescence (respectivement en vert et en rouge) dans le même noyau (ADN du noyau marqué au DAPI en bleu ; échelle = 5 mm). C. Carte du chromosome X humain montrant les gènes soumis à l’inactivation et ceux y échappant spécifiquement dans chaque tissu ou de façon plus ubiquitaire (panneau de gauche ; adapté de [46]). Les gènes échappant à l’inactivation (exemple de KDM6A) montrent des couvertures inférieures en ARN XIST (RAP [RNA antisense purification]-seq) et des niveaux plus faibles de marques répressives d’histone (CUT&RUN [cleavage under targets and release using nuclease]) par rapport aux gènes sujets à inactivation (exemple de POLA1 [DNA polymerase alpha 1]) (panneau central, d’après [24]). Ces gènes sont transcrits à partir des deux chromosomes X comparés aux gènes soumis à l’inactivation, ici illustré par les images d’hybridation in situ sur ARN à droite (transcrits naissants de KDM6A ou POLA1 en vert, ARN XIST en rouge, ADN du noyau marqué au DAPI en bleu ; échelle = 5 μm). |
| Dans le texte | |
 |
Figure 3 Chromosome X et biais de sexe dans la réponse immunitaire. A. La susceptibilité aux maladies auto-immunes (notamment le lupus érythémateux systémique) augmente avec le nombre de chromosomes X présents dans les cellules des individus. B. Principaux gènes du système immunitaire (SI) portés par le chromosome X humain et décrits comme échappant à l’inactivation du chromosome X chez l’Homme ou la souris. La position du gène XIST est montrée en vert. A gauche, gènes du chromosome X associés à une maladie touchant le système immunitaire (informations extraites de la base de données OMIM [Online Mendelian Inheritance in Man]). C. La régulation dynamique de l’inactivation du chromosome X dans le compartiment immunitaire pourrait permettre l’expression de gènes du système immunitaire (tels que TLR7) à partir du/des chromosome(s) X inactif(s), induisant une réponse immunitaire plus efficace chez les femmes XX, XXX ainsi que chez les hommes XXY, mais également une susceptibilité accrue aux maladies auto-immunes. Tandis que les cellules progénitrices hématopoïétiques présentent un chromosome X inactif recouvert par un nuage compact d’ARN XIST et les marques chromatiniennes répressives associées (H3K27me3, H2AK119ub, macroH2A), ces caractéristiques sont perdues au cours de leur différenciation et reviennent lors de l’activation des lymphocytes B et des lymphocytes T. chr. : chromosome ; Xi : chromosome X inactif ; Xa : chromosome X actif ; NK : natural killer (Figure réalisée avec l’aide de Biorender). |
| Dans le texte | |
 |
Figure 4 Biais de sexe dans le compartiment neural. A. De nombreuses maladies neurodégénératives et déficits mentaux montrent des biais entre les sexes (* plus de femmes sont touchées par la maladie d’Alzheimer, leur mortalité plus tardive peut contribuer à ce biais). B. Les cerveaux humains mâles et femelles montrent des différences dans le volume de certaines aires (mesures obtenues par imagerie par résonance magnétique [IRM] [78]). Les zones en orange ou vert correspondent respectivement aux zones plus volumineuses dans le cerveau femelle ou mâle. C. Carte du chromosome X humain montrant les gènes associés à un phénotype dans le système nerveux central (informations issues de la base de données OMIM), associés à un retard mental (XLID [87]) ou échappant à l’inactivation du chromosome X dans le compartiment neural (d’après [46]). TDAH : trouble de déficit de l’attention avec/sans hyperactivité ; SNC : système nerveux central ; XLID : X-linked intellectual disability. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




