| Issue |
Med Sci (Paris)
Volume 40, Number 12, Décembre 2024
Épigénétique : développement et destin cellulaire
|
|
|---|---|---|
| Page(s) | 947 - 954 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024178 | |
| Published online | 20 December 2024 | |
Expositions environnementales et modifications de l’épigénome dans la période des 1000 premiers jours de vie
Environmental exposures and epigenome changes within the first 1000 days of life
Université Grenoble Alpes, Inserm, CNRS, Team of environmental epidemiology applied to development and respiratory health, IAB, Grenoble, France
*
johanna.lepeule@univ-grenoble-alpes.fr
Les expositions environnementales précoces peuvent influencer le développement et la santé de l’enfant à long terme. Des modifications épigénétiques pourraient partiellement expliquer ces effets, et leur identification conduire à des progrès significatifs dans la compréhension des mécanismes impliqués. Dans cette revue, nous présentons les données récentes en épidémiologie épigénétique et environnementale pendant la période des 1 000 premiers jours de vie concernant plusieurs expositions très courantes, dont le tabac, les phénols et les phtalates, les polluants de l’air, la température ambiante et la végétation.
Abstract
Early environmental exposures can have long-term effects on child’s development and health. Epigenetic modifications may partly explain these effects, and studying them could lead to significant advances in our understanding of the underlying mechanisms. This review summarises recent data on epigenetic and environmental epidemiology during the first 1000 days of life for several common exposures, including tobacco, phenols and phthalates, air pollutants, ambient temperature and vegetation.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Biorender.com).
Intérêt de l’étude des marques épigénétiques dans le contexte de la DOHaD
Les effets des expositions environnementales précoces (in utero et postnatales précoces) sur le développement et la santé de l’enfant, notamment les maladies cardio-métaboliques, respiratoires ou les troubles neurodéveloppementaux, constituent un riche domaine de recherche. Ces maladies ont vu leur prévalence augmenter partout dans le monde ces dernières décennies [1] et constituent un enjeu majeur de santé publique.
Les 1 000 premiers jours de la vie, depuis la conception jusqu’aux deux ans de l’enfant, sont une période critique pendant laquelle les organes se développent rapidement et simultanément, et sont particulièrement vulnérables aux agressions environnementales. Lorsque la femme enceinte et le fœtus sont exposés à des conditions stressantes, la physiologie maternelle s’adapte, notamment pour protéger le fœtus, et celuici adapte parfois aussi son métabolisme pour survivre, avec de potentielles conséquences pour sa santé future. C’est à partir d’observations faites dès les années 1980 par l’épidémiologiste britannique David Barker qu’a émergé au début des années 2000 le concept de la DOHaD (Developmental Origins of Health and Disease) (→). Celui-ci se concentre sur l’étude des effets sanitaires à court et long termes des expositions environnementales subies durant la phase de développement (vie fœtale et premières années de la vie) [2]. Des études réalisées chez l’animal ont fourni des preuves des effets à court et long termes de nombreuses expositions fœtales, notamment la nutrition et les perturbateurs endocriniens, mais aussi les polluants de l’air [3]. La compréhension des mécanismes biologiques sous-jacents à ces effets reste cependant limitée, et l’hypothèse d’une programmation développementale, reposant notamment sur des modifications épigénétiques au cours du développement, particulièrement plausible, a été émise [3]. En effet, l’épigénome, grâce à une plasticité remarquable, subit une reprogrammation considérable au cours de la gamétogenèse, du stade embryonnaire préimplantatoire, de l’organogenèse et du développement [4]. Les modifications épigénétiques précoces pourraient être des biomarqueurs d’exposition et expliquer des mécanismes conduisant à des effets sur la santé de l’enfant ou de l’adulte (Figure 1).
(→) Voir le numéro thématique DOHaD, m/s n° 1, janvier 2016
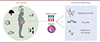 |
Figure 1 Rôle des expositions environnementales sur les marques épigénétiques pendant la période périnatale. |
Chez l’homme, de nombreuses études suggèrent que des mécanismes épigénétiques peuvent être altérés par des facteurs environnementaux, tels que les polluants chimiques et physiques [5]. La méthylation de l’ADN est le mécanisme le mieux compris et le plus étudié à l’échelle épidémiologique, avec des études qui incluent plusieurs milliers de participants. Les analyses statistiques reposent sur différentes approches dont la plus courante est une approche agnostique (sans hypothèse a priori) pangénomique qui teste l’association entre la méthylation des cytosines au niveau de chaque site de dinucléotides CpG (CpGme) et l’exposition étudiée (epigenome wide association study, EWAS) pour identifier les sites différentiellement méthylés. Ces analyses peuvent s’accompagner de la recherche de régions, composées de plusieurs sites CpG adjacents, différentiellement méthylées (DMR, differentially methylated region). Une approche alternative consiste à cibler certains sites CpG sélectionnés a priori dans les séquences de gènes candidats, pour leur pertinence dans les processus étudiés. D’autres études peuvent reposer sur la déviation chez les individus exposés de l’âge épigénétique (estimé à partir de la méthylation de l’ADN) par rapport à l’âge clinique (horloge épigénétique). Depuis quelques années, l’implication des micro ARN (miARN) dans la réponse aux expositions est également analysée. En revanche, examiner les modifications d’histones à l’échelle d’une étude épidémiologique de plusieurs milliers de sujets s’avère aujourd’hui irréalisable.
La plupart des études ont été conduites sur des échantillons de sang de cordon ou de placenta. Le placenta est un tissu particulièrement pertinent. C’est un organe transitoire qui joue un rôle clé dans la programmation fœtale. Il assure le transport des nutriments et de l’oxygène vers le fœtus, permet l’élimination des déchets et régule les échanges gazeux ainsi que les interactions hormonales entre la mère et le fœtus. Le placenta agit comme une barrière partielle que de nombreux produits chimiques (fumée de tabac, phénols, phtalates, particules fines) peuvent toutefois traverser et atteindre le fœtus. Il est ainsi considéré comme une « archive moléculaire » précise des expositions environnementales pendant la grossesse [6].
L’objectif de cette revue est de présenter un état des connaissances sur les associations entre les expositions maternelles, au cours de la grossesse, à différents facteurs environnementaux et les marques épigénétiques telles que la méthylation de l’ADN et les miARN pendant la période périnatale des 1 000 jours. Elle traite plus précisément des expositions au tabac, aux phénols synthétiques, aux phtalates, ainsi qu’aux polluants atmosphériques, à la température ambiante et au déficit de végétation. Ces expositions durant la grossesse ont toutes été associées, à différents niveaux, à des effets délétères sur la santé de la mère et du fœtus (retard de croissance intra-utérin, troubles du développement des systèmes respiratoire et neurologique de l’enfant). Les phénols et les phtalates, les polluants atmosphériques, la température ambiante et le déficit de végétation sont des expositions passives et ubiquitaires en population générale [7].
Le tabac, bien qu’étant une exposition davantage liée au comportement individuel, est également traité dans cette revue car il partage certaines similitudes avec les polluants atmosphériques en matière de composition chimique, de toxicité et de voie d’exposition. L’exposition au tabac au cours de la grossesse est associée à de nombreux effets sur le développement de l’enfant. Pour chaque exposition, cette revue s’attache à faire émerger les connaissances épidémiologiques et les enjeux spécifiques. Les problématiques et enjeux communs au champ de recherche de l’épigénétique environnementale sont discutés.
Exposition maternelle au tabac
Le tabac est un mélange toxique et cancérigène de plus de 5 000 produits chimiques. En France, la prévalence de la consommation de tabac au cours du troisième trimestre de la grossesse est estimée à 16 % [8]. Elle est probablement sous-estimée en raison de la stigmatisation et de la pression sociale et médicale exercée sur les femmes enceintes qui fument. De nombreuses revues de la littérature, publiées au cours des dernières années, synthétisent l’état de la connaissance actuelle sur l’association entre exposition au tabac pendant la grossesse et modifications épigénétiques [9].
Dans le sang de cordon, une méta-analyse des résultats d’EWAS provenant de 13 cohortes de naissance du consortium Pregnancy and Childhood Epigenetics (PACE) [10] a montré que l’exposition du fœtus au tabagisme maternel était associée à une méthylation différenciée de CpG localisés sur les gènes AHRR, GFI1 et CYP1A1. Les gènes AHRR et CYP1A1 ont un rôle clé dans la voie de signalisation du récepteur d’aryl hydrocarbone (AhR), qui intervient dans la détoxification des composants de la fumée de tabac. Quant au gène GFI1, il est impliqué dans divers processus liés au développement.
Bien que moins fréquentes, certaines études épidémiologiques ont analysé dans le tissu placentaire recueilli à la naissance les effets sur la méthylation de l’ADN de la consommation de tabac pendant la grossesse. Dans le cadre du consortium PACE, une méta-analyse des résultats de 7 cohortes a montré qu’une exposition du fœtus au tabagisme maternel était associée à une méthylation différentiée de sites CpG du gène LINC00886-LEKR1 dans le placenta [11]. En comparant les niveaux de méthylation de l’ADN placentaire chez 568 femmes enceintes de la cohorte française EDEN1, les auteurs ont identifié à la fois des DMR ayant des altérations dites « réversibles » (qui étaient présentes dans le placenta des femmes ayant fumé du tabac pendant la grossesse, mais pas chez les femmes ayant arrêté de fumer avant la grossesse) et des altérations « non réversibles » (identifiées chez des anciennes fumeuses dont le placenta n’a pas été exposé directement à la cigarette, et chez les fumeuses tout au long de la grossesse). Ces résultats suggèrent que la consommation de tabac antérieure à la grossesse peut affecter les niveaux de méthylation de l’ADN du placenta, mais également qu’une partie de ces effets « disparaît » lors de l’arrêt de la consommation de tabac [12].
Deux études centrées sur des gènes candidats et menées sur le sang de cordon [13] et sur le placenta [14] ont montré que des enfants exposés au tabac pendant la grossesse présentent une expression placentaire accrue du gène CYP1A1 [13] et diminuée du gène AHRR comparé à des enfants non exposés [14].
Peu d’études se sont intéressées à la persistance, à moyen et à long termes, des effets d’une exposition tabagique prénatale sur la méthylation de l’ADN des enfants. Dans l’étude longitudinale britannique ALSPAC (Avon Longitudinal Study of Parents and Children), des CpG différentiellement méthylés des gènes AHRR, MYO1G, CYP1A1 et CNT-NAP2 dans le sang de cordon étaient également retrouvés dans le sang de l’enfant à 7 et à 17 ans. Ceci suggère que des modifications peuvent persister à long terme après une exposition prénatale au tabac [15]. Peu d’études se sont focalisées sur les associations entre exposition au tabac pendant la grossesse et expression des miARN. Dans l’une des premières études, Maccani et al. ont montré, à partir d’une analyse centrée sur des gènes candidats dans le placenta, que l’expression de trois miARN (miR-16, miR-21 et miR-146a), impliqués dans les processus de croissance et de développement de l’enfant, était associée à une exposition au tabac pendant la grossesse [16]. Dans le sang de cordon d’enfants exposés, Herberth et al. ont identifié une augmentation de l’expression du miARN miR-223, qui pourrait être impliqué dans le risque d’allergies chez l’enfant [17]. Une étude récente menée sur 1 200 enfants inclus dans le projet européen Human Early Life Exposome (HELIX), comprenant des analyses de méthylation de l’ADN et d’expression de miARN [18], montre qu’une exposition au tabac pendant la grossesse est associée à des modifications de la méthylation de l’ADN de 41 sites CpG dans le sang de l’enfant à l’âge de 8 ans. En revanche, aucune association significative n’a été identifiée entre l’exposition in utero du fœtus au tabac et l’expression des miARN. Les auteurs ont également identifié un effet dose-réponse dans les marques moléculaires liées au tabagisme.
L’identification des sites CpG ou des DMR qui pourraient jouer un rôle de médiateur des effets d’une exposition in utero au tabac vis-à-vis de la santé ultérieure de l’enfant est une perspective des études épigénétiques. Elle suppose le développement de méthodes d’analyses de médiation spécifiques à la grande dimension et à la corrélation des sites candidats. À notre connaissance, quelques études ont pu identifier des gènes (notamment les gènes AHRR, GFI1, MYO1G, BLCAP, SKI et COASY) dont les niveaux de méthylation pourraient expliquer une partie des effets liés à une exposition au tabac pendant la grossesse vis-à-vis du poids de naissance de l’enfant [19] et de l’âge gestationnel [20].
Exposition maternelle aux phénols et phtalates
Les perturbateurs endocriniens se lient à certains récepteurs nucléaires (comme les récepteurs des œstrogènes ou des glucocorticoïdes), qui participent à la régulation de l’expression génique via différents mécanismes, dont la modification des marques épigénétiques. De nombreux produits chimiques sont connus ou soupçonnés d’être des perturbateurs endocriniens. Ici, nous nous concentrons sur deux familles de composés : les phénols synthétiques et les phtalates en raison de leur utilisation dans de nombreux produits de consommation courante, et de leur courte demi-vie qui en font des cibles intéressantes pour la prévention. Les sources d’exposition à ces composés proviennent de différents types de plastiques (par exemple, polychlorure de vinyle [PVC ; phtalates] et polycarbonate [ bisphénols]), des produits de soins personnels et cosmétiques (parabènes, triclosan) ou des fixateurs d’encre (bisphénols). Concernant les phtalates, plusieurs études ont eu recours à une approche centrée sur des gènes candidats et ont inclus au plus deux gènes. Ces études ont permis, entre autres, d’identifier des associations négatives entre les métabolites du di-2-éthylhexyl phtalate (DEHP), utilisé notamment dans les plastiques de type PVC, et la méthylation de l’ADN placentaire (diminution) de IGF2, un gène soumis à empreinte parentale codant un facteur de croissance [21,22]. Ces associations étaient parfois différenciées selon le sexe de l’enfant, avec des associations principalement observées dans les placentas de fœtus féminins [21]. Les autres associations observées comprenaient des associations négatives entre le statut de méthylation du gène H19 [21] et des éléments répétés LINE-1 (long interspersed nuclear element-1) [23] en lien avec l’exposition globale à tous les phtalates (qui prend en compte la somme des concentrations d’exposition) et aux phtalates caractérisés par une faible masse moléculaire. À notre connaissance, seules deux études à l’échelle de l’épigénome sur le placenta ont été publiées. L’une s’intéressait à plus de 850 000 sites CpG mais la puissance statistique et la généralisation des résultats étaient limitées par le fait qu’elle comprenait seulement 16 placentas [24]. L’autre étude fournissait des informations sur la méthylation d’environ 450 000 sites CpG dans 200 placentas de fœtus masculins, collectés à la naissance, et rapportait des associations positives (augmentation de la méthylation) entre la plupart des phtalates et au moins une DMR [25]. Des associations avec des sites CpG liés au gène IGF2 étaient également rapportées. Cependant, contrairement à celles observées par LaRocca et al. [21], ces associations étaient positives.
Pour ce qui est du sang de cordon, une étude portant sur les effets de l’exposition à un mélange de phtalates et de bisphénol A pendant la grossesse n’a pas mis en évidence d’association significative avec les marques de méthylation [26].
Concernant les phénols, la plupart des études sont soit focalisées sur quelques gènes candidats [21,27], soit faites avec une taille d’échantillon limitée (par exemple, n = 6 pour l’analyse à l’échelle de l’épigénome) [28] et/ou portent sur l’effet d’un seul composé, le bisphénol A. Deux études à l’échelle de l’épigénome avec des tailles importantes de population ont cependant été réalisées à partir de deux cohortes françaises distinctes. La première, se fondant sur la cohorte EDEN, inclue neuf composés de la famille des phénols et montre de nombreuses associations positives entre la méthylation de l’ADN placentaire et l’exposition à un composé en particulier, le triclosan (un biocide utilisé dans des produits d’hygiène et de soins personnels) [29]. Certaines de ces associations ont été retrouvées dans la seconde étude, portant sur la cohorte plus récente SEPAGES2 [30]. L’effet de ce composé n’a pas été évalué dans les études disposant de données de méthylation de l’ADN dans le sang de cordon.
Les études sur la méthylation de l’ADN à l’échelle de l’épigénome avec une taille d’échantillon significative sont encore rares. Néanmoins, les quelques études publiées pointent vers un effet du triclosan sur une augmentation de la méthylation de l’ADN placentaire [29,30]. Les approches centrées sur des gènes candidats suggèrent également une diminution de la méthylation de l’ADN placentaire sur des sites CpG localisés sur le gène IGF2 en lien avec une exposition accrue aux métabolites du DEHP [21,22]. La majorité des études ont analysé l’effet de chaque composé et peu l’effet de mélange [26].
À ce jour, seules trois études ont examiné les effets de l’exposition aux phénols et aux phtalates sur l’expression des miARN dans le placenta humain [31–33] et aucune ne s’est intéressée au sang de cordon. Une étude se focalisant sur 29 miARN a révélé des associations entre les phtalates de faible masse moléculaire et des niveaux d’expression diminués du miR-185 [32]. Cette étude a par ailleurs mis en évidence des associations négatives entre les phénols et l’expression de deux autres miARN (miR-142-3p et miR-15a-5p). L’association avec miR-15a-5p était seulement observée chez les placentas de fœtus féminins. Ces miARN pourraient être impliqués dans les processus d’apoptose. Les deux autres études se sont focalisées sur le bisphénol A. L’une n’a pas mis en évidence d’association [33] tandis que l’autre n’a pas conduit d’analyses ajustées sur les facteurs de confusion [53] (→) et avait une taille de population réduite [31].
(→) Voir les mots de la science de J.P. Hardelin, m/s n° 4, avril 2024, page 381
Exposition ambiante aux polluants de l’air, à la température, et au déficit de végétation
En 2020, entre 71 % et 96 % de la population urbaine européenne était exposée à des niveaux de particules fines (PM10 et PM2,5)3 dépassant les recommandations de l’Organisation mondiale de la santé (OMS) [34,35]. Ces polluants, ainsi que le dioxyde d’azote (NO2), sont émis par le transport, certaines activités industrielles, le chauffage, l’agriculture, ou peuvent être d’origine naturelle (feux, érosion des sols). Les particules fines présentes dans l’air peuvent se révéler toxiques pour l’organisme. En particulier, des traces de particules ultrafines (d’un diamètre inférieur à 1 nm) de carbone inhalées par les femmes enceintes ont été retrouvées dans le sang de cordon, le placenta, ainsi que dans le foie, les poumons et le cerveau du fœtus [36].
Généralement, l’exposition aux polluants de l’air ambiant pendant la grossesse a été associée à une diminution du niveau de méthylation globale de l’ADN dans le sang de cordon et le placenta [37,38]. Des analyses EWAS et des approches centrées sur des gènes candidats, réalisées avec des cohortes mère-enfant européennes, nord-américaines et chinoises, ont aussi mis en évidence des associations entre l’exposition prénatale aux polluants majeurs de l’air et des modifications localisées des niveaux de méthylation de l’ADN touchant certains sites CpG et gènes dans le sang de cordon et le placenta. Les sites du génome qui sont affectés peuvent être spécifiques à chaque tissu [37].
Dans le sang de cordon, ces modifications épigénétiques touchent notamment des gènes codant des protéines mitochondriales et des protéines connues pour être impliquées dans les mécanismes de défense contre le stress oxydant [39].
Dans le placenta, plusieurs études ont mis en évidence un lien entre les niveaux d’exposition aux polluants de l’air, plus particulièrement au dioxyde d’azote, et la méthylation de gènes impliqués dans l’hypoxie, la pré-éclampsie4, l’inflammation, l’immunité, le neurodéveloppement et le métabolisme [40,41,37,42]. De plus, certains résultats suggèrent qu’une partie des sites affectés pourraient expliquer l’effet des polluants de l’air sur des indicateurs de croissance fœtale, comme le poids et le périmètre crânien à la naissance [41,42]. Par ailleurs, plusieurs études ont suggéré un effet du sexe de l’enfant sur les régions sensibles à ces modifications [37,41]. Ainsi, dans le placenta des fœtus masculins, des changements plus nombreux ont été observés dans la méthylation de l’ADN de gènes impliqués dans le neurodéveloppement ; alors que la méthylation de l’ADN placentaire des fœtus féminins montre un nombre plus important de modifications dans des gènes associés à la réponse au stress oxydant et à l’hypoxie [41]. Des études supplémentaires seront nécessaires pour évaluer si ces modifications épigénétiques jouent un rôle, protecteur ou délétère, sur la santé de l’enfant.
L’exposition à des évènements climatiques extrêmes
En France, la fréquence, l’intensité, et la durée des vagues de chaleur augmentent, faisant peser un risque sur la santé des femmes enceintes. Dans la cohorte française EDEN, treize DMR ont été identifiées en lien avec l’exposition prénatale à la température et à l’humidité relative pour différentes fenêtres d’exposition [40]. Cinq de ces DMR étaient notamment localisées sur le gène codant la protéine TRIM26 (tripartite motif-containing protein 26), une E3 ubiquitine ligase impliquée dans la régulation de la réponse antivirale et à différentes formes de stress oxydant.
Une étude chinoise, publiée en 2020, s’est intéressée plus particulièrement au gène soumis à empreinte parentale H19, impliqué dans l’embryogénèse et la croissance du placenta [43]. La méthylation de l’ADN de ce gène, mesurée dans le sang de cordon chez 550 participants, est négativement associée à la température et à l’humidité relative estimées durant le premier trimestre de grossesse mais positivement associée à ces paramètres durant le troisième trimestre. Des associations sont également observées au second trimestre avec la durée d’ensoleillement. Les auteurs évoquent un possible rôle du stress thermique et des rayons ultraviolets qui sont capables de modifier l’expression de l’ADN méthyltransférase impliquée dans les processus de méthylation de l’ADN. Une seconde étude menée chez 567 couples mère-enfant s’est focalisée sur la méthylation de l’ADN du promoteur du gène GPR61 qui code la G protein-coupled receptor 61, capable d’affecter le métabolisme énergétique [44]. Elle conclue sur le rôle important de la méthylation de l’ADN du gène GPR61, mesurée dans le sang de cordon, dans la relation liant l’exposition moyenne à l’humidité relative et la variation de température journalière pendant la grossesse, avec le poids de naissance. Les recherches doivent se poursuivre en impliquant, plus particulièrement, les groupes d’individus les plus affectés par le changement climatique.
L’exposition aux espaces verts
L’exposition aux espaces verts est associée à de nombreux effets bénéfiques sur la santé, y compris des issues de grossesse plus favorables. Différents mécanismes pourraient entrer en jeu, notamment : une promotion de l’activité physique, des interactions sociales ou une réduction de l’exposition aux polluants atmosphériques. Dans un contexte d’urbanisation croissante, des travaux de recherche ont été initiés afin de définir les possibles mécanismes épigénétiques sous-jacents.
Une étude publiée en 2023 s’est intéressée aux associations entre l’exposition prénatale aux espaces naturels et une accélération de l’âge épigénétique gestationnel chez 1 359 couples mère-enfant recrutés à Rotterdam [45]. Les espaces naturels (espaces verts et « bleus »5) étaient caractérisés par plusieurs méthodes. L’âge épigénétique gestationnel était calculé grâce aux horloges épigénétiques de Bohlin’s et Knight’s fondées sur la méthylation de l’ADN, respectivement de 96 et 148 sites CpG, mesurée dans le sang de cordon. Les chercheurs n’observent pas d’association significative entre l’exposition prénatale aux différentes mesures d’espaces naturels et une accélération de l’âge épigénétique gestationnel. Ils concluent sur la nécessité de s’intéresser à un plus grand nombre de sites CpG dans de futurs travaux.
Cette recommandation fait le lien avec les recherches de Alfano et al., publiées en 2023, s’appuyant sur 538 couples mère-enfant de la cohorte belge ENVIRONAGE (ENVIRonmental influence ON early AGEing) [46]. Cette étude a examiné le rôle de l’exposition aux espaces naturels avec une approche EWAS couvrant 396 641 sites CpG. Elle s’est intéressée plus particulièrement à l’exposition à la végétation non agricole, et a mis en évidence des associations entre les différents indicateurs de végétation et 147 DMR mesurées dans le sang de cordon. Parmi ces régions, 85 étaient toujours significatives après prise en compte de l’exposition aux PM2,5. Plusieurs DMR étaient portées par le gène HLA-DRB5 (lié au complexe majeur d’histocompatibilité et à certains troubles neurologiques) et le gène RPTOR (codant une protéine régulant la prolifération cellulaire). D’autres DMR étaient localisées sur des gènes déjà associés à l’exposition aux espaces verts dans des études antérieures tels que les gènes KCNQ1DN (un ARN long non codant soumis à empreinte parentale), PRSS36 (codant la sérine protéase 36) ou ZNF274 (codant une protéine à doigt de zinc). Ce travail corrobore les conclusions d’une étude similaire soulignant une association significative entre l’exposition à la végétation et la méthylation du gène HTR2A mesurée dans le placenta [47]. Ce gène code un récepteur de la sérotonine (5-hydroxytryptamine receptor 2A), jouant un rôle crucial dans le développement du cerveau chez le fœtus et dans les fonctions cognitives de l’adulte. Ces travaux se focalisent sur la quantité d’espaces verts mais la qualité, l’accessibilité et l’attractivité pourraient aussi jouer un rôle important.
Très peu de travaux se sont intéressés aux liens entre l’exposition à la pollution atmosphérique et l’expression des miARN dans le placenta humain [48,49] ou le sang de cordon [50], et aucun n’a exploré les liens avec la végétation ou la chaleur ambiante. Une étude a mesuré l’expression de six miARN (miR-16, miR-20a, miR-21, miR-34a, miR-146a, miR-222) impliqués dans le cycle cellulaire, la prolifération, l’apoptose, l’inflammation et l’angiogenèse, dans 210 échantillons de placenta, et a montré une association positive de l’expression de miR-20a avec l’exposition aux PM2,5 au premier trimestre, tandis qu’au deuxième trimestre l’expression de miR-21a, miR-146a et miR-222 était négativement associée à l’exposition [49]. Par ailleurs, l’expression de miR-21 était positivement associée à l’exposition aux PM2,5 au premier trimestre, mais négativement associée au deuxième trimestre. Le gène suppresseur de tumeur PTEN (phosphatase et homologue de la tensine) a été identifié comme une cible commune des miARN significativement associés à l’exposition aux particules fines. Plus récemment, un travail expérimental a montré que les PM10 pouvaient altérer l’expression de miR-125b-5p en ciblant le gène TXNRD1 et en supprimant les fonctions des cellules trophoblastiques [48].
Dans le sang de cordon, des niveaux d’expression plus faibles du cluster miR-17/92 ont été observés en association avec une exposition prénatale accrue aux PM2,5 [50]. Le cluster miR-17/92 est impliqué dans le développement, ainsi que dans le vieillissement et diverses maladies, il code six miARN agissant comme oncogènes.
Défis et perspectives de l’épigénétique environnementale
Le domaine de l’épigénétique environnementale dans le cadre de la DOHaD a connu un développement considérable au cours de la dernière décennie. L’enjeu est à la fois d’identifier et de mieux comprendre les mécanismes impliqués dans les associations observées entre l’environnement et la santé de la mère et de l’enfant, mais aussi d’identifier des biomarqueurs d’exposition, comme cela a pu être réalisé pour la consommation prénatale de tabac à partir d’échantillons de sang de cordon [51]. D’autres travaux, non évoqués dans cette revue, visent à utiliser les marques épigénétiques comme un biomarqueur précoce de maladies. Ainsi, l’épidémiologie épigénétique est un champ de recherche prometteur qui pourrait apporter des améliorations notables en santé publique et en médecine préventive et personnalisée.
Pour autant, ce champ est confronté à de nombreuses limites et des défis importants. Les plus saillants sont évoqués ci-après, mais le lecteur peut se référer à d’autres travaux plus détaillés [9,52]. La très grande majorité des travaux s’est focalisée sur la méthylation de l’ADN. La possibilité, récente pour les études épidémiologiques, de pouvoir disposer de données d’expression de miARN permettra de compléter ce panel de résultats. Les vastes ensembles de données épigénétiques posent des défis en termes de stockage, d’analyse et d’interprétation. En se concentrant sur des gènes spécifiques, les approches « gènes candidats » ne permettent pas d’identifier des schémas plus larges de méthylation à l’échelle du génome et limitent la découverte d’informations nouvelles liées à la méthylation de l’ADN. À l’inverse, les approches pangénomiques, qui analysent l’ensemble du génome, permettent de nouvelles découvertes, mais nécessitent des méthodes sophistiquées pour tenir compte des risques d’erreur et de fausse découverte. Pour maîtriser ces risques, la réplication et les méta-analyses jouent un rôle essentiel, et permettent de synthétiser les résultats de diverses études et renforcer la robustesse des conclusions, mais elles doivent surmonter des difficultés liées à l’hétérogénéité des données et des méthodologies. Ces défis nécessitent une collaboration interdisciplinaire et internationale ainsi qu’une évolution constante des méthodes statistiques pour permettre de fournir des résultats fiables, pertinents et applicables en santé publique. Le caractère dynamique des marques épigénétiques complique la détermination des relations causales et en fait un candidat potentiel pour le développement de médicaments. La spécificité tissulaire est également cruciale, car les modifications épigénétiques peuvent varier considérablement selon les types de tissus, rendant complexe la généralisation des résultats. La composition cellulaire des échantillons est une composante importante à estimer et à prendre en compte dans les analyses car elle influence les variations épigénétiques observées. Dans le futur, des approches sur cellules uniques devraient permettre de mieux comprendre l’impact de l’hétérogénéité cellulaire. Enfin, la question de l’effet des différences de méthylation de l’ADN observées sur l’expression des gènes reste souvent méconnue. Pour relever l’ensemble de ces défis, un effort concerté et collaboratif entre différentes spécialités, incluant l’épidémiologie, la biologie moléculaire, et la toxicologie, sera nécessaire pour mieux comprendre les effets des expositions environnementales sur l’épigénome et in fine, les effets sur la santé.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Guariguata L, Jeyaseelan S. Children and non-communicable disease - Global burden report 2019. [Google Scholar]
- Barker DJP. The developmental origins of adult disease. J Am Coll Nutr 2004 ; 23 : 588S–95S. [CrossRef] [PubMed] [Google Scholar]
- Barouki R, Melén E, Herceg Z, et al. Epigenetics as a mechanism linking developmental exposures to long-term toxicity. Environ Int 2018 ; 114 : 77–86. [CrossRef] [PubMed] [Google Scholar]
- Reik W, Dean W, Walter J. Epigenetic reprogramming in mammalian development. Science 2001 ; 293 : 1089–93. [CrossRef] [PubMed] [Google Scholar]
- Bakulski KM, Blostein F, London SJ. Linking Prenatal Environmental Exposures to Lifetime Health with Epigenome-Wide Association Studies: State-of-the-Science Review and Future Recommendations. Environ Health Perspect 2023 ; 131 : 126001. [CrossRef] [PubMed] [Google Scholar]
- Maccani MA, Marsit CJ. Epigenetics in the placenta. Am J Reprod Immunol 2009 ; 62 : 78–89. [CrossRef] [PubMed] [Google Scholar]
- Adélaïde L, Hough I, Seyve E, et al. Environmental and social inequities in continental France: an analysis of exposure to heat, air pollution, and lack of vegetation. J Expo Sci Environ Epidemiol 2024. https://doi.org/10.1038/s41370-024-00641-6. [Google Scholar]
- Demiguel V, Blondel B, Bonnet C, et al. Evolution de la consommation de tabac à l’occasion d’une grossesse en France en 2016. Bull Epidemiol Hebd 2018 ; 35. [Google Scholar]
- Nakamura A, François O, Lepeule J. Epigenetic Alterations of Maternal Tobacco Smoking during Pregnancy: A Narrative Review. Int J Environ Res Public Health 2021 ; 18 : 5083. [CrossRef] [PubMed] [Google Scholar]
- Joubert BR, Håberg SE, Nilsen RM, et al. 450K epigenome-wide scan identifies differential DNA methylation in newborns related to maternal smoking during pregnancy. Environ Health Perspect 2012 ; 120 : 1425–31. [CrossRef] [PubMed] [Google Scholar]
- Everson TM, Vives-Usano M, Seyve E, et al. Placental DNA methylation signatures of maternal smoking during pregnancy and potential impacts on fetal growth. Nat Commun 2021 ; 12 : 5095. [CrossRef] [PubMed] [Google Scholar]
- Rousseaux S, Seyve E, Chuffart F, et al. Immediate and durable effects of maternal tobacco consumption alter placental DNA methylation in enhancer and imprinted gene-containing regions. BMC Med 2020 ; 18 : 306. [CrossRef] [PubMed] [Google Scholar]
- Novakovic B, Ryan J, Pereira N, et al. Postnatal stability, tissue, and time specific effects of AHRR methylation change in response to maternal smoking in pregnancy. Epigenetics 2014 ; 9 : 377–86. [CrossRef] [PubMed] [Google Scholar]
- Suter M, Abramovici A, Showalter L, et al. In utero tobacco exposure epigenetically modifies placental CYP1A1 expression. Metabolism 2010 ; 59 : 1481–90. [CrossRef] [PubMed] [Google Scholar]
- Richmond RC, Timpson NJ, Sørensen TI. Exploring possible epigenetic mediation of early-life environmental exposures on adiposity and obesity development. Int J Epidemiol 2015 ; 44 : 1191–8. [CrossRef] [PubMed] [Google Scholar]
- Maccani MA, Knopik VS. Cigarette Smoke Exposure-Associated Alterations to Non-Coding RNA. Front Genet 2012 ; 3. [PubMed] [Google Scholar]
- Herberth G, Bauer M, Gasch M, et al. Maternal and cord blood miR-223 expression associates with prenatal tobacco smoke exposure and low regulatory T-cell numbers. J Allergy Clin Immunol 2014 ; 133 : 543–50. [CrossRef] [PubMed] [Google Scholar]
- Vives-Usano M, Hernandez-Ferrer C, Maitre L, et al. In utero and childhood exposure to tobacco smoke and multi-layer molecular signatures in children. BMC Medicine 2020 ; 18 : 243. [CrossRef] [PubMed] [Google Scholar]
- Küpers LK, Xu X, Jankipersadsing SA, et al. DNA methylation mediates the effect of maternal smoking during pregnancy on birthweight of the offspring. Int J Epidemiol 2015 ; 44 : 1224–37. [CrossRef] [PubMed] [Google Scholar]
- Jumentier B, Barrot C-C, Estavoyer M, et al. High-Dimensional Mediation Analysis: A New Method Applied to Maternal Smoking, Placental DNA Methylation, and Birth Outcomes. Environ Health Perspect 2023 ; 131 : 047011. [CrossRef] [PubMed] [Google Scholar]
- LaRocca J, Binder AM, McElrath TF, Michels KB. The impact of first trimester phthalate and phenol exposure on IGF2/H19 genomic imprinting and birth outcomes. Environ Res 2014 ; 133 : 396–406. [CrossRef] [PubMed] [Google Scholar]
- Zhao Y, Chen J, Wang X, et al. Third trimester phthalate exposure is associated with DNA methylation of growth-related genes in human placenta. Sci Rep 2016 ; 6 : 33449. [CrossRef] [PubMed] [Google Scholar]
- Zhao Y, Shi H, Xie C, et al. Prenatal phthalate exposure, infant growth, and global DNA methylation of human placenta. Environ Mol Mutagen 2015 ; 56 : 286–92. [CrossRef] [PubMed] [Google Scholar]
- Grindler NM, Vanderlinden L, Karthikraj R, et al. Exposure to Phthalate, an Endocrine Disrupting Chemical, Alters the First Trimester Placental Methylome and Transcriptome in Women. Sci Rep 2018 ; 8 : 6086. [CrossRef] [PubMed] [Google Scholar]
- Jedynak P, Tost J, Calafat AM, et al. Pregnancy exposure to phthalates and DNA methylation in male placenta - An epigenome-wide association study. Environ Int 2022 ; 160 : 107054. [CrossRef] [PubMed] [Google Scholar]
- Sol CM, Gaylord A, Santos S, et al. Fetal exposure to phthalates and bisphenols and DNA methylation at birth: the Generation R Study. Clinical Epigenetics 2022 ; 14 : 125. [CrossRef] [PubMed] [Google Scholar]
- Nahar MS, Liao C, Kannan K, et al. In utero bisphenol A concentration, metabolism, and global DNA methylation across matched placenta, kidney, and liver in the human fetus. Chemosphere 2015 ; 124 : 54–60. [CrossRef] [PubMed] [Google Scholar]
- Song X, Wang Z, Zhang Z, et al. Differential methylation of genes in the human placenta associated with bisphenol A exposure. Environ Res 2021 ; 200 : 111389. [CrossRef] [PubMed] [Google Scholar]
- Jedynak P, Tost J, Calafat AM, et al. Pregnancy exposure to synthetic phenols and placental DNA methylation - An epigenome-wide association study in male infants from the EDEN cohort. Environ Pollut 2021 ; 290 : 118024. [CrossRef] [PubMed] [Google Scholar]
- Jedynak P, Broséus L, Tost J, et al. Prenatal exposure to triclosan assessed in multiple urine samples and placental DNA methylation. Environ Pollut 2023 ; 335 : 122197. [CrossRef] [PubMed] [Google Scholar]
- De Felice B, Manfellotto F, Palumbo A, et al. Genome-wide microRNA expression profiling in placentas from pregnant women exposed to BPA. BMC Med Genomics 2015 ; 8 : 56. [CrossRef] [PubMed] [Google Scholar]
- LaRocca J, Binder AM, McElrath TF, Michels KB. First-Trimester Urine Concentrations of Phthalate Metabolites and Phenols and Placenta miRNA Expression in a Cohort of U.S. Women. Environ Health Perspect 2016 ; 124 : 380–87. [CrossRef] [PubMed] [Google Scholar]
- Li Q, Kappil MA, Li A, et al. Exploring the associations between microRNA expression profiles and environmental pollutants in human placenta from the National Children’s Study (NCS). Epigenetics 2015 ; 10 : 793–802. [CrossRef] [PubMed] [Google Scholar]
- European Environment Agency. Europe’s air quality status 2022. https://www.eea.europa.eu/ 2022. [Google Scholar]
- World Health Organization. Billions of people still breathe unhealthy air: new WHO data. https://www.who.int/ 2022. [Google Scholar]
- Bongaerts E, Lecante LL, Bové H, et al. Maternal exposure to ambient black carbon particles and their presence in maternal and fetal circulation and organs: an analysis of two independent population-based observational studies. Lancet Planet Health 2022 ; 6 : e804–11. [CrossRef] [PubMed] [Google Scholar]
- Ladd-Acosta C, Feinberg JI, Brown SC, et al. Epigenetic marks of prenatal air pollution exposure found in multiple tissues relevant for child health. Environ Int 2019 ; 126 : 363–76. [CrossRef] [PubMed] [Google Scholar]
- Janssen BG, Godderis L, Pieters N, et al. Placental DNA hypomethylation in association with particulate air pollution in early life. Part Fibre Toxicol 2013 ; 10 : 22. [CrossRef] [PubMed] [Google Scholar]
- Gruzieva O, Xu C-J, Breton CV, et al. Epigenome-Wide Meta-Analysis of Methylation in Children Related to Prenatal NO2 Air Pollution Exposure. Environ Health Perspect 2017 ; 125 : 104–10. [CrossRef] [PubMed] [Google Scholar]
- Abraham E, Rousseaux S, Agier L, et al. Pregnancy exposure to atmospheric pollution and meteorological conditions and placental DNA methylation. Environ Int 2018 ; 118 : 334–47. [CrossRef] [PubMed] [Google Scholar]
- Broséus L, Guilbert A, Hough I, et al. Placental DNA methylation signatures of prenatal air pollution exposure and potential effects on birth outcomes: an analysis of three prospective cohorts. Lancet Planet Health 2024 ; 8 : e297–308. [CrossRef] [PubMed] [Google Scholar]
- Zhao Y, Wang P, Zhou Y, et al. Prenatal fine particulate matter exposure, placental DNA methylation changes, and fetal growth. Environ Int 2021 ; 147 : 106313. [CrossRef] [PubMed] [Google Scholar]
- Yang M, He T, Jiang L, et al. The role of maternal methylation in the association between prenatal meteorological conditions and neonatal H19/H19-DMR methylation. Ecotoxicol Environ Saf. 2020 ; 197 : 110643. [CrossRef] [PubMed] [Google Scholar]
- Li ZY, Gong YX, Yang M, et al. Weather and Birth Weight: Different Roles of Maternal and Neonatal GPR61 Promoter Methylation. Biomed Environ Sci 2022 ; 35 : 181–93. [PubMed] [Google Scholar]
- Marques I, Santos S, Monasso GS, et al. Associations of green and blue space exposure in pregnancy with epigenetic gestational age acceleration. Epigenetics 2023 ; 18 : 2165321. [CrossRef] [PubMed] [Google Scholar]
- Alfano R, Bijnens E, Langie SAS, et al. Epigenome-wide analysis of maternal exposure to green space during gestation and cord blood DNA methylation in the ENVIRONAGE cohort. Environ Res 2023 ; 216 : 114828. [CrossRef] [PubMed] [Google Scholar]
- Dockx Y, Bijnens E, Saenen N, et al. Residential green space in association with the methylation status in a CpG site within the promoter region of the placental serotonin receptor HTR2A. Epigenetics 2022 ; 17 : 1863–74. [CrossRef] [PubMed] [Google Scholar]
- Chaiwangyen W, Pintha K, Tantipaiboonwong P, et al. PM10 Alters Trophoblast Cell Function and Modulates miR-125b-5p Expression. Biomed Res Int 2022 ; 2022 : 3697944. [CrossRef] [Google Scholar]
- Tsamou M, Vrijens K, Madhloum N, et al. Air pollution-induced placental epigenetic alterations in early life: a candidate miRNA approach. Epigenetics 2018 ; 13 : 135–46. [CrossRef] [PubMed] [Google Scholar]
- Tsamou M, Nawrot TS, Carollo RM, et al. Prenatal particulate air pollution exposure and expression of the miR-17/92 cluster in cord blood: Findings from the ENVIRONAGE birth cohort. Environ Int 2020 ; 142 : 105860. [CrossRef] [PubMed] [Google Scholar]
- Reese SE, Zhao S, Wu MC, et al. DNA Methylation Score as a Biomarker in Newborns for Sustained Maternal Smoking during Pregnancy. Environ Health Perspect 2017 ; 125 : 760–6. [CrossRef] [PubMed] [Google Scholar]
- Lecorguillé M, Lepeule J. Expositions environnementales pendant la grossesse et épigénétique chez l’enfant. Sages-Femmes 2022 ; 21 : 49–54. [CrossRef] [Google Scholar]
- Hardelin JP. Facteur « confondant » ou de confusion. Med Sci (Paris) 2024 ; 40 : 381. [CrossRef] [EDP Sciences] [Google Scholar]
Liste des figures
 |
Figure 1 Rôle des expositions environnementales sur les marques épigénétiques pendant la période périnatale. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




