| Issue |
Med Sci (Paris)
Volume 40, Number 11, Novembre 2024
|
|
|---|---|---|
| Page(s) | 812 - 815 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024142 | |
| Published online | 10 December 2024 | |
Perte de porosité de l’endothélium des capillaires sinusoïdes du foie et stéatose hépatique dysmétabolique
La signalisation par la sémaphorine 3A mise en cause
Semaphorin-3A signaling decreases the porosity of sinusoidal endothelial cells in steatotic liver diseases
1
Université Paris-Cité, Inserm, Centre de recherche sur l’inflammation, UMR1149, Paris, France
2
APHP, Hôpital Beaujon, Service d’hépatologie, DMU DIGEST, Centre de référence des maladies vasculaires du foie, FILFOIE, ERN RARE-LIVER, Clichy, France
3
APHP, Hôpital européen George Pompidou, Hôpital Corentin-Celton, Service de gériatrie, Institut CARPEM, Paris, France
Les avancées récentes de la recherche permettent de mieux comprendre l’association entre les maladies cardiovasculaires et hépatiques dans le contexte du syndrome métabolique. Le syndrome métabolique, comportant notamment le diabète et l’obésité, est fortement associé au développement de la stéatose hépatique dysmétabolique. Celle-ci peut évoluer en stéatohépatite, une forme potentiellement sévère de la maladie, caractérisée par une inflammation associée à la stéatose, une souffrance hépatocytaire, avec ou sans fibrose hépatique. Le métabolisme des lipides et du glucose est à l’interface entre la stéatose hépatique dysmétabolique et les maladies cardiovasculaires [1]. En effet, le foie reçoit des acides gras libres, des lipoprotéines et des glucides du sang, et produit des triglycérides, libérés dans la circulation sanguine sous forme de lipoprotéines de très basse densité (very low density lipoproteins, VLDL). L’échange de macromolécules entre le sang et le parenchyme hépatique est facilité par la présence, dans les cellules endothéliales des capillaires sinusoïdes, de petits pores, appelés fenêtres, permettant l’échange bidirectionnel de substrats entre les hépatocytes et le sang. Ces fenêtres, groupées en « plaques criblées », ont un diamètre compris entre 50 et 150 nm, et évoluent de manière dynamique (contraction ou dilatation) selon les conditions physiologiques [2]. Le processus pathologique associant une réduction du nombre et de la taille de ces fenêtres (diminution de la porosité de l’endothélium) et l’apparition d’une membrane basale (normalement inexistante) est connu sous le nom de « capillarisation » [3]. Eberhard et collaborateurs viennent de montrer comment une voie de signalisation reliant l’hyperlipidémie à la diminution de porosité de l’endothélium des sinusoïdes contribue à la stéatose hépatique dysmétabolique [4].
Une « capillarisation » des cellules endothéliales des sinusoïdes a été décrite lors de la stéatose hépatique dysmétabolique chez la souris et chez l’homme [3, 5]. Chez la souris, il a de plus été montré que lors d’une exposition excessive aux lipides, la capillarisation des cellules endothéliales sinusoïdales qu’elle entraîne favorise la stéatose et la stéatohépatite [3]. En effet, la perte de fenêtres dans l’endothélium des sinusoïdes hépatiques causée par l’inhibition de la voie de signalisation du facteur de croissance endothélial vasculaire A (VEGF-A) ou par la déficience en protéine associée aux vésicules plasmalemmiques (PLVAP) deux modulateurs de la perméabilité vasculaire entraîne une stéatose étendue. Bien qu’en raison de cette capillarisation des cellules endothéliales sinusoïdales, les lipoprotéines ne parviennent plus aux hépatocytes et s’accumulent dans le sang, une stéatose hépatique est induite. La principale hypothèse expliquant ce phénomène est un mécanisme compensatoire : la lipogenèse de novo dans les hépatocytes [3]. Inversement, l’augmentation de la porosité endothéliale des sinusoïdes hépatiques chez des souris rendues déficientes en phospholipase A2 du groupe IVA (IVA-PLA2) [6] ou en molécule d’adhérence vasculaire 1 (VCAM1) [7] diminue la fibrose hépatique dans un contexte de stéatohépatite dysmétabolique. Ainsi, même si le lien entre hyperlipidémie, perte de porosité endothéliale des sinusoïdes hépatiques, et stéatose hépatique est bien établi, les mécanismes moléculaires sous-jacents restent mal connus.
Eberhard et collaborateurs ont concentré leurs recherches sur la sémaphorine 3A (SEMA3A), notamment car on savait que la concentration plasmatique de cette sémaphorine augmente chez les personnes atteintes de stéatose hépatique dysmétabolique [8]. Les sémaphorines sont des protéines de signalisation pour de nombreux types de cellules, comme les cellules nerveuses, cardiovasculaires, hépatiques, ainsi que les cellules cancéreuses. La signalisation par les sémaphorines entraîne notamment des modifications du cytosquelette qui influent sur la forme des cellules. Ces chercheurs ont constaté que l’expression du gène SEMA3A dans les cellules endothéliales des sinusoïdes hépatiques est supérieure à son expression dans les hépatocytes, chez l’homme. De plus, ils ont observé que cette expression dans les cellules endothéliales sinusoïdales augmente dans un contexte de stéatose hépatique dysmétabolique : in vitro, en analysant des cellules endothéliales sinusoïdales humaines exposées à de l’acide palmitique, et in vivo, en analysant trois modèles murins différents de stéatose hépatique dysmétabolique (un modèle d’obésité et de diabète induits génétiquement, un modèle d’obésité induite génétiquement sans diabète, et un modèle d’obésité induite par l’alimentation).
Les fenêtres des cellules endothéliales des sinusoïdes hépatiques sont des structures dynamiques qui résultent d’un remodelage continu du cytosquelette de ces cellules. Eberhard et collègues ont montré que SEMA3A réduit la porosité des sinusoïdes hépatiques de façon dose-dépendante, par un contrôle du remodelage des filaments d’actine via une signalisation impliquant l’AMP cyclique (AMPc). Ils ont montré que SEMA3A active plusieurs kinases, telles que ROCK2 et PAK1, et que l’activité de la kinase LIMK1 est nécessaire pour induire pleinement la perte des fenêtres chez les souris. Pour analyser l’effet de SEMA3A in vivo, ils ont étudié des souris mutantes ayant une déficience hétérozygote ubiquitaire du gène Sema3a (souris de génotype Sema3a+/-). Ces souris, lorsqu’elles sont nourries avec un régime alimentaire standard (non gras), ont une plus grande porosité de leurs sinusoïdes hépatiques et un moindre degré de stéatose hépatique par rapport à des souris témoins de génotype « sauvage » (Sema3a+/+). Une réduction de la stéatose hépatique chez les souris Sema3a+/- a également été constatée lorsque les souris étaient soumises à un régime gras. Pour étayer l’hypothèse selon laquelle l’expression moindre de Sema3a dans les cellules endothéliales des sinusoïdes hépatiques était responsable des effets bénéfiques constatés chez les souris hétérozygotes pour la mutation ubiquitaire de ce gène, les auteurs ont produit des souris privées de SEMA3A uniquement dans les cellules endothéliales (par le système cre-lox inductible par le tamoxifène, avec l’expression de la recombinase cre sous contrôle du promoteur du gène de la cadhérine-5) et ont confirmé, chez ces mutants conditionnels, la diminution de la stéatose hépatique, associée à une augmentation de la sécrétion de VLDL par les hépatocytes, lorsque les souris étaient nourries avec un régime gras. Ce résultat confirme donc l’effet néfaste de SEMA3A produit par les cellules endothéliales sur l’accumulation de lipides dans le foie qui est responsable de la stéatose hépatique. Il convient cependant de noter que, dans ce modèle murin, l’expression de Sema3a n’est pas seulement supprimée dans les cellules endothéliales des sinusoïdes hépatiques, mais aussi dans les autres types de cellules endothéliales : on ne peut donc pas exclure la possibilité que des cellules endothéliales autres que celles des sinusoïdes hépatiques contribuent, au moins en partie, aux effets observés chez les souris mutantes.
Eberhard et collaborateurs ont de plus montré que SEMA3A interagit avec le corécepteur membranaire neuropiline-1 (NRP1) pour induire la « capillarisation » anormale des sinusoïdes et la stéatose hépatique. Or NRP1 est le corécepteur de plusieurs autres molécules de signalisation, incluant VEGF-A. NRP1 est notamment impliqué dans le métabolisme des lipides et la résistance à l’insuline associée à l’obésité [9]. En utilisant, in vitro, des cellules endothéliales sinusoïdales murines en culture primaire, incubées avec des anticorps bloquants dirigés contre les domaines de liaison spécifique de NRP1 à SEMA3 et à VEGF-A, ces auteurs ont montré que la « capillarisation » pathologique de ces cellules dépend du domaine de liaison à SEMA3A de NRP1 plutôt que de son domaine de liaison à VEGF-A. Étant donné que SEMA3A et VEGF-A ont été décrits comme ayant des effets opposés sur la porosité endothéliale des sinusoïdes hépatiques [10], la proportion de VEGF-A et SEMA3A, plutôt qu’un seul de ces facteurs, pourrait contrôler cette porosité et le développement de la stéatose hépatique (Figure 1).
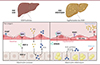 |
Figure 1. Modulateurs de la « capillarisation » des cellules endothéliales sinusoïdales hépatique dans la stéatose hépatique métabolique. En conditions physiologiques, la présence de petits pores, appelés « fenêtres » (fenestrae), dans les cellules endothéliales des sinusoïdes hépatiques (CESH) permet le transfert des acides gras libres (AGL) du sang vers les hépatocytes, où les lipoprotéines de très basse densité (VLDL) sont synthétisées et sécrétées dans le sang. La protéine associée aux vésicules du plasmalemme PLVAP et le facteur de croissance de l’endothélium vasculaire VEGF-A sont des modulateurs positifs de la formation et du maintien de ces fenêtres. Aux premiers stades de la stéatose hépatique dysmétabolique, les cellules endothéliales des sinusoïdes subissent un processus pathologique de « capillarisation », caractérisé par une diminution de leurs fenêtres et l’apparition d’une membrane basale sous l’endothélium, ce qui diminue sa porosité. Cela empêche l’entrée des AGL du sang dans les hépatocytes, conduisant à une hyperlipidémie. L’induction compensatoire d’une lipogenèse de novo dans les hépatocytes entraîne la stéatose hépatique. Dans la stéatose dysmétabolique, il a été montré précédemment que la molécule d’adhérence des cellules vasculaires VCAM1 et la phospholipase A2 du groupe IVA (IVA-PLA2) favorisent ce processus de « capillarisation », réduisant ainsi la porosité des sinusoïdes du foie. Eberhard et collaborateurs ont mis en évidence l’implication, dans ce processus, de la signalisation par la sémaphorine 3A (SEMA3A) / neuropiline 1 (NRP1), qui devient ainsi une nouvelle cible thérapeutique potentielle pour tenter de freiner le développement précoce de la stéatose hépatique dysmétabolique (4). |
Une stratégie thérapeutique visant à améliorer le fonctionnement des cellules endothéliales des sinusoïdes du foie a déjà été proposée contre la stéatose hépatique et la stéatohépatite dysmétaboliques, avec des molécules ciblant par exemple la voie de signalisation du monoxyde d’azote (NO) ou le stress oxydant [11]. Agir sur la porosité de cet endothélium en réduisant la signalisation par la sémaphorine 3A, comme le suggèrent Eberhard et collaborateurs, pourrait désormais constituer une nouvelle opportunité thérapeutique.
Comprendre le mécanisme de la « capillarisation » des cellules endothéliales des sinusoïdes hépatiques dans un contexte d’hyperlipidémie peut avoir des implications au-delà de la stéatose hépatique dysmétabolique. En particulier, il reste à explorer le lien entre diminution de la porosité des sinusoïdes hépatiques et complications cardiovasculaires dans le contexte du syndrome métabolique. De plus, il a été montré que cette porosité diminue aussi avec l’âge, un processus connu sous le nom de « pseudo-capillarisation » [11], et dont il convient de rechercher les éventuelles conséquences médicales afin d’évaluer son potentiel de cible thérapeutique dans les maladies liées au vieillissement.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Raggi P, Milic J, Manicardi M, et al. Metabolic dysfunction-associated steatotic liver disease: An opportunity for collaboration between cardiology and hepatology. Atherosclerosis 2024 ; 392 : 117523. [CrossRef] [PubMed] [Google Scholar]
- Braet F, Wisse E. Structural and functional aspects of liver sinusoidal endothelial cell fenestrae: a review. Comp Hepatol 2002 ; 1 : 1–17. [CrossRef] [PubMed] [Google Scholar]
- Hammoutene A, Rautou PE. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. J Hepatol 2019 ; 70 : 1278–91. [CrossRef] [PubMed] [Google Scholar]
- Eberhard D, Balkenhol S, et al. Semaphorin-3A regulates liver sinusoidal endothelial cell porosity and promotes hepatic steatosis. Nat Cardiovasc Res 2024 ; 3 : 734–53. [Google Scholar]
- Rautou PE, Wettstein G, Bedossa P, et al. Liver sinusoidal endothelial cell (LSEC) capillarization in NASH and its evolution following lanifibranor treatment: an exploratory study of the NATIVE clinical trial. Hepatology 2021 ; 74 : abstract 1874. [Google Scholar]
- Kawashita E, Ozaki T, Ishihara K, et al. Endothelial group IVA phospholipase A2 promotes hepatic fibrosis with sinusoidal capillarization in the early stage of non-alcoholic steatohepatitis in mice. Life Sci 2022 ; 294 : 120355. [CrossRef] [PubMed] [Google Scholar]
- Guo Q, Furuta K, Islam S, et al. Liver sinusoidal endothelial cell expressed vascular cell adhesion molecule 1 promotes liver fibrosis. Front Immunol 2022 ; 13 : 983255. [CrossRef] [PubMed] [Google Scholar]
- Šamadan L, Papić N, Mijić M, et al. Do semaphorins play a role in development of fibrosis in patients with nonalcoholic fatty liver disease? Biomedicines 2022 ; 10 : 3014. [CrossRef] [PubMed] [Google Scholar]
- Zhou J, Xu S, Zhu Y, et al. Inhibition of neuropilin-1 improves non-alcoholic fatty liver disease in high-fat-diet induced obese mouse. Minerva Endocrinol (Torino) 2023 ; 48 : 194–205. [PubMed] [Google Scholar]
- Pan Q, Chanthery Y, Liang WC, et al. Blocking neuropilin-1 function has an additive effect with anti-VEGF to inhibit tumor growth. Cancer Cell 2007 ; 11 : 53–67. [CrossRef] [PubMed] [Google Scholar]
- Gracia-Sancho J, Caparrós E, Fernández-Iglesias A, Francés R. Role of liver sinusoidal endothelial cells in liver diseases. Nat Rev Gastroenterol Hepatol 2021 ; 18 : 411–31. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Modulateurs de la « capillarisation » des cellules endothéliales sinusoïdales hépatique dans la stéatose hépatique métabolique. En conditions physiologiques, la présence de petits pores, appelés « fenêtres » (fenestrae), dans les cellules endothéliales des sinusoïdes hépatiques (CESH) permet le transfert des acides gras libres (AGL) du sang vers les hépatocytes, où les lipoprotéines de très basse densité (VLDL) sont synthétisées et sécrétées dans le sang. La protéine associée aux vésicules du plasmalemme PLVAP et le facteur de croissance de l’endothélium vasculaire VEGF-A sont des modulateurs positifs de la formation et du maintien de ces fenêtres. Aux premiers stades de la stéatose hépatique dysmétabolique, les cellules endothéliales des sinusoïdes subissent un processus pathologique de « capillarisation », caractérisé par une diminution de leurs fenêtres et l’apparition d’une membrane basale sous l’endothélium, ce qui diminue sa porosité. Cela empêche l’entrée des AGL du sang dans les hépatocytes, conduisant à une hyperlipidémie. L’induction compensatoire d’une lipogenèse de novo dans les hépatocytes entraîne la stéatose hépatique. Dans la stéatose dysmétabolique, il a été montré précédemment que la molécule d’adhérence des cellules vasculaires VCAM1 et la phospholipase A2 du groupe IVA (IVA-PLA2) favorisent ce processus de « capillarisation », réduisant ainsi la porosité des sinusoïdes du foie. Eberhard et collaborateurs ont mis en évidence l’implication, dans ce processus, de la signalisation par la sémaphorine 3A (SEMA3A) / neuropiline 1 (NRP1), qui devient ainsi une nouvelle cible thérapeutique potentielle pour tenter de freiner le développement précoce de la stéatose hépatique dysmétabolique (4). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




