| Issue |
Med Sci (Paris)
Volume 40, Number 11, Novembre 2024
|
|
|---|---|---|
| Page(s) | 815 - 818 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024143 | |
| Published online | 10 December 2024 | |
Granulocytes basophiles et lymphocytes T auxiliaires folliculaires dans le lupus érythémateux systémique
Basophil granulocytes control pathogenic accumulation of T follicular helper cells during lupus
1
Université Paris Cité, Centre de recherche sur l’inflammation, Inserm UMR1149, CNRS EMR8252, Laboratoire d’excellence Inflamex, Paris, France
2
Inovarion, Paris, France
3
Université de Bordeaux, ImmunoConcept Lab CNRS UMR5164, Bordeaux, France
a
quentin.simon@inserm.fr
b
john.tchen@inserm.fr
c
nicolas.charles@inserm.fr
Le lupus érythémateux systémique est une maladie auto-immune d’étiologie multifactorielle, pouvant atteindre différents organes comme la peau, les articulations ou les reins. Sa prévalence est estimée à environ 50 personnes pour 100 000. La maladie touche préférentiellement les femmes jeunes [1, 2]. La perte de tolérance immunitaire est responsable de la production d’auto-anticorps dirigés contre des antigènes du soi (auto-antigènes), essentiellement de nature nucléaire (ADN double brin, ribonucléoprotéines) [1, 2]. Ces auto-anticorps jouent un rôle physiopathologique essentiel : associés aux auto-antigènes et à des facteurs du complément, ils forment des complexes immuns qui s’accumulent dans les tissus cibles et provoquent une inflammation chronique pouvant entraîner un dysfonctionnement de l’organe concerné [1]. L’atteinte rénale, ou néphropathie lupique, constitue la cause majeure de morbidité et de mortalité pour cette maladie [1]. Via les récepteurs des fragments constants (FcR) des anticorps, les complexes immuns activent certains acteurs de l’immunité innée, comme les macrophages, les granulocytes neutrophiles et basophiles, ainsi que les cellules dendritiques plasmacytoïdes, ce qui conduit à la production aberrante de médiateurs de l’inflammation et à une amplification de la production d’autoanticorps [1–3]. Parallèlement au rôle prépondérant des lymphocytes B autoréactifs dans la pathogenèse, des anomalies quantitatives et fonctionnelles des lymphocytes T ont été constatées chez les patients et dans des modèles murins de la maladie. Dans le sang des patients, les lymphocytes T CD4+ auxiliaires folliculaires, sont surreprésentés comparativement aux sujets sains [2]. Au cours du lupus, les lymphocytes T auxiliaires folliculaires amplifient la réponse auto-immune en organisant les centres germinatifs1 via leurs interactions avec les lymphocytes B et par leur production d’interleukine 21, une cytokine impliquée dans la différenciation des lymphocytes B en cellules productrices d’anticorps [2, 4].
Rôle pathogénique des granulocytes basophiles dans le lupus érythémateux systémique
Les granulocytes basophiles ont été initialement décrits comme des acteurs importants de la réponse immunitaire de type 2, principalement dirigée contre les infections parasitaires et les allergènes [5]. Ces granulocytes expriment le récepteur des IgE de forte affinité (FcHRI), dont l’agrégation par des complexes IgE-antigènes conduit à la production de médiateurs inflammatoires (comme l’interleukine 4) qui favorisent la réponse TH de type 2 (TH2) [5, 6]. Nous avons précédemment montré, tant chez les patients que dans différents modèles murins de la maladie, que les granulocytes basophiles étaient activés au cours du lupus, entre autres via des IgE autoréactives contenues dans les complexes immuns, et qu’ils s’accumulaient dans les organes lymphoïdes secondaires (rate et ganglions lymphatiques), où ils promouvaient la production d’auto-anticorps [7, 8] (→).
(→) Voir la Synthèse de J. Tchen et N. Charles, m/s n° 4, avril 2022, page 366
Cependant, les mécanismes cellulaires et moléculaires par lesquels les granulocytes basophiles amplifient la réponse humorale auto-immune restaient à éclaircir. Les résultats de travaux de recherche sur l’interaction entre granulocytes basophiles et lymphocytes T auxiliaires folliculaires au cours du lupus érythémateux systémique répondent à cette question [9].
Les granulocytes basophiles contrôlent la quantité et le fonctionnement des lymphocytes T auxiliaires folliculaires dans le contexte lupique
Les organes lymphatiques secondaires se composent de zones T, de zones intermédiaires, appelées « bordures lymphocytes T - lymphocytes B », et de follicules B, dans lesquels on peut trouver des centres germinatifs. C’est au sein de ces centres germinatifs que se déroulent les étapes de maturation d’affinité (zone sombre), de commutation isotypique2 (zone claire) puis de différenciation des lymphocytes B en cellules B mémoires ou en plasmablastes (cellules productrices d’anticorps) sous l’influence des lymphocytes T auxiliaires folliculaires (Figure 1) [10]. Dans deux modèles murins de lupus érythémateux systémique, l’un spontané (souris Lyn-/-), l’autre induit par une injection de pristane3, les lymphocytes T auxiliaires folliculaires s’accumulent dans les organes lymphatiques secondaires sous la dépendance des granulocytes basophiles. En effet, la déplétion de ces derniers aboutit à une chute du nombre de lymphocytes T auxiliaires folliculaires dans ces structures, ce qui, par extension, réduit le nombre de lymphocytes B des centres germinatifs, diminue la quantité d’auto-anticorps produits, et in fine diminue les dépôts de complexes immuns dans les reins des souris. Dans la rate, nous avons pu localiser les granulocytes basophiles à la bordure lymphocytes T - lymphocytes B. Ils y soutiennent préférentiellement les lymphocytes T exprimant la molécule CD90, un marqueur des précurseurs de lymphocytes T auxiliaires folliculaires, qui se situent dans cette zone et qui sont à l’origine des lymphocytes T auxiliaires folliculaires qui formeront avec les lymphocytes B les centres germinatifs dans le follicule B (Figure 1) [11]. Les granulocytes basophiles favorisent donc l’accumulation des lymphocytes T auxiliaires folliculaires dans les organes lymphatiques secondaires. Chez les souris lupiques, la suppression des granulocytes basophiles réduit le nombre de lymphocytes T auxiliaires folliculaires ainsi que leur production d’interleukines 21 et 4, deux cytokines respectivement associées à la différenciation terminale des lymphocytes B en cellules productrices d’anticorps et à la commutation isotypique. Cette modification du nombre et de la fonction des lymphocytes T auxiliaires folliculaires, qui concerne plus particulièrement ceux de type 2 (producteurs d’interleukine 4), en l’absence de granulocytes basophiles est associée à une réduction du nombre de lymphocytes B ayant procédé à la commutation de classe. Notons que comparativement à des individus témoins, les personnes atteintes de lupus érythémateux systémique ont un nombre augmenté de lymphocytes T auxiliaires folliculaires de type 2 dans le sang, et ce nombre est corrélé avec la sévérité de la maladie. Par ailleurs, nous avons montré que les lymphocytes T auxiliaires folliculaires issus de souris Lyn-/- qui possèdent des granulocytes basophiles sont plus aptes à induire des plasmablastes en culture ex vivo que ceux issus des souris Lyn-/- dépourvues de ces granulocytes. Ces résultats indiquent que les granulocytes basophiles influencent le nombre de lymphocytes T auxiliaires folliculaires dans les organes lymphatiques secondaires et soutiennent leur fonction pro-humorale dépendante de l’interleukine 21 et de l’interleukine 4.
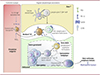 |
Figure 1. Au cours du lupus, les granulocytes basophiles favorisent l’accumulation de lymphocytes T auxiliaires folliculaires pathogéniques dans les organes lymphatiques secondaires. Dans la circulation sanguine, l’interleukine (IL) 3 et les IgE autoréactives induisent une surexpression de PD-L1 (programmed cell death ligand 1) à la surface des granulocytes basophiles. Leur migration vers les organes lymphatiques secondaires est favorisée par la prostaglandine D2 (PGD2). Au sein de la zone des lymphocytes T (zone T) de ces organes, les cellules dendritiques présentent l’antigène aux lymphocytes T « naïfs », qui se différencient en cellules précurseurs des lymphocytes T auxiliaires folliculaires (pré-lymphocytes T auxiliaires folliculaires, exprimant CD90 et CXCR5) et se dirigent vers une zone bordant le follicule B appelée « bordure lymphocytes T-lymphocytes B » (bordure T-B). Dans cette zone, les granulocytes basophiles interagissent avec les pré-lymphocytes T auxiliaires folliculaires par la voie de signalisation PD-L1/PD-1, et produisent de l’interleukine 4 qui permet la différenciation de ces lymphocytes en lymphocytes T auxiliaires folliculaires de type 2. Dans la zone claire du centre germinatif, ces derniers encouragent la commutation isotypique dans les lymphocytes B auto-réactifs et promeuvent leur différenciation en plasmablastes producteurs d’auto-anticorps. Ce processus pathogénique aboutit à la formation de complexes immuns circulant dans le sang, à l’origine, entre autres, de la néphropathie lupique. |
PD-L1 et l’interleukine 4 sont deux acteurs clef de la promotion des lymphocytes T auxiliaires folliculaires par les granulocytes basophiles dans le lupus
Les lymphocytes T auxiliaires folliculaires sont caractérisés par l’expression du facteur de transcription BCL6 (B-cell lymphoma 6), du récepteur membranaire CXCR5 (C-X-C motif chemokine receptor 5), ainsi que par une forte expression de la molécule d’interaction PD-1 (programmed cell death-1), dont les ligands sont PD-L1 et PD-L2. À l’instar des lymphocytes B du centre germinatif, les granulocytes basophiles expriment PD-L1. L’augmentation de l’expression de PD-L1 par les granulocytes basophiles dans le contexte lupique, chez l’homme et chez la souris, nous a incités à interférer expérimentalement avec cette expression pour tenter de comprendre le lien fonctionnel entre ces cellules et les lymphocytes T auxiliaires folliculaires dans la maladie. Ex vivo, l’interleukine 3 (dont la production par les lymphocytes T est augmentée dans la maladie) et l’agrégation des FcHRI induisent la surexpression de PD-L1 à la surface des granulocytes basophiles, un effet renforcé par l’interleukine 4. Dans le modèle murin de lupus induit par le pristane, la suppression de l’expression de PD-L1 spécifiquement dans les granulocytes basophiles réduit l’accumulation des lymphocytes T auxiliaires folliculaires dans les organes lymphatiques secondaires ainsi que les taux d’immunoglobulines (Ig) G auto-réactives, ce qui se produit également lorsque seuls les granulocytes basophiles ne peuvent plus produire l’interleukine 4, ou encore chez des souris mutées constitutivement dépourvues de granulocytes basophiles. Ces résultats sont corroborés par ceux obtenus ex vivo dans un système de co-culture mêlant granulocytes basophiles et lymphocytes T naïfs. Dans ce modèle, les granulocytes basophiles induisent la différenciation de ces lymphocytes en lymphocytes T auxiliaires folliculaires, dont la production d’interleukine 4 est dépendante de l’expression de l’interleukine 4 et de PD-L1 par ces granulocytes. De même, les granulocytes basophiles isolés à partir de prélèvements sanguins de volontaires sains sont capables d’induire ex vivo des lymphocytes T auxiliaires folliculaires, notamment ceux de type 2, plus efficacement que les granulocytes basophiles murins. Cet effet dépend de l’interaction entre PD-L1, exprimé par les granulocytes basophiles, et PD-1 exprimé par les lymphocytes T activés, ainsi que de la production d’interleukine 4 par les granulocytes basophiles. En lien avec ces observations, les granulocytes basophiles induisent l’expression du facteur de transcription TH2 GATA3 dans les lymphocytes T, de manière dépendante de l’interleukine 4. Par ailleurs, l’expression de l’interleukine 4 et de PD-L1 par les granulocytes basophiles leur permet d’inhiber, dans les lymphocytes T, l’expression de BACH2 (BTB domain and CNC homolog 2), un facteur de transcription réprimant l’expression de l’interleukine 4 et de BCL6. La production de PD-L1 et de l’interleukine 4 par les granulocytes basophiles est donc importante pour l’accumulation de lymphocytes T auxiliaires folliculaires dans les organes lymphatiques secondaires dans un contexte lupique. De plus, l’interleukine 4 produite par les granulocytes basophiles a un effet direct sur les lymphocytes B en favorisant la commutation isotypique vers les IgG. Ainsi, les souris déficientes en granulocytes basophiles, ou celles privées de PD-L1 spécifiquement dans ces cellules, sont protégées de la maladie induite par le pristane, tandis que chez les souris dont les granulocytes basophiles sont déficients en interleukine 4, on constate une forte accumulation d’IgM autoréactives, mais pas d’IgG pathogénique. Enfin, après avoir mis en évidence le rôle majeur des interleukines 3 et 4 dans l’interaction fonctionnelle pathogénique entre les lymphocytes T auxiliaires folliculaires et les granulocytes basophiles au cours du lupus érythémateux systémique, nous avons montré que le traitement de souris lupiques avec des anticorps monoclonaux ciblant l’une ou l’autre de ces interleukines diminue l’expression de PD-L1 et de marqueurs d’activation des granulocytes basophiles in vivo, ce qui entraîne rapidement une réduction spectaculaire du nombre des lymphocytes T auxiliaires folliculaires et des cellules productrices d’auto-anticorps dans les organes lymphatiques secondaires.
Perspectives
Nous avons donc mis en évidence l’existence d’un lien mécanistique entre les granulocytes basophiles et les lymphocytes T auxiliaires folliculaires dans le lupus érythémateux systémique [9]. En exprimant PD-L1 et l’interleukine 4, ces granulocytes promeuvent un programme transcriptionnel associé à la différenciation des lymphocytes T en lymphocytes T auxiliaires folliculaires de type 2, qui sont impliqués dans l’expansion de plasmablastes auto-réactifs et la production d’auto-anticorps pathogéniques (Figure 1). Les granulocytes basophiles ainsi que les interleukines 3 et 4 sont désormais considérés comme des cibles thérapeutiques prometteuses dans le lupus érythémateux systémique.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
La commutation isotypique (ou commutation de classe) est un processus qui, lors de la maturation d’un lymphocyte B, permet de changer l’isotype (classe) des immunoglobulines produites : c’est un changement de la chaîne lourde des anticorps. Cela permet à la réponse immunitaire humorale d’être plus efficace et de s’adapter au type d’agent pathogène.
Le pristane est un alcane terpénoïde saturé naturel, qui a d’abord été extrait de l’huile du foie des requins, d’où son nom (en latin, pristis signifie « requin »). Il est également présent dans l’huile minérale et certains aliments. Le pristane est connu pour induire une réaction auto-immune chez les rongeurs.
Références
- Anders HJ, Saxena R, Zhao MH, et al. Lupus nephritis. Nat Rev Dis Primers 2020 ; 6 : 7. [CrossRef] [PubMed] [Google Scholar]
- Moulton VR, Suarez-Fueyo A, Meidan E, et al. Pathogenesis of human systemic lupus erythematosus: a cellular perspective. Trends Mol Med 2017 ; 23 : 615–35. [CrossRef] [PubMed] [Google Scholar]
- Charles N, Hardwick D, Daugas E, et al. Basophils and the T helper 2 environment can promote the development of lupus nephritis. Nat Med 2010 ; 16 : 701–7. [CrossRef] [PubMed] [Google Scholar]
- Mountz JD, Hsu HC, Ballesteros-Tato A. Dysregulation of T follicular helper cells in lupus. J Immunol 2019 ; 202 : 1649–58. [CrossRef] [PubMed] [Google Scholar]
- Voehringer D. Protective and pathological roles of mast cells and basophils. Nat Rev Immunol 2013 ; 13 : 362–75. [CrossRef] [PubMed] [Google Scholar]
- Charles N, Watford WT, Ramos HL, et al. Lyn kinase controls basophil GATA-3 transcription factor expression and induction of Th2 cell differentiation. Immunity 2009 ; 30 : 533–43. [CrossRef] [PubMed] [Google Scholar]
- Tchen J, Charles N. Les granulocytes basophiles et les IgE dans l’autoimmunité : mécanismes et cibles thérapeutiques. Med Sci (Paris) 2022 ; 38 : 366–73. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Pellefigues C, Dema B, Lamri Y, et al. Prostaglandin D2 amplifies lupus disease through basophil accumulation in lymphoid organs. Nat Commun 2018 ; 9 : 725. [CrossRef] [PubMed] [Google Scholar]
- Tchen J, Simon Q, Chapart L, et al. PD-L1- and interleukine4-expressing basophils promote pathogenic accumulation of T follicular helper cells in lupus. Nat Commun 2024 ; 15 : 3389. [Google Scholar]
- Ma CS, Deenick EK, Batten M, Tangye SG. The origins, function, and regulation of T follicular helper cells. J Exp Med 2012 ; 209 : 1241–53. [CrossRef] [PubMed] [Google Scholar]
- Yeh CH, Finney J, Okada T, et al. Primary germinal center-resident T follicular helper cells are a physiologically distinct subset of CXCR5hi PD-1hi T follicular helper cells. Immunity 2022 ; 55 : 272–89 e7. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Au cours du lupus, les granulocytes basophiles favorisent l’accumulation de lymphocytes T auxiliaires folliculaires pathogéniques dans les organes lymphatiques secondaires. Dans la circulation sanguine, l’interleukine (IL) 3 et les IgE autoréactives induisent une surexpression de PD-L1 (programmed cell death ligand 1) à la surface des granulocytes basophiles. Leur migration vers les organes lymphatiques secondaires est favorisée par la prostaglandine D2 (PGD2). Au sein de la zone des lymphocytes T (zone T) de ces organes, les cellules dendritiques présentent l’antigène aux lymphocytes T « naïfs », qui se différencient en cellules précurseurs des lymphocytes T auxiliaires folliculaires (pré-lymphocytes T auxiliaires folliculaires, exprimant CD90 et CXCR5) et se dirigent vers une zone bordant le follicule B appelée « bordure lymphocytes T-lymphocytes B » (bordure T-B). Dans cette zone, les granulocytes basophiles interagissent avec les pré-lymphocytes T auxiliaires folliculaires par la voie de signalisation PD-L1/PD-1, et produisent de l’interleukine 4 qui permet la différenciation de ces lymphocytes en lymphocytes T auxiliaires folliculaires de type 2. Dans la zone claire du centre germinatif, ces derniers encouragent la commutation isotypique dans les lymphocytes B auto-réactifs et promeuvent leur différenciation en plasmablastes producteurs d’auto-anticorps. Ce processus pathogénique aboutit à la formation de complexes immuns circulant dans le sang, à l’origine, entre autres, de la néphropathie lupique. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




