| Issue |
Med Sci (Paris)
Volume 40, Number 11, Novembre 2024
|
|
|---|---|---|
| Page(s) | 829 - 836 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024152 | |
| Published online | 10 December 2024 | |
Les tunneling nanotubes
Une modalité de communication inter-cellulaire cruciale mais méconnue
Tunneling nanotubes (TNTs): An essential yet overlooked modality of inter-cellular communication
Trafic membranaire et pathogénèse, Institut Pasteur, Université Paris Cité, CNRS UMR 3691, Paris, France
Les tunneling nanotubes (TNT) sont des protrusions membranaires ouvertes permettant la communication directe entre cellules distantes. Des recherches récentes ont révélé leur importance biologique, notamment dans le système nerveux où leurs rôles pourraient être cruciaux. Observés dans le cerveau en développement, les TNT sont impliqués dans les maladies neurodégénératives, les cancers du cerveau et dans d’autres types de maladies, soulignant leur rôle physiopathologique. Leur découverte pourrait conduire à reconsidérer le cerveau comme un réseau neuronal physiquement connecté, complémentant ainsi la théorie de Cajal1 sur les neurones en tant qu’entités distinctes.
Abstract
Tunneling nanotubes (TNTs) are open membranous protrusions that allow direct communication between distant cells. Recent research has revealed their significant biological roles, prompting a reassessment of many physiological and pathological processes, especially in the nervous system where TNT properties could play a key physiological role. TNT-like connections have been observed in the developing brain and are implicated in neurodegenerative diseases, brain cancers, as well as in other diseases, underscoring their importance in pathophysiological events.
This review covers the key features of TNTs, including their structural properties, formation mechanisms, and detection challenges. We also explore their functions, focusing on the nervous system. The discovery of TNTs may lead to a reconsideration of brain function as a physically connected neuronal network, as proposed by Golgi, complementing Cajal’s theory of neurons as separate entities.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Chiara Zurzolo).
Au sein d’un organisme multicellulaire, les cellules doivent communiquer entre elles afin d’assurer le bon fonctionnement de l’ensemble de l’organisme. Cette communication peut s’accomplir indirectement par la sécrétion de vésicules extracellulaires ou de signaux chimiques, comme les hormones, les cytokines et les neurotransmetteurs, mais ces mécanismes ne permettent pas une communication sélective sur de longues distances. Les jonctions communicantes, quant à elles, permettent la diffusion directe d’ions ou de petites molécules, mais elles ne peuvent connecter que des cellules adjacentes. En 2004, Rustom et al. ont identifié une nouvelle modalité de communication entre des cellules : les « tunneling nanotubes »2 ou TNT [1]. Ces longues protrusions membranaires connectent directement les cellules, même à distance, facilitant ainsi des échanges sélectifs de différents cargos3 [2, 3] (→).
(→) Voir la Nouvelle de S. Souriant et al., m/s n° 11, novembre 2019, page 825
Plusieurs TNT peuvent se former entre une paire de cellules ou entre plusieurs cellules, conduisant ainsi à la formation de réseaux cellulaires fonctionnels. In vitro, ces protrusions membranaires peuvent connecter différents types de cellules, telles que les cellules épithéliales, les cellules mésenchymateuses ou les cellules du système immunitaire. Les TNT peuvent également connecter des cellules des systèmes nerveux central et périphérique, telles que les neurones, les astrocytes, les microglies, les photorécepteurs, les cellules endothéliales cérébrales, les péricytes et les cellules de Schwann [4–6], redéfinissant ainsi notre vision de la communication interneuronale. En effet, bien que Camillo Golgi ait proposé, au début du XXe siècle, la théorie réticulaire suggérant que les neurones sont fusionnés et interconnectés, les travaux portant sur les synapses ont confirmé la théorie neuronale de Santiago Ramón y Cajal, qui définit les neurones comme des cellules individuelles et séparées [7], invalidant ainsi la théorie de Golgi. Toutefois, les recherches sur les TNT montrent que les cellules du système nerveux peuvent former des réseaux interconnectés, non seulement au cours du développement, mais aussi dans le système nerveux mature. Plus largement, la découverte des TNT remet en question le dogme même de l’unité cellulaire, l’unité basique structurelle et fonctionnelle constituant les organismes [8], en introduisant le concept de super-cellularité [9]. La formation de ces réseaux interconnectés permet d’équilibrer rapidement les besoins métaboliques, les nutriments, les acides nucléiques, ainsi que les facteurs de stress et les organites, en facilitant des réponses rapides et spécifiques entre cellules indépendamment de leur distance ou de leur diversité tissulaire. Il est donc essentiel de caractériser précisément la structure, la formation et les fonctions des TNT pour mieux comprendre cette modalité cruciale de communication inter-cellulaire.
Les caractéristiques des TNT
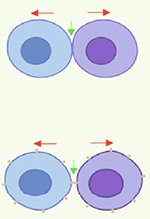
Les TNT sont des protrusions membranaires connectant directement des cellules et ne résultant pas de la division cellulaire, contrairement aux ponts intercellulaires [10]. Les caractéristiques suivantes ont été définies à partir d’expériences menées sur des cellules en culture : 1) d’un point de vue morphologique, les TNT sont fins (20-700 nm), longs (jusqu’à 100 μm), droits, n’adhèrent pas au substrat et connectent deux cellules ou plus, qu’elles soient du même type ou pas ; 2) ils contiennent un cytosquelette composé de filaments d’actine F (F pour « filamenteux ») ; 3) ils sont ouverts à leurs deux extrémités ; ce qui permet 4) une continuité cytoplasmique entre les cellules connectées et le transfert de différents types de cargos, à savoir de petites molécules (comme des ions), des macromolécules (comme des acides nucléiques ou des protéines), des organites (mitochondries, endosomes, etc.), et des agents infectieux (Figure 1). Il existe également des TNT dits « fermés », car une de leurs extrémités est fermée et connectée à une autre cellule par la juxtaposition de connexine 43 (Cx43), formant une jonction communicante [11]. Ces TNT fermés permettent le transfert de signaux électriques (se produisant en quelques millisecondes) et de petites molécules entre les cellules connectées [12] (Figure 1).
 |
Figure 1. Caractéristiques des TNT. Les TNT peuvent être fins ou épais en fonction de leur composition interne. Les TNT fins sont constitués uniquement d’un cytosquelette d’actine F, tandis que les TNT épais contiennent également des microtubules. Les TNT peuvent être constitués de plusieurs TNT individuels (TNTi). À ce jour, ces TNTi n’ont été observé que dans les cellules neuronales, où ils ne sont constitués que d’un cytosquelette d’actine F. Le mécanisme de transport des cargos cellulaires dépend du type de TNT : les TNT ouverts permettent le transfert passif ou actif de composants cytosoliques ou membranaires ; les TNT fermés permettent le transfert de petites molécules et d’ions, facilitant notamment le couplage électrique entre les cellules connectées. |
Ces caractéristiques distinguent les TNT d’autres types de protrusions, telles que les filopodes, les ponts inter-cellulaires ou les cytonèmes4. Par exemple, bien que les TNT et les cytonèmes partagent des caractéristiques subcellulaires (possession d’un cytosquelette d’actine) et morphologiques (longueur et diamètre) communes [10], les cytonèmes transportent des cargos, tels que des morphogènes, vers les cellules receveuses via une interaction ligand-récepteur, et aucune étude n’a, jusqu’à présent, montré qu’ils étaient capables, contrairement au TNT, de transférer de gros cargos, comme les organites, ou de faciliter le couplage électrique.
Bien qu’apparaissant comme constitués d’un seul tube en microscopie à faible résolution, une analyse ultra-structurale des TNT, par microscopie électronique cryogénique corrélative (Cryo-EM), entre des cellules neuronales in vitro a révélé qu’ils peuvent en réalité être constitués d’un faisceau de 2 à 11 tubes individuels ouverts (appelés TNTi) contenant de l’actine. Ces TNTi, d’un diamètre moyen de 123 nm, forment ensemble un faisceau d’un diamètre compris entre 145 et 700 nm (305 nm, en moyenne) et sont maintenus ensemble par la N-cadhérine [13] (Figure 1). Une telle analyse ultra-structurale est nécessaire pour déterminer si des TNT formés par d’autres types cellulaires peuvent également être constitués de plusieurs TNTi. D’autres TNT sont constitués d’un seul faisceau plus épais, et sont plus longs (jusqu’à 250 μm), contenant, en plus du cytosquelette d’actine, des microtubules [2, 14], comme c’est le cas dans les carcinomes épidermoïdes [15] ou les astrocytes [16]. Ces TNT épais semblent plus résistants comparés aux TNT fins et seraient plutôt impliqués dans le transfert de gros organites, comme les lysosomes et les mitochondries. Notons que les TNT connectant les cellules neuronales ne semblent pas contenir de microtubules. Pourtant, bien que les TNTi connectant les cellules de la lignée neuronale CAD (cellules CATH.a différenciées) et la lignée cellulaire de neuroblastome SHSY5 ne contiennent pas de microtubules, ils permettent le passage de mitochondries, ce qui suggère que les mitochondries sont transportées dans les TNTi via un mécanisme indépendant des microtubules. Certains TNT peuvent également contenir des filaments intermédiaires, comme c’est le cas pour les carcinomes épidermoïdes [15], mais leur rôle a été beaucoup moins étudié.
Les TNT sont des protrusions très dynamiques : leur longueur et leur diamètre peuvent varier au cours du temps, subissant des remodelages dus à la motilité des cellules et au transport des cargos. Leur durée de vie est également variable, allant de quelques minutes (TNT fins) à plusieurs heures (TNT épais) en culture [17, 18]. En raison de leur nature dynamique, il n’est pas exclu que les TNT fermés puissent éventuellement se transformer en TNT ouverts [12, 19]. Cependant, cette possibilité n’a pas encore été étudiée.
La vitesse de transfert des cargos le long des TNT dépend principalement des mécanismes de transport impliqués (diffusion passive ou transport actif) [12]. Le transport actif dépend du taux de croissance des TNT, des protéines motrices impliquées, et de leur dépendance à l’actine ou aux microtubules. La vitesse du transport actif atteint plusieurs μm/min [20]. Le transport actif via les TNT est plus lent comparé à celui observé dans les axones et les dendrites, en raison du plus petit diamètre des TNT imposant une résistance plus élevée au déplacement des cargos. Par exemple, le transport axonal des mitochondries est d’environ 100 à 1 400 nm/s, tandis que des images en microscopie confocale (qui offre typiquement une résolution latérale théorique de 200 nm) montrent que le trafic des mitochondries le long des TNT atteint un maximum d’environ 80 nm/s dans les cellules neuroendocrines tumorales (cellules PC12) [21].
Les mécanismes de formation des TNT
Les TNT peuvent se former à partir de précurseurs filopodiaux induits par l’actine, ou à la suite d’un détachement cellulaire [14] (Figure 2), et, dans le cas des neurones, ils peuvent connecter aussi bien le soma que les neurites [22]. Les deux mécanismes de formation impliquent le mouvement cellulaire et le remodelage du cytosquelette [23] et, jusqu’à présent, ils n’ont pas été associés à des différences structurelles ou fonctionnelles particulières. Bien que pouvant se produire simultanément dans le même type cellulaire, un mode de formation pourrait être favorisé selon le type de cellule [18]. Les études ayant identifié le mode de formation des TNT selon les types cellulaires sont répertoriées dans le Tableau I. Les TNT se forment principalement au cours du développement [10]. Dans les tissus adultes, leur présence reste minimale dans les conditions physiologiques mais elle augmente en réponse à un stress, qui peut être dû à une infection [3] ou à une maladie, telle que le cancer [24] (→) ou les maladies neurodégénératives [25, 26] (→).
(→) Voir la Synthèse de M. Morin et al., m/s n° 6-7, juin-juillet 2022, page 585
(→) Voir la Synthèse de G. Dorban et al., m/s n° 6-7, juin-juillet 2010, page 610
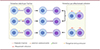 |
Figure 2. Modes de formation des TNT. Dans le modèle du mécanisme induit par l’actine (à gauche), une cellule, ou les deux, peuvent étendre une protrusion vers la cellule/protrusion cible. Lorsque l’extrémité de la protrusion atteint sa cible, une fusion membranaire se produit, entraînant la formation de TNT à extrémités ouvertes. Dans le modèle du détachement cellulaire (à droite), les deux cellules restent en contact étroit pendant plusieurs minutes, ce qui provoque la fusion des membranes. Par la suite, les cellules s’éloignent l’une de l’autre tout en maintenant leur contact, ce qui conduit à la formation d’un TNT, formé à partir d’une cellule ou des deux. Dans le cas des TNT à extrémités fermés, les jonctions communicantes assurent le contact entre les deux membranes juxtaposées à l’extrémité des TNT (images du bas). La formation de TNT fermés nécessite un niveau d’expression élevé de connexines pour augmenter la probabilité de formation d’une jonction communicante. |
Mécanisme de formation privilégié des TNT.
Formation des TNT à partir de précurseurs filopodiaux induits par l’actine
La formation des TNT induits par l’actine [18] implique probablement des composants moléculaires communs à d’autres types de protrusions, telles que les filopodes, les microvillosités ou les stéréocils5. Ce processus débute par l’émergence d’une protrusion de type filopode, à partir de la membrane plasmique d’une cellule donneuse, suivie de son allongement et de la polymérisation de l’actine grâce à des régulateurs et des agrégateurs d’actine [27]. Lorsque la protrusion atteint la cellule cible, ou une autre protrusion, le TNT en croissance établit un contact physique et peut fusionner, un processus potentiellement facilité par des molécules d’adhérence, telles que la N-cadhérine [13, 28], et des molécules de fusion, qui restent à déterminer. Le mécanisme sous-jacent à la formation des TNT induits par l’actine reste largement méconnu et fait l’objet de recherches en cours. Par exemple, les facteurs régulant ce processus [13, 28] ainsi que l’éventuelle influence de chimio-attractants, similaires à ceux observés pour les cytonèmes, ne sont pas encore complètement élucidés [23].
Formation des TNT à partir d’un détachement cellulaire
Les TNT formés par détachement cellulaire ont été observés dans diverses lignées cellulaires d’origines différentes, notamment des cellules immunitaires [20], des cellules de la crête neurale (CCN) et des cellules endothéliales primaires de la veine ombilicale humaine (cellules HUVEC) [29]. Ce processus implique une période de contact entre les cellules avant qu’elles ne migrent dans des directions opposées. Dans les lymphocytes T, la formation de TNT nécessite un contact entre les deux cellules d’au moins 4 minutes [20]. Déterminer si une seule ou les deux cellules contribuent à la formation du TNT n’est cependant pas clairement établi. Les mécanismes sous-jacents au contact initial des cellules et à la fusion cellulaire subséquente restent également mal compris. En effet, nous ne savons pas si la fusion cellulaire observée dans la formation de TNT par détachement implique les mêmes mécanismes que la fusion cellulaire classique, qui requiert généralement des protéines de fusion [30] pour créer des pores de fusion. En outre, les processus régulant la motilité cellulaire après la fusion, ainsi que le rôle des molécules d’adhérence et de la polymérisation de l’actine dans la formation des TNT par détachement, ne sont pas encore complètement élucidés.
L’identification des TNT
Les TNT ont été grandement étudiés in vitro, mais leur identification in vivo reste rare, en raison de leur nature transitoire et fragile [31]. La recherche d’un marqueur spécifique des TNT demeure infructueuse jusqu’à présent, ce qui pourrait expliquer que leur présence dans les tissus soit passée inaperçue. Des limitations freinent également les études : l’hétérogénéité morphologique, le manque de cibles moléculaires pour leur identification, ainsi que les méthodes d’imagerie à faible résolution [2]. Une clarification s’avère donc nécessaire pour comprendre en particulier si le mécanisme de formation des TNT dépend du type cellulaire, de leurs caractéristiques morphologiques (TNT fins, longs et/ou constitués de TNTi) et moléculaires (cytosquelette d’actine, de microtubule et/ou de filament intermédiaire), et déterminer si différentes structures permettent différentes fonctions cellulaires.
A priori, les TNT ouverts pourraient se former soit par induction par l’actine, soit par détachement cellulaire (Figure 2). Les TNT fermés peuvent également se former par ces deux mécanismes, mais le détachement cellulaire serait probablement plus favorable à leur formation, car, comparé à la formation par induction d’actine, ce mécanisme augmente la probabilité de créer une jonction lacunaire complète. En ce qui concerne le lien entre la composition du cytosquelette et les mécanismes de formation des TNT, à notre connaissance, aucune réponse n’a encore été rapportée.
L’évaluation de la capacité de ces structures à transférer du matériel ou à induire un couplage électrique entre les cellules n’est pas systématique. Il est néanmoins crucial de réserver le terme « TNT » aux structures qui remplissent clairement l’un de ces critères expérimentaux [2, 10]. Ainsi, lorsque la capacité à transférer des cargos ou à induire un couplage électrique ne sont pas avérés, une appellation plus appropriée, ou le terme général « semblable aux TNT », devrait être utilisé. Au cours des 10 dernières années, la nomenclature utilisée pour décrire des structures similaires aux TNT, comme les « nanotubes des cellules T » [20], les « ponts épithéliaux » [33], ou les « TNT interpérycites » (IP-TNT) [34], a conduit à s’éloigner de la définition originale des TNT telle qu’établie en 2004 par Rustom et al. [1]. De meilleures approches techniques et plus de rigueur sont donc nécessaires pour identifier les TNT [2, 4, 31]. Bien que d’autres protrusions puissent jouer un rôle important dans la communication inter-cellulaire, la caractérisation précise des TNT reste en effet essentielle pour de futures découvertes dans ce domaine prometteur de recherche [10, 27].
Les TNT dans le système nerveux
Divers agents pathogènes, tels que les virus [3] ou les prions [25, 26], peuvent exploiter les TNT et les structures semblables aux TNT pour envahir les cellules eucaryotes. Ces structures pourraient donc avoir une origine évolutive ancienne et une fonction, jusqu’à présent sous-estimée, dans la communication intercellulaire. Notons que les plantes aussi utilisent un type de connexions cytoplasmiques, les plasmodesmes, pour transmettre des signaux électriques en vue d’une communication à longue distance [35]. Dans le cas spécifique des cellules neuronales, les TNT pourraient jouer un rôle, important au cours du développement du système nerveux, qui serait apparu antérieurement à la transmission synaptique telle que nous la connaissons. Cette hypothèse, que nous proposons, repose sur l’observation de TNT connectant des lignées cellulaires neuronales dans des états non différenciés [13, 29], montrant cette capacité « présynaptique » pour une communication rapide et spécifique à longue distance [8].
L’importance physiologique des TNT dans le développement du cerveau, mais aussi leur participation à la propagation des processus neurodégénératifs ont été confirmées par plusieurs études que nous relatons.
Rôles des TNT dans le développement du système nerveux
La signalisation calcique est essentielle pour le développement neuronal [36]. Lors de l’induction neuronale, une augmentation du Ca2+ intracellulaire dans l’ectoderme dorsal des stades blastula à gastrula est nécessaire, période au cours de laquelle des structures semblables aux TNT ont été observées [10], suggérant que les TNT pourraient faciliter le transfert de Ca2+ entre cellules distantes, augmentant ainsi le Ca2+ intracellulaire et contribuant à l’induction neuronale.
Durant la neurulation, des connexions, semblables aux TNT, remplissent une fonction mécanique en reliant physiquement les cellules non ectodermiques, à l’origine d’une couche fermée et unique enveloppant le tube neural [10]. Ces connexions contiennent de plus de petits cargos, suggérant leur rôle potentiel dans le transfert de cargos entre les plis neuraux, pendant la fermeture du tube neural.
Des études in vitro ont montré que les TNT peuvent coupler électriquement les astrocytes et les neurones immatures. Le couplage électrique entre neurones et astrocytes dans le cerveau pourrait donc se produire principalement au cours du développement embryonnaire précoce, ce couplage disparaissant lorsque les neurones maturent [19].
Dans les embryons de poulet, des connexions membranaires courtes (environ 1-2 μm) et longues (jusqu’à 100 μm) (des TNT et/ou des ponts intercellulaires) maintiennent un contact étroit entre cellules de la crête neurale (CCN) voisines. Ces connexions pourraient fournir des informations cruciales sur la position et le nombre de cellules voisines, influencer la direction des cellules et faciliter le transfert de cargos cytoplasmiques entre les CCN en migration. Des connexions ressemblant à des TNT ont également été observées entre les cellules granulaires du cervelet en développement et pourraient participer à leur migration tangentielle [37].
Enfin, des connexions, semblables à des TNT, formées entre des péricytes et des cellules endothéliales dans le cerveau, pourraient participer à l’angiogenèse physiologique mais aussi pathologique [4].
La machinerie moléculaire impliquée dans la formation des TNT présente des similitudes avec les processus activés lors du développement du système nerveux, ce que nous allons présenter.
Mécanismes impliqués dans la formation des TNT au cours du développement du cerveau
Le mécanisme de formation des TNT varie selon le type cellulaire. En effet, l’expression de certains acteurs moléculaires peut soit favoriser soit inhiber la formation des TNT en fonction du type de cellule [27]. Dans les cellules neuronales, la formation de TNT peut être induite par Eps8 (substrat de la voie de signalisation des récepteurs du facteur de croissance épidermique 8), une protéine régulatrice de l’actine, enrichie dans les cônes de croissance et les processus neuronaux en développement [27]. L’expression ectopique de Eps8 augmente en effet significativement la formation des TNT dans les cellules neuronales CAD.
La voie Wnt/Ca2+, une cascade intracellulaire impliquée dans le remodelage du cytosquelette d’actine, est associée à la croissance et au guidage des axones, au développement des dendrites et à la fonction synaptique. Des expériences menées sur des cellules CAD et des cultures primaires de neurones corticaux ont montré que cette voie contribue à la formation des TNT et au transfert de cargos [38]. Il est donc plausible que la voie Wnt/Ca2+ régule la formation des TNT pendant le développement cérébral.
La voie de signalisation de la protéine PKA (protéine kinase A) dépendante du cAMP (adénosine monophosphate cyclique), ou voie cAMP/ PKA, qui régule le cytosquelette d’actine et la dynamique de l’actine F, est nécessaire pour soutenir la sélectivité des jonctions communicantes dans le système nerveux chez Caenorhabditis elegans, mais, dans les cellules cancéreuses humaines, cette voie induit la formation de TNT fermés [11].
Enfin, Myo10 (Myosin-X), une protéine motrice associée à l’actine, est présente dans les corps cellulaires, les neurites, les cônes de croissance et les extrémités des filopodes. Elle est également un inducteur de TNT et augmente le transfert de vésicules dans les cellules neuronales [27].
Rôles physiopathologiques des TNT dans le système nerveux adulte
Les TNT ont rarement été observés dans le système nerveux normal mature. Il existe toutefois quelques exceptions, telles que les IP-TNT, un type de TNT fermé qui connecte des péricytes avec des cellules du même type ou de différents types. Dans la rétine, ces TNT connectent les péricytes et sont responsables du couplage neurovasculaire, c’est-à-dire l’induction d’une constriction/dilatation des vaisseaux capillaires en réponse à une stimulation lumineuse afin de réguler le flux sanguin [34]. La détérioration des IP-TNT réduit la fréquence des vagues calciques, ce qui altère la régulation du flux sanguin et du couplage vasculaire.
Depuis la première démonstration que les TNT peuvent transférer des protéines prions mal repliées [26], il est apparu que les TNT étaient effectivement exacerbés dans les neurones affectés par des agrégats amyloïdes. Dans des modèles de maladies neurodégénératives, telles que la maladie d’Alzheimer, la maladie de Parkinson ou la maladie de Huntington, les TNT contribuent à la propagation de protéines de type prions entre les cellules du système nerveux. In vitro, augmenter ou diminuer le nombre de TNT augmente ou réduit, respectivement, la transmission amyloïde entre les cellules neuronales [38]. Les TNT permettent néanmoins aux neurones altérés de recevoir des autres cellules, des organites fonctionnels, tels que les mitochondries, afin de résister [39].
Les TNT permettent également la propagation de virus, comme cela a été montré pour le SARS-CoV-2 (severe acute respiratory syndrome-coronavirus-2) [40]. Les lignées cellulaires neuronales ne sont pas permissives à ce coronavirus, en raison de la faible expression du récepteur viral ACE2 (enzyme de conversion de l’angiotensine 2) sur les neurones. Néanmoins, in vitro, ces cellules peuvent être infectées par le transfert direct de particules virales, via les TNT, depuis des cellules épithéliales infectées. L’infection par le SARS-CoV-2 augmente par ailleurs le nombre de cellules connectées par des TNT. Durant l’infection, le virus pourrait donc être transféré directement des cellules épithéliales permissives aux cellules neuronales via les TNT, puis utiliser ces derniers pour se propager dans le cerveau.
Enfin, les TNT peuvent connecter les cellules de glioblastome pour former un syncytium multicellulaire, participant ainsi à l’invasion, la survie au stress, la résistance aux traitements des cellules tumorales [41]. Comme les TNT fermés, les microtubes tumoraux interconnectés (TM) [42] sont des connexions cytoplasmiques continues à une extrémité mais se terminant par une jonction communicante à l’autre extrémité, ce qui permet aux cellules tumorales connectées d’être couplées électriquement. Bien que les TNT aient principalement été observés dans les glioblastomes, leur présence dans d’autres types de cellules tumorales, telles que des cellules PC12 ou les cellules SH-SY5, provenant de neuroblastome humain [18], suggère qu’ils jouent un rôle dans différents types de cancer du cerveau.
Conclusion
Nous avons résumé dans cette revue, les principales caractéristiques et les fonctions des TNT. L’identification de TNT dans le système nerveux incite à reconsidérer la vision classique de la connectivité neuronale. En effet, leur présence indique que les cellules du système nerveux présentent un comportement extrêmement dynamique. Bien qu’elles soient principalement constituées d’unités individuelles distinctes, comme le proposait Cajal, leur structure peut évoluer en fonction du contexte cellulaire. Ainsi, au cours du développement du système nerveux ou en réponse à un stress cellulaire, les cellules peuvent former transitoirement des réseaux neuronaux interconnectés, comme le suggérait Golgi, pour permettre une communication spécifique sur de grandes distances. Bien que cette synthèse se soit focalisée sur une description du rôle des TNT dans le système nerveux, le concept de super-cellularité introduit par leur découverte s’appliquent également à d’autres types cellulaires.
Des études restent cependant nécessaires, non seulement pour identifier des marqueurs spécifiques des TNT, permettant une détection sans équivoque de ces structures dans les différents tissus, mais aussi pour découvrir des modulateurs potentiels qui permettront d’améliorer notre compréhension de leurs fonctions dans les états physiologiques et pathologiques. Les TNT présentent en effet un comportement dichotomique, participant au maintien de l’homéostasie cellulaire et tissulaire, mais pouvant être aussi détournés et utilisés par les agents infectieux. Des recherches supplémentaires sont essentielles pour identifier les acteurs moléculaires impliqués dans les processus pathologiques qui pourraient potentiellement être ciblés pour développer de nouvelles approches thérapeutiques.
Remerciements
Nous voudrions remercier les membres de l’équipe Zurzolo pour les discussions et le soutien. Les figures ont été conçues à l’aide de biorender.
Financement
Ce travail a été soutenu par une subvention dédiée appelée Big Brain Theory Program cofinancée par l’Institut Pasteur et l’Institut du Cerveau (ICM), le programme Inception (subvention Investissement d’Avenir) ANR-16-CONV-0005 et l’équipe FRM - EQU202103012630 à CZ.
Liens d’intérêts
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Rustom A, Saffrich R, Markovic I, et al. Nanotubular highways for intercellular organelle transport. Science 2004 ; 303 : 1007–10. [CrossRef] [PubMed] [Google Scholar]
- Cordero Cervantes D, Zurzolo C. Peering into tunneling nanotubes-The path forward. EMBO J 2021 ; 40 : e105789. [CrossRef] [PubMed] [Google Scholar]
- Souriant S, Dupont M, Neyrolles O, et al. Les nanotubes membranaires des macrophages infectés par le VIH-1 – Un moyen pour le virus de se propager plus vite dans un contexte de tuberculose. Med Sci (Paris) 2019 ; 35 : 825–7. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Capobianco DL, Simone L, Svelto M, Pisani F. Intercellular crosstalk mediated by tunneling nanotubes between central nervous system cells. What we need to advance. Front Physiol 2023 ; 14 : 1214210. [CrossRef] [PubMed] [Google Scholar]
- Ortin-Martinez A, Yan NE, Tsai ELS, et al. Photoreceptor nanotubes mediate the in vivo exchange of intracellular material. EMBO J 2021 ; 40 : e107264. [CrossRef] [PubMed] [Google Scholar]
- Zhu H, Xue C, Xu X, et al. Rab8a/Rab11a regulate intercellular communications between neural cells via tunneling nanotubes. Cell Death Dis 2016 ; 7 : e2523. [CrossRef] [PubMed] [Google Scholar]
- Shepherd GM, Erulkar SD. Centenary of the synapse: from Sherrington to the molecular biology of the synapse and beyond. Trends Neurosci 1997 ; 20 : 385–92. [CrossRef] [PubMed] [Google Scholar]
- Zurzolo C. Tunneling nanotubes: Reshaping connectivity. Curr Opin Cell Biol 2021 ; 71 : 139–147. [CrossRef] [PubMed] [Google Scholar]
- Rustom A. The missing link: does tunnelling nanotube-based supercellularity provide a new understanding of chronic and lifestyle diseases? Open Biol 2016 ; 6. [Google Scholar]
- Korenkova O, Pepe A, Zurzolo C. Fine intercellular connections in development: TNTs, cytonemes, or intercellular bridges?. Cell Stress 2020 ; 4 : 30–43. [CrossRef] [PubMed] [Google Scholar]
- Tishchenko A, Azorín DD, Vidal-Brime L, et al. Cx43 and Associated Cell Signaling Pathways Regulate Tunneling Nanotubes in Breast Cancer Cells. Cancers 2020 ; 12. [PubMed] [Google Scholar]
- Abounit S, Zurzolo C. Wiring through tunneling nanotubes--from electrical signals to organelle transfer. J Cell Sci 2012 ; 125 : 1089–98. [CrossRef] [PubMed] [Google Scholar]
- Sartori-Rupp A, Cordero Cervantes D, Pepe A, et al. Correlative cryo-electron microscopy reveals the structure of TNTs in neuronal cells. Nat Commun 2019 ; 10 : 342. [Google Scholar]
- Austefjord MW, Gerdes HH, Wang X. Tunneling nanotubes: Diversity in morphology and structure. Commun Integr Biol 2014 ; 7 : e27934. [CrossRef] [PubMed] [Google Scholar]
- Sáenz-de-Santa-María I. Bernardo-Castiñeira C, Enciso E, et al. Control of long-distance cell-to-cell communication and autophagosome transfer in squamous cell carcinoma via tunneling nanotubes. Oncotarget 2017 ; 8 : 20939–60. [CrossRef] [PubMed] [Google Scholar]
- Wang X, Bukoreshtliev NV, Gerdes HH. Developing neurons form transient nanotubes facilitating electrical coupling and calcium signaling with distant astrocytes. PLoS One 2012 ; 7 : e47429. [CrossRef] [PubMed] [Google Scholar]
- Gurke S, Barroso JF, Gerdes HH. The art of cellular communication: tunneling nanotubes bridge the divide. Histochem Cell Biol 2008 ; 129 : 539–50. [CrossRef] [PubMed] [Google Scholar]
- Bukoreshtliev NV, Wang X, Hodneland E, et al. Selective block of tunneling nanotube (TNT) formation inhibits intercellular organelle transfer between PC12 cells. FEBS Lett 2009 ; 583 : 1481–8. [CrossRef] [PubMed] [Google Scholar]
- Wang X, Gerdes HH. Long-distance electrical coupling via tunneling nanotubes. Biochim Biophys Acta 2012 ; 1818 : 2082–6. [CrossRef] [PubMed] [Google Scholar]
- Sowinski S, Jolly C, Berninghausen O, et al. Membrane nanotubes physically connect T cells over long distances presenting a novel route for HIV-1 transmission. Nat Cell Biol 2008; 10 : 211–9. [CrossRef] [PubMed] [Google Scholar]
- Wang X, Gerdes HH. Transfer of mitochondria via tunneling nanotubes rescues apoptotic PC12 cells. Cell Death Differ 2015 ; 22 : 1181–91. [CrossRef] [PubMed] [Google Scholar]
- Tardivel M, Bégard S, Bousset L, et al. Tunneling nanotube (TNT)-mediated neuron-to neuron transfer of pathological Tau protein assemblies. Acta Neuropathol Commun 2016 ; 4 : 117. [CrossRef] [PubMed] [Google Scholar]
- Dagar S, Pathak D, Oza HV, Mylavarapu SVS. Tunneling nanotubes and related structures: molecular mechanisms of formation and function. Biochem J 2021 ; 478 : 3977–98. [CrossRef] [PubMed] [Google Scholar]
- Morin M, Moindjie H, Nahmias C. Le transport mitochondrial — Quel impact dans le cancer ? Med Sci (Paris) 2022 ; 38 : 585–93. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Dorban G, Antoine N, Defaweux V. Les prions exploitent les communications neuro-immunitaires. Med Sci (Paris) 2010 ; 26 : 610–4. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Gousset K, Schiff E, Langevin C, et al. Prions hijack tunnelling nanotubes for intercellular spread. Nat Cell Biol 2009 ; 11 : 328–36. [Google Scholar]
- Ljubojevic N, Henderson JM, Zurzolo C. The Ways of Actin: Why Tunneling Nanotubes Are Unique Cell Protrusions. Trends Cell Biol 2021 ; 31 : 130–42. [CrossRef] [PubMed] [Google Scholar]
- Hanna S.J, McCoy-Simandle K, Miskolci V, et al. The Role of Rho-GTPases and actin polymerization during Macrophage Tunneling Nanotube Biogenesis. Sci Rep 2017 ; 7 : 8547. [CrossRef] [PubMed] [Google Scholar]
- Wang X, Veruki ML, Bukoreshtliev NV, et al. Animal cells connected by nanotubes can be electrically coupled through interposed gap-junction channels. Proc Natl Acad Sci USA 2010 ; 107 : 17194–9. [CrossRef] [PubMed] [Google Scholar]
- Brukman NG, Uygur B, Podbilewicz B, Chernomordik L. V. How cells fuse. J Cell Biol 2019; 218 : 1436–51. [CrossRef] [PubMed] [Google Scholar]
- Sáenz-de-Santa-María I, Henderson JM, Pepe A, Zurzolo C. Identification and Characterization of Tunneling Nanotubes for Intercellular Trafficking. Curr Protoc 2023; 3 : e939. [CrossRef] [PubMed] [Google Scholar]
- Reichert D, Scheinpflug J, Karbanová J, et al. Tunneling nanotubes mediate the transfer of stem cell marker CD133 between hematopoietic progenitor cells. Exp Hematol 2016 ; 44, 1092–1112. e1092. [CrossRef] [PubMed] [Google Scholar]
- Zani BG, Indolfi L, Edelman ER. Tubular bridges for bronchial epithelial cell migration and communication. PLoS One 2010 ; 5 : e8930. [CrossRef] [PubMed] [Google Scholar]
- Alarcon-Martinez L, Villafranca-Baughman D, Quintero H, et al. Interpericyte tunnelling nanotubes regulate neurovascular coupling. Nature 2020 ; 585 : 91–5. [CrossRef] [PubMed] [Google Scholar]
- Miguel-Tomé S, Llinás RR. Broadening the definition of a nervous system to better understand the evolution of plants and animals. Plant Signal Behav 2021 ; 16 : 1927562. [CrossRef] [PubMed] [Google Scholar]
- Leclerc C, Néant I, Moreau M. The calcium: an early signal that initiates the formation of the nervous system during embryogenesis. Front Mol Neurosci 2012 ; 5: 3. [CrossRef] [Google Scholar]
- Cordero Cervantes D, Khare H, Wilson AM, et al. 3D reconstruction of the cerebellar germinal layer reveals tunneling connections between developing granule cells. Sci Adv 2023 ; 9 : eadf3471. [CrossRef] [PubMed] [Google Scholar]
- Vargas JY, Loria F, Wu YJ, et al. The Wnt/Ca2+ pathway is involved in interneuronal communication mediated by tunneling nanotubes. EMBO J 2019 ; 38 : e101230. [CrossRef] [PubMed] [Google Scholar]
- Chakraborty R, Nonaka T, Hasegawa M, Zurzolo C. Tunnelling nanotubes between neuronal and microglial cells allow bi-directional transfer of α-Synuclein and mitochondria. Cell Death Dis 2023 ; 14 : 329. [CrossRef] [PubMed] [Google Scholar]
- Pepe A, Pietropaoli S, Vos M, et al. Tunneling nanotubes provide a route for SARS-CoV-2 spreading. Sci Adv 2022 ; 8 : eabo0171. [CrossRef] [PubMed] [Google Scholar]
- Valdebenito S, Malik S, Luu R, et al. Tunneling nanotubes, TNT, communicate glioblastoma with surrounding non-tumor astrocytes to adapt them to hypoxic and metabolic tumor conditions. Sci Rep 2021 ; 11 : 14556. [CrossRef] [PubMed] [Google Scholar]
- Wang X, Liang J, Sun H. The Network of Tumor Microtubes: An Improperly Reactivated Neural Cell Network With Stemness Feature for Resistance and Recurrence in Gliomas. Front Oncol 2022 ; 12 : 921975. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Liste des figures
 |
Figure 1. Caractéristiques des TNT. Les TNT peuvent être fins ou épais en fonction de leur composition interne. Les TNT fins sont constitués uniquement d’un cytosquelette d’actine F, tandis que les TNT épais contiennent également des microtubules. Les TNT peuvent être constitués de plusieurs TNT individuels (TNTi). À ce jour, ces TNTi n’ont été observé que dans les cellules neuronales, où ils ne sont constitués que d’un cytosquelette d’actine F. Le mécanisme de transport des cargos cellulaires dépend du type de TNT : les TNT ouverts permettent le transfert passif ou actif de composants cytosoliques ou membranaires ; les TNT fermés permettent le transfert de petites molécules et d’ions, facilitant notamment le couplage électrique entre les cellules connectées. |
| Dans le texte | |
 |
Figure 2. Modes de formation des TNT. Dans le modèle du mécanisme induit par l’actine (à gauche), une cellule, ou les deux, peuvent étendre une protrusion vers la cellule/protrusion cible. Lorsque l’extrémité de la protrusion atteint sa cible, une fusion membranaire se produit, entraînant la formation de TNT à extrémités ouvertes. Dans le modèle du détachement cellulaire (à droite), les deux cellules restent en contact étroit pendant plusieurs minutes, ce qui provoque la fusion des membranes. Par la suite, les cellules s’éloignent l’une de l’autre tout en maintenant leur contact, ce qui conduit à la formation d’un TNT, formé à partir d’une cellule ou des deux. Dans le cas des TNT à extrémités fermés, les jonctions communicantes assurent le contact entre les deux membranes juxtaposées à l’extrémité des TNT (images du bas). La formation de TNT fermés nécessite un niveau d’expression élevé de connexines pour augmenter la probabilité de formation d’une jonction communicante. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




