| Issue |
Med Sci (Paris)
Volume 40, Novembre 2024
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 34 - 39 | |
| Section | Prix SFM | |
| DOI | https://doi.org/10.1051/medsci/2024130 | |
| Published online | 18 November 2024 | |
Le tamoxifène, une molécule à fort potentiel thérapeutique pour toutes les myopathies centronucléaires
Tamoxifen, a high-potential molecule to treat all centronuclear myopathies
IGBMC – CNRS UMR 7104 – Inserm U 1258, Illkirch, France
*
ginestec@igbmc.fr
**
jocelyn@igbmc.fr
Les myopathies centronucléaires sont des maladies congénitales rares, caractérisées par une faiblesse musculaire et un positionnement anormal des organites. Les principaux gènes associés à ces pathologies sont MTM1 (codant la myotubularine 1), DNM2 (codant la dynamine 2), BIN1 (codant le bridging integrator 1) et RYR1 (codant le récepteur à la ryanodine 1). À ce jour, aucun traitement n’est approuvé. Cependant, le tamoxifène, une molécule déjà utilisée en clinique dans le cancer du sein, a montré des effets positifs sur le phénotype musculaire de modèles murins qui reproduisent trois des formes principales de myopathies centronucléaires. Dans cet article, les effets du tamoxifène sont comparés pour les différentes formes de ces pathologies.
Abstract
Centronuclear myopathies are rare congenital disorders characterized by muscle weakness and mislocalization of organelles. The main genes associated to these muscle diseases are MTM1, DNM2, BIN1 and RYR1. To date, no therapy is available. Nevertheless, tamoxifen, a pharmacological compound already used in clinics for breast cancer, showed beneficial effects on the muscle phenotypes in mouse models for centronuclear myopathies. Here, the effects of tamoxifen on muscle phenotypes will be compared in the various forms of this muscle disease.
© 2024 médecine/sciences – Inserm
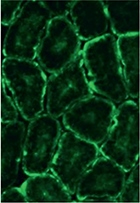
© C. Gineste
Vignette : Marquage par immunofluorescence de la desmine (vert) sur une coupe transversale de muscle strié squelettique (tibial antérieur) de souris malade (MCN-Bin1).
Introduction
Les myopathies centronucléaires, dont fait partie la myopathie myotubulaire, sont des maladies héréditaires rares du muscle, qui se manifestent cliniquement par une faiblesse musculaire et une hypotonie. La caractéristique histopathologique principale est la mauvaise localisation des organites dans la fibre musculaire telle qu’une internalisation des noyaux en l’absence de régénérescence musculaire ou une agrégation des mitochondries [1, 2]. Les différentes formes de myopathies centronucléaires sont définies en fonction du gène muté et de la sévérité de la maladie. La myopathie myotubulaire est la forme liée au chromosome X. Elle est causée par des mutations dans le gène MTM1 (codant la myotubularine 1) et elle est responsable de la forme la plus sévère [3]. Les formes autosomiques sont dues à des mutations dans six gènes identifiés à ce jour – DNM2 codant la dynamine 2, RYR1 codant le récepteur à la ryanodine 1, BIN1 codant le bridging integrator 1, TTN codant la titine, SPEG codant la striated muscle enriched protein kinase, ZAK codant la mitogen-activated protein kinase kinase kinase 20 – DNM2, RYR1 et BIN1 étant les plus fréquemment mutés [4]. La myopathie centronucléaire liée à DNM2 est une forme dominante à l’origine d’un spectre de sévérité variable selon la mutation [5–7]. La forme liée à BIN1 est associée à des mutations dominantes ou récessives, la forme récessive étant associée à un début précoce de la maladie (à la naissance ou au cours de l’enfance), et la forme dominante débutant plus tardivement (âge adulte) [8, 9]. La forme liée à RYR1 est une forme récessive à l’origine d’une sévérité modérée de la maladie [10, 11].
Aujourd’hui, aucune thérapie n’est approuvée pour ces maladies rares du muscle, quelle qu’en soit la forme. Néanmoins, le tamoxifène, un agent pharmacologique déjà utilisé en clinique depuis de nombreuses années, notamment dans le traitement du cancer du sein [12], a montré des effets bénéfiques chez des modèles précliniques de myopathies centronucléaires. Ces modèles murins reproduisent les défauts retrouvés chez les patients atteints des formes MTM1, DNM2 et BIN1. Les souris déficientes pour Mtm1 démontrent une forme très sévère de la maladie et ont une durée de vie écourtée [13]. Celles dont le gène Dnm2 porte la mutation S619L développent une forme sévère, mais sans impact sur l’espérance de vie [14]. Les souris déficientes pour Bin1 reproduisent une forme modérée de la maladie [15]. Ces trois modèles murins présentent les mêmes symptômes cliniques, cellulaires et moléculaires que ceux retrouvés chez les patients, à savoir une faiblesse musculaire, une atrophie des fibres, une localisation anormale des mitochondries et une augmentation du niveau de la dynamine 2. Le tamoxifène agit différemment sur chacun de ces paramètres selon le modèle murin.
Le tamoxifène améliore la force musculaire dans différents modèles murins de myopathies centronucléaires
Un suivi longitudinal des animaux malades, traités et non traités par supplémentation en tamoxifène dans la nourriture, a permis d’évaluer le phénotype in vivo des modèles animaux Mtm1, Bin1 et Dnm2. Ce suivi a mis en évidence des effets positifs du tamoxifène sur le phénotype myopathique dès la première semaine de traitement. Ces effets du tamoxifène sont rapides et stables, comme l’atteste l’amélioration des mesures de performances motrices des souris Mtm1, Bin1 et Dnm2 traitées [16, 17]. À l’échelle du muscle de base, les trois modèles présentent une faiblesse musculaire (i.e. perte de force maximale). Le traitement au tamoxifène augmente la force maximale chez les modèles Bin1 et Mtm1 [16, 17], mais pas chez le modèle Dnm2 [17]. L’effet du tamoxifène sur la faiblesse musculaire est donc indépendant de la sévérité de la maladie et semble être associé au gène muté. En revanche, la production de force à des contractions sous-maximales est fortement augmentée chez tous les modèles en réponse à l’administration de tamoxifène. Cet effet est similaire à celui rapporté chez un modèle murin de la myopathie de Duchenne [18]. Néanmoins, chez les trois modèles de myopathies centronucléaires, l’atrophie musculaire persiste après le traitement au tamoxifène [16, 17]. Ainsi, l’augmentation de la production de force serait associée à une meilleure capacité des fibres musculaires à se contracter.
La cause majeure de la faiblesse musculaire dans les myopathies centronucléaires est un défaut du couplage excitation-contraction, caractérisé par une réduction de la libération de calcium au cours de la contraction [15, 19]. Cette réduction ne serait pas causée par une diminution des stocks de calcium dans le réticulum sarcoplasmique, et pourrait s’expliquer par la diminution du niveau protéique du récepteur à la ryanodine (RYR1) [17, 20]. La normalisation du niveau de RYR1 en réponse à l’administration de tamoxifène, notamment chez le modèle Bin1 suggère que le tamoxifène pourrait avoir un rôle majeur sur la régulation calcique impliquée dans l’amélioration de la contractilité du muscle. Cette hypothèse est étayée par l’augmentation du niveau de calcium cytosolique rapportée chez les souris Mtm1 traitées au tamoxifène [16].
La dynamine 2 : un pivot pathologique et thérapeutique
La quantité de DNM2 est largement augmentée dans les muscles de patients MTM1, ainsi que dans les muscles du modèle murin Mtm1 [21]. Elle est également anormalement élevée dans les muscles des modèles Bin1 et Dnm2 [17]. La diminution d’expression de la protéine DNM2 chez ces différents modèles, via des modulations génétiques ou de l’ARN interférence, améliore considérablement le phénotype musculaire, tant d’un point de vue fonctionnel qu’histologique [14, 15, 21]. La quantité de DNM2 joue donc un rôle majeur dans le développement de la maladie. Cette hypothèse est confirmée par le phénotype myopathique induit par la surexpression de Dnm2 chez des animaux contrôles [22]. La quantité de DNM2 est diminuée chez les modèles Mtm1, Bin1 et Dnm2 suite à une administration de tamoxifène [16, 17]. Ainsi, l’amélioration du phénotype contractile en réponse au tamoxifène pourrait être liée, au moins en partie, à la réduction du niveau de la DNM2. Cette quantité protéique varie sans qu’il n’y ait de modification au niveau de l’expression du gène Dnm2, quelle que soit la condition [17, 23]. Ainsi, la modulation de la quantité de la DNM2 serait principalement associée à des modifications de la stabilité ou de la dégradation de la protéine. Les marqueurs des systèmes protéolytiques sont augmentés chez les modèles Bin1 et Dnm2 (i.e. p62 et LC3 pour le système autophagique et culline 3 – CUL3 – pour le système ubiquitine-protéasome) [15, 17]. Le protéasome répond au tamoxifène, comme démontré par la normalisation du niveau de CUL3 chez les animaux traités, contrairement à l’autophagie pour laquelle les marqueurs restent anormalement élevés posttraitement. La culline 3 est une ubiquitine ligase qui joue un rôle dans la dégradation des protéines dans le muscle strié squelettique et qui est impliquée dans le mécanisme physiopathologique à l’origine de diverses formes de myopathie à némaline [24, 25]. L’évolution en parallèle des quantités de CUL3 et de DNM2 dans le muscle des modèles Bin1 et Dnm2 suggère que celle de la CUL3 pourrait être associée à celle de la DNM2. Le tamoxifène pourrait donc améliorer la dégradation de la DNM2 par le protéasome en impliquant la CUL3.
Une amélioration du phénotype histologique dépendante du gène muté
Le défaut histologique commun retrouvé dans le muscle des souris Mtm1, Bin1 et Dnm2 est un mauvais positionnement des mitochondries. Chez le modèle Mtm1, ces organites forment un cercle en périphérie des fibres musculaires [16]. Chez les modèles Dnm2 et Bin1, les mitochondries s’accumulent au centre des myofibres [17]. Ces anomalies sont totalement absentes après administration de tamoxifène, mais uniquement chez le modèle Bin1 (Figure 1). En revanche, elles persistent dans le muscle chez les modèles Mtm1 et Dnm2 traités, quelle que soit la dose de tamoxifène administrée [17].
 |
Figure 1 Le tamoxifène prévient la mauvaise distribution des mitochondries au sein des fibres musculaires uniquement pour la forme Bin1. Images représentatives de l’activité oxydative de la SDH (succinate déshydrogénase) sur des coupes de muscle tibial antérieur de souris contrôles (WT) non-traitées et de souris malades (Tg) non-traitées et traitées au tamoxifène, pour les lignées Mtm1, Dnm2 et Bin1. |
La desmine joue un rôle dans le positionnement des noyaux et des mitochondries [26, 27]. Chez les modèles murins de myopathies centronucléaires, la desmine est anormalement positionnée dans la fibre musculaire [17, 28]. La localisation de la desmine est concordante avec celle des mitochondries, au moins chez les souris Dnm2 et Bin1, avec et sans tamoxifène [17]. Ceci indique que l’effet bénéfique du tamoxifène sur le phénotype histologique est vraisemblablement lié à une normalisation de la distribution de la desmine dans la cellule musculaire. L’ensemble de ces données atteste du rôle de la desmine dans le positionnement des organites dans les myopathies centronucléaires.
Une internalisation des noyaux est aussi une caractéristique histopathologique des myopathies centronucléaires. Le tamoxifène montre un effet bénéfique, bien que partiel, sur le nombre de fibres présentant des noyaux anormalement localisés chez le modèle Mtm1, alors qu’il n’a aucun effet sur ce phénotype chez les souris Dnm2. Ces résultats indiquent que l’effet du tamoxifène sur le phénotype histologique ne dépend pas de la sévérité de la maladie, mais semble plutôt être associé au gène muté.
Dans l’ensemble, après traitement au tamoxifène, la production de force est améliorée chez les modèles Mtm1 et Dnm2, alors que la force est normalisée chez le modèle Bin1. Ces résultats suggèrent que l’élimination des défauts histologiques n’est pas indispensable à l’amélioration de la contractilité du muscle. De manière intéressante, le nombre de fibres avec une accumulation anormale de SDH (succinate déshydrogénase) est négativement corrélé à la force sous-maximale chez le modèle Bin1 (Figure 2). Ainsi, l’amélioration des défauts histologiques potentialise la normalisation de la fonction musculaire.
 |
Figure 2 Relation linéaire entre le nombre de fibres présentant une accumulation anormale de SDH et la production de force sous-maximale chez les souris Bin1 traitées () et non-traitées () par le tamoxifène. Plus le nombre de fibres avec une accumulation anormale de SDH est grand, plus la production de force est faible. r2 = 0,61 ; différence significative, P < 0,01. SDH = succinate déshydrogénase. |
Le tamoxifène n’agit pas par la voie génomique
Le tamoxifène est un modulateur des récepteurs aux œstrogènes, qui peut avoir des effets dits « génomiques » par modulation de la transcription, ou des effets dits « non-génomiques » par activation de cascades de signalisation indépendantes de la modulation de la transcription [29]. Afin de déterminer si le tamoxifène agit par modulation de la transcription, le transcriptome de muscle entier de souris malades traitées au tamoxifène a été comparé à celui de souris malades non-traitées, pour les modèles Dnm2 et Mtm1. Le transcriptome des différents modèles murins de myopathies centronucléaires est très largement altéré [30]. Chez le modèle Dnm2, les gènes dérégulés sont associés à l’inflammation, à la contraction musculaire, au développement du muscle et à l’organisation de la matrice extracellulaire [17]. Seulement 10 % des gènes associés à la signature de la maladie sont au moins partiellement compensés après traitement par le tamoxifène. Ces résultats indiquent que le tamoxifène a un effet minime sur le transcriptome (Figure 3). Cependant, les gènes différentiellement exprimés après administration de tamoxifène ne sont pas majoritairement associés aux voies moléculaires altérées par la mutation. Chez le modèle Mtm1, les gènes les plus dérégulés sont associés à la contraction musculaire et à l’inflammation [30]. Seulement sept gènes sont différentiellement exprimés après traitement au tamoxifène, dont uniquement trois sont associés à la maladie [16]. Ainsi, l’amélioration du phénotype observée chez les modèles murins de myopathies centronucléaires après traitement par le tamoxifène ne semble pas liée à des modifications transcriptionnelles. Ceci suggère que l’effet thérapeutique du tamoxifène passe par des effets non-génomiques.
 |
Figure 3 Le tamoxifène n’a pas, ou peu, d’effet sur les gènes dérégulés chez les souris modèles des formes Dnm2 et Mtm1. Analyse de l’expression différentielle des gènes chez les souris Dnm2 (A-C) et Mtm1 (D-F). (A et D) Nombre de gènes différentiellement exprimés (DEGs) chez les souris malades traitées et non-traitées, contrôles (WT) traitées et non-traitées, malades traitées et contrôles non-traitées (DEGs associés à la maladie). (B et E) Diagramme de Venn des gènes dérégulés. (C et F) Effet du tamoxifène sur les DEGs associés à la maladie et affectés par le tamoxifène, spécifiquement chez les souris malades traitées. |
Une alternative thérapeutique pour toutes les formes de myopathie centronucléaire ?
Remarquablement, le tamoxifène a prouvé être bénéfique pour traiter les formes MTM1, BIN1 et DNM2. Le gène MTM1 code la myotubularine 1 qui est une phosphatase des phosphoinositides et qui joue un rôle dans le trafic membranaire dans le muscle. Le gène DNM2 code la dynamine 2 qui est impliquée dans la tubulation et la fission membranaire dans le muscle. Le gène BIN1 code l’amphiphysine 2 dont le rôle est associé à la courbure de la membrane et à la biogénèse des tubules transverses dans le muscle. Le gène RYR1 code le canal calcique RYR1 qui est localisé sur la membrane du réticulum sarcoplasmique et permet la libération du calcium vers le cytosol et la contraction musculaire.
Les principaux gènes mutés dans les myopathies centronucléaires codent donc pour les protéines jouant un rôle structural ou fonctionnel, au niveau de la triade, pour le couplage excitation-contraction. Ces données suggèrent un mécanisme physiopathologique commun à toutes ces formes et donc la possibilité de guérir les différentes formes de myopathies centronucléaires avec une approche thérapeutique commune. Le tamoxifène pourrait donc être bénéfique pour toutes les formes de myopathies centronucléaires, quel que soit le gène muté, y compris la forme RYR1, une des plus fréquentes de ces pathologies.
Conclusion
Le tamoxifène apporte des bénéfices fonctionnels notables pour plusieurs formes de myopathies centronucléaires, au moins partiellement par la diminution du niveau anormalement élevé de la DNM2 (Figure 4). Les effets positifs rapportés chez les modèles précliniques montrant différentes sévérités suggèrent que le tamoxifène pourrait être efficace chez des patients avec des formes adultes ou infantiles. Par ailleurs, même si le mécanisme d’action du tamoxifène dans le muscle n’est pas totalement compris à ce jour, notre étude a permis d’éclaircir son action dans le contexte des myopathies centronucléaires. De plus, l’effet principal du tamoxifène ne serait pas génomique, ce qui ouvre de nouvelles perspectives d’investigations quant aux voies moléculaires sous-jacentes à l’amélioration de la fonction musculaire. Enfin, le tamoxifène pourrait servir d’approche thérapeutique commune aux myopathies centronucléaires, quel que soit le gène muté, afin de contrecarrer la faiblesse musculaire.
 |
Figure 4 Le tamoxifène a des effets bénéfiques au niveau fonctionnel, histologique et/ou moléculaire chez les souris modèles des formes Bin1, Dnm2 et Mtm1. N/A = non disponible. DNM2 = dynamine 2. CUL3 = culline 3. |
Prix SFM
Charlotte Gineste a reçu le prix Impulsion lors des journées de la Société française de myologie (SFM) 2023.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Jungbluth H, Wallgren-Pettersson C, Laporte J. Centronuclear (myotubular) myopathy. Orphanet J Rare Dis 2008 ; 3 : 26. [CrossRef] [PubMed] [Google Scholar]
- Romero NB. Centronuclear myopathies: a widening concept. Neuromuscul Dis 2010 ; 20 : 223–228. [CrossRef] [Google Scholar]
- Laporte J, Hu LJ, Kretz C, et al. A gene mutated in X-linked myotubular myopathy defines a new putative tyrosine phosphatase family conserved in yeast. Nat Genet 1996 ; 13 : 175–182. [Google Scholar]
- Jungbluth H, Treves S, Zorzato F, et al. Congenital myopathies: disorders of excitation-contraction coupling and muscle contraction. Nat Rev Neurol 2018 ; 14 : 151–167. [CrossRef] [PubMed] [Google Scholar]
- Bitoun M, Bevilacqua JA, Prudhon B, et al. Dynamin 2 mutations cause sporadic centronuclear myopathy with neonatal onset. Ann Neurol 2007 ; 62 : 666–670. [CrossRef] [PubMed] [Google Scholar]
- Bitoun M, Maugenre S, Jeannet PY, et al. Mutations in dynamin 2 cause dominant centronuclear myopathy. Nat Genet 2005 ; 37 : 1207–1209. [CrossRef] [PubMed] [Google Scholar]
- Bohm J, Biancalana V, Dechene ET, et al. Mutation spectrum in the large GTPase dynamin 2, and genotype-phenotype correlation in autosomal dominant centronuclear myopathy. Hum Mut 2012 ; 33 : 949–959. [CrossRef] [Google Scholar]
- Bohm J, Biancalana V, Malfatti E, et al. Adult-onset autosomal dominant centronuclear myopathy due to BIN1 mutations. Brain 2014 ; 137 : 3160–3170. [CrossRef] [PubMed] [Google Scholar]
- Nicot AS, Toussaint A, Tosch V, et al. Mutations in amphiphysin 2 (BIN1) disrupt interaction with dynamin 2 and cause autosomal recessive centronuclear myopathy. Nat Genet 2007 ; 39 : 1134–1139. [CrossRef] [PubMed] [Google Scholar]
- Bevilacqua JA, Monnier N, Bitoun M, et al. Recessive RYR1 mutations cause unusual congenital myopathy with prominent nuclear internalization and large areas of myofibrillar disorganization. Neuropathol Appl Neurobiol 2011 ; 37 : 271–284. [CrossRef] [PubMed] [Google Scholar]
- Wilmshurst JM, Lillis S, Zhou H, et al. RYR1 mutations are a common cause of congenital myopathies with central nuclei. Ann Neurol 2010 ; 68 : 717–726. [CrossRef] [PubMed] [Google Scholar]
- Jordan VC. Tamoxifen: a most unlikely pioneering medicine. Nat Rev Drug Discov 2003 ; 2 : 205–213. [CrossRef] [PubMed] [Google Scholar]
- Buj-Bello A, Laugel V, Messaddeq N, et al. The lipid phosphatase myotubularin is essential for skeletal muscle maintenance but not for myogenesis in mice. PNAS 2002 ; 99 : 15060–15065. [CrossRef] [PubMed] [Google Scholar]
- Massana Munoz X, Kretz C, Silva-Rojas R, et al. Physiological impact and disease reversion for the severe form of centronuclear myopathy linked to dynamin. JCI Insight 2020 ; 5 : e137899. [CrossRef] [PubMed] [Google Scholar]
- Silva-Rojas R, Nattarayan V, Jaque-Fernandez F, et al. Mice with muscle-specific deletion of Bin1 recapitulate centronuclear myopathy and acute downregulation of dynamin 2 improves their phenotypes. Mol Ther 2022 ; 30 : 868–880. [CrossRef] [PubMed] [Google Scholar]
- Gayi E, Neff LA, Massana Muñoz X, et al. Tamoxifen prolongs survival and alleviates symptoms in mice with fatal X-linked myotubular myopathy. Nat Com 2018 ; 9 : 4848. [CrossRef] [Google Scholar]
- Gineste C, Simon A, Braun M, et al. Tamoxifen improves muscle structure and function of Bin1- and Dnm2-related centronuclear myopathies. Brain 2023 ; 146 : 3029–3048. [CrossRef] [PubMed] [Google Scholar]
- Dorchies OM, Reutenauer-Patte J, Dahmane E, et al. The anticancer drug tamoxifen counteracts the pathology in a mouse model of duchenne muscular dystrophy. Am J Pathol 2013 ; 182 : 485–504. [CrossRef] [PubMed] [Google Scholar]
- Kutchukian C, Lo Scrudato M, Tourneur Y, et al. Phosphatidylinositol 3-kinase inhibition restores Ca2+ release defects and prolongs survival in myotubularin-deficient mice. PNAS 2016 ; 113 : 14432–14437. [CrossRef] [PubMed] [Google Scholar]
- Al-Qusairi L, Weiss N, Toussaint A, et al. T-tubule disorganization and defective excitation-contraction coupling in muscle fibers lacking myotubularin lipid phosphatase. PNAS 2009 ; 106 : 18763–18768. [CrossRef] [PubMed] [Google Scholar]
- Cowling BS, Chevremont T, Prokic I, et al. Reducing dynamin 2 expression rescues X-linked centronuclear myopathy. JCI 2014 ; 124 : 1350–1363. [CrossRef] [PubMed] [Google Scholar]
- Cowling BS, Toussaint A, Amoasii L, et al. Increased expression of wild-type or a centronuclear myopathy mutant of dynamin 2 in skeletal muscle of adult mice leads to structural defects and muscle weakness. Am J Pathol 2011 ; 178 : 2224–2235. [CrossRef] [PubMed] [Google Scholar]
- Maani N, Sabha N, Rezai K, et al. Tamoxifen therapy in a murine model of myotubular myopathy. Nat Com 2018 ; 9 : 4849. [CrossRef] [Google Scholar]
- Blondelle J, Tallapaka K, Seto JT, et al. Cullin-3 dependent deregulation of ACTN1 represents a new pathogenic mechanism in nemaline myopathy. JCI Insight 2019 ; 5 : e125665. [CrossRef] [Google Scholar]
- Mansur A, Joseph R, Kim ES, et al. Dynamic regulation of inter-organelle communication by ubiquitylation controls skeletal muscle development and disease onset. Elife 2023 ; 12 : e81966. [CrossRef] [PubMed] [Google Scholar]
- Milner DJ, Mavroidis M, Weisleder N, et al. Desmin cytoskeleton linked to muscle mitochondrial distribution and respiratory function. J Cell Biol 2000 ; 150 : 1283–1296. [CrossRef] [PubMed] [Google Scholar]
- Ralston E, Lu Z, Biscocho N, et al. Blood vessels and desmin control the positioning of nuclei in skeletal muscle fibers. J Cell Physiol 2006 ; 209 : 874–882. [CrossRef] [PubMed] [Google Scholar]
- Hnia K, Tronchere H, Tomczak KK, et al. Myotubularin controls desmin intermediate filament architecture and mitochondrial dynamics in human and mouse skeletal muscle. JCI 2011 ; 121 : 70–85. [CrossRef] [PubMed] [Google Scholar]
- Fuentes N, Silveyra P. Estrogen receptor signaling mechanisms. Adv Protein Chem Struct Biol 2019 ; 116 : 135–170. [CrossRef] [PubMed] [Google Scholar]
- Djeddi S, Reiss D, Menuet A, et al. Multi-omics comparisons of different forms of centronuclear myopathies and the effects of several therapeutic strategies. Mol Ther 2021 ; 29 : 2514–2534. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 Le tamoxifène prévient la mauvaise distribution des mitochondries au sein des fibres musculaires uniquement pour la forme Bin1. Images représentatives de l’activité oxydative de la SDH (succinate déshydrogénase) sur des coupes de muscle tibial antérieur de souris contrôles (WT) non-traitées et de souris malades (Tg) non-traitées et traitées au tamoxifène, pour les lignées Mtm1, Dnm2 et Bin1. |
| Dans le texte | |
 |
Figure 2 Relation linéaire entre le nombre de fibres présentant une accumulation anormale de SDH et la production de force sous-maximale chez les souris Bin1 traitées () et non-traitées () par le tamoxifène. Plus le nombre de fibres avec une accumulation anormale de SDH est grand, plus la production de force est faible. r2 = 0,61 ; différence significative, P < 0,01. SDH = succinate déshydrogénase. |
| Dans le texte | |
 |
Figure 3 Le tamoxifène n’a pas, ou peu, d’effet sur les gènes dérégulés chez les souris modèles des formes Dnm2 et Mtm1. Analyse de l’expression différentielle des gènes chez les souris Dnm2 (A-C) et Mtm1 (D-F). (A et D) Nombre de gènes différentiellement exprimés (DEGs) chez les souris malades traitées et non-traitées, contrôles (WT) traitées et non-traitées, malades traitées et contrôles non-traitées (DEGs associés à la maladie). (B et E) Diagramme de Venn des gènes dérégulés. (C et F) Effet du tamoxifène sur les DEGs associés à la maladie et affectés par le tamoxifène, spécifiquement chez les souris malades traitées. |
| Dans le texte | |
 |
Figure 4 Le tamoxifène a des effets bénéfiques au niveau fonctionnel, histologique et/ou moléculaire chez les souris modèles des formes Bin1, Dnm2 et Mtm1. N/A = non disponible. DNM2 = dynamine 2. CUL3 = culline 3. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




