| Issue |
Med Sci (Paris)
Volume 40, Number 6-7, Juin-Juillet 2024
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 569 - 572 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024072 | |
| Published online | 08 July 2024 | |
L’immunocytokine FAP-IL2v: Un co-traitement efficace pour pallier la résistance au trastuzumab du cancer du sein HER2+
The immunocytokine FAP-IL2v : a potent co-therapy for preventing resistance to trastuzumab in HER2+ breast cancer
1
Master Biologie Moléculaire et Cellulaire (BMC), Parcours Immunologie, M2 Immunologie Translationnelle et Biothérapies, Sorbonne Université, Paris, France
2
Centre de recherche des Cordeliers, Inserm U1138, Université Paris Cité, Sorbonne Université, Paris, France
3
Gustave Roussy Cancer Campus, Villejuif, France
a pariseleleonore@yahoo.fr
b laura.prudhomme@etu.sorbonne-universite.fr
c pol_jonathan@yahoo.fr
Dans le cadre de leur module d’analyse scientifique, des étudiants des promotions 2022-2023 et 2023-2024 des Master 2 « Immunologie Translationnelle et Biothérapies » (ITB) et « Immunologie Intégrative et Systémique » (I2S) (Mention Biologie Moléculaire et Cellulaire, Parcours Immunologie, Sorbonne Université) se sont penchés sur la littérature et ont pris la plume pour partager avec les lecteurs de m/s quelques-uns des faits marquants de l’actualité en immunologie. Voici une sélection de quelques-unes de ces nouvelles, illustrant la large palette des axes de recherche en cours sur les mécanismes physiopathologiques des maladies infectieuses, auto-immunes, inflammatoires et tumorales et sur le développement d’immunothérapies pour le traitement de ces pathologies.
On y découvre ainsi de nouvelles avancées sur l’analyse transcriptomique du microenvironnement inflammatoire de pathologies autoimmunes, sur des aspects mécanistiques impliqués dans la survie des cellules cancéreuses et la réponse immunitaire anti-tumorale des cellules NK, l’interconnexion entre le système immunitaire et le système nerveux périphérique, le développement de nouvelles immunothérapies permettant de cibler préférentiellement le microenvironnement tumoral et la prise en charge des effets secondaires autoimmuns cardiaques induits par les immunothérapies.
Toute l’équipe pédagogique remercie également chaleureusement les différents tuteurs, experts dans le domaine en lien avec les nouvelles, qui ont accompagné avec bienveillance et enthousiasme le travail de nos étudiants !
© 2024 médecine/sciences – Inserm
L’actualité scientifique vue par les étudiants du Master 2 « Immunologie Translationnelle et Biothérapies » (ITB) et « Immunologie Intégrative et Systémique » (I2S) (Mention Biologie Moléculaire et Cellulaire, Parcours Immunologie, Sorbonne Université)
Équipe pédagogique
Bertrand Bellier (Professeur des Universités, Sorbonne Université)
Claire Deligne (Maîtresse de Conférences, Sorbonne Université)
Stéphanie Graff-Dubois (Professeur des Universités, Sorbonne Université)
Pierre-Emmanuel Joubert (Maître de Conférences, Sorbonne Université)
Encarnita Mariotti-Ferrandiz (Maîtresse de Conférences, Sorbonne Université)
Véronique Mateo (Maîtresse de Conférences, Sorbonne Université)
Sophie Sibéril (Maîtresse de Conférences, Sorbonne Université)

Série coordonnée par Sophie Sibéril.
Le cancer du sein se développe majoritairement à partir des cellules épithéliales des canaux lactifères ou encore des glandes mammaires. Avec près de 2,3 millions de nouveaux cas et 685 000 décès en 2020, il est à ce jour le cancer le plus diagnostiqué dans le monde [1]. Il constitue la principale cause de mort par cancer chez la femme et la cinquième cause de décès dus aux cancers dans la population générale.
On distingue 4 types moléculaires de cancer du sein en fonction de l’expression des récepteurs HER2 (human epidermal growth factor receptor-2), ER (estrogen receptor), PR (progesterone receptor) et du marqueur de prolifération cellulaire Ki-67 : 1) le type « luminal A » correspond à un tissu tumoral ER+ PR+/- HER2− Ki-67faible ; 2) les cancers du sein « luminal B » sont ER+ PR+/- et soit HER2+ soit HER2− Ki-67élevé ; 3) les cancers du sein dits « HER2+ » surexpriment HER2, et enfin 4) les tumeurs du sein « TNBC » (triple negative breast cancer) sont ER− PR− HER2−. Le sous-type moléculaire est déterminé au diagnostic et conditionne le pronostic et la prise en charge du patient [2].
Les tumeurs de type « HER2+ » représentent 25 à 30 % des cancers du sein et sont associées à un mauvais pronostic [3–5]. Elles sont principalement traitées par chimiothérapie néoadjuvante combinée à une thérapie ciblée : le trastuzumab. Le trastuzumab est un anticorps monoclonal humanisé de sous-classe IgG1 qui se lie avec une haute affinité au domaine extracellulaire de HER2, empêchant son interaction et son activation par son ligand. Il inhibe ainsi la prolifération des cellules malignes qui surexpriment HER2 [6]. En plus de cet effet direct, le trastuzumab présente une activité antitumorale indirecte médiée par des cellules immunitaires exprimant des récepteurs du fragment Fc des anticorps (FcR), en particulier les cellules NK (natural killer) ; ce phénomène est connu sous l’appellation d’ADCC pour antibody dependent cell-mediated cytotoxicity [7]. Malheureusement, le traitement par anti-HER2 comme le trastuzumab ne bénéficie qu’à 40 à 60 % des patients et une récidive de la maladie a été rapportée dans 15 à 20 % des cas [3] en raison du développement de mécanismes de résistance [8].
Résistance au trastuzumab et cellules stromales du microenvironnement tumoral chez les patientes atteintes de cancer du sein HER2+
Le microenvironnement tumoral (TME, pour tumor microenvironment) contient des cellules stromales qui soutiennent la croissance des cellules malignes et les protègent des effecteurs immunitaires antitumoraux. Parmi ces cellules, les fibroblastes associés au cancer, ou CAF (pour cancer-associated fibroblasts), sont majoritaires. Les CAF se distinguent des fibroblastes issus de stromas sains par la production de facteurs de croissance et de protéines de la matrice extracellulaire favorisant la prolifération et la survie des cellules tumorales [9]. Plusieurs sous-types de fibroblastes ont été décrits dans la littérature sur la base d’analyses transcriptomiques, notamment dans les cancers du sein. En particulier, les CAF-S1 et pCAF, qui se caractérisent respectivement par une expression élevée des protéines FAP (fibroblast activation protein) et PDPN (Podoplanine), présentent des fonctions inflammatoires et immunosuppressives. À l’inverse, les sCAF (qui expriment la protéine S100A4) seraient capables de présenter des antigènes et de stimuler l’immunité antitumorale [10–12].
Rivas et al. ont récemment montré, dans une cohorte de 22 patientes, que les tumeurs HER2+ traitées par le trastuzumab étaient enrichies en leucocytes chez les individus sans rechute (RF pour relapse-free) en comparaison aux sujets dont la tumeur réapparaît après traitement (Rel pour relapse) [3]. Dans deux cohortes publiques indépendantes de cancers du sein HER2+, les auteurs ont observé que le ratio entre les cellules immunitaires infiltrant la tumeur et les cellules stromales était plus élevé 1) dans la tumeur des patientes présentant une réponse pathologique complète (pCR pour pathological complete response) en comparaison aux patientes conservant une tumeur résiduelle (RD pour residual disease) post-trastuzumab (cohorte GSE50948), et 2) dans le tissu tumoral des patientes RF après traitement avec les anticorps anti-HER2 en comparaison aux patientes Rel (cohorte GSE55348). En parallèle, des analyses bioinformatiques ont montré un enrichissement significatif de la signature en CAF-S1 et pCAF dans la tumeur des patientes RD et Rel en comparaison aux patients pCR et RF. À l’inverse, les patientes RF présentaient un tissu cancéreux enrichi en sCAF avant traitement par trastuzumab. Ces données suggèrent donc que les fibroblastes immunosuppressifs CAF-S1 et pCAF sont associés à une résistance au trastuzumab chez les patientes HER2+ [3].
Importance des voies de l’IL-2 et du TGF-β dans le potentiel thérapeutique du trastuzumab
L’exclusion immunitaire étant apparente dans les tumeurs des patientes ne répondant pas au trastuzumab, les auteurs ont alors recherché des signatures de gènes immunitaires associées à la réponse aux anti-HER2 [3]. Parmi eux, un ensemble de gènes induits par l’interleukine 2 (IL-2) dans les cellules NK était inversement corrélé avec l’expression de gènes signatures des CAF-S1 et pCAF dans la cohorte GSE55348 et pCAF dans la cohorte GSE50948. Autrement dit, une faible signature de réponse à l’IL-2 des cellules NK dans la tumeur avant trastuzumab est prédictive d’une récidive de la maladie après traitement. Dans ce sens, des analyses immunohistologiques des tumeurs HER2+ des 22 patientes de la cohorte de Rivas et al. ont révélé un nombre accru de cellules NK CD56+ intra-tumorales dans les tumeurs des patientes RF par rapport aux sujets Rel après traitement par anti-HER2 [3].
Par ailleurs, il a été récemment montré que les CAF produisent le facteur de croissance TGF-β1 (transforming growth factor beta 1) aux effets pléiotropes autocrines et paracrines. Cette activité particulière des CAF est communément observée au cours de la carcinogenèse. Elle contribue activement à la prolifération, la migration, l’invasion et les métastases des cellules cancéreuses [13]. Dans le cancer du sein, les CAF-S1 stimulent la migration des cellules cancéreuses et leur transition épithélio-mésenchymateuse de façon dépendante du TGF-β [14]. Rivas et al. ont montré in vitro que l’expression de la protéine d’activation fibroblastique FAP était induite par le TGF-β dans les fibroblastes du sein [3]. Dans les cohortes de patientes présentant un cancer du sein HER2+ et traitées par trastuzumab, ils ont observé une corrélation entre la signature génique de réponse au TGF-β (TBRS) et l’expression de FAP dans les cellules stromales (fibroblastes, cellules endothéliales) et immunitaires (macrophages, cellules NK et lymphocytes T) du TME. Point important, la TBRS fibroblastique est augmentée chez les patientes RD et fortement corrélée avec les signatures des CAF-S1 et pCAF [3].
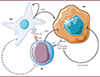 |
Figure 1. L’immunocytokine FAP-IL2v restaure l’efficacité du trastuzumab dans un modèle de cancer du sein HER2+. Dans les cancers du sein HER2+, les cellules tumorales (BCC pour breast cancer cells) surexpriment HER2, un récepteur du facteur de croissance épidermique (EGF) qui stimule la prolifération cellulaire. Le trastuzumab, un anticorps monoclonal humanisé anti-HER2, est utilisé dans le traitement de ces cancers. D’une part, le trastuzumab inhibe la prolifération des BCC positives pour HER2 et induit la mort cellulaire (cytoxicité directe). D’autre part, il est un puissant médiateur de la cytotoxicité cellulaire dépendante des anticorps (ADCC pour antibody dependent cellular cytotoxicity), via sa liaison au récepteur Fc (FcR) des lymphocytes NK (natural killer) cytotoxiques (cytotoxicité indirecte). Cependant, de nombreux cancers HER2+ sont résistants au trastuzumab. Cette résistance est due aux fibroblastes associés au cancer (CAF pour cancer associated fibroblasts) qui sont impliqués dans la survie et la prolifération des BCC via la sécrétion de TGF-β (transforming growth factor beta) qui a un effet autocrine et paracine. Ce facteur de croissance stimule le pouvoir invasif et métastatique des BCC et inhibe l’activité effectrice des cellules immunitaires antitumorales. L’activité du TGF-β stimule également l’expression de la protéine d’activation des fibroblastes FAP à la surface des CAF. L’immunocytokine FAP-IL2v est une molécule recombinante composée d’une variante de l’IL-2 avec une affinité préférentielle pour les cellules T et NK fusionnée à un anticorps ciblant FAP. Il a été montré que, en présence de CAF exprimant FAP, la molécule FAP-IL2v permet de restaurer l’efficacité du trastuzumab en favorisant la survie des cellules NK médiatrices d’ADCC. TME: tumor microenvironment. |
Dans l’ensemble, ces résultats indiquent que la résistance aux anticorps anti-HER2 résulte d’un enrichissement en CAF-S1 et pCAF exprimant FAP sous l’action du TGF-β, et d’une diminution concomitante de la sensibilité des cellules NK intra-tumorales à l’IL-2. Ces résultats suggèrent donc que l’IL-2 pourrait permettre de contrecarrer ces mécanismes de résistance au trastuzumab.
FAP-IL2v restaure l’efficacité du trastuzumab dans un modèle de cancer du sein HER2+
L’IL2 recombinante (aldesleukine) est un puissant immunomodulateur approuvé pour le traitement des patients atteints d’un carcinome rénal métastatique ou d’un mélanome. Son administration systémique reste cependant limitée en raison d’effets secondaires sévères [15]. Pour pallier ces effets indésirables, une immunocytokine composée d’IL2v (une variante de l’IL-2 avec une affinité préférentielle pour les cellules T et NK) fusionnée à un anticorps ciblant FAP a été conçue. À l’inverse de l’aldesleukine, l’activité de FAP-IL2v est concentrée dans les tissus enrichis en FAP, tels que le TME des cancers du sein HER2+.
Rivas et al. ont évalué l’efficacité de FAP-IL2v en combinaison avec le traitement au trastuzumab. Pour cela, les auteurs ont développé un modèle ex vivo en trois dimensions de tumeurs humaines de sein HER2+ (HER2+ 3DiBC) [3]. Ce modèle inclut des cellules malignes du sein positives pour HER2, des fibroblastes, et des cellules immunitaires primaires naïves. En présence des cellules immunitaires et en absence de fibroblastes, l’efficacité anti-tumorale du trastuzumab est modérée (réduction de 39 % du nombre de cellules cancéreuses). L’introduction de fibroblastes abolit l’ADCC induite par le trastuzumab. L’addition de FAP-IL2v dans le modèle HER2+ 3DiBC potentialise l’efficacité du trastuzumab et permet d’obtenir une réduction remarquable de 80 % de la masse tumorale. Cet effet bénéfique de FAP-IL2v est dépendant de l’activité du TGF-β et de la présence de fibroblastes ; les fibroblastes en co-culture avec les cellules tumorales surexpriment FAP, servant ainsi, dans le TME, de point d’ancrage au FAP-IL2v. Ce dernier acteur agit sur l’activité du trastuzumab en stimulant l’ADCC médiée par les cellules NK. De fait, son bénéfice thérapeutique est abrogé par l’administration d’anticorps neutralisant l’activité des cellules NK CD16+ [3].
Conclusion
La résistance des tumeurs du sein HER2+ au traitement par le trastuzumab peut résulter d’un enrichissement du TME en CAF à activité immunosuppressive dépendante du TGF-β (comme les CAF-S1 ou pCAF). Ce microenvironnement est favorable au développement des cellules malignes mais délétère au recrutement et à la survie des cellules immunitaires antitumorales telles que les lymphocytes NK, ces derniers contribuant à l’activité thérapeutique des anticorps anti-HER2 via le mécanisme d’ADCC.
Afin de stimuler la survie et les fonctions effectrices des lymphocytes, comme les lymphocytes NK, l’administration systémique d’IL-2 a été envisagée pour améliorer l’efficacité des immunothérapies, comme le trastuzumab. Si son intérêt thérapeutique a été démontré dans plusieurs indications oncologiques, son application clinique reste limitée à cause d’effets secondaires sévères. Des variantes de l’IL-2 ont donc été élaborées pour pallier cette contrainte. Parmi celles-ci, les immunocytokines consistent en une IL-2 recombinante modifiée pour se fixer préférentiellement aux récepteurs de l’IL-2 des lymphocytes effecteurs (lymphocytes NK, lymphocytes T CD8+) plutôt que régulateurs (lymphocytes T CD4+ FoxP3+) [15]. Elles sont fusionnées à un anticorps spécifique d’un antigène enrichi dans le tissu à traiter pour augmenter la biodisponibilité locale en IL-2. L’étude de Rivas et al. révèle que l’immunocytokine FAP-IL2v permet de restaurer l’efficacité du traitement des tumeurs du sein HER2+ par le trastuzumab, en rétablissant l’ADCC dans un TME riche en CAF FAP+ immunosuppressifs [3]. Des essais cliniques dans des cohortes de patientes porteuses de tumeurs HER2+ RD/Rel permettraient d’évaluer l’intérêt clinique de l’association du trastuzumab avec la molécule FAP-IL2v.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Arnold M, Morgan E, Rumgay H, et al. Current and future burden of breast cancer : Global statistics for 2020 and 2040. Breast 2022; 66 : 15–23. [CrossRef] [PubMed] [Google Scholar]
- Guiu S, Michiels S, Andre F, et al. Molecular subclasses of breast cancer : how do we define them? The IMPAKT 2012 Working Group Statement. Ann Oncol 2012 ; 23 : 2997–3006. [CrossRef] [PubMed] [Google Scholar]
- Rivas EI, Linares J, Zwick M, et al. Targeted immunotherapy against distinct cancer-associated fibroblasts overcomes treatment resistance in refractory HER2+ breast tumors. Nat Commun 2022; 13 : 5310. [CrossRef] [PubMed] [Google Scholar]
- Valabrega G, Montemurro F, Aglietta M. Trastuzumab : mechanism of action, resistance and future perspectives in HER2-overexpressing breast cancer. Ann Oncol 2007 ; 18 : 977–984. [CrossRef] [PubMed] [Google Scholar]
- Kunte S, Abraham J, Montero AJ. Novel HER2-targeted therapies for HER2-positive metastatic breast cancer. Cancer 2020; 126 : 4278–88. [CrossRef] [PubMed] [Google Scholar]
- McKeage K, Perry CM. Trastuzumab : a review of its use in the treatment of metastatic breast cancer overexpressing HER2. Drugs 2002 ; 62 : 209–243. [CrossRef] [PubMed] [Google Scholar]
- Ahmed S, Sami A, Xiang J. HER2-directed therapy : current treatment options for HER2-positive breast cancer. Breast Cancer 2015 ; 22 : 101–116. [CrossRef] [PubMed] [Google Scholar]
- Watanabe S, Yonesaka K, Tanizaki J, et al. Targeting of the HER2/HER3 signaling axis overcomes ligand-mediated resistance to trastuzumab in HER2-positive breast cancer. Cancer Med 2019 ; 8 : 1258–1268. [CrossRef] [PubMed] [Google Scholar]
- Sonnenblick A, Salmon-Divon M, Salgado R, et al. Reactive stroma and trastuzumab resistance in HER2-positive early breast cancer. Int J Cancer 2020; 147 : 266–76. [CrossRef] [PubMed] [Google Scholar]
- Friedman G, Levi-Galibov O, David E, et al. Cancer-associated fibroblast compositions change with breast cancer progression linking the ratio of S100A4(+) and PDPN(+) CAFs to clinical outcome. Nat Cancer 2020; 1 : 692–708. [CrossRef] [PubMed] [Google Scholar]
- Costa A, Kieffer Y, Scholer-Dahirel A, et al. Fibroblast Heterogeneity and Immunosuppressive Environment in Human Breast Cancer. Cancer Cell 2018 ; 33 : 463–79 e10. [CrossRef] [PubMed] [Google Scholar]
- Bonneau C, Elies A, Kieffer Y, et al. A subset of activated fibroblasts is associated with distant relapse in early luminal breast cancer. Breast Cancer Res 2020; 22 : 76. [CrossRef] [PubMed] [Google Scholar]
- Wu F, Yang J, Liu J, et al. Signaling pathways in cancer-associated fibroblasts and targeted therapy for cancer. Signal Transduct Target Ther 2021; 6 : 218. [CrossRef] [PubMed] [Google Scholar]
- Pelon F, Bourachot B, Kieffer Y, et al. Cancer-associated fibroblast heterogeneity in axillary lymph nodes drives metastases in breast cancer through complementary mechanisms. Nat Commun 2020; 11 : 404. [CrossRef] [PubMed] [Google Scholar]
- Pol JG, Caudana P, Paillet J, et al. Effects of interleukin-2 in immunostimulation and immunosuppression. J Exp Med 2020; 217. [Google Scholar]
Liste des figures
 |
Figure 1. L’immunocytokine FAP-IL2v restaure l’efficacité du trastuzumab dans un modèle de cancer du sein HER2+. Dans les cancers du sein HER2+, les cellules tumorales (BCC pour breast cancer cells) surexpriment HER2, un récepteur du facteur de croissance épidermique (EGF) qui stimule la prolifération cellulaire. Le trastuzumab, un anticorps monoclonal humanisé anti-HER2, est utilisé dans le traitement de ces cancers. D’une part, le trastuzumab inhibe la prolifération des BCC positives pour HER2 et induit la mort cellulaire (cytoxicité directe). D’autre part, il est un puissant médiateur de la cytotoxicité cellulaire dépendante des anticorps (ADCC pour antibody dependent cellular cytotoxicity), via sa liaison au récepteur Fc (FcR) des lymphocytes NK (natural killer) cytotoxiques (cytotoxicité indirecte). Cependant, de nombreux cancers HER2+ sont résistants au trastuzumab. Cette résistance est due aux fibroblastes associés au cancer (CAF pour cancer associated fibroblasts) qui sont impliqués dans la survie et la prolifération des BCC via la sécrétion de TGF-β (transforming growth factor beta) qui a un effet autocrine et paracine. Ce facteur de croissance stimule le pouvoir invasif et métastatique des BCC et inhibe l’activité effectrice des cellules immunitaires antitumorales. L’activité du TGF-β stimule également l’expression de la protéine d’activation des fibroblastes FAP à la surface des CAF. L’immunocytokine FAP-IL2v est une molécule recombinante composée d’une variante de l’IL-2 avec une affinité préférentielle pour les cellules T et NK fusionnée à un anticorps ciblant FAP. Il a été montré que, en présence de CAF exprimant FAP, la molécule FAP-IL2v permet de restaurer l’efficacité du trastuzumab en favorisant la survie des cellules NK médiatrices d’ADCC. TME: tumor microenvironment. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




