| Issue |
Med Sci (Paris)
Volume 40, Number 6-7, Juin-Juillet 2024
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 573 - 575 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024073 | |
| Published online | 08 July 2024 | |
Des bactéries pour lutter contre les tumeurs
Bacteria to fight tumors
1
Mention Biologie Moléculaire et Cellulaire (BMC), Parcours Immunologie, Master 2 Immunologie Translationnelle et Biothérapies (ITB), Sorbonne Université, Paris, France
2
Équipe « Biopharmaceuticals & Microorganisms Against Pathologies », UMR ISP 1282 Université de Tours – INRAE, Faculté de Pharmacie, Tours, France
a sopuechberty@gmail.com
b tinhinan.lassouani@gmail.com
c farahamm4r@gmail.com
d isabelle.poisson@univ-tours.fr
L’enjeu des thérapies anti-cancéreuses
Les thérapies anti-cancéreuses majoritairement utilisées depuis des décennies (la chimiothérapie et la radiothérapie) consistent en la dégradation des cellules tumorales de façon non spécifique. Aujourd’hui, la recherche se tourne vers de nouvelles thérapies anti-cancéreuses plus spécifiques pour pallier aux effets secondaires causés par les thérapies conventionnelles. Néanmoins, ces nouvelles thérapies provoquent encore d’autres effets secondaires, tels que la destruction de cellules saines. Il est donc primordial que les nouvelles stratégies permettent de réactiver et d’éduquer le système immunitaire pour qu’il élimine spécifiquement les cellules cancéreuses.
Les cancers sont dus à une prolifération anormale de cellules, engendrant la formation d’une tumeur. Les cellules tumorales réorganisent leur micro-environnement tumoral (MET) pour favoriser leur croissance et pour échapper au système immunitaire [1]. Ce MET est caractérisé par une disponibilité en oxygène très réduite (hypoxie) due à une vascularisation faible ou aberrante. Le MET est composé de cellules tumorales, de cellules immunitaires et de fibroblastes. Néanmoins, ces cellules immunitaires expriment très souvent la molécule inhibitrice PD-1 (programmed death-1), responsable de l’inhibition de leur activité après son interaction avec les ligands PD-L1 (programmed death-ligand 1) ou PD-L2 exprimés par les cellules cancéreuses. Le pouvoir immunosuppresseur du MET, quant à lui, induit la présence de cellules au phénotype tolérogène et anti-inflammatoire, telles que les lymphocytes T (LT) régulateurs et les macrophages de type M2, favorisant ainsi le développement tumoral [1]. Enfin, la zone hypoxique, au cœur de la tumeur, constitue une barrière qui empêche le recrutement de cellules effectrices capables de tuer les cellules cancéreuses, mais aussi l’acheminement des biomédicaments jusqu’à la tumeur.
Ainsi, lorsque l’injection intra-tumorale n’est pas possible, un traitement anticancéreux capable d’atteindre la tumeur par voie intraveineuse pour réactiver le système immunitaire serait une plus-value dans l’arsenal thérapeutique du cancer. Dans cette optique, l’utilisation de virus ou de bactéries comme vecteurs permettant l’acheminement ou la production in situ de molécules immunostimulantes, serait une stratégie prometteuse pour le traitement du cancer.
Le rôle des cytokines pro-inflammatoires
Parmi les molécules immunostimulantes, les cytokines pro-inflammatoires jouent un rôle clé dans la mise en place d’une réponse anti-tumorale efficace, en particulier l’interféron-gamma (IFN-γ). Cette cytokine a un effet pro-apoptotique et anti-prolifératif. Elle permet l’activation de macrophages pro-inflammatoires (de type M1) qui produisent à leur tour des cytokines pro-inflammatoires très importantes dans la lutte contre la tumeur [2], dont l’IL(interleukine)-8. Les macrophages sont également capables de présenter, par leurs molécules du CMH (complexe majeur d’histocompatibilité), des antigènes tumoraux, permettant ainsi l’activation des LT cytotoxiques. Une stratégie visant à induire l’expression de l’IFN-γ, ou d’une autre cytokine, permettrait donc de recruter et de réactiver les cellules immunitaires inhibées par le microenvironnement suppresseur [1].
Des bactéries répondant aux ultrasons
Chen et al. ont conçu une thérapie anti-tumorale fondée sur des bactéries capables d’infiltrer les tumeurs solides et d’exprimer in situ l’IFN-γ : l’URB pour ultrasound-responsive bacterium. Les URB proviennent d’une souche bactérienne d’Escherichia coli non pathogène capable de survivre et de proliférer en milieu anaérobie. Les bactéries ont été modifiées génétiquement par transfection d’un plasmide porteur de la séquence codant l’IFN-γ. Dans ce modèle, l’activation de la transcription du gène inséré est sous le contrôle d’un promoteur inductible à 45 °C, donc dépendant de la chaleur générée par des irradiations d’ultrasons périodiques. Les ultrasons ont l’avantage de posséder une bonne pénétrance des tissus, contrairement aux inducteurs chimiques dont la concentration optimale dans le MET est difficilement atteignable.
Lors de l’injection des bactéries par voie intraveineuse, celles-ci sont préférentiellement attirées par l’environnement hypoxique des tumeurs. L’attraction de la bactérie peut s’expliquer par l’excrétion par le MET de métabolites induisant un chimiotactisme pour ces bactéries [3–5]. Par ailleurs, E. coli a la faculté de proliférer en milieu anaérobie ; elle possède également un flagelle lui conférant une bonne capacité à pénétrer les tissus tumoraux [2,3]. La bactérie utilisée dans cette stratégie présente un tropisme particulier pour le MET. Les bactéries expriment également des auto-capteurs qui leur permettent de moduler l’expression de leurs gènes en fonction de la densité de la colonie bactérienne. Ce mécanisme, appelé quorum sensing, implique une expression génique uniquement lorsque les bactéries prolifèrent, comme c’est le cas dans les conditions du MET, ce qui permet de cibler le lieu d’expression du gène d’intérêt, en l’occurrence la tumeur [6,7].
L’INF-γ produit par les bactéries réactive le système immunitaire
Dans l’étude de Chen et al., l’injection par voie intraveineuse d’environ dix millions d’URB, dans un modèle murin de cancer du sein, permet d’induire, après activation des bactéries avec des ultrasons, une diminution du volume de la tumeur et un ralentissement de la croissance tumorale, ainsi qu’une augmentation de la survie des souris traitées.
Les auteurs se sont ensuite intéressés aux mécanismes moléculaires et cellulaires de cet effet anti-tumoral obtenu in vivo (Figure 1). La production d’IFN-γ par les bactéries au sein de la tumeur irradiée, mesurée par la technique ELISA, est corrélée à une augmentation de l’apoptose des cellules tumorales [3]. De plus, les lipopolysaccharides exprimés à la surface des E. coli, s’infiltrant dans la tumeur, se fixent au récepteur TLR4 (Toll-like receptor 4) des macrophages, conduisant à l’activation de la voie de signalisation NF-κB (nuclear factor κB) et à la production de cytokines pro-inflammatoires, dont l’IFN-γ (Figure 1) [8]. Ces résultats suggèrent donc que la production d’IFN-γ dans la tumeur résulte à la fois de la production exogène des bactéries suite à leur irradiation, mais également de la réaction immunitaire liée à la présence de motifs immunogéniques sur les bactéries injectées.
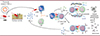 |
Figure 1. Mécanismes anti-tumoraux induits par l’injection de bactéries URB irradiées. La présence des bactéries URB au sein de la tumeur induit la production in situ d’IFN-γ et l’activation des macrophages via la fixation de motifs lipopolysaccharidiques au récepteur inné TLR4. Les macrophages se différencient alors en macrophages pro-inflammatoires de type M1 producteurs d’IFN-γ et de TNF-α, qui vont favoriser l’activation de l’immunité adaptative – lymphocytes T CD8+ cytotoxiques (LTc), lymphocytes T CD4+ helper (LTh), et réponse humorale médiée par les lymphocytes B (LB) –, contribuant ainsi à une réponse anti-tumorale efficace et protectrice à long terme. GzmB : Granzyme B ; PFN : Perforine ; ADCC : cytotoxicité à médiation cellulaire dépendante des anticorps ; CDC : cytotoxicité dépendant du complément. |
Cette production d’IFN-γ participe à l’amplification de la réaction immunitaire globale. En effet, l’analyse des molécules exprimées par les différentes populations de cellules immunitaires, montre que la production d’IFN-γ est à l’origine d’une réduction du nombre de macrophages anti-inflammatoires de type M2 et d’une augmentation du nombre de macrophages pro-inflammatoires de type M1 [3]. Ces macrophages de type M1 activent les LT CD8+ cytotoxiques, avec pour conséquence, une augmentation de l’expression par ces cellules du marqueur de prolifération Ki76, et de la production de molécules pro-inflammatoires et cytotoxiques : TNF-α (tumor necrosis alpha) et Granzyme B. Parallèlement, la population de LT régulateurs, qui joue un rôle clé dans la modulation de l’activité des cellules immunitaires dans les cancers, diminue, avec comme résultat, une réduction des marqueurs anti-inflammatoires : l’IL-10 et Tim (T-cell immunoglobulin domain and mucin domain) [3]. La production d’IFN-γ s’accompagne également d’une augmentation du nombre de LT CD8+ et de LT CD4+ mémoires (Figure 1).
L’IFN-γ produit à la suite de l’injection des URB entraîne donc une activation des cellules immunitaires innées, en particulier des macrophages qui activent de nombreuses cellules effectrices, dont les LT, via la production de cytokines pro-inflammatoires et/ou la présentation d’antigènes tumoraux. Les LT activés, qui participent également à l’amplification de la réponse immunitaire anti-tumorale par des mécanismes de cytotoxicité et/ou de production de cytokines pro-inflammatoires, se différencient en cellules mémoires, ce qui suggère un effet protecteur à long terme du traitement.
L’efficacité de cette stratégie thérapeutique a par ailleurs été confirmée dans un autre modèle de métastases pulmonaires [3].
Une nouvelle voie thérapeutique
Cette étude montre que la stratégie thérapeutique utilisant les URB est très prometteuse en cancérologie. L’intérêt de la thérapie à base d’URB permet de cibler les tumeurs sans endommager les tissus sains. Les URB présentes majoritairement dans la tumeur sont stimulées par ultrasons, puis induisent localement le recrutement et l’activation des macrophages, entraînant une cascade de réactions conduisant à l’apoptose des cellules tumorales (Tableau I). L’URB est donc une solution de choix pour les tumeurs difficilement résécables par chirurgie ou pour les métastases.
Réponse immunitaire et évolution de la tumeur avec traitement par URB irradiées, ou sans URB.
Une étude ultérieure a proposé une optimisation en utilisant des URB exprimant des antagonistes de PD1 afin de limiter l’inhibition de la réponse immunitaire [10]. Dans cette optique, il pourrait être intéressant de concevoir des plasmides permettant de synthétiser à la fois des cytokines pro-inflammatoires et des inhibiteurs de molécules supprimant la réponse immunitaire [11], ou, plus généralement, une combinaison de molécules anti-tumorales adaptées au MET de différents types de cancer.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Hinshaw DC, Shevde LA. The Tumor Microenvironment Innately Modulates Cancer Progression. Cancer Res 2019 ; 79 : 4557–4566. [CrossRef] [Google Scholar]
- Jorgovanovic D, Song M, Wang L, et al. Roles of IFN-γ in tumor progression and regression: a review. Biomarker Research 2020; 8 : 49. [CrossRef] [PubMed] [Google Scholar]
- Chen Y, Du M, Yuan Z, et al. Spatiotemporal control of engineered bacteria to express interferon-γ by focused ultrasound for tumor immunotherapy. Nat Commun 2022; 13 : 4468. [CrossRef] [PubMed] [Google Scholar]
- Forbes NS. Engineering the perfect (bacterial) cancer therapy. Nat Rev Cancer 2010 ; 10 : 785–794. [CrossRef] [PubMed] [Google Scholar]
- Kasinskas RW, Forbes NS. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol Bioeng 2006 ; 94 : 710–721. [CrossRef] [PubMed] [Google Scholar]
- Wu MR, Jusiak B, Lu TK. Engineering advanced cancer therapies with synthetic biology. Nat Rev Cancer 2019 ; 19 : 187–195. [PubMed] [Google Scholar]
- Surette MG, Miller MB, Bassler BL. Quorum sensing in Escherichia coli, Salmonella typhimurium, and Vibrio harveyi: a new family of genes responsible for autoinducer production. Proc Natl Acad Sci U S A 1999 ; 96 : 1639–1644. [CrossRef] [PubMed] [Google Scholar]
- Duong MT-Q, Qin Y, You S-H, et al. Bacteria-cancer interactions: bacteria-based cancer therapy. Exp Mol Med 2019; 51 : 1–15. [CrossRef] [PubMed] [Google Scholar]
- Malley BW, Li D, McQuone SJ, et al. Combination Nonviral Interleukin-2 Gene Immunotherapy For Head and Neck Cancer: From Bench Top to Bedside. Laryngoscope 2005 ; 115 : 391–404. [CrossRef] [PubMed] [Google Scholar]
- Abedi MH, Yao MS, Mittelstein DR, et al. Ultrasound-controllable engineered bacteria for cancer immunotherapy. Nat Commun 2022; 13 : 1585. [CrossRef] [PubMed] [Google Scholar]
- Dróżdż M, Makuch S, Cieniuch G, et al. Obligate and facultative anaerobic bacteria in targeted cancer therapy: Current strategies and clinical applications. Life Sciences 2020; 261 : 118296. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
Liste des tableaux
Réponse immunitaire et évolution de la tumeur avec traitement par URB irradiées, ou sans URB.
Liste des figures
 |
Figure 1. Mécanismes anti-tumoraux induits par l’injection de bactéries URB irradiées. La présence des bactéries URB au sein de la tumeur induit la production in situ d’IFN-γ et l’activation des macrophages via la fixation de motifs lipopolysaccharidiques au récepteur inné TLR4. Les macrophages se différencient alors en macrophages pro-inflammatoires de type M1 producteurs d’IFN-γ et de TNF-α, qui vont favoriser l’activation de l’immunité adaptative – lymphocytes T CD8+ cytotoxiques (LTc), lymphocytes T CD4+ helper (LTh), et réponse humorale médiée par les lymphocytes B (LB) –, contribuant ainsi à une réponse anti-tumorale efficace et protectrice à long terme. GzmB : Granzyme B ; PFN : Perforine ; ADCC : cytotoxicité à médiation cellulaire dépendante des anticorps ; CDC : cytotoxicité dépendant du complément. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




