| Issue |
Med Sci (Paris)
Volume 40, Number 6-7, Juin-Juillet 2024
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 576 - 577 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024074 | |
| Published online | 08 July 2024 | |
Expression du récepteur PD-1 par les cellules NK en contact avec les cellules tumorales : de l’origine à la fonction
PD-1 receptor expression by NK cells after contact with tumor cells: from origin to function
1
Master Biologie Moléculaire et Cellulaire (BMC), Parcours Immunologie, M2 Immunologie Intégrative et Systémique (I2S), Sorbonne Université, Paris, France
2
Master Biologie Moléculaire et Cellulaire (BMC), Parcours Immunologie, M2 Immunologie Translationnelle et Biothérapies (ITB), Sorbonne UNiversité, Paris, France
3
Sorbonne Université, Inserm U1135, CNRS ERL8285, Centre d’immunologie et des maladies infectieuses (CIMI-Paris), Hôpital Pitié-Salpêtrière, Paris, France
a merabet9anis@gmail.com
b flo.westrelin123@gmail.com
c vincent.vieillard@sorbonne-universite.fr
L’activité anti-tumorale des cellules NK est modulée par la molécule PD-1
Les cellules NK (natural killer) sont des lymphocytes appartenant au système immunitaire inné. Elles sont de véritables sentinelles dans l’immunosurveillance contre les virus et les processus tumoraux. Bien que décrites comme des « tueuses en série » [1] (→) leurs fonctions immuno-régulatrices et cytotoxiques sont très finement régulées par une multitude de récepteurs. Parmi ces récepteurs, la molécule PD-1 (programmed death-1), qui fait partie des points de contrôle immunitaire, induit une signalisation inhibitrice suite à l’interaction avec son ligand, PD-L1 (programmed death-ligant 1) [2] (→).
(→) Voir la Nouvelle de M. Ménager et S. de Saint Basile, m/s n° 5, mai 2007, page 473
(→) Voir la Synthèse de P.L. Bernard et al., m/s hors série n° 1, octobre 2020, page 50
Récemment, Ardolino et al. ont démontré que la surexpression de PD-1 à la surface des cellules NK au sein du microenvironnement tumoral est associée à un mécanisme de trogocytose [3], un mécanisme particulier de transfert de fragments de membranes.
La trogocytose à l’origine de l’expression membranaire du récepteur PD-1 par les cellules NK en contact avec des cellules tumorales
La trogocytose (du grec trogo, ronger) est un processus intercellulaire actif de transfert de fragments de membranes, et de toutes les protéines qu’elles contiennent, d’une cellule à une autre. Grâce à la trogocytose, une cellule peut ainsi acquérir et exprimer temporairement à sa surface des protéines qui ont été synthétisées par d’autres cellules [4]. Ce mécanisme peut être à l’origine de la trogoptose, un phénomène de mort cellulaire induit par la rupture de la membrane cytoplasmique qui peut participer à la défense anti-tumorale [4].
La trogocytose est un mécanisme conservé à travers l’évolution et décrit pour la plupart des cellules hématopoïétiques qui contribuent à la modulation des réponses immunitaires. Dans certains cas, la trogocytose permet une modulation des fonctions des cellules NK. Grâce à ce mécanisme, les cellules NK peuvent en effet acquérir le récepteur CCR7 (C-C motif chemokine receptor 7), ce qui leur permet de rejoindre les ganglions lymphatiques par chimiotactisme en suivant un gradient de CCL (C-C motif chemokine ligand) 19 et CCL21 [5]. Néanmoins, il a également été montré que le transfert de la tétraspanine CD9 par des cellules tumorales provenant d’un cancer ovarien à des cellules NK entraîne leur inhibition fonctionnelle [6].
La trogocytose peut donc être une arme à double tranchant, en modulant positivement la réponse immunitaire, ou en constituant un processus d’échappement tumoral par l’acquisition de molécules inhibitrices présentes dans le microenvironnement tumoral [7].
L’étude de Ardolino et al., qui utilise un modèle de co-culture de splénocytes isolés de souris avec des cellules tumorales de différentes origines (RMA et C1498) exprimant fortement PD-1, démontre que l’expression du récepteur PD-1 par les cellules NK infiltrant la tumeur est associée à un mécanisme de trogocytose [3]. En effet, l’expression de PD-1 à la surface des cellules NK est inhibée dans des conditions expérimentales de blocage des interactions directes entre les splénocytes et les cellules tumorales, ou de blocage de la trogocytose par des inhibiteurs de la synthèse d’ATP (actinomycine) ou de la polymérisation d’actine (latrunculine). Ces résultats montrent donc un phénomène de transfert actif de PD-1 des cellules tumorales vers les cellules NK qui nécessite un contact direct entre les deux types cellulaires. Les auteurs ont également mis en évidence un transfert de lipides de la membrane cytoplasmique des cellules tumorales vers la membrane des cellules NK, confirmant l’existence de ce mécanisme de trogocytose à l’origine du transfert de PD-1 aux cellules NK (Figure 1) [3].
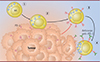 |
Figure 1. Trogocytose du recepteur PD-1 par les cellules NK en contact avec des cellules tumorales. (1) Les cellules NK activées, matures et fonctionnelles, présentes dans le microenvironnement tumoral, sont attirées vers la tumeur. (2) En contact avec les cellules tumorales, les cellules NK s’engagent dans un processus de trogocytose à la suite duquel elles acquièrent des fragments de membrane chargés de protéines de la tumeur. (3) Les cellules NK expriment alors le récepteur PD-1 trogocytosé. Leur activité anti-tumorale se retrouve ainsi inhibée. (4) Le traitement par des anticorps anti-PD-1 permet de bloquer l’action inhibitrice du récepteur PD-1 et ainsi de restaurer partiellement l’activité antitumorale des cellules NK. NK : natural killer ; PD-1 : programmed death-1. |
Les récepteurs SLAM induisent la trogocytose de PD-1 sur les cellules NK en présence des cellules tumorales
Les récepteurs SLAM (signaling lymphocytic activation molecule) sont une famille de médiateurs importants dans les interactions cellulaires : ils ont pour principale fonction de favoriser l’adhérence cellulaire [8]. Ardolino et al ont donc émis l’hypothèse que les récepteurs SLAM pourraient favoriser la trogocytose de PD-1. Pour vérifier cette hypothèse, ils ont utilisé des splénocytes de souris présentant une délétion complète du locus SLAM. Ils ont alors pu observer que l’absence de SLAM inhibe complètement la trogocytose du récepteur PD-1 par les cellules NK. Par contre, le blocage d’autres molécules d’adhérence, comme LFA-1 (lymphocyte function associated antigen-1), n’avait aucun effet sur l’expression de PD-1, suggérant que les récepteurs SLAM jouent un rôle spécifique dans la trogocytose induite par les cellules NK [3].
Le récepteur PD-1 est efficacement trogocytosé par les cellules NK activées in vivo
Afin d’étudier la trogocytose de PD-1 in vivo, les auteurs ont utilisé un modèle de souris déficientes en PD-1, greffées avec des cellules tumorales exprimant fortement le récepteur PD-1. Ils ont ainsi montré que les cellules NK peuvent également acquérir PD-1 in vivo. Il est par ailleurs intéressant de noter que l’expression de PD-1 est plus forte sur les cellules NK activées CD11b+CD27+ exprimant CD69 et Sca-1 [3]. Cela suggère que les cellules NK les plus susceptibles de participer à la trogocytose sont les cellules les plus activées, matures et fonctionnelles [3].
PD-1 acquis par trogocytose est fonctionnel et supprime l’activité anti-tumorale des cellules NK
Les auteurs se sont également interrogés sur l’effet de PD-1 trogocytosé par les cellules NK sur la prolifération tumorale. Ils ont injecté a des souris déficientes pour le gène PD-1, des cellules tumorales RMA-S (bien connues pour être des cibles sensibles aux cellules NK), exprimant ou non le récepteur PD-1. Les résultats ont montré que l’expression du récepteur PD-1 par les cellules tumorales favorise une croissance tumorale plus agressive. Ces données ont été confirmées en utilisant des d’anticorps anti-PD-1 qui ont permis de restaurer partiellement l’activité anti-tumorale des cellules NK. Toutefois, après déplétion des cellules NK, les anticorps anti-PD-1 n’avaient plus d’effet sur la prolifération tumorale. L’ensemble de ces données suggèrent que, in vivo, l’effet immunosuppresseur de PD-1 repose en partie sur sa trogocytose sur les cellules NK (Figure 1) [3].
Conclusion
Le microenvironnement tumoral est régi par des relations complexes entre les cellules qui le composent. Bien que l’origine du récepteur PD-1 à la membrane des cellules NK reste discutée, le mécanisme de trogocytose proposé par Ardolino et al. permet d’expliquer la surexpression de PD-1 à la surface des cellules NK en présence des cellules tumorales. En inhibant l’activité anti-tumorale des cellules NK, la trogocytose constitue ainsi un nouveau mécanisme d’échappement tumoral [3].
Ces avancées ont permis d’étendre notre compréhension sur la trogocytose et du rôle du récepteur PD-1 dans le contrôle anti-tumoral par les cellules NK. Néanmoins, des investigations complémentaires sont nécessaires afin de mieux appréhender son mécanisme d’action.
La trogocytose émerge donc comme un processus biologique complexe et polyvalent avec des implications significatives dans la dynamique tumorale. La compréhension des signaux moléculaires et des interactions spécifiques qui induisent la trogocytose pourrait ouvrir la voie au développement de thérapies ciblées visant à endiguer ce processus intercellulaire.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Ménager M, de Saint Basile S. Une étape de maturation terminale des granules cytotoxiques est nécessaire à l’excrétion de leur contenu lytique. Med Sci (Paris) 2007 ; 23 : 473–474. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Bernard PL, Laletin V, Pastor S, et al. Une piste en immunothérapie du cancer - Cibler la signalisation des cellules NK. Med Sci (Paris) 2020 (hs1); 36 : 50–5. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Hasim MS, Marotel M, Hodgins JJ, et al. When killers become thieves: Trogocytosed PD-1 inhibits NK cells in cancer. Sci Adv 2022; 8 : eabj3286. [CrossRef] [PubMed] [Google Scholar]
- Miyake K, Karasuyama H. The Role of Trogocytosis in the Modulation of Immune Cell Functions. Cells 2021; 10 : 1255. [CrossRef] [PubMed] [Google Scholar]
- Reed J, Reichelt M, Wetzel SA. Lymphocytes and Trogocytosis-Mediated Signaling. Cells 2021; 10 : 1478. [CrossRef] [PubMed] [Google Scholar]
- Gonzalez VD, Huang Y-W, Delgado-Gonzalez A, et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep 2021; 36 : 109632. [CrossRef] [PubMed] [Google Scholar]
- Mattei F, Andreone S, Spadaro F, et al. Trogocytosis in innate immunity to cancer is an intimate relationship with unexpected outcomes. iScience 2022; 25 : 105110. [CrossRef] [PubMed] [Google Scholar]
- Claus M, Urlaub D, Fasbender F, et al. SLAM family receptors in natural killer cells – Mediators of adhesion, activation and inhibition via cis and trans interactions. Clin Immunol 2019 ; 204 : 37–42. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Trogocytose du recepteur PD-1 par les cellules NK en contact avec des cellules tumorales. (1) Les cellules NK activées, matures et fonctionnelles, présentes dans le microenvironnement tumoral, sont attirées vers la tumeur. (2) En contact avec les cellules tumorales, les cellules NK s’engagent dans un processus de trogocytose à la suite duquel elles acquièrent des fragments de membrane chargés de protéines de la tumeur. (3) Les cellules NK expriment alors le récepteur PD-1 trogocytosé. Leur activité anti-tumorale se retrouve ainsi inhibée. (4) Le traitement par des anticorps anti-PD-1 permet de bloquer l’action inhibitrice du récepteur PD-1 et ainsi de restaurer partiellement l’activité antitumorale des cellules NK. NK : natural killer ; PD-1 : programmed death-1. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




