| Issue |
Med Sci (Paris)
Volume 40, Number 5, Mai 2024
|
|
|---|---|---|
| Page(s) | 437 - 444 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024054 | |
| Published online | 31 May 2024 | |
Les circuits synthétiques de gènes fonctionnant en boucle fermée
Concept et dernières avancées
Closed-loop synthetic gene circuits for cell-based therapies
1
École normale supérieure de Lyon, Université Claude Bernard Lyon 1, Université de Lyon, Lyon, France
2
Université de Lyon, VetAgro Sup, Marcy-l’Étoile, France
Les progrès récents de la biologie synthétique ont ouvert la voie à de nouvelles thérapies fondées sur des cellules rendues aptes à produire de manière autonome des substrats afin de traiter des maladies chroniques. Ces cellules modifiées intègrent un ensemble de gènes fonctionnant en circuit synthétique à boucle fermée, qui permettent de délivrer un effecteur thérapeutique en réponse à un signal pathologique déterminé. Bien que prometteuses chez la souris, ces thérapies font face à des obstacles cliniques liés à leur sûreté et à leur implémentation in vivo. Les dernières générations de circuits synthétiques cherchent à résoudre ces problèmes grâce à des stratégies de bioingénierie avancées, que nous présentons dans cet article.
Abstract
Recent advances in synthetic biology have paved the way for new cellular therapies, using cells capable of autonomously treating chronic diseases. These cells integrate a set of genes functioning in a closed-loop synthetic circuit, delivering a therapeutic effector in response to a specific pathological signal. While promising in mice, these therapies face clinical challenges related to safety and feasibility of in vivo implementation. The latest generations of synthetic circuits aim to address these issues through advanced bioengineering strategies outlined in this article.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette (© Clélia Giraudot).
La place des circuits synthétiques de gènes dans les nouvelles thérapies cellulaires
Récemment, les avancées dans les domaines de la biologie synthétique et des thérapies cellulaires ont révolutionné le traitement de certains cancers, et ces domaines continuent de faire l’objet de recherches intensives. Les thérapies cellulaires consistent à greffer, injecter ou implanter des cellules vivantes afin de soigner des maladies, que ce soit pour régénérer des tissus endommagés ou pour combattre des cancers [1]. Ces cellules, bien caractérisées, sont compétentes pour restaurer une fonction déficiente chez le patient. Il peut s’agir de cellules génétiquement modifiées comme les cellules CAR-T1 (chimeric antigen receptor T) qui ciblent les cellules tumorales et les éliminent [2,4] (→).
(→) Voir la Synthèse de V. Catros, m/s n° 4, avril 2019, page 316
Les thérapies cellulaires ont des champs d’application très variés, tels que la médecine régénérative, la greffe de moelle osseuse ou l’immunothérapie.
Appartenant aux nouvelles thérapies cellulaires, les circuits synthétiques de gènes correspondent à un ensemble de gènes rassemblés de manière artificielle dans une cellule [5,6] (→).
(→) Voir la Nouvelle de M. Morel, m/s n° 6-7, juin-juillet 2017, page 591
Ces circuits synthétiques utilisent les outils développés par la biologie synthétique, un domaine de recherche interdisciplinaire qui combine des principes de biologie, d’ingénierie, de génétique et d’informatique dans le but de concevoir et construire de nouveaux systèmes biologiques artificiels ou de reprogrammer des systèmes biologiques existants. Les circuits synthétiques de gènes correspondent à l’implémentation de circuits logiques dans une cellule, à l’image des circuits électroniques [5,6]. Ces systèmes sont capables de traiter les informations provenant de l’environnement, le résultat de ce traitement déclenchant une action cellulaire (modification d’un métabolisme, modification de l’énergétique cellulaire, production de nouvelle molécule, sécrétion, etc.) [5,7].
Des cellules ont ainsi été modifiées génétiquement, par exemple pour pouvoir détecter et répondre à un signal sans fil provenant d’un smartphone (une lumière émise dans le rouge lointain [far-red light]) ou à des courants électriques transmis à l’aide d’aiguilles d’acupuncture aux cultures de cellules [8,9]. Récemment, l’équipe de Martin Fussenegger (École polytechnique fédérale de Zurich, Bâle, Suisse) a créé un système de cellules humaines modifiées pour former une pile à combustible métabolique alimentée par le glucose sanguin, et apte à alimenter un petit dispositif électronique [10]. Ces circuits synthétiques de gènes ne sont pas à finalité thérapeutique. Ils peuvent néanmoins être utilisés pour certaines applications comme, par exemple, le système de pile à combustible métabolique qui pourrait alimenter un pacemaker grâce au glucose sanguin et donc permettre de s’affranchir des systèmes actuels de batterie.
Lorsque ces systèmes sont développés dans un but thérapeutique, ils entrent dans le cadre des thérapies cellulaires de nouvelle génération que l’on nomme thérapie fondée sur la cellule (ou en anglais, cell-based therapy) [11]. De nombreuses preuves de concept de circuits synthétiques de gènes développés dans un but thérapeutique ont été obtenues ces dernières années. Par exemple, des cellules ont été programmées pour détecter et tuer les bactéries Staphylococcus aureus (staphylocoques doré) résistantes à la méticilline, ou pour détecter le niveau de glucose sanguin et sécréter en conséquence de l’insuline pour le traitement du diabète sucré [12,13]. Très prometteuses, l’immense majorité de ces nouvelles thérapies cellulaires restent néanmoins à l’état expérimental.
Le principe de la boucle fermée
Les circuits à boucle fermée représentent une catégorie particulière de circuits synthétiques de gènes. Un circuit fonctionnant sur le principe de la boucle fermée est un système dans lequel la sortie du circuit est continuellement contrôlée et renvoyée au système pour en réguler le comportement, créant ainsi une boucle d’autorégulation [14,15]. Le but du circuit de gènes sera alors de réguler étroitement un paramètre biologique afin de soigner une maladie.
Pour former le circuit en boucle fermée, trois éléments essentiels sont nécessaires (Figure 1) : un senseur capable de détecter le marqueur biologique à évaluer ; une voie de traitement du signal capable de traiter l’ensemble des signaux reçus et de déclencher une réponse appropriée ; et un effecteur apte à moduler le marqueur biologique choisi. Les « cellules régulatrices » (en anglais, designer cells) sont le support biologique du circuit synthétique de gènes fonctionnant à boucle fermée. Ces cellules sont modifiées génétiquement pour comporter les éléments du circuit (le senseur, la voie de traitement du signal, et l’effecteur), puis greffées au patient [14]. Leur rôle est de scruter l’environnement en permanence afin d’évaluer son état, et de produire une réponse adaptée en cas d’altération.
 |
Figure 1. Le concept de circuit thérapeutique fonctionnant sur le principe de la boucle fermée. Lors d’une perturbation de l’homéostasie chez un patient atteint d’une maladie chronique, le système en boucle fermée détecte la perturbation via des biomarqueurs spécifiques et rétablit l’homéostasie de manière autonome. Il est composé (1) d’un senseur, qui détecte les marqueurs de la maladie exprimés par le patient, (2) d’une voie de traitement du signal, qui intègre les signaux pour fournir une réponse adaptée, et (3) d’un effecteur, qui rétablit l’homéostasie et guérit la crise. Le circuit thérapeutique en boucle fermée est inséré dans la cellule régulatrice. |
Une boucle fermée présente l’avantage majeur d’éviter au système de se trouver dans des états extrêmes, contrairement à la boucle ouverte. Un circuit en boucle fermée possède en effet un système d’auto-régulation, tel que décrit par Norbert Wiener en 1948 dans son ouvrage fondateur sur la théorie de la cybernétique [15]. Ce système d’auto-régulation constitue l’application directe de la théorie de la cybernétique dans la cellule régulatrice, permettant de maintenir artificiellement l’homéostasie du système. L’intérêt d’un tel système peut être facilement illustré dans le cas du diabète de type 1. Le traitement de référence du diabète de type 1 est l’insulinothérapie, impliquant plusieurs mesures de la glycémie au cours de la journée ainsi que des injections sous-cutanées d’insuline en réponse, constituant un système ouvert. Or, en cas d’erreurs d’administration, ce traitement peut déclencher un état d’hyper- ou d’hypoglycémie chez le patient. Contrairement à ce système ouvert, un système à boucle fermée fonctionnera de manière autonome : il mesure la glycémie en permanence et ajuste la dose d’insuline en fonction de la concentration de glucose. Ce système à boucle fermée peut être hybride et utiliser une pompe à insuline et un capteur électronique, ou il peut être sous la forme d’un circuit synthétique de gènes implémenté dans une cellule [13,16]. En surveillant la glycémie de façon aussi précise et continue, le système à boucle fermée se montre donc plus efficace pour éviter les situations d’hyper- ou d’hypoglycémie [17].
Chez la souris, plusieurs circuits synthétiques de gènes fonctionnant sur le principe de la boucle fermée ont montré leur capacité à détecter et à moduler divers biomarqueurs dans la circulation sanguine, notamment les hormones thyroïdiennes, l’acide urique ou l’insuline [18-21].
Les dernières avancées dans le domaine des circuits synthétiques à boucle fermée
La conception des premiers circuits en boucle fermée reposait sur l’utilisation de récepteurs physiologiques et de voies de transcription préexistantes dans les cellules. Néanmoins, l’activation accidentelle d’autres cibles naturelles de la voie initialement visée, pouvait être responsable d’effets indésirables. La capacité à déclencher uniquement la réponse appropriée est appelée « l’orthogonalité ». En d’autres termes, un signal spécifique engendrera une réponse distincte et non influencée par d’autres signaux présents dans le système, isolant et contrôlant de manière indépendante différentes composantes d’un système complexe. Les travaux les plus récents se portent ainsi sur la recherche de l’orthogonalité dans le circuit et sur l’optimisation des circuits pour prévenir les réponses inappropriées.
Les systèmes d’auto-destruction
Si l’implantation de cellules régulatrices est à l’origine d’effets indésirables, mettre fin à la réponse des cellules n’est pas réalisable aisément. Des gènes suicides, également appelés kill switches ou systèmes d’auto-destruction programmés, ont donc été conçus pour tuer les cellules régulatrices, ou pour désactiver l’expression du transgène en situation de crise. Par exemple, le lénalidomide, un médicament approuvé par la FDA (Food Drug Administration) pour traiter le myélome multiple, a été exploité comme système d’auto-destruction dans les cellules CAR-T [22]. Le lénalidomide recrute une ubiquitine ligase qui poly-ubiquitine le CAR, favorisant ainsi sa dégradation. D’autres médicaments approuvés par la FDA ont été transformés en systèmes d’auto-destruction, comme le grazoprevir, un inhibiteur de protéase, ou des antibiotiques, tels que la doxycycline [23-26]. Toutefois, l’usage des antibiotiques dans un contexte non infectieux pourrait favoriser l’émergence de bactéries résistantes aux antibiotiques. D’autres petites molécules proches de médicaments approuvés par la FDA ont également été développées et testées en tant que système d’auto-destruction, comme le 4-hydroxytamoxifène, un métabolite d’un anti-œstrogène, ou des molécules non toxiques, telles que l’acide vanillique ou l’acide abscissique, une hormone végétale [26,27]. Il est également possible de contrôler l’activation des cellules à l’aide de molécules qui joueront alors le rôle de système activateur, ou on-switch. Un système dépendant de l’administration de lénalidomide a été élaboré dans les cellules CAR-T rendant le CAR fonctionnel uniquement en présence de la molécule [22]. Le lénalidomide induit en effet la dimérisation des deux protéines membranaires portant, chacune, le domaine d’activation et le domaine de détection du CAR.
Employer des systèmes d’auto-destruction est donc envisagé afin d’accroître la sécurité du système. Cependant, l’idéal serait de disposer de systèmes qui ne génèrent pas d’effets secondaires. Pour cela, les senseurs pourraient être améliorés afin de mieux contrôler les conditions pour lesquelles le système sera activé.
L’ingénierie de senseurs et d’effecteurs complexes
L’ingénierie avancée des senseurs et des effecteurs permet d’obtenir des caractéristiques sur mesure, et ainsi de limiter la détection de signaux indésirables. Différents domaines protéiques clés, chacun doté de capacités particulières, sont assemblés de manière rationnelle pour former une protéine chimérique. Les protéines résultantes sont donc complètement synthétiques et capables de remplir de nouvelles fonctions, telles que la détection d’un signal physique. Par exemple, une protéine « thermomètre » a été conçue pour détecter la température corporelle [28]. Un criblage des protéines endogènes réagissant à la température avait révélé que ces protéines naturelles n’étaient activées qu’à de hautes températures [28]. Une protéine présentant un domaine en hélice homodimérisé à la température de 37 °C et qui se monomérise lorsque la température atteint 40 °C a donc été conçue. Le domaine d’activation de cette protéine n’est exposé que lorsque celle-ci est sous la forme de monomère, c’est-à-dire à la température de 40 °C ; elle peut alors se lier à un promoteur synthétique orthogonal, qui ne répondra qu’à cette protéine. Ce commutateur de gène synthétique, appelé HEAT, peut ainsi faire la distinction entre une gamme de températures physiologiques et une gamme de températures pathologiques.
Grâce à l’ingénierie protéique [29] (→), divers senseurs ont été élaborés pour répondre à des caractéristiques particulières, comme un senseur de biomarqueurs cardiaques, pour traiter et prévenir l’infarctus du myocarde [30], ou un récepteur CAR universel fonctionnant avec un adaptateur, afin de reconnaître la plupart des cellules cancéreuses [31].
(→) Voir Le mot de la science d’Anna Salvetti, m/s n° 3, mars 2024, page 287
La complexification du traitement du signal grâce aux portes logiques
Une maladie ne peut pas toujours être définie par un unique marqueur spécifique. Il est donc important de pouvoir intégrer plusieurs signaux pour discriminer les différentes situations. La prise en compte de plusieurs signaux est la garantie que l’activation des circuits thérapeutiques sera spécifique de la maladie. Différents circuits thérapeutiques en boucle fermée ont été conçus pour intégrer plusieurs marqueurs d’une maladie avec des portes logiques booléennes2. Il existe de nombreuses solutions pour mettre en œuvre une porte logique booléenne dans une cellule. Par exemple, le psoriasis est une maladie auto-immune dans laquelle deux cytokines pro-inflammatoires sont principalement exprimées : le facteur de nécrose tumorale (TNF-α) et l’interleukine 22 (IL-22). Si la cellule ne comporte qu’un seul senseur, le circuit thérapeutique pourrait être activé par un virus ou une bactérie qui serait à l’origine de la production de l’une ou l’autre cytokine inflammatoire, mais pas des deux. Des cellules régulatrices ont montré leur efficacité, chez la souris, pour traiter spécifiquement le psoriasis grâce à l’utilisation de deux senseurs distincts associés par une logique de porte « ET » [32]. Dans ce cas, l’activation du premier senseur par un signal permet la traduction du second senseur à l’origine de la réponse, de sorte que les deux récepteurs doivent être activés séquentiellement pour produire l’effecteur thérapeutique. En 2023, Bertschi et al. ont publié un système expérimental plus complexe dans lequel jusqu’à cinq signaux pouvaient être combinés grâce à des portes logiques « ET » et « OU » [27]. L’un des inconvénients majeurs des portes logiques multiples est la réduction du signal de sortie par rapport au bruit de fond, un phénomène observé lors de la multiplication des portes [27]. Enfin, afin de spatialiser le traitement du signal, différentes cellules peuvent collaborer grâce à des portes logiques, chacune traitant une partie des signaux d’entrée [31]. L’amélioration du traitement du signal au sein des cellules régulatrices est un domaine de recherche en évolution constante.
Les facteurs de transcription synthétiques
La plupart des circuits thérapeutiques en boucle fermée utilisent des facteurs de transcription pour intégrer le signal. Les portes logiques booléennes ne font pas exception puisqu’elles associent plusieurs domaines de signalisation connus pour activer des voies de signalisation spécifiques. Comme nous l’avons mentionné, l’induction de cascades de signalisation impliquant des voies préexistantes dans la cellule soulève la question de la transcription de gènes indésirables. Donahue et al. ont développé une bibliothèque de facteurs de transcription et de promoteurs synthétiques [33] qui comprend 44 facteurs de transcription activateurs, 12 facteurs de transcription inhibiteurs et 83 promoteurs, ce qui permet de concevoir rationnellement des voies de traitement du signal synthétiques et orthogonales [33]. Ces auteurs ont démontré que tous les éléments pouvaient fonctionner ensemble in vitro avec des promoteurs appropriés, pour créer des portes logiques complexes [33]. Une autre bibliothèque pertinente pour la régulation synthétique de la transcription a été testée récemment dans les cellules CAR-T, et utilisée avec succès chez la souris [26]. L’inconvénient de ces facteurs de transcription reste le délai induit par les différentes étapes entre la détection du signal et la sécrétion de l’effecteur par la cellule régulatrice.
Optimisation de la responsivité3 cellulaire grâce aux cascades de signalisation protéique
Afin de réduire le délai de réponse du circuit et d’éviter une activation transcriptionnelle inappropriée de gènes, une dernière approche consiste à utiliser un système de traitement du signal qui contourne l’étape transcriptionnelle. Le traitement du signal peut alors être réalisé par un circuit synthétique entièrement protéique. Gao et al. ont publié un circuit protéique dans lequel la transmission du signal est fondée sur des clivages successifs de protéases induisant, finalement, la mort cellulaire par l’activation de la caspase-3 [34]. Comme ce système ne nécessite pas d’étape de transcription ni de traduction, le traitement du signal est beaucoup plus rapide tout en restant modulable et orthogonal [34].
Différents modèles4 ont été développés pour traiter les signaux d’entrée en utilisant des portes logiques booléennes, des filtres passe-bande (réponse seulement sur une plage de concentrations donnée), ou pour répondre de manière pulsatile (réponse rapide et brève du système à un changement de concentration) [34]. Un avantage majeur de ce type de circuit est sa compacité : tous les composants du circuit peuvent en effet être codés par un seul transcrit d’ADN de moins de six kilobases, sans qu’il soit nécessaire que la séquence d’ADN soit insérée dans le génome de la cellule [34]. Ce type de stratégie a été utilisé chez la souris pour le traitement du diabète, en permettant la sécrétion rapide d’insuline, en moins de 25 minutes, en réponse à une augmentation de la glycémie [36].
Toutes les améliorations des circuits synthétiques en boucle fermée publiées jusqu’à présent ont visé à améliorer la vitesse, la réversibilité et l’orthogonalité des voies de traitement du signal, tout en évitant les fuites. Ces améliorations sont présentées dans la Figure 2.
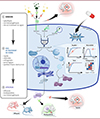 |
Figure 2. Principales caractéristiques idéales d’un circuit synthétique de gènes à but thérapeutique. Chaque élément d’un circuit synthétique de gènes à but thérapeutique peut être amélioré pour trouver le meilleur compromis entre plusieurs critères idéaux. (1) Les senseurs sont idéalement spécifiques, non immunogènes chez la souris et l’homme, et liés à (2) une voie de traitement du signal, qui peut être régulée au niveau transcriptionnel ou protéique (par une cascade de protéases). La voie de traitement du signal est idéalement très réactive, réversible et orthogonale, et peut utiliser des portes logiques et un système d’auto-destruction pour améliorer la sécurité du circuit. (3) Les effecteurs doivent être efficaces, disponibles au bon endroit, et non toxiques pour l’organisme. |
Les enjeux
La preuve de concept de circuits thérapeutiques synthétiques efficaces en boucle fermée est désormais établie, mais de nombreux travaux de recherche sont encore nécessaires afin qu’ils puissent être administrés en clinique à un grand nombre de patients. La survie in vivo des cellules régulatrices, en particulier, reste l’un des verrous technologiques majeurs de cette thérapie cellulaire.
Il existe deux stratégies principales pour mettre en œuvre in vivo une thérapie fondée sur des cellules régulatrices. La première consiste en une greffe de cellules autologues isolées du patient et modifiées [1] : il peut s’agir de cellules différenciées provenant de tissus [37], de cellules immunitaires, comme les lymphocytes T et B, les cellules NK (natural killer), les macrophages [31,38,39], ou de cellules souches pluripotentes induites (iPS) [28]. Une greffe autologue permet de bénéficier de la tolérance du système immunitaire du receveur. Cependant, il n’est pas toujours possible d’utiliser ces cellules autologues. Une autre stratégie consiste donc à utiliser, en particulier chez la souris, des lignées cellulaires pour obtenir une preuve de concept du fonctionnement d’un circuit. Les lignées cellulaires, « immortelles », présentent l’avantage de pouvoir être produites en grande quantité, sans dépendre d’un donneur. Cependant la limite de cette stratégie est que le fonctionnement d’un circuit dépendra de la lignée cellulaire utilisée, en particulier si l’orthogonalité n’est pas parfaite. Ainsi, la lignée cellulaire humaine HEK293T (human embryonic kidney 293T) a été utilisée chez la souris pour démontrer le concept des circuits thérapeutiques en boucle fermée [12,40]. Cependant, cette lignée étant très répandue, la dérive cellulaire entre laboratoires engendre des problèmes de reproductibilité. De plus, comme pour les autres greffes hétérologues, un défi majeur reste la lutte contre le rejet du greffon (les cellules HEK293T) par l’hôte (la souris). Pour protéger les cellules régulatrices qui constituent le greffon, celui-ci est le plus souvent encapsulé, afin de le dissimuler au système immunitaire de l’hôte receveur tout en permettant la circulation des petites molécules, en particulier les molécules thérapeutiques. Deux systèmes d’encapsulation ont été développés : la micro-encapsulation des cellules avec un polymère d’alginate [41], ou un implant millimétrique contenant les cellules [42]. La micro-encapsulation est largement utilisée en recherche translationnelle, et les dernières générations de microcapsules présentent différents revêtements sophistiqués diminuant leur immunogénicité. Le système d’implant, qui a été récemment publié, présente l’avantage de pouvoir être retiré facilement. La Figure 3 présente les avantages et les inconvénients de ces deux systèmes.
 |
Figure 3. Comparaison de deux méthodes d’encapsulation de cellules hétérologues pour les thérapies in vivo. L’encapsulation de cellules régulatrices avec (A) un polymère d’alginate ou (B) un implant millimétrique retirable : deux façons de permettre la survie de cellules hétérologues chez la souris. L’implant millimétrique présente une chambre contenant les cellules. Les cellules peuvent survivre grâce à l’oxygène et aux nutriments apportés par la circulation sanguine périphérique. Les microcapsules peuvent être injectées dans diverses localisations, y compris intrapéritonéale et intrathécale par exemple, alors que l’implant ne peut être transplanté que par voie intrapéritonéale, sous anesthésie. Dans le cadre du traitement de la fibrose, des revêtements spécifiques ont été développés pour les deux techniques avec, respectivement, la chimiokine CXCL2 (C-X-C motif chemokine ligand 2) pour le polymère d’alginate, et le tétrahydropyrane phényl triazole (THPT) pour l’implant, permettant une durée de vie plus longue du dispositif. La taille totale diffère considérablement entre les deux systèmes, ce qui affecte la capacité de chargement : de quelques centaines de cellules pour une microcapsule à des millions pour l’implant récupérable. La taille des pores est plus large pour l’implant mais ajustable. Dans les deux systèmes, les cellules hétérologues ne peuvent pas quitter le dispositif et les cellules immunitaires (lymphocytes T ou cellules Natural Killer) ne peuvent pas y pénétrer, à l’exception des macrophages qui peuvent traverser les pores. Les petites molécules telles que les anticorps, les cytokines, les ions, les médicaments, les antigènes ou les motifs moléculaires associés aux dommages (DAMP) peuvent entrer et sortir librement dans les deux systèmes. |
Pour surmonter l’obstacle de l’immunogénicité du greffon et son rejet par le receveur, la transduction et la perfusion de cellules autologues, comme cela est réalisé pour la thérapie cellulaire CAR-T, est une approche prometteuse [2]. Cependant, comme pour les cellules CAR-T, les cellules primaires de chaque patient nécessitent d’être prélevées puis modifiées ex vivo, ce qui s’avère être un important obstacle à un développement à grande échelle de cette thérapie. Les cellules régulatrices encapsulées peuvent en revanche être développées de façon industrielle, comme les autres médicaments. Bien que de nombreuses études aient utilisé des cellules HEK293T encapsulées dans un implant d’alginate, leur utilisation clinique pour le traitement de patients reste discutable, les essais cliniques utilisant cette approche ayant échoué en phase I [41]. Par ailleurs, les cellules encapsulées pourraient dériver et alors sécréter des modulateurs ayant des effets indésirables sur l’hôte.
La mise en œuvre in vivo de circuits thérapeutiques en boucle fermée se situe donc aujourd’hui à la croisée des chemins, entre greffe de cellules autologues et encapsulation.
Liens d’intérêts
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Les cellules CAR-T sont des lymphocytes T qui ont été génétiquement modifiés pour exprimer le CAR (chimeric antigen receptor), un récepteur chimérique basé sur le récepteur des lymphocytes T, capable de reconnaître un antigène spécifique des cellules tumorales [2]. Après injection dans le sang du patient, la cellule CAR-T rencontre la cellule tumorale, et est alors stimulée par la liaison de son récepteur CAR à cet antigène exprimé par la cellule tumorale, ce qui entraîne en la destruction de la cellule tumorale par la cellule CAR-T [2]. En Europe, le tisagenlecleucel (KymriahTM) et l’axicabtagene ciloleucel (YescartaTM) ont obtenu leur autorisation de mise sur le marché (AMM) en 2018 [3].
Une des premières applications de la biologie synthétique est un modèle d’oscillateur, le repressilator, s’appuyant sur un réseau de gènes [35].
Références
- Guedan S, Ruella M, June CH. Emerging Cellular Therapies for Cancer. Annu Rev Immunol 2019 ; 37 : 145–171. [CrossRef] [PubMed] [Google Scholar]
- Asmamaw Dejenie T, Tiruneh G/Medhin M, Dessie Terefe G, et al. Current updates on generations, approvals, and clinical trials of CAR T-cell therapy. Human Vaccines & Immunotherapeutics 2022; 0 : 2114254. [CrossRef] [PubMed] [Google Scholar]
- Detela G, Lodge A. EU Regulatory Pathways for ATMPs: Standard, Accelerated and Adaptive Pathways to Marketing Authorisation. Molecular Therapy - Methods & Clinical Development 2019 ; 13 : 205–232. [CrossRef] [Google Scholar]
- Catros V.. Les CAR-T cells, des cellules tueuses spécifiques d’antigènes tumoraux - De nouvelles générations pour le traitement des tumeurs solides. Med Sci (Paris) 2019 ; 35 : 316–326. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Xie M, Fussenegger M. Designing cell function: assembly of synthetic gene circuits for cell biology applications. Nat Rev Mol Cell Biol 2018 ; 19 : 507–525. [CrossRef] [PubMed] [Google Scholar]
- Morel M.. Des gènes synthétiques à l’assaut du cancer - Vers des traitements plus efficaces grâce à des programmes génétiques autonomes. Med Sci (Paris) 2017 ; 33 : 591–593. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Chakraborty D, Rengaswamy R, Raman K. Designing Biological Circuits: From Principles to Applications. ACS Synth. Biol. 2022; 11 : 1377–88. [CrossRef] [Google Scholar]
- Yu Y, Yu G, Ye H. Constructing Smartphone-Controlled Optogenetic Switches in Mammalian Cells. Methods Mol Biol 2021; 2312 : 125–39. [CrossRef] [PubMed] [Google Scholar]
- Huang J, Xue S, Buchmann P, et al. An electrogenetic interface to program mammalian gene expression by direct current. Nat Metabol 2023; 5 : 1395–407. [CrossRef] [Google Scholar]
- Maity D, Guha Ray P, Buchmann P, et al. Blood-Glucose-Powered Metabolic Fuel Cell for Self-Sufficient Bioelectronics. Adv Mater 2023; 35 : e2300890. [CrossRef] [PubMed] [Google Scholar]
- Bashor CJ, Hilton IB, Bandukwala H, et al. Engineering the next generation of cell-based therapeutics. Nat Rev Drug Discov 2022; 21 : 655–75. [CrossRef] [PubMed] [Google Scholar]
- Liu Y, Bai P, Woischnig A-Ket al. Immunomimetic Designer Cells Protect Mice from MRSA Infection. Cell 2018 ; 174 : 259–70.e11. [CrossRef] [PubMed] [Google Scholar]
- Xie M, Ye H, Wang Het al. β-cell-mimetic designer cells provide closed-loop glycemic control. Science 2016 ; 354 : 1296–1301. [CrossRef] [PubMed] [Google Scholar]
- Giraudot C. Un exemple de circuit synthétique de gènes reposant sur le principe de la boucle fermée pour réguler une maladie métabolique [Thèse de doctorat vétérinaire]. Lyon : Université Claude Bernard Lyon I. 2023. [Google Scholar]
- Wiener N. Cybernetics or Control and Communication in the Animal and the Machine. The MIT Press, 1948 : 194 p. [Google Scholar]
- Leelarathna L, Choudhary P, Wilmot EG, et al. Hybrid closed-loop therapy: Where are we in 2021? Diabetes Obes Metab 2021; 23 : 655–60. [CrossRef] [PubMed] [Google Scholar]
- Bekiari E, Kitsios K, Thabit Het al. Artificial pancreas treatment for outpatients with type 1 diabetes: systematic review and meta-analysis. BMJ 2018 ; 361 : k1310. [CrossRef] [PubMed] [Google Scholar]
- Kemmer C, Gitzinger M, Daoud-El Baba Met al. Self-sufficient control of urate homeostasis in mice by a synthetic circuit. Nat Biotechnol 2010 ; 28 : 355–360. [CrossRef] [PubMed] [Google Scholar]
- Rössger K, Charpin-El-Hamri G, Fussenegger M. A closed-loop synthetic gene circuit for the treatment of diet-induced obesity in mice. Nat Commun 2013 ; 4 : 2825. [CrossRef] [PubMed] [Google Scholar]
- Saxena P, Charpin-El Hamri G, Folcher Met al. Synthetic gene network restoring endogenous pituitary-thyroid feedback control in experimental Graves’ disease. Proc Natl Acad Sci U S A 2016 ; 113 : 1244–1249. [CrossRef] [PubMed] [Google Scholar]
- Stefanov B-A, Fussenegger M. Biomarker-driven feedback control of synthetic biology systems for next-generation personalized medicine. Front Bioeng Biotechnol 2022; 10 : 986210. [CrossRef] [PubMed] [Google Scholar]
- Jan M, Scarfò I, Larson RC, et al. Reversible ON- and OFF-switch chimeric antigen receptors controlled by lenalidomide. Sci Transl Med 2021; 13 : eabb6295. [CrossRef] [PubMed] [Google Scholar]
- Xue S, Yin J, Shao J, et al. A Synthetic-Biology-Inspired Therapeutic Strategy for Targeting and Treating Hepatogenous Diabetes. Mol Ther 2017 ; 25 : 443–455. [CrossRef] [PubMed] [Google Scholar]
- Ye H, Xie M, Xue S, et al. Self-adjusting synthetic gene circuit for correcting insulin resistance. Nat Biomed Eng 2017 ; 1 : 0005. [Google Scholar]
- Labanieh L, Majzner RG, Klysz D, et al. Enhanced safety and efficacy of protease-regulated CAR-T cell receptors. Cell 2022; 185 : 1745–63.e22. [CrossRef] [PubMed] [Google Scholar]
- Li H-S, Israni DV, Gagnon KA, et al. Multidimensional control of therapeutic human cell function with synthetic gene circuits. Science 2022; 378 : 1227–34. [CrossRef] [PubMed] [Google Scholar]
- Bertschi A, Wang P, Galvan S, et al. Combinatorial protein dimerization enables precise multi-input synthetic computations. Nat Chem Biol 2023; 19 : 767–77. [CrossRef] [PubMed] [Google Scholar]
- Stefanov B-A, Teixeira AP, Mansouri M, et al. Genetically Encoded Protein Thermometer Enables Precise Electrothermal Control of Transgene Expression. Adv Sci (Weinh) 2021; 8 : e2101813. [CrossRef] [PubMed] [Google Scholar]
- Haiech J, Ranjeva R, Kilhoffer MC. Biologie des systèmes et ingénierie biologique modifient la découverte et le développement des médicaments. Med Sci (Paris) 2012 ; 28 : 207–212. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Stefanov B-A. Synthetic biology circuits: temperature and myocardial infarction sensors for precision therapeutics [Doctoral Thesis]. ETH Zurich. 2022. [Google Scholar]
- Cho JH, Okuma A, Sofjan K, et al. Engineering advanced logic and distributed computing in human CAR immune cells. Nat Commun 2021; 12 : 792. [CrossRef] [PubMed] [Google Scholar]
- Schukur L, Geering B, Charpin-El Hamri G, et al. Implantable synthetic cytokine converter cells with AND-gate logic treat experimental psoriasis. Sci Transl Med 2015; 7 : 318ra201. [CrossRef] [PubMed] [Google Scholar]
- Donahue PS, Draut JW, Muldoon JJ, et al. The COMET toolkit for composing customizable genetic programs in mammalian cells. Nat Commun 2020; 11 : 779. [CrossRef] [PubMed] [Google Scholar]
- Gao XJ, Chong LS, Kim MS, et al. Programmable protein circuits in living cells. Science 2018 ; 361 : 1252–1258. [CrossRef] [PubMed] [Google Scholar]
- Elowitz MB, Leibler S. A synthetic oscillatory network of transcriptional regulators. Nature 2000 ; 403 : 335–338. [CrossRef] [PubMed] [Google Scholar]
- Mahameed M, Xue S, Stefanov B-A, et al. Engineering a Rapid Insulin Release System Controlled By Oral Drug Administration. Adv Sci (Weinh) 2022; 9 : e2105619. [CrossRef] [PubMed] [Google Scholar]
- Nims RJ, Pferdehirt L, Ho NB, et al. A synthetic mechanogenetic gene circuit for autonomous drug delivery in engineered tissues. Sci Adv 2021; 7 : eabd9858. [CrossRef] [PubMed] [Google Scholar]
- Li H-S, Wong NM, Tague E, et al. High-performance multiplex drug-gated CAR circuits. Cancer Cell 2022; S1535–6108(22)00372–5. [PubMed] [Google Scholar]
- Page A, Delles M, Nègre D, et al. Engineering B cells with customized therapeutic responses using a synthetic circuit. Molecular Therapy - Nucleic Acids 2023; 33 : 1–14. [CrossRef] [Google Scholar]
- Hell D.. Self-Adjusting Cytokine Neutralizer Cells as a Closed-Loop Delivery System of Anti-Inflammatory Biologicals. ACS Synth Biol 2018 ; 7 : 2518–2528. [CrossRef] [PubMed] [Google Scholar]
- Ashimova A, Yegorov S, Negmetzhanov B, et al. Cell Encapsulation Within Alginate Microcapsules: Immunological Challenges and Outlook. Front Bioeng Biotechnol 2019 ; 7 : 380. [CrossRef] [PubMed] [Google Scholar]
- Bose S, Volpatti LR, Thiono D, et al. A retrievable implant for the long-term encapsulation and survival of therapeutic xenogeneic cells. Nat Biomed Eng 2020; 4 : 814–26. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Le concept de circuit thérapeutique fonctionnant sur le principe de la boucle fermée. Lors d’une perturbation de l’homéostasie chez un patient atteint d’une maladie chronique, le système en boucle fermée détecte la perturbation via des biomarqueurs spécifiques et rétablit l’homéostasie de manière autonome. Il est composé (1) d’un senseur, qui détecte les marqueurs de la maladie exprimés par le patient, (2) d’une voie de traitement du signal, qui intègre les signaux pour fournir une réponse adaptée, et (3) d’un effecteur, qui rétablit l’homéostasie et guérit la crise. Le circuit thérapeutique en boucle fermée est inséré dans la cellule régulatrice. |
| Dans le texte | |
 |
Figure 2. Principales caractéristiques idéales d’un circuit synthétique de gènes à but thérapeutique. Chaque élément d’un circuit synthétique de gènes à but thérapeutique peut être amélioré pour trouver le meilleur compromis entre plusieurs critères idéaux. (1) Les senseurs sont idéalement spécifiques, non immunogènes chez la souris et l’homme, et liés à (2) une voie de traitement du signal, qui peut être régulée au niveau transcriptionnel ou protéique (par une cascade de protéases). La voie de traitement du signal est idéalement très réactive, réversible et orthogonale, et peut utiliser des portes logiques et un système d’auto-destruction pour améliorer la sécurité du circuit. (3) Les effecteurs doivent être efficaces, disponibles au bon endroit, et non toxiques pour l’organisme. |
| Dans le texte | |
 |
Figure 3. Comparaison de deux méthodes d’encapsulation de cellules hétérologues pour les thérapies in vivo. L’encapsulation de cellules régulatrices avec (A) un polymère d’alginate ou (B) un implant millimétrique retirable : deux façons de permettre la survie de cellules hétérologues chez la souris. L’implant millimétrique présente une chambre contenant les cellules. Les cellules peuvent survivre grâce à l’oxygène et aux nutriments apportés par la circulation sanguine périphérique. Les microcapsules peuvent être injectées dans diverses localisations, y compris intrapéritonéale et intrathécale par exemple, alors que l’implant ne peut être transplanté que par voie intrapéritonéale, sous anesthésie. Dans le cadre du traitement de la fibrose, des revêtements spécifiques ont été développés pour les deux techniques avec, respectivement, la chimiokine CXCL2 (C-X-C motif chemokine ligand 2) pour le polymère d’alginate, et le tétrahydropyrane phényl triazole (THPT) pour l’implant, permettant une durée de vie plus longue du dispositif. La taille totale diffère considérablement entre les deux systèmes, ce qui affecte la capacité de chargement : de quelques centaines de cellules pour une microcapsule à des millions pour l’implant récupérable. La taille des pores est plus large pour l’implant mais ajustable. Dans les deux systèmes, les cellules hétérologues ne peuvent pas quitter le dispositif et les cellules immunitaires (lymphocytes T ou cellules Natural Killer) ne peuvent pas y pénétrer, à l’exception des macrophages qui peuvent traverser les pores. Les petites molécules telles que les anticorps, les cytokines, les ions, les médicaments, les antigènes ou les motifs moléculaires associés aux dommages (DAMP) peuvent entrer et sortir librement dans les deux systèmes. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




