| Issue |
Med Sci (Paris)
Volume 40, Number 3, Mars 2024
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 304 - 307 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024020 | |
| Published online | 22 March 2024 | |
La technologie PROTAC
Une approche thérapeutique prometteuse en oncologie
PROTAC technology: a promising approach in oncology
1
Polytech Nice Sophia, Spécialité Génie biologique 5e année, Pharmacologie et Biotechnologies, Université Côte d’Azur, France
2
Polytech’Nice Sophia, Département Génie Biologique, Université Côte d’Azur
3
Institute for Research on Cancer and Ageing, Nice (IRCAN), UMR CNRS 7284 INSERM U1081 UCA, Nice, France
4
Centre Méditerranéen de Médecine Moléculaire, INSERM U1065 – UCA, Nice, France
a marina.azuaga-moreso@etu.univ-cotedazur.fr
b claire.bertrand@etu.univ-cotedazur.fr
c joanna.duffrene@etu.univ-cotedazur.fr
d marine.dumont@etu.univ-cotedazur.fr
e aurane.lecouffe@etu.univ-cotedazur.fr
f charlotte.muller@etu.univ-cotedazur.fr
g Nicole.arrighi@univ-cotedazur.fr
h Cercina.ONESTO@univ-cotedazur.fr
Au cours des dernières décennies, des progrès remarquables ont été accomplis dans la lutte contre le cancer grâce aux thérapies ciblées avec le développement des inhibiteurs de kinases et plus récemment des inhibiteurs de points de contrôle immunitaire. Bien que très efficaces pour contrôler la croissance ou la progression des tumeurs, ces thérapies se heurtent sur le long terme à des phénomènes de résistance des cellules cancéreuses qui induisent des rechutes chez les patients. Une alternative innovante à ces stratégies anti-cancer repose sur la dégradation ciblée de protéines d’intérêt et non sur leur inhibition, et ce, grâce à la technologie PROTAC (proteolysis-targeting chimera) développée dès 2001 par le laboratoire de C. Crews et R.J. Deshais [1].
Fonctionnement et caractéristiques du système PROTAC
Une molécule PROTAC® est une chimère perméable hétéro bi-fonctionnelle1 permettant la dégradation ciblée de protéines d’intérêt (PI). Elle est composée d’un ligand spécifique de la protéine d’intérêt, relié par un linker à un ligand spécifique d’une E3 ligase. Une partie de la molécule PROTAC se lie donc à la protéine cible alors que l’autre partie recrute le complexe ubiquitine ligase E3. Cette proximité entre l’ubiquitine ligase et la protéine cible facilite alors la polyubiquitination de cette dernière et sa dégradation par le système UPS (ubiquitin proteasome system) (Figure 1) [1].
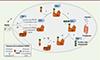 |
Figure 1. Principe de la dégradation ciblée de protéines par la technologie PROTAC. (1) Entrée de la molécule PROTAC dans la cellule. (2) Formation du complexe ternaire : une extrémité du PROTAC se lie spécifiquement au complexe E3 ligase tandis que l’autre extrémité se fixe spécifiquement à la protéine ciblée par le PROTAC. (3) Recrutement de l’enzyme E2 chargée en ubiquitine par le complexe E3 ligase. (4) Ubiquitination de la protéine d’intérêt par l’enzyme E2. (5) Dégradation par le protéasome de la protéine cible ubiquitinylée. (6) Séparation du complexe E3 ligase et de l’enzyme E2, et recyclage de la molécule PROTAC. |
Différents types de molécules PROTAC ont été développés. Concernant la nature du ligand spécifique de la protéine d’intérêt, on retrouve les PROTAC à base de petites molécules inhibitrices qui nécessitent la présence de poches de liaison relativement profondes sur la PI, mais aussi, plus récemment, des PROTAC à base de peptides spécifiques de la PI, nommés p-PROTAC. Ces derniers présentent une plus forte spécificité et induisent des taux de dégradation de la PI plus élevés que les PROTAC à base de petites molécules, mais ont une perméabilité membranaire et une stabilité cellulaire plus faibles [4]. Concernant le recrutement du complexe E3 ligase, la plupart des PROTAC utilisent des ligands spécifiques d’une des E3 ligases ubiquitaires suivantes : Von Hippel-Lindau (VHL), Cereblon (CRBN), ou encore Mouse Double Minute 2 (MDM2) [1].
En parallèle, des molécules PROTAC universelles ont également été développées. Leur intérêt est de pouvoir cibler n’importe quelle PI préalablement étiquetée par génie génétique, la molécule PROTAC universelle reconnaissant l’étiquette et non la PI elle-même. Les deux systèmes PROTAC universels les plus utilisés sont les systèmes HaloPROTAC et dTAG. Ils permettent de répondre à des questions biologiques, mais ils ne peuvent être utilisés comme agents thérapeutiques pour le traitement des maladies, contrairement aux PROTAC décrits précédemment [1].
La technologie PROTAC : de multiples avantages pour invalider une cible
Le système PROTAC est une véritable révolution pour l’invalidation d’une cible thérapeutique puisqu’il permet de détruire la PI au lieu de l’inhiber, contrairement aux thérapies ciblées actuellement utilisées en clinique. Les molécules inhibitrices utilisées en cancérologie fonctionnent selon un modèle « occupancy-driven », l’inhibition s’arrêtant dès lors que le traitement est stoppé. Le premier avantage du PROTAC réside dans son mode de fonctionnement qui repose sur un « event-driven model », c’est-à-dire que la dégradation de la PI a lieu même après la dissociation du complexe PROTAC-PI [2]. Ainsi, une seule molécule PROTAC peut participer à la dégradation de plusieurs molécules de la PI. Une très faible quantité de PROTAC est requise pour la destruction des PI nouvellement synthétisées. Le second avantage du système PROTAC réside dans la diversité des ligands (peptide ou petite molécule inhibitrice) pouvant être utilisés pour cibler la PI, permettant ainsi de dégrader des PI diverses et variées [3]. D’ailleurs, il est désormais possible de cibler des protéines jusqu’ici considérées comme « undruggable », telle que la protéine RAS mutée, qui joue un rôle central dans la prolifération incontrôlée des cellules cancéreuses. Il est également envisageable de cibler des facteurs de transcription comme le proto-oncogène c-MYC par exemple, dont l’inhibition pharmacologique est complexe en raison de l’absence de site catalytique [3]. Plus généralement, cette stratégie représente un avantage pour cibler les protéines non enzymatiques (et donc plus difficiles à inhiber d’un point de vue pharmacologique) qui jouent un rôle dans les processus tumoraux (« scaffolding proteins », ubiquitine ligase c-Cbl, facteurs de transcription, etc.) [4].
Par ailleurs, une difficulté de taille dans les traitements anti-cancéreux actuels est de lutter contre la résistance aux thérapies induite par une adaptation des cellules cancéreuses à long terme. L’avantage majeur du système PROTAC est de limiter cette résistance en détruisant de manière efficace et durable les protéines surexprimées, premier mécanisme de résistance.
Les propriétés pharmacocinétiques des molécules PROTAC sont également un atout : leur action est rapide (quelques heures après l’injection), stable et durable (plusieurs semaines in vivo) [5]. L’avantage majeur par rapport à une thérapie ciblée au moyen d’anticorps monoclonaux humanisés est que les molécules PROTAC ont démontré une importante biodisponibilité orale et une bonne pénétration tissulaire [2].
Des essais prometteurs in vitro et chez l’animal
Plusieurs résultats prometteurs in vitro et en pré-clinique permettent d’attester de la pertinence de l’utilisation de cette nouvelle technologie. En effet, de récentes études menées avec des PROTAC ciblant différentes protéines mutées de la voie de signalisation RAS/RAF/MEK/ERK ont témoigné de leur efficacité.
C’est le cas notamment du PROTAC LC-2, le premier PROTAC à cibler l’oncogène KRASG12C endogène, retrouvé dans 50 % des adénocarcinomes pulmonaires possédant la mutation G12C de KRAS. LC-2 combine un ligand du complexe VHL-E3 ligase et le ligand MRTX849, un inhibiteur covalent de KRASG12C. Cet inhibiteur MRTX849 a montré une efficacité dans des essais cliniques mais à court terme seulement, puisqu’une résistance adaptative et une réactivation de la voie de signalisation RAS/RAF/MEK/ERK ont été observées lors de ces essais. Une dégradation maximale de KRASG12C a pu être observée à une concentration faible (2,5 µM) du PROTAC LC-2 avec une forte sélectivité dans différentes lignées tumorales homo- et hétérozygotes pour la mutation KRAS G12C. Cette dégradation rapide et stable est maintenue jusqu’à 72 h (durée maximale testée) et n’entraîne pas de ré-expression du gène KRASG12C. Elle permet ainsi une atténuation prolongée de la voie de signalisation, contrairement à un traitement avec l’inhibiteur MRTX849 seul [6].
Une autre molécule PROTAC, le SJF-0628, a également fait ses preuves in vitro pour le ciblage du mutant constitutif actif V600E de la protéine kinase BRAF, un oncogène dont l’implication n’est plus à démontrer dans les cancers humains, et notamment dans le mélanome cutané. Dans cette stratégie thérapeutique, le ligand de BRAFV600E présent sur le PROTAC correspond au Vemurafenib, un inhibiteur spécifique du mutant V600E. Cet inhibiteur, utilisé seul dans le cadre de thérapies ciblées, est très efficace mais finit par générer des résistances à long terme [7]. Afin d’éviter ces dernières, la molécule PROTAC SJF-0628 a été développée pour permettre la dégradation spécifique de toutes les formes mutantes du gène BRAF, tout en épargnant la forme WT.
Il a été démontré dans un modèle murin de xénogreffe de cellules de mélanome BRAFV600E humaines que l’administration de 100 nM de SJF-0628 pendant 3 jours, induit une dégradation presque complète de BRAFV600E au sein de la tumeur dès 4 h de traitement, et se prolongeant jusqu’à 72 h. Le SJF-0628 a également été testé en administration quotidienne pendant 10 jours dans un modèle de xénogreffe de cellules de mélanome portant cette fois la mutation BRAF G469A. Une réduction tumorale significative a alors pu être observée. Ce candidat PROTAC pourrait donc être utile pour réduire la croissance tumorale médiée par toutes les mutations oncogéniques de BRAF et pas seulement la mutation V600E, tout en présentant une toxicité minime pour l’organisme [8].
Les BET-PROTAC qui induisent la dégradation des BET (bromodomain and extra-terminal domain), activateurs de la transcription d’oncogènes et dont fait partie BRD4, ont également été développés comme stratégie thérapeutique dans le cancer du sein triple-négatif (TNBC). Les BET-PROTAC MZ1 et ARV-825 ciblant BRD4 ont montré une efficacité importante sur la prolifération tumorale et sur l’induction de l’apoptose de lignées cellulaires de TNBC sensibles ou résistantes aux inhibiteurs de BET (BETi). Ces molécules thérapeutiques induisent également une diminution de la croissance tumorale dans un modèle in vivo de souris xénogreffées avec des cellules résistantes aux BETi. Ces BET-PROTAC sont d’autant plus intéressants que BRD4 est un acteur retrouvé également dans d’autres types de cancers, dont les leucémies myéloïdes aiguës et les cancers de la prostate [9].
Un passage clinique en bonne voie
La technologie PROTAC fait l’objet d’essais cliniques dans le traitement de divers cancers. L’un des premiers PROTAC à avoir franchi le cap des essais cliniques est l’ARV-110 (Bavdegalutamide), actuellement en phase II dans le traitement du cancer de la prostate métastatique résistant à la castration. Ce PROTAC s’attaque au récepteur aux androgènes (AR), facteur clé dans l’évolution du cancer et cible actuelle des traitements d’hormonothérapie. En pré-clinique, une meilleure inhibition de la progression tumorale comparé à l’enzalutamide, un inhibiteur classique des AR, avait été démontrée en présence de l’ARV-110. Dans l’étude clinique de phase I/II avec l’ARV-110, une diminution des niveaux d’antigène spécifique de la prostate (PSA) a été observée de même qu’une réduction tumorale chez les patients présentant les mutations T878X et/ou H875Y du récepteur aux androgènes [10].
Un autre PROTAC, le ER-PROTAC ARV-471, est, quant à lui, en essai de phase II pour le traitement du cancer du sein métastatique ER+/HER2-. Les études cliniques de phase I ont montré une innocuité de la molécule PROTAC mais surtout une activité anti-tumorale. En effet, l’analyse des biopsies tumorales a montré que l’ARV-471 dégradait jusqu’à 89 % le récepteur des oestrogènes (ER). De plus, cette molécule PROTAC a démontré 40 % d’effets cliniques bénéfiques chez les patientes traitées, avec rémission partielle pour 3 d’entre elles. Il est à présent également envisagé d’évaluer l’effet d’une thérapie combinée avec le palbociclib, un inhibiteur de CDK4/6, et donc inhibiteur de la prolifération cellulaire, dans l’espoir d’observer un effet synergique (https://clinicaltrials.gov/study/NCT04072952). Ces deux exemples de molécules PROTAC ne sont cependant pas les seules à être en essai clinique : il existe d’autres candidats actuellement en phase I pour le traitement de différents cancers, présentés dans le Tableau 1 [11].
Molécules PROTAC en essai clinique pour le traitement de divers cancers. AR : Androgen Receptor, ER: Estrogen Receptor, BCL-xl : B-cell lymphoma-extra large, BRD9 : Bromodomain-containing protein 9, IRAK4 : interleukin-1 receptor-associated kinase 4, STAT3 : signal transducer and activator of transcription 3, BTK : Burton’s tyrosine kinase.
La technologie PROTAC présente un grand nombre d’avantages par rapport aux thérapies ciblées anti-cancer et a su faire ses preuves in vitro, mais surtout in vivo chez l’homme. Les perspectives d’améliorations des PROTAC concernent la possibilité de contrôler leur activation, de les coupler avec des anticorps monoclonaux afin d’atteindre une encore plus grande spécificité, ou encore de s’affranchir d’une perméabilité limitée dans certains cas, en assemblant directement la molécule PROTAC à l’intérieur de la cellule (in-cell CLIPTAC) [12]. Dans un premier temps, ils représentent un réel espoir pour les patients atteints d’un cancer du sein ou de la prostate et pourraient bientôt arriver sur le marché, tout en restant relativement abordables par rapport au coût élevé des thérapies ciblées.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
La molécule PROTAC est composée 1) d’un ligand de la protéine d’intérêt, souvent une petite molécule inhibitrice qui a déjà été développée par ailleurs et a montré une efficacité in vitro et in vivo contre la protéine d’intérêt, et que l’on va utiliser pour construire cette molécule PROTAC ; 2) d’un ligand du complexe E3 ligase (la pomalidomide par exemple, ligand de l’E3 ligase Cereblon). Ces deux ligands (l’un spécifique de la protéine d’intérêt, l’autre de l’E3 ligase) vont alors être reliés entre eux par un linker dont la nature chimique est importante pour améliorer la stabilité de la molécule PROTAC, sa bio-disponibilité et sa perméabilité cellulaire.
Références
- Burslem GM, Crews CM. Proteolysis-Targeting Chimeras as Therapeutics and Tools for Biological Discovery. Cell 2020; 181 : 102–14. [CrossRef] [PubMed] [Google Scholar]
- Hu Z, Crews CM. Recent Developments in PROTAC-Mediated Protein Degradation: From Bench to Clinic. Chembiochem Eur J Chem Biol 2022; 23 : e202100270. [CrossRef] [PubMed] [Google Scholar]
- Memon H, Patel BM. PROTACs: Novel Approach for Cancer Breakdown by Breaking Proteins. Life Sci 2022; 300 : 120577. [CrossRef] [PubMed] [Google Scholar]
- Lei H, Wang W, Wu Y. Targeting Oncoproteins for Degradation by Small Molecules in Myeloid Leukemia. Leuk Lymphoma 2018 ; 59 : 2297–2304. [CrossRef] [PubMed] [Google Scholar]
- Mares A, Miah AH, Smith IED, et al. Extended Pharmacodynamic Responses Observed upon PROTAC-Mediated Degradation of RIPK2. Commun Biol 2020; 3 : 140. [CrossRef] [PubMed] [Google Scholar]
- Bond MJ, Chu L, Nalawansha DA, et al. Targeted Degradation of Oncogenic KRASG12C by VHL-Recruiting PROTACs. ACS Cent Sci 2020; 6 : 1367–75. [CrossRef] [PubMed] [Google Scholar]
- Garbe C, Abusaif S, Eigentler TK. Vemurafenib. Recent Results Cancer Res 2014 ; 201 : 215–225. [CrossRef] [PubMed] [Google Scholar]
- Alabi S, Jaime-Figueroa S, Yao Z, et al. Mutant-Selective Degradation by BRAF-Targeting PROTACs. Nat Commun 2021; 12 : 920. [CrossRef] [PubMed] [Google Scholar]
- Noblejas-López MDM, Nieto-Jimenez C, Burgos M, et al. Activity of BET-Proteolysis Targeting Chimeric (PROTAC) Compounds in Triple Negative Breast Cancer. J Exp Clin Cancer Res 2019 ; 38 : 383. [CrossRef] [PubMed] [Google Scholar]
- Gao X, Burris HA III, Vuky J, et al. Phase 1/2 Study of ARV-110, an Androgen Receptor (AR) PROTAC Degrader, in Metastatic Castration-Resistant Prostate Cancer (mCRPC). J Clin Oncol 2022; 40: 17. [CrossRef] [Google Scholar]
- Békés M, Langley DR, Crews CM. PROTAC Targeted Protein Degraders: The Past Is Prologue. Nat Rev Drug Discov 2022; 21 : 181–200. [CrossRef] [PubMed] [Google Scholar]
- Cecchini C, Pannilunghi S, Tardy S, et al. From Conception to Development: Investigating PROTACs Features for Improved Cell Permeability and Successful Protein Degradation. Front Chem 2021; 9 : 672267. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
Liste des tableaux
Molécules PROTAC en essai clinique pour le traitement de divers cancers. AR : Androgen Receptor, ER: Estrogen Receptor, BCL-xl : B-cell lymphoma-extra large, BRD9 : Bromodomain-containing protein 9, IRAK4 : interleukin-1 receptor-associated kinase 4, STAT3 : signal transducer and activator of transcription 3, BTK : Burton’s tyrosine kinase.
Liste des figures
 |
Figure 1. Principe de la dégradation ciblée de protéines par la technologie PROTAC. (1) Entrée de la molécule PROTAC dans la cellule. (2) Formation du complexe ternaire : une extrémité du PROTAC se lie spécifiquement au complexe E3 ligase tandis que l’autre extrémité se fixe spécifiquement à la protéine ciblée par le PROTAC. (3) Recrutement de l’enzyme E2 chargée en ubiquitine par le complexe E3 ligase. (4) Ubiquitination de la protéine d’intérêt par l’enzyme E2. (5) Dégradation par le protéasome de la protéine cible ubiquitinylée. (6) Séparation du complexe E3 ligase et de l’enzyme E2, et recyclage de la molécule PROTAC. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




