| Issue |
Med Sci (Paris)
Volume 38, Number 3, Mars 2022
|
|
|---|---|---|
| Page(s) | 243 - 245 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2022017 | |
| Published online | 25 March 2022 | |
Les macrophages associés à la tumeur
De nouvelles cibles pour contrecarrer la chimiorésistance au 5-fluorouracile dans les cancers colorectaux ?
Tumor-associated macrophages: New targets to thwart 5-FU chemoresistance in colorectal cancers?
1
Université Grenoble Alpes, Inserm U1209, CNRS UMR 5309, Institut pour l’avancée des biosciences, Boulevard de la Chantourne, 38700 La Tronche, France
2
Équipe de mécanobiologie, immunité et cancer, Institut pour l’avancée des biosciences
3
Département d’analyse cytologique et pathologique, CHU Grenoble Alpes, Grenoble, France
4
Service d’hépato-gastro-entérologie, CHU Grenoble Alpes, Grenoble, France
Le fluorouracile (5-FU) est un analogue de base pyrimidique utilisé dans de nombreuses combinaisons de chimiothérapie, notamment contre les cancers colorectaux. Malgré les progrès dans le traitement de ces cancers, le pronostic des formes avancées reste sombre, notamment en raison de la forte prévalence de la chimiorésistance au 5-FU. Les mécanismes impliqués dans cette chimiorésistance sont multiples : modulation du transport du 5-FU dans la cellule (ainsi que son exportation), métabolisme de la molécule, modification de sa cible, modification de l’équilibre entre facteurs apoptotiques et anti-apoptotiques, adaptation au microenvironnement tumoral, et transition épithélio-mésenchymateuse [1]. La plupart des études portant sur la chimiorésistance se sont focalisées sur la cellule cancéreuse elle-même, et l’importance du microenvironnement tumoral a été longtemps minimisée. Des travaux récents, dont ceux de notre laboratoire, montrent cependant que le microenvironnement joue en réalité un rôle beaucoup plus important dans la chimiorésistance des tumeurs.
Rôle des macrophages dans la résistance aux chimiothérapies
Dans de nombreuses tumeurs solides, les macrophages forment une composante essentielle de la réponse immunitaire associée à la tumeur, et leur abondance est habituellement corrélée à un pronostic défavorable. Ces macrophages associés à la tumeur ont été impliqués dans la croissance tumorale, l’échappement immunitaire, la néoangiogenèse, ou encore la résistance aux traitements. En effet, de nombreuses études ont montré que la déplétion des macrophages associés aux tumeurs (en utilisant par exemple des liposomes de clodronate) accroît la sensibilité aux chimiothérapies [2]. Parallèlement, les études de co-culture in vitro ont mis en évidence le rôle des macrophages dans l’induction d’une chimiorésistance des cellules tumorales contre le paclitaxel, la doxorubicine, l’étoposide ou la gemcitabine [3, 4]. Les mécanismes impliqués dans ces résistances induites par les macrophages à différentes chimiothérapies reposent le plus souvent sur la sécrétion, par les macrophages, de facteurs modifiant la réponse des cellules cancéreuses. Un exemple d’un tel mécanisme est la sécrétion de désoxycytidine, qui inhibe l’induction d’apoptose par la gemcitabine dans les adénocarcinomes pancréatiques [5].
Dans les cancers colorectaux, l’implication des macrophages dans la chimiorésistance au 5-FU a été suggérée par des études in vitro et in vivo. Les mécanismes proposés sont divers, mais ils reposent, eux aussi, sur des facteurs sécrétés par les macrophages. La sécrétion d’interleukine 6 (IL-6) par les macrophages a été proposée comme responsable de l’activation, dans les cellules cancéreuses, de STAT3 (signal transducer and activator of transcription 3), induisant l’inhibition de la voie de signalisation RAB22A/BCL2 via l’expression du microARN miR-204-5p, ce qui favorise la résistance au 5-FU [6]. De manière similaire, la sécrétion de putrescine, un membre de la famille des polyamines, inhibe la voie JNK/caspase 3 dans les cellules cancéreuses, favorisant également leur résistance au 5-FU [7]. Ces mécanismes n’ont toutefois pas été validés dans l’espèce humaine, et leurs effets semblaient quantitativement faibles in vivo. Partant du constat que les macrophages associés à la tumeur sont très souvent situés dans les zones hypoxiques, où ils favorisent la néoangiogenèse, nous avons voulu savoir dans quelle mesure l’hypoxie, dont nous avions montré précédemment l’importance pour la modulation de différentes fonctions immunologiques des macrophages [8], pouvait également moduler l’implication de ces cellules dans la chimiorésistance au 5-FU.
Chimiorésistance au 5-FU induite par les macrophages hypoxiques
Nous avons observé que les macrophages hypoxiques, contrairement à leurs homologues normoxiques, induisent une résistance complète des cellules tumorales au 5-FU dans des conditions expérimentales reproduisant le rapport macrophages/quantité de 5-FU existant dans les tissus tumoraux in vivo. Cette chimiorésistance semble être due à une action directe des macrophages et ne pas impliquer la sécrétion d’un facteur soluble induisant une résistance des cellules cancéreuses au 5-FU. L’étude comparative du protéome des macrophages normoxiques et hypoxiques a mis en évidence l’expression différentielle d’une protéine à l’origine de cette chimiorésistance : la dihydropyrimidine déshydrogénase (DPD). Cette enzyme de la voie du catabolisme des bases pyrimidiques catalyse la réduction du 5-FU en dihydrofluorouracile (5-FUH2), une molécule inactive. L’implication de la DPD dans la chimiorésistance au 5-FU a été confirmée par des études fonctionnelles, révélant ainsi un rôle clé des macrophages hypoxiques [9]. Pour confirmer l’intérêt médical de ce résultat, nous avons étudié l’expression de la DPD dans des tumeurs primitives et des métastases hépatiques issues de patients porteurs d’un adénocarcinome colorectal. Nous avons alors constaté que cette enzyme est peu ou pas exprimée dans les cellules cancéreuses (expliquant la sensibilité habituelle de ces cancers au 5-FU), tandis qu’elle l’est fortement par les macrophages, qui représentent la principale source d’expression de la DPD dans le microenvironnement de la tumeur primitive comme dans celui des métastases hépatiques [9].
Un mécanisme spécifiquement humain
Ce rôle de la DPD synthétisée par les macrophages hypoxiques comme source principale de chimiorésistance de la tumeur au 5-FU n’avait pas été mis en évidence dans les nombreuses études in vitro et in vivo publiées jusqu’à présent, vraisemblablement en raison, d’une part, des modèles de macrophages étudiés, et, d’autre part, des conditions de culture utilisées. En effet, nous avons découvert que, contrairement aux hépatocytes murins, qui, comme les hépatocytes humains, expriment le gène de la DPD, les macrophages murins ne l’expriment pas, à cause d’un contrôle inhibiteur épigénétique par méthylation de son promoteur [9]. Nous avons également montré que la concentration en oxygène joue un rôle prépondérant dans l’expression de ce gène par les macrophages humains. Or la majorité des expériences réalisées in vitro utilisent des conditions riches en oxygène, qui inhibent fortement l’expression du gène dans les macrophages issus de monocytes, et ne permettent donc pas d’apprécier l’importance de cette enzyme dans le processus de chimiorésistance au 5-FU.
Mécanisme de contrôle de l’expression du gène codant la DPD par l’oxygène
De plus, nous avons montré que le contrôle de l’expression du gène codant la DPD dans les macrophages humains hypoxiques n’est pas transcriptionnel mais traductionnel, sous la dépendance de HIF-2α (hypoxia-induced factor2α), alors que HIF-1α ne semble jouer aucun rôle dans l’expression de ce gène par les macrophages [9]. La protéine HIF-2α est stabilisée en condition d’hypoxie modérée (25 mmHg), et intervient dans le contrôle traductionnel, indépendamment de son activité connue comme facteur de transcription. Un des mécanismes envisagés repose sur la participation de HIF-2α à un complexe initiateur de la traduction (eIF4FHypoxique) faisant notamment intervenir eIF4E2, un complexe identifié dans la réponse adaptative à l’hypoxie dans les cellules de mammifères, en remplacement du complexe eiF4F (comprenant eIF4E), actif seulement lorsque l’oxygène est présent en abondance [10].
Nos travaux ont donc mis en évidence le fait que la chimiorésistance d’une tumeur cancéreuse au 5-FU, chez l’homme, est étroitement liée au microenvironnement tumoral, et plus particulièrement au rôle inattendu d’une enzyme catalysant la dégradation du 5-FU, la dihydropyrimidine déshydrogénase, dont la présence dans les macrophages associés à la tumeur est finement contrôlée par la teneur en oxygène (Figure 1). Ce résultat désigne les macrophages présents dans le microenvironnement tumoral comme cibles privilégiées pour contrecarrer la chimiorésistance des cancers colorectaux au 5-FU.
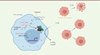 |
Figure 1. Schéma du mécanisme de chimiorésistance au 5-FU impliquant les macrophages en hypoxie. Le contrôle traductionnel de l’expression du gène codant la dihydropyrimidine déshydrogénase (DPD) par les macrophages associés à la tumeur est sous la dépendance d’un complexe d’initiation de la traduction comprenant HIF-2α, une protéine stabilisée en condition d’hypoxie. La DPD dégrade le 5-fluorouracile (5-FU) en dihydrofluorouracile (5-FUH2), qui est une molécule inactive. Ce mécanisme illustre l’importance du microenvironnement tissulaire dans les processus de résistance aux traitements anti-cancéreux. |
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Marin JJG, de Medina FS, Castaño B, et al. Chemoprevention, chemotherapy, and chemoresistance in colorectal cancer. Drug Metab Rev 2012 ; 44 : 148–172. [CrossRef] [PubMed] [Google Scholar]
- Ruffell B, Coussens LM. Macrophages and therapeutic resistance in cancer. Cancer Cell 2015 ; 27 : 462–472. [CrossRef] [PubMed] [Google Scholar]
- Mitchem JB, Brennan DJ, Knolhoff BL, et al. Targeting tumor-infiltrating macrophages decreases tumor-initiating cells, relieves immunosuppression, and improves chemotherapeutic responses. Cancer Res 2013 ; 73 : 1128–1141. [CrossRef] [PubMed] [Google Scholar]
- Shree T, Olson OC, Elie BT, et al. Macrophages and cathepsin proteases blunt chemotherapeutic response in breast cancer. Genes Dev 2011 ; 25 : 2465–2479. [CrossRef] [PubMed] [Google Scholar]
- Halbrook CJ, Pontious C, Kovalenko I, et al. Macrophage-released pyrimidines inhibit gemcitabine therapy in pancreatic cancer. Cell Metab 2019 ; 29 : 1390–9 e6. [CrossRef] [PubMed] [Google Scholar]
- Yin Y, Yao S, Hu Y, et al. The immune-microenvironment confers chemoresistance of colorectal cancer through macrophage-derived IL6. Clin Cancer Res 2017 ; 23 : 7375–7387. [CrossRef] [PubMed] [Google Scholar]
- Zhang X, Chen Y, Hao L, et al. Macrophages induce resistance to 5-fluorouracil chemotherapy in colorectal cancer through the release of putrescine. Cancer Lett 2016 ; 381 : 305–313. [CrossRef] [PubMed] [Google Scholar]
- Court M, Petre G, Atifi ME, et al. Proteomic signature reveals modulation of human macrophage polarization and functions under differinge environmental oxygen conditions. Mol Cell Proteomics 2017 ; 16 : 2153–2168. [CrossRef] [PubMed] [Google Scholar]
- Malier M, Gharzeddine K, Laverriere M-H, et al. Hypoxia drives dihydropyrimidine dehydrogenase expression in macrophages and confers chemoresistance in colon cancer. Cancer Res 2021; doi: 10.1158/0008-5472.CAN-21-1572. [PubMed] [Google Scholar]
- Uniacke J, Holterman CE, Lachance G, et al. An oxygen-regulated switch in the protein synthesis machinery. Nature 2012 ; 486 : 126–129. [CrossRef] [PubMed] [Google Scholar]
© 2022 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Schéma du mécanisme de chimiorésistance au 5-FU impliquant les macrophages en hypoxie. Le contrôle traductionnel de l’expression du gène codant la dihydropyrimidine déshydrogénase (DPD) par les macrophages associés à la tumeur est sous la dépendance d’un complexe d’initiation de la traduction comprenant HIF-2α, une protéine stabilisée en condition d’hypoxie. La DPD dégrade le 5-fluorouracile (5-FU) en dihydrofluorouracile (5-FUH2), qui est une molécule inactive. Ce mécanisme illustre l’importance du microenvironnement tissulaire dans les processus de résistance aux traitements anti-cancéreux. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




