| Issue |
Med Sci (Paris)
Volume 37, Number 2, Février 2021
Modèles alternatifs
|
|
|---|---|---|
| Page(s) | 167 - 177 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2020282 | |
| Published online | 16 February 2021 | |
L’anémone de mer Nematostella vectensis
Un modèle émergent pour la recherche biomédicale : mécano-sensibilité, régénération et longévité
The sea anemone Nematostella vectensis, an emerging model for biomedical research: Mechano-sensitivity, extreme regeneration and longevity
1
Université Côte d’Azur, CNRS, Inserm – Institut de Recherche sur le Cancer et le Vieillissement (IRCAN), 06107 Nice, France
2
Université Côte d’Azur – Institut fédératif de recherche – ressources marines, 06107 Nice, France
3
Institut de l’audition, Institut Pasteur, Inserm UMRS 1120, 75012 Paris, France
4
Collège de France, 75005 Paris, France
*
eric.rottinger@univ-cotedazur.fr
Nematostella, petite anémone de mer, possède de fascinantes propriétés, telles que la régénération du corps entier, l’absence de signes de vieillissement et d’affections liées à l’âge comme, par exemple, le développement de cancers. Elle se cultive aisément et se reproduit en laboratoire. Malgré son aspect « simple », cet invertébré marin de l’embranchement des cnidaires partage avec les vertébrés des caractéristiques non seulement morphologiques, mais également génomiques. La communauté scientifique développe aujourd’hui une variété d’outils de génomique fonctionnelle permettant l’utilisation de cet animal de façon intégrative dans le domaine de la médecine régénérative, de la longévité et des maladies mécano-sensorielles. Son étude se présente comme particulièrement prometteuse pour faire progresser la connaissance dans ces différents domaines, offrant des possibilités expérimentales qui font défaut dans les modèles animaux classiques.
Abstract
Nematostella has fascinating features such as whole-body regeneration, the absence of signs of aging and importantly, the absence of age-related diseases. Easy to culture and spawn, this little sea anemone in spite of its “simple” aspect, displays interesting morphological characteristics similar to vertebrates and an unexpected similarity in gene content/genome organization. Importantly, the scientific community working on Nematostella is developing a variety of functional genomics tools that enable scientists to use this anemone in the field of regenerative medicine, longevity and mecano-sensory diseases. As a complementary research model to vertebrates, this marine invertebrate is emerging and promising to dig deeper into those fields of research in an integrative manner (entire organism) and provides new opportunities for scientists to lift specific barriers that can be encountered with other commonly used animal models.
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette (Photo © Vincent Michel).
Les cnidaires (méduses, hydres, coraux, gorgones, anémones de mer) forment un groupe d’animaux majoritairement marins et strictement aquatiques. Considérés comme « taxon frère » des bilatériens, leur séparation est datée à 600 millions d’années (Figure 1A) [1], ce qui leur confère une position phylogénique d’importance pour étudier l’évolution de phénomènes biologiques et le développement (« EvoDevo ») [2]. L’embranchement des cnidaires est formé de deux clades majeurs, les médusozoaires (hydres, méduses) et les anthozoaires (anémones de mer, coraux, gorgones) (Figure 1B). Tous les cnidaires ont en commun de posséder des cellules spécifiques et exclusives à cet embranchement, les cnidocytes. Il s’agit de cellules sensorielles urticantes (aussi appelés nématocytes) en forme de capsules chargées d’un cocktail de toxines et d’un petit harpon qui, à la suite d’une stimulation mécanique (par exemple le contact avec une proie), expulsent leur contenu pour paralyser la proie avant son ingestion, ou pour se défendre contre des prédateurs [3]. Ce déploiement ultra-rapide fait partie des processus cellulaires les plus rapides du règne animal [4].
 |
Figure 1. Phyolgénie simplifiée des métazoaires (animaux). A. Phylogénie des métazoaires, mettant en évidence la position clé des cnidaires en tant que groupe sœur des animaux bilatériens. La position des cténophores et porifères à l’extérieur des bilatériens reste controversée (lignes en pointillés). B. Phylogénie des cnidaires, illustrant les relations entre les principaux groupes (figure modifiée à partir de [11]). |
Dans la recherche de modèles cnidaires complémentaires au modèle historique de l’hydre [5], permettant un accès au matériel embryonnaire et au développement d’outils de génomique fonctionnelle, Hand et Uhlinger ont publié, dans les années 1990, un protocole permettant de cultiver, faire pondre et compléter le cycle de vie d’un cnidaire anthozoaire, le polype anémone de mer Nematostella vectensis (Figure 2A) [6]. Cette publication a suscité un fort intérêt dans la communauté scientifique, qui a depuis développé cette anémone de mer comme modèle EvoDevo avec un vaste répertoire de ressources et d’outils (Tableau I) [7]. Depuis, d’autres cnidaires hydrozoaires, tels que la méduse Clytia ou le polype colonial Hydractinia, ont été développés pour étudier, entre autres, la spécification de la lignée germinale, l’ovogénèse, ou encore la mise en place des axes du corps [8, 9]. Néanmoins, Nematostella reste à ce jour le modèle de recherche cnidaire anthozoaire le plus développé en raison de son fort potentiel pour la biologie de la régénération et pour tenter de percer les mystères de la longévité.
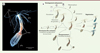 |
Figure 2. L’anémone de mer Nematostella vectensis (Cnidaria, Anthozoa). A. Image d’un polype adulte de Nematostella. (*) bouche, (ten) tentacules, (pha) pharynx, (mes) mésentères, (phy) physa. B.Représentation schématique des trajectoires développementales de Nematostella : Développement embryonnaire, régénération, bourgeonnement et décroissance/re-croissance (figure modifiée à partir de [11]). |
Liste des techniques, ressources et outils pour la culture et la génomique fonctionnelle de Nematostella vectensis.
Morphologie et cycle de vie de Nematostella
Cette petite anémone de mer translucide, d’environ 1 à 3 cm au stade adulte (Figure 2A), vit dans des piscines naturelles/estuaires d’eau saumâtre ou dans des marais salants [10]. Ainsi, elle est particulièrement tolérante aux variations environnementales, telles que les changements de salinité ou de température. Cette tolérance a été un fort atout pour l’élevage de cet animal en conditions artificielles dans les laboratoires de recherche [7].
Dans son milieu naturel, Nematostella vit enfouie dans le sédiment, et seules les tentacules émergent afin d’attraper ses proies. Une fois paralysée par le cocktail de toxines contenu dans les cnidocytes, la proie est portée à la bouche par les tentacules, pour ensuite être ingérée, via le pharynx, et digérée dans la cavité gastrique. La majeure partie du corps de l’animal est constituée de cette cavité gastrique dans laquelle se logent les mésentères, des structures à l’origine de la production de gamètes, de la digestion et du stockage des lipides [11]. Contrairement à la majorité des anémones de mer, qui possèdent un pied pour se fixer au substrat, Nematostella présente à l’extrémité opposée de sa tête une structure appelée physa. Des contractions musculaires péristaltiques le long du corps la font osciller de la bouche jusqu’à ce physa, facilitant ainsi son enfouissement dans le substrat et l’élimination de débris de ses épithéliums externes.
Comme tous les cnidaires, Nematostella est un animal diploblastique, dont les organes s’édifient à partir de deux feuillets embryonnaires. Les deux tissus épithéliaux, l’endomésoderme (aussi nommé gastroderme) interne et l’ectoderme externe, constituent l’intégralité de son corps, y compris les mésentères. Une étude récente estime la diversité cellulaire des tissus de Nematostella à environ 100 types ou états cellulaires [12]. L’ectoderme non-mésentérique sert de barrière protectrice entre l’animal et son environnement. Il est constitué principalement de cellules spécialisées, comme des neurones, des cellules glandulaires/à mucus, des cellules épithéliales et des cnidocytes. L’endomésoderme non-mésentérique contient ces mêmes types cellulaires mais également des cellules myoépithéliales qui forment les muscles pariétaux, ainsi que des cellules qui participent à la digestion et à l’absorption des nutriments. Dans les mésentères, l’ectoderme est formé principalement de cnidocytes et de cellules qui sécrètent des enzymes digestives, alors que l’endomésoderme est constitué des gonades et de cellules myoépithéliales, qui forment les muscles rétracteurs, ainsi que de cellules impliquées dans l’absorption et le stockage des nutriments [11]. L’ectoderme est séparé de l’endomésoderme par une matrice extracellulaire nommée « mésoglée ». Celle-ci est principalement acellulaire, bien que des cellules amiboïdes migratoires de fonction inconnue y aient été observées. Des neurites1 issus de l’ectoderme la traversent, créant un lien entre les deux tissus [13].
Nematostella possède un système nerveux diffus et relativement simple. Bien qu’aucune structure centralisatrice assimilable à un cerveau n’ait été observée, il existe dans ses tissus des structures nerveuses organisées, telles que des condensations neuronales (par exemple, des voies longitudinales de neurites, le long des mésentères) ou des structures semblables à des neuropiles2. Des anneaux nerveux ont également été observés autour de la bouche et du pharynx de l’animal [7]. Le système nerveux de Nematostella se compose en fait d’une multitude de types de neurones qui sont interconnectés, y compris des neurones ganglionnaires (semblables aux interneurones), des cellules sensorielles ou sensori-motrices, des cellules glandulaires de type neurosécrétrices, et des cnidocytes [7].
La reproduction de Nematostella s’effectue de façon sexuée et asexuée. La reproduction asexuée se réalise de différentes façons : fission transversale, bourgeonnement/pincement du physa, ou régénération à partir de fragments de l’animal [14, 15] (Figure 2B). Très peu d’informations sont disponibles sur les mécanismes de fission et de bourgeonnement. Par contre, l’excès de nourriture semble favoriser le pincement et le détachement du physa, donnant naissance à un clone, qui régénérera ses parties orales (Carvalho et Röttinger, communication personnelle). Nematostella est un animal gonochorique, c’est-à-dire qu’il présente des sexes séparés. Sa fécondation est externe. Elle se réalise par la rencontre entre le sperme et l’œuf dans la colonne d’eau dans laquelle vit3 cet animal. En laboratoire, un stimulus lumineux de 9 h permet d’induire la ponte de l’œuf et la fécondation est contrôlable [6]. Après la fécondation, l’œuf subit des clivages successifs, formant une blastula qui s’invagine à partir du pôle animal lors de la gastrulation, avant de s’allonger et se transformer en larve nageuse ciliée, nommée planula [16]. Cette larve possède un pharynx ouvert sur l’extérieur par une bouche. Les deux premiers mésentères se forment progressivement. Cinq à six jours après la fécondation, la planula s’arrête de nager. Elle se pose sur le substrat et entame sa légère métamorphose, induisant ainsi le développement de ses quatre premiers tentacules (Figure 2B). Le polype continuera de grandir, à une vitesse dépendant de la température et de l’apport en nutriments (Carvalho, Amiel et Röttinger, données non publiées). Les polypes adultes sexuellement matures possèdent 8 mésentères et au moins 16 tentacules. En laboratoire, le cycle de vie complet de Nematostella s’effectue en 12 à 16 semaines [6]. Cependant, en optimisant le régime alimentaire, le cycle de vie peut être effectué en moins de 8 semaines (Carvalho, Amiel et Röttinger, données non publiées), une optimisation de la durée du cycle de vie qui rend ce modèle attrayant pour des approches d’ingénierie génomique et des études de génétique.
Nematostella est très tolérante face aux privations de nourriture. En effet, l’absence de nourriture ne semble pas avoir de conséquences importantes ou létales à court terme. Dans ces conditions de restriction, Nematostella est capable de réduire son activité mitotique [17] et sa taille diminue progressivement. Elle peut ainsi survivre plusieurs semaines, voire plusieurs mois, sans apports nutritionnels. La reprise de l’alimentation induit une prolifération cellulaire, qui s’accompagne de la croissance de l’animal et restaure un équilibre physiologique (Figure 2B).
Génome, ressources et outils expérimentaux disponibles
Le premier génome séquencé et publié d’un animal non-bilatérien4 a été celui de Nematostella, en 2007 [18]. On escomptait un génome relativement simple auquel allait manquer une grande partie des gènes présents chez les bilatériens. Or, à la surprise de la communauté scientifique, après comparaison avec les génomes d’invertébrés (comme la drosophile, qui a perdu de nombreux gènes au cours de l’évolution) et de vertébrés (comme la souris), celui de Nematostella s’est révélé être d’une grande complexité et de nombreuses similitudes avec celui des vertébrés ont été identifiées. En effet, Nematostella possède la très grande majorité des familles de gènes et des voies de signalisations des vertébrés bilatériens, telles que la famille des Wnt, FGF (fibroblast growth factor), TGF-β (transforming growth factor β), ou Notch [18]. Il existe également une forte synténie5 des gènes orthologues, ainsi qu’une conservation de l’organisation entre introns et exons [18]. La préservation d’une régulation épigénétique a également été rapportée [19]. Les régions activatrices, préférentiellement pour les gènes du développement de Nematostella, sont en effet caractérisées par la même combinaison de modifications des histones que chez les bilatériens vertébrés [19]. La distribution et l’abondance des éléments de régulation de ces gènes sont également partagées avec les vertébrés [19].
Depuis le séquençage de son génome, une panoplie de ressources de type « omiques » a été développée : données transcriptomiques (ARNseq) et épigénomiques, en particulier de la structure chromatinienne (souvent obtenues par ATAC-seq)6. Ces études vont de l’analyse globale de l’organisme à celle de cellules uniques [12, 20] (Tableau I). Au cours des dernières décennies, de nombreux outils moléculaires et de génomique fonctionnelle ont également été mis en œuvre [21] (Tableau I). Comme pour les modèles vertébrés utilisés dans les laboratoires, chez Nematostella, les techniques de génomique fonctionnelle applicables s’étendent de la transgenèse, induite par la méganucléase, à la modification des gènes eux-mêmes, avec le recours croissant aux méthodes utilisant le système CRISPR/Cas9, qui permet un gain ou une perte de fonction du gène soit par insertion (knock-in), soit par délétion (knock-out) de séquences nucléotidiques [22]. La mise en place d’outils génétiques, lignées mutantes ou transgéniques, a été facilitée par l’optimisation récente de ces techniques génétiques, mais également par l’amélioration du protocole utilisé pour l’alimentation de ces anémones (Carvalho, Amiel et Röttinger, données non publiées). L’ensemble des caractéristiques biologiques, la conservation génomique et la panoplie d’outils de génomique fonctionnelle disponible chez Nematostella, permettent ainsi d’envisager désormais des projets de recherche ambitieux à vocation biomédicale.
Nematostella, un épithélium au service de la cosmétique et de la médecine
L’intérêt pour les recherches en cosmétique ou en science biomédicale utilisant Nematostella a commencé à émerger récemment. En 2014, une équipe s’est en effet focalisée sur l’étude des propriétés potentielles des cnidocytes pour le développement de stratégies de diffusion/pénétration sous-cutanée de crèmes ou de principes actifs [23]. Des essais in cellulo/in vitro ont été conduits afin d’évaluer la capacité de ces cellules mécano-sensibles à favoriser la pénétration de molécules dans une couche de cellules épithéliales. L’hypothèse était qu’une fois activées et une fois leurs microcapsules ancrées dans les épithéliums, ces cellules ouvrent une voie de passage pour des molécules d’intérêt au travers de la couche de cellules épithéliales. Il a ainsi été montré qu’en présence de cnidocytes, la pénétration à travers un épithélium de nicotinamide, une vitamine hydrosoluble de la famille des vitamines B, était améliorée. Cette augmentation de l’efficacité du transport trans-épithélial peut être durable dans le temps, lorsque les cnidocytes sont insérés dans la couche de cellules épithéliales [23]. Bien que ces travaux n’aient pas encore eu d’application, ils révèlent un aspect intéressant des capacités de ces cellules propres aux cnidaires.
Il est important de noter que certaines structures anatomiques, ainsi que certains types cellulaires, sont très bien conservés entre Nematostella et les vertébrés, dont l’homme. L’existence de telles similitudes a permis le développement de projets de recherche dans le domaine de la mécano-transduction, en particulier pour l’étude des mécanismes de la transduction des cellules sensorielles de l’oreille interne, qui contient les organes sensoriels de l’audition et de l’équilibration. Chez les vertébrés, ces cellules sensorielles présentent à leur sommet une touffe ciliaire constituée de stéréocils, des microvillosités rigides emplies de filaments d’actine, d’un kinocil constitué de microtubules, et baignant dans un liquide de composition ionique particulière (riche en ions K+), l’endolymphe (Figures 3A, C, D). Ces touffes ciliaires jouent le rôle de détecteurs des mouvements de ce liquide qui sont provoqués par l’onde sonore et les accélérations linéaire ou angulaire [24].
Une dissection génétique, fondée sur l’identification des gènes responsables de surdité neurosensorielle chez l’homme, associée à l’étude de modèles murins (obtenus par inactivation totale ou conditionnelle des gènes orthologues), a permis d’identifier un grand nombre de protéines jouant un rôle crucial dans les cellules sensorielles de l’oreille interne. Parmi celles-ci, les protéines défectueuses dans le syndrome de Usher7 se sont révélées être des constituants importants de complexes moléculaires impliqués dans la mise en place et le fonctionnement des touffes ciliaires [25]. Les protéines codées par les gènes identifiés dans le syndrome de Usher de type I participent ainsi à la machinerie moléculaire de la transduction mécano-électrique dans les cellules sensorielles de l’oreille interne [26]. L’application des techniques de spectrométrie de masse dans ce domaine devrait permettre d’identifier de nouveaux composants de cette machinerie, ou des modifications post-traductionnelles impliquées dans sa régulation. Néanmoins, le nombre réduit de cellules sensorielles dans l’oreille interne des modèles vertébrés (quelques milliers par oreille) rend difficile ces approches.
Certaines anémones de mer – dont Nematostella – possèdent des structures très semblables à celles retrouvées dans les cellules sensorielles de l’oreille interne des vertébrés (Figure 3A, B) [27, 28]. Comme chez les vertébrés, les cellules sensorielles des cnidaires présentent à leur apex des touffes ciliaires constituées de stéréocils, qui détectent et transmettent les vibrations liquidiennes. Ces systèmes permettent à l’animal de détecter les mouvements liquidiens engendrés par des proies qui nagent à proximité. En réponse à la stimulation des touffes ciliaires, les cellules sensorielles envoient un message neuronal aux cnidocytes, qui expulsent alors un filament et des toxines qui paralysent ces proies [29]. Des études de microscopie électronique à balayage ont révélé que la structure de ces touffes ciliaires était proche de celle des cellules sensorielles vestibulaires de l’oreille interne des vertébrés, et ces touffes étaient principalement localisées le long des tentacules (Figure 3B). Récemment, des expériences d’immunohistochimie utilisant des anticorps spécifiques des protéines humaines présentes dans ces touffes ciliaires, telles que la cadhérine 23, ont mis en évidence un immunomarquage, à la surface des tentacules de l’animal, semblable à celui observé dans l’oreille interne des vertébrés [28] (Figure 3C, D)8.
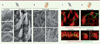 |
Figure 3. Structure et immuno-marquage de composants des touffes ciliaires des cellules sensorielles de l’oreille interne de souris et des tentacules d’anémone de mer. L’observation des touffes ciliaires, en microscopie électronique à balayage, montre des structures voisines dans l’oreille interne de mammifère, cochlée (organe de l’audition) ou vestibule (organes de l’équilibration) (A), et à la surface des tentacules des anémones de mer (B). Des marquages immunohistochimiques montrent que les touffes ciliaires des cellules sensorielles de l’oreille interne des souris (C) et des tentacules de Nematostella (D) sont constituées de microvillosités (stéréocils) emplies de filaments d’actine (révélés par la phalloïdine, en rouge), d’un kinocil composé de microtubules (marqués par un anticorps anti-tubuline, en vert), et expriment la cadhérine-23, un composant de la machinerie de mécanotransduction dans l’oreille interne des vertébrés (images non publiées © Vincent Michel). |
Chez la souris, l’inactivation du gène Pou4f3 codant Brn3c (brain-specific homeobox 3C) conduit, dès l’embryogenèse, à la mort des cellules sensorielles dans l’oreille interne [30, 31]. Chez Nematostella, l’inactivation d’un gène codant un facteur de transcription de la famille POU/Brn3 (NvPOU4) n’empêche pas la spécification initiale des différents types de cellules neurales et des cnidocytes. En revanche, les animaux NvPOU4 -/- sont dépourvus d’une sous-population de cellules nerveuses, les cellules Elav+ (embryonic lethal, abnormal vision), et de cnidocytes matures. NvPOU joue donc un rôle essentiel dans la différenciation terminale de plusieurs types de cellules neurales, dont les cnidocytes [32].
Si la physiologie des cellules sensorielles de Nematostella est encore mal connue et si les facteurs de transcription impliqués dans leur différenciation terminale restent à découvrir, les connaissances actuelles conduisent cependant à considérer ce cnidaire comme un modèle intéressant pour appréhender la composition, l’organisation et la régulation des complexes moléculaires participant à la mécano-transduction des cellules sensorielles de l’oreille interne, notamment le couplage de cette machinerie avec le maintien de la structure des stéréocils [33]. La facilité d’élevage de Nematostella dans les laboratoires permet l’accès à une grande quantité de matériel biologique, y compris de cellules sensorielles, auquel s’ajoute la possibilité de manipulations génétiques. Nematostella pourrait ainsi devenir un modèle utile pour tester certains candidats médicaments s’adressant à des formes de surdité humaine ayant pour origine des atteintes fonctionnelles des touffes ciliaires. La connaissance des mécanismes impliqués dans les propriétés de régénération cellulaire de cet organisme pourrait ainsi contribuer aux recherches qui visent à rétablir la capacité de régénération du neuroépithélium de l’oreille interne, perdue chez les mammifères.
Nematostella, un modèle pour comprendre la relation entre développement embryonnaire et régénération extrême
Nematostella est capable de régénérer son corps entier à partir de fragments. Cette capacité régénérative des cnidaires intrigue les observateurs depuis des siècles [5, 34] : elle serait potentiellement associée à une longévité extrême de l’animal, voire à son « immortalité ». Les modèles historiques à la base des observations sur la régénération extrême reposent sur l’hydre d’eau douce et sur la planaire [35]. Néanmoins, chez ces animaux, l’accès au matériel embryonnaire est limité, rendant le développement d’outils de génomique fonctionnelle fastidieux [36]. Ce verrou technique rend difficiles, voire impossibles, les études concernant des questions majeures, telles que la compréhension de la conservation, dans le processus de régénération, des mécanismes impliqués dans l’embryogenèse, ces deux processus aboutissant in fine à un même organisme fonctionnel [34]. La comparaison de ces deux processus développementaux permettrait en effet d’en découvrir les éléments communs et d’identifier des gènes ou des processus cellulaires et biochimiques spécifiques à chacun. Nematostella combine un ensemble d’atouts biologiques et technologiques qui la rendent très intéressante comme modèle d’étude de la régénération extrême et des trajectoires développementales [20, 37].
La régénération extrême chez Nematostella vectensis
À la suite d’un accident naturel, ou d’une amputation expérimentale, Nematostella peut reconstituer les parties manquantes de son corps (Figure 3A) [17, 38]. Contrairement à l’hydre, mais comme chez les vertébrés amphibiens, cette régénération implique une prolifération cellulaire [17, 38]. Sa vitesse dépend de la température de culture. Elle se réalise selon 4 étapes stéréotypées distinctes [38]. La chronologie précise des étapes morphologiques et tissulaires de la régénération, couplée aux outils permettant d’évaluer in vivo la cicatrisation et la reformation du pharynx, permettent d’évaluer de façon systématique les effets de perturbations (pharmacologiques, génétiques, environnementales, etc.) sur ce processus [38].
Les analyses de la capacité régénérative de diverses parties du corps de Nematostella ont révélé que les mésentères (ses organes reproducteurs et digestifs) sont nécessaires pour l’activation de la réponse régénérative [39]. En particulier, ces organes participent à l’activation de deux populations de cellules souches et à la reformation des structures manquantes après amputation (Figure 4B) ; l’absence des mésentères bloque le processus peu après la cicatrisation, inhibant l’ensemble de la dynamique cellulaire subséquente et la régénération [39].
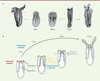 |
Figure 4. La régénération extrême chez Nematostella. A. La régénération orale après amputation sous-pharyngée chez Nematostella (ligne pointillée rouge) est achevée après 120 heures à 22 °C et restitue un organisme pleinement fonctionnel. Les animaux ont été fixés à différents moments au cours de la régénération et colorés à la phalloïdine pour indiquer les filaments d’actine (noirs). B.Modèle actuel du processus de régénération chez Nematostella. Après l’amputation sous le pharynx, une interaction physique entre les mésentères et les épithéliums du site d’amputation est requise pour déclencher la réponse régénérative. Cette réponse implique l’activation de deux populations de cellules souches (jaunes et bleues) qui migrent vers le site d’amputation, où elles se divisent activement et participent à la reformation des structures manquantes. hpa : heures post-amputation (d’après [38, 39]). |
Redéploiement de programme embryonnaire et identification de gènes spécifiques de la régénération extrême chez Nematostella
Très peu d’études se sont intéressées aux aspects moléculaires de la régénération chez Nematostella. La comparaison des transcriptomes des structures orales et aborales lors de leur régénération a cependant montré que, pour les étapes précoces, les gènes impliqués étaient différents selon le processus [40]. Dans une étude examinant les profils d’expression de gènes, soit au cours du développement embryonnaire, soit lors de la régénération, des différences subtiles ont été observées entre ces deux situations [41]. Considérant que le développement embryonnaire est activé par la fécondation d’une cellule totipotente, l’œuf, alors que la régénération est déclenchée dans une large population de cellules ayant différents degrés de différenciation par le stress physique dû à l’amputation, il n’est pas étonnant que la régénération ne soit pas une simple réactivation du processus de développement embryonnaire. Le processus de régénération doit en effet intégrer l’information du tissu différencié encore en place, de la position des cellules le long du corps de l’animal, et de la partie manquante, afin d’activer une réponse régénérative spécifique permettant la reformation exacte des cellules, des tissus ou des structures absentes, à intégrer aux parties existantes.
Pour tenter de comprendre dans quelle mesure la régénération reproduit le développement embryonnaire, et pour identifier les gènes spécifiques de la régénération impliqués dans le déclenchement et la coordination précise des processus cellulaires et morphologiques en cause, une étude récente [20, 37] a comparé les séquences issues de données de séquençage d’ARN (ARNseq) couvrant 16 stades de la régénération aux données de séquençage obtenues sur 28 stades du développement embryonnaire, larvaire et post-métamorphose9. Cette comparaison bioinformatique a montré que la régénération mobilise un processus de transcription relativement modeste comparé à celui de l’embryogenèse, avec un nombre de gènes activés au cours de l’embryogenèse supérieur de 90 % au nombre de ceux qui sont activés au cours de la régénération (Figure 4A) [37]. La régénération met également en place un réseau de régulation génique qui lui est spécifique. Cette différence entre les deux processus a été confirmée fonctionnellement par les études des voies de signalisation (MEK/ERK) activées, soit au cours du développement embryonnaire [42, 43], soit au cours de la régénération [37]. Parmi les gènes dont la dynamique transcriptionelle est spécifique au processus de régénération, certains correspondent, chez les bilatériens, aux gènes associés à la cicatrisation et à l’apoptose (Figure 4B). En utilisant un inhibiteur large des caspases (pan-caspase) [65] (→), le Z-Vad, il a été montré que l’apoptose n’est pas essentielle pour le développement embryonnaire ou la métamorphose. En revanche, elle est indispensable pour déclencher la régénération. L’inhibition de l’apoptose après amputation bloque en effet la régénération de façon très précoce, empêchant le rôle inducteur des mésentères dans l’activation de la prolifération cellulaire [37].
(→) Voir le numéro thématique Vieillissement et mort, m/s n° 12, décembre 2020, pages 1109-1212
Régénération extrême et longévité
Alors que certaines Nematostella sont cultivées dans les laboratoires depuis plus de 30 ans, aucun signe apparent de vieillissement ou de maladies liées à l’âge n’a été décrit à ce jour. À l’exception de certaines modifications morphologiques (comme le nombre de tentacules ou de mésentères) qui sont associées au développement post-métamorphique de l’animal, les seuls signes qui pourraient s’apparenter à un vieillissement sont l’assombrissement des gonades et la diminution de la quantité d’ovocytes produits, résultat d’une induction trop intense de la ponte [44]. Ce phénotype est néanmoins réversible en espaçant la périodicité de la ponte et en y associant un régime alimentaire particulier (Röttinger, données non publiées). Mais il ne s’agit là que d’observations ; la durée de vie, voire la longévité de cette anémone de mer, nécessitent encore d’être évaluées, comme cela a été fait avec l’hydre [45, 46]. Chez l’hydre, l’absence de mortalité, observée pendant plus de 8 ans, peut s’expliquer par un taux élevé de cellules souches en renouvellement constant et rapide, un nombre de types cellulaires réduit, un plan corporel simple et une lignée germinale qui n’est pas séparée du soma [46]. Chez Nematostella, le taux de cellules souches semble être bien plus faible que celui de l’hydre, comparable à celui des vertébrés [39] ; le renouvellement cellulaire varie selon l’état métabolique [17] ; le nombre de types cellulaires est plus important [12] ; l’organisation morphologique/anatomique est plus complexe que chez l’hydre (avec la présence d’un pharynx et de mésentères) ; et la lignée germinale est séparée du soma [14].
La seule espèce d’hydre utilisée en laboratoire et capable de se reproduire de façon sexuée, entre en sénescence dès l’induction de la formation de gamètes (sénescence post-reproductive [47]), suggérant l’existence d’un compromis (trade-off) entre longévité et reproduction sexuée, une idée dont la pertinence chez d’autres cnidaires, tels que Nematostella, nécessite cependant d’être examinée. Chez Nematostella, certaines observations semblent infirmer cette idée. Les animaux se reproduisant sexuellement en laboratoire ne présentent en effet pas d’augmentation de sénescence/mortalité. Il devient donc important de déterminer les taux de mortalité et de reproduction sexuée versus asexuée de Nematostella durant plusieurs années, afin de pouvoir évaluer précisément la longévité de cette anémone de mer.
Chez les vertébrés, les télomères sont importants dans le processus de vieillissement [65] (→).
(→) Voir le numéro thématique Vieillissement et mort, m/s n° 12, décembre 2020, pages 1109-1212
Leur intégrité dépend de l’activité d’une ADN polymérase spécifique, la télomérase. Les séquences télomériques, présentes aux extrémités des chromosomes de Nematostella, sont similaires en taille et en identité nucléotidique à celles des vertébrés, indiquant une forte conservation de ces séquences au cours de l’évolution [48]. La télomérase est une ribonucléoprotéine constituée de TERT, sa sous-unité protéique responsable de l’activité de transcription inverse, et TERC, un ARN qui sert de matrice pour la synthèse des séquences télomériques. Traut et al. [48] n’avaient initialement pas détecté d’activité télomérase dans des extraits totaux de Nematostella, suggérant la mobilisation du mécanisme alternatif de recombinaison ALT (alternative lengthening of telomeres) pour le maintien des télomères. Toutefois, des techniques plus sensibles nous ont permis d’observer une activité télomérase chez Nematostella (Carvalho et Röttinger, données non publiées). Ainsi, comme chez les vertébrés, la sous-unité TERT codée dans le génome de Nematostella semble impliquée dans la synthèse des séquences télomériques lors de la division cellulaire.
Chez l’homme, l’altération d’un des gènes codant un constituant de la télomérase se traduit, dès la première génération, par l’apparition d’un syndrome d’insuffisance médullaire appelé dyskératose congénitale ou syndrome de Zinsser-Cole-Engman [57] (→).
(→) Voir la Synthèse de C. Hoareau-Aveilla et al., m/s n° 4, avril 2008, page 390
Les patients présentent des anomalies de pigmentation cutanée, une dystrophie des ongles et des anomalies de la muqueuse buccale (leucoplasie). Les complications sont liées à l’insuffisance médullaire, à la fibrose pulmonaire et aux cancers, la médiane de survie étant de 42 ans [56]. La prédisposition au cancer semble être une conséquence du dysfonctionnement des télomères. Nematostella présente des télomères qui ont une taille similaire à celle des télomères humains (5-20kb), plus courte que celle des télomères de souris [48]. De par l’analogie de ces séquences télomériques (avec celles de l’homme), et grâce à l’accès à l’enzyme régulatrice TERT, Nematostella apparaît être un modèle de génomique fonctionnelle prometteur pour la biologie des télomères et pour comprendre pourquoi ce cnidaire présente une régénération extrême, une longévité accrue et l’absence de cancer, contrairement à l’homme.
Conclusion et perspectives
Le développement de modèles d’animaux marins non-conventionnels ayant des propriétés « extraordinaires » paraît essentiel à l’acquisition de connaissances fondamentales biomédicales. Nematostella en est un bel exemple. Ce modèle devrait permettre de comprendre certaines propriétés biologiques majeures, telles que la régénération entière du corps ou l’extrême longévité, absentes chez les organismes « modèles » classiques, et d’en déchiffrer les mécanismes cellulaires et moléculaires. L’intérêt de l’étude de Nematostella ne s’arrête pas à cette compréhension, ni même à celle de la diversité biologique et de l’évolution au sein des métazoaires. Il s’agit en effet d’utiliser ces propriétés et fonctions perdues au cours de l’évolution à des fins de recherche thérapeutique, par exemple, pour « vieillir en bonne santé ».
Bien que Nematostella paraisse un organisme marin « simple », l’analyse de son génome a permis de mettre en évidence sa grande complexité génétique, voisine de celle des vertébrés. Cette caractéristique, combinée aux fortes similitudes de certaines structures avec celles des vertébrés (par exemple les stéréocils impliqués dans la mécanotransduction liquidienne), au développement d’outils de génomique fonctionnelle de plus en plus performants, et à la facilité d’accès à ce matériel biologique, invite à une utilisation accrue de cette anémone de mer, par exemple pour comprendre, à l’échelle moléculaire, le fonctionnement des cellules sensorielles auditives, une exploration qui se heurte à l’obstacle que constitue le faible nombre de ces cellules chez les vertébrés. L’intérêt d’un criblage à haut débit de substances ayant un effet préventif ou curatif dans certaines maladies, devrait également être envisagé.
Un autre intérêt de l’utilisation de ce modèle est de permettre de réduire l’expérimentation sur les vertébrés, en conformité avec les règles édictées par la directive européenne, qui impose le principe des 3R (Réduction – Raffinement – Remplacement). Le développement en laboratoire de l’entièreté du cycle de vie de ce nouveau modèle, qui comporte une fécondation inductible, et d’outils moléculaires puissants, permettra ainsi les recherches fondamentales et comparatives, tout en préservant la population naturelle de l’espèce.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
L’ensemble de ces données sont disponibles pour la communauté scientifique dans une banque de données dédiée, NvERTx (http://nvertx.ircan.org) [20].
Références
- Dunn CW, Hejnol A, Matus DQ, et al. Broad phylogenomic sampling improves resolution of the animal tree of life. Nature 2008 ; 452 : 745–749. [CrossRef] [PubMed] [Google Scholar]
- Technau U, Steele RE. Evolutionary crossroads in developmental biology: Cnidaria. Development 2011 ; 138 : 1447–1458. [PubMed] [Google Scholar]
- Babonis LS, Martindale MQ, Ryan JF. Do novel genes drive morphological novelty? An investigation of the nematosomes in the sea anemone Nematostella vectensis. BMC Evol Biol 2016 ; 16 : 114. [CrossRef] [PubMed] [Google Scholar]
- Holstein T, Tardent P. An ultrahigh-speed analysis of exocytosis: nematocyst discharge. Science 1984 ; 223 : 830–833. [Google Scholar]
- Trembley A. Mémoires pour servir à l’histoire d‘un genre de polypes d’eau douce, à bras en forme de cornes. Leiden : Verbeek JH, 1744 : 404 p. [Google Scholar]
- Hand C, Uhlinger KR. The culture, sexual and asexual reproduction, and growth of the sea anemone Nematostella vectensis. Biol Bull 1992 ; 182 : 169–176. [CrossRef] [PubMed] [Google Scholar]
- Layden MJ, Rentzsch F, Röttinger E. The rise of the starlet sea anemone Nematostella vectensis as a model system to investigate development and regeneration. WIREs Dev Biol 2016 ; 5 : 408–428. [CrossRef] [Google Scholar]
- Amiel A, Chang P, Momose T, Houliston E. Clytia hemisphaerica: a cnidarian model for studying oogenesis. In: Verlhac MH, Villeneuve A eds. Oogenesis: the universal process. NewYork :Wiley, 2010 : 82–101. [Google Scholar]
- DuBuc TQ, Schnitzler CE, Chrysostomou E, et al. Transcription factor AP2 controls cnidarian germ cell induction. Science 2020; 367 : 757–62. [Google Scholar]
- Hand C, Uhlinger KR. The unique, widely distributed, estuarine sea anemone, Nematostella vectensis, Stephenson: a review, new facts, and questions. Estuaries 1994 ; 17 : 501. [CrossRef] [Google Scholar]
- Steinmetz PRH, Aman A, Kraus JEM, Technau U. Gut-like ectodermal tissue in a sea anemone challenges germ layer homology. Nat Ecol Evol 2017 ; 1 : 1–8. [CrossRef] [PubMed] [Google Scholar]
- Sebé-Pedrós A, Saudemont B, Chomsky E, et al. Cnidarian cell type diversity and regulation revealed by whole-organism single-cell RNA-Seq. Cell 2018 ; 173 : 1520. [CrossRef] [PubMed] [Google Scholar]
- Nakanishi N, Renfer E, Technau U, Rentzsch F. Nervous systems of the sea anemone Nematostella vectensis are generated by ectoderm and endoderm and shaped by distinct mechanisms. Development 2012 ; 139 : 347–357. [PubMed] [Google Scholar]
- Hand C, Uhlinger KR. The culture, sexual and asexual reproduction, and growth of the sea anemone Nematostella vectensis. Biol Bull 1992 ; 182 : 169–176. [CrossRef] [PubMed] [Google Scholar]
- Hand C, Uhlinger KR. Asexual reproduction by transverse fission and some anomalies in the sea anemone Nematostella vectensis. Invertebr Biol 1995 ; 114 : 9. [Google Scholar]
- Ormestad M, Martindale M, Rottinger E. A comparative gene expression database for invertebrates. EvoDevo 2011 ; 2 : 17. [CrossRef] [PubMed] [Google Scholar]
- Passamaneck YJ, Martindale MQ. Cell proliferation is necessary for the regeneration of oral structures in the anthozoan cnidarian Nematostella vectensis. BMC Dev Biol 2012 ; 12 : 1. [CrossRef] [PubMed] [Google Scholar]
- Putnam NH, Srivastava M, Hellsten U, et al. Sea anemone genome reveals ancestral eumetazoan gene repertoire and genomic organization. Science 2007 ; 317 : 86–94. [Google Scholar]
- Schwaiger M, Schonauer A, Rendeiro AF, et al. Evolutionary conservation of the eumetazoan gene regulatory landscape. Genome Research 2014 ; 24 : 639–650. [CrossRef] [PubMed] [Google Scholar]
- Warner JF, Guerlais V, Amiel AR, et al. NvERTx: a gene expression database to compare embryogenesis and regeneration in the sea anemone Nematostella vectensis. Development 2018 ; 145 : 162867. [Google Scholar]
- Genikhovich G, Technau U. The starlet sea anemone Nematostella vectensis: an anthozoan model organism for studies in comparative genomics and functional evolutionary developmental biology. Cold Spring Harb Protoc 2009 ; 9 : 129–129. [Google Scholar]
- Ikmi A, McKinney SA, Delventhal KM, Gibson MC. TALEN and CRISPR/Cas9-mediated genome editing in the early-branching metazoan Nematostella vectensis. Nat Commun 2014 ; 5 : 5486. [Google Scholar]
- Tal Y, Ayalon A, Sharaev A, et al. Continuous drug release by sea anemone Nematostella vectensis stinging microcapsules. Marine Drugs 2014 ; 12 : 734–745. [CrossRef] [PubMed] [Google Scholar]
- Pepermans E, Michel V, Goodyear R, et al. The CD2 isoform of protocadherin-15 is an essential component of the tip-link complex in mature auditory hair cells. EMBO Mol Med 2014 ; 6 : 984–992. [Google Scholar]
- Michalski N, Petit C. Genes involved in the development and physiology of both the peripheral and central auditory systems. Annu Rev Neurosci 2019 ; 42 : 67–86. [CrossRef] [PubMed] [Google Scholar]
- Richardson GP, Petit C. Hair-bundle links: genetics as the gateway to function. Cold Spring Harb Perspect Med 2019 ; 9 : a033142. [Google Scholar]
- Watson GM, Mire P, Hudson RR. Hair bundles of sea anemones as a model system for vertebrate hair bundles. Hear Res 1997 ; 107 : 53–66. [CrossRef] [PubMed] [Google Scholar]
- Watson GM, Pham L, Graugnard EM, Mire P. Cadherin 23-like polypeptide in hair bundle mechanoreceptors of sea anemones. J Comp Physiol A Neuroethol Sens Neural Behav Physiol 2008 ; 194 : 811–820. [CrossRef] [PubMed] [Google Scholar]
- Watson GM, Mire P, Kinler KM. Mechanosensitivity in the model sea anemone Nematostella vectensis. Marine Biology 2009 ; 156 : 2129–2137. [Google Scholar]
- Erkman L, McEvilly RJ, Luo L, et al. Role of transcription factors Brn-3.1 and Brn-3.2 in auditory and visual system development. Nature 1996 ; 381 : 603–606. [CrossRef] [PubMed] [Google Scholar]
- Xiang M, Gan L, Li D, et al. Essential role of POU-domain factor Brn-3c in auditory and vestibular hair cell development. Proc Natl Acad Sci USA 1997 ; 94 : 9445–9450. [CrossRef] [Google Scholar]
- Tournière O, Dolan D, Richards GS, et al. NvPOU4/brain3 functions as a terminal selector gene in the nervous system of the cnidarian Nematostella vectensis. Cell Rep 2020; 30 : 4473–5. [CrossRef] [PubMed] [Google Scholar]
- Caberlotto E, Michel V, Foucher I, et al. Usher type 1G protein sans is a critical component of the tip-link complex, a structure controlling actin polymerization in stereocilia. Proc Natl Acad Sci USA 2011 ; 108 : 5825–5830. [CrossRef] [Google Scholar]
- Morgan TH. Columbia university biological series: regeneration. New York: Macmillan, 1901 : 316 p [Google Scholar]
- Siebert S, Farrell JA, Cazet JF, et al. Stem cell differentiation trajectories in Hydra resolved at single-cell resolution. Science 2019; 365 : eaav9314. [Google Scholar]
- Wittlieb J, Khalturin K, Lohmann JU, et al. Transgenic Hydra allow in vivo tracking of individual stem cells during morphogenesis. Proc Natl Acad Sci USA 2006 ; 103 : 6208–6211. [CrossRef] [Google Scholar]
- Warner JF, Amiel AR, Johnston H, Röttinger E. Regeneration is a partial redeployment of the embryonic gene network. BioRxiv 2019; 658930. doi: https://doi.org/10.1101/658930. [Google Scholar]
- Amiel AR, Johnston HT, Nedoncelle K, et al. Characterization of morphological and cellular events underlying oral regeneration in the sea anemone. Nematostella vectensis. Int J Mol Sci 2015 ; 16 : 28449–28471. [CrossRef] [Google Scholar]
- Amiel AR, Foucher K, Ferreira S, Röttinger E. Synergic coordination of stem cells is required to induce a regenerative response in anthozoan cnidarians. BioRxiv 2019; 891804. doi: https://doi.org/10.1101/2019.12.31.891804. [Google Scholar]
- Schaffer AA, Bazarsky M, Levy K, et al. A transcriptional time-course analysis of oral vs. aboral whole-body regeneration in the sea anemone Nematostella vectensis. BMC Genomics 2016 ; 17 : 718. [CrossRef] [PubMed] [Google Scholar]
- Burton PM, Finnerty JR. Conserved and novel gene expression between regeneration and asexual fission in Nematostella vectensis. Dev Genes Evol 2009 ; 219 : 79–87. [CrossRef] [PubMed] [Google Scholar]
- Layden MJ, Johnston H, Amiel AR, et al. MAPK signaling is necessary for neurogenesis in Nematostella vectensis. BMC Biol 2016 ; 14 : 61. [CrossRef] [PubMed] [Google Scholar]
- Amiel AR, Johnston H, Chock T, et al. A bipolar role of the transcription factor ERG for cnidarian germ layer formation and apical domain patterning. Dev Biol 2017 ; 430 : 346–361. [CrossRef] [PubMed] [Google Scholar]
- Fritzenwanker JH, Technau U. Induction of gametogenesis in the basal cnidarian Nematostella vectensis (Anthozoa). Dev Genes Evol 2002 ; 212 : 99–103. [CrossRef] [PubMed] [Google Scholar]
- Martínez DE. Mortality patterns suggest lack of senescence in hydra. Exp Gerontol 1998 ; 33 : 217–225. [CrossRef] [PubMed] [Google Scholar]
- Schaible R, Scheuerlein A, Dan΄ko MJ, et al. Constant mortality and fertility over age in Hydra. Proc Natl Acad Sci USA 2015 ; 112 : 15701–15706. [CrossRef] [Google Scholar]
- Yoshida K, Fujisawa T, Hwang JS, et al. Degeneration after sexual differentiation in hydra and its relevance to the evolution of aging. Gene 2006 ; 385 : 64–70. [Google Scholar]
- Traut W, Szczepanowski M, Vítková M, et al. The telomere repeat motif of basal metazoa. Chromosome Res 2007 ; 15 : 371–382. [PubMed] [Google Scholar]
- Shay JW, Pereira-Smith OM, Wright WE. A role for both RB and p53 in the regulation of human cellular senescence. Exp Cell Res 1991 ; 196 : 33–39. [CrossRef] [PubMed] [Google Scholar]
- Counter CM, Avilion AA. Telomere shortening associated with chromosome instability is arrested in immortal cells which express telomerase activity. EMBO J 1992 ; 11 : 1921–1929. [PubMed] [Google Scholar]
- Shay JW. Role of telomeres and telomerase in aging and cancer. Cancer Discovery 2016 ; 6 : 584–593. [CrossRef] [PubMed] [Google Scholar]
- Bodnar AG, Ouellette M, Frolkis M, et al. Extension of lifespan by introduction of telomerase into normal human cells. Science 1998 ; 279 : 349–352. [Google Scholar]
- Ding Z, Wu CJ, Jaskelioff M, et al. Telomerase reactivation following telomere dysfunction yields murine prostate tumors with bone metastases. Cell 2012 ; 148 : 896–907. [CrossRef] [PubMed] [Google Scholar]
- Blasco MA, Lee HW, Hande MP, et al. Telomere shortening and tumor formation by mouse cells lacking telomerase RNA. Cell 1997 ; 91 : 25–34. [CrossRef] [PubMed] [Google Scholar]
- Lee HW, Blasco MA, Gottlieb GJ, et al. Essential role of mouse telomerase in highly proliferative organs. Nature 1998 ; 392 : 569–574. [CrossRef] [PubMed] [Google Scholar]
- Alter BP, Giri N, Savage SA, Rosenberg PS. Cancer in dyskeratosis congenita. Blood 2009 ; 113 : 6549–6557. [Google Scholar]
- Hoareau-Aveilla C, Henry Y, Leblanc T. La dyskératose congénitale : une maladie méconnue due à un maintien défectueux des télomères. Med Sci (Paris) 2008 ; 24 : 390–398. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Röttinger E, Dahlin P, Martindale MQ. A framework for the establishment of a cnidarian gene regulatory network for endomesoderm specification: the inputs of b-catenin/TCF signaling. PLoS Genet 2012 ; 8 : e1003164. [CrossRef] [PubMed] [Google Scholar]
- Layden MJ, Röttinger E, Wolenski FS, et al. Microinjection of mRNA or morpholinos for reverse genetic analysis in the starlet sea anemone. Nematostella vectensis. Nat Protoc 2013 ; 8 : 924–934. [CrossRef] [Google Scholar]
- Wikramanayake AH, Hong M, Lee NP, et al. An ancient role for nuclear beta-catenin in the evolution of axial polarity and germ layer segregation. Nature 2003 ; 426 : 446–450. [CrossRef] [PubMed] [Google Scholar]
- Zimmerman B, Robb M.C.S., Genikhovich G, et al. Sea anemone genomes reveal ancestral metazoan chromosomal macrosynteny. BioRxiv 2020; 359448. doi: https://doi.org/10.1101/2020.10.30.359448. [Google Scholar]
- Magie CR, Daly M, Martindale MQ. Gastrulation in the cnidarian Nematostella vectensis occurs via invagination not ingression. Dev Biol 2007 ; 305 : 483–497. [CrossRef] [PubMed] [Google Scholar]
- Renfer E, Amon-Hassenzahl A, Steinmetz PRH, Technau U. A muscle-specific transgenic reporter line of the sea anemone Nematostella vectensis. Proc Natl Acad Sci USA 2010 ; 107 : 104–108. [CrossRef] [Google Scholar]
- Tulin S, Aguiar D, Istrail S, Smith J. A quantitative reference transcriptome for Nematostella vectensis early embryonic development: a pipeline for de novo assembly in emerging model systems. EvoDevo 2013 ; 4 : 16. [CrossRef] [PubMed] [Google Scholar]
- Vieillissement et mort : de la cellule à l’individu. Med Sci (Paris) 2020 : 36 : 1109–212. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des tableaux
Liste des techniques, ressources et outils pour la culture et la génomique fonctionnelle de Nematostella vectensis.
Liste des figures
 |
Figure 1. Phyolgénie simplifiée des métazoaires (animaux). A. Phylogénie des métazoaires, mettant en évidence la position clé des cnidaires en tant que groupe sœur des animaux bilatériens. La position des cténophores et porifères à l’extérieur des bilatériens reste controversée (lignes en pointillés). B. Phylogénie des cnidaires, illustrant les relations entre les principaux groupes (figure modifiée à partir de [11]). |
| Dans le texte | |
 |
Figure 2. L’anémone de mer Nematostella vectensis (Cnidaria, Anthozoa). A. Image d’un polype adulte de Nematostella. (*) bouche, (ten) tentacules, (pha) pharynx, (mes) mésentères, (phy) physa. B.Représentation schématique des trajectoires développementales de Nematostella : Développement embryonnaire, régénération, bourgeonnement et décroissance/re-croissance (figure modifiée à partir de [11]). |
| Dans le texte | |
 |
Figure 3. Structure et immuno-marquage de composants des touffes ciliaires des cellules sensorielles de l’oreille interne de souris et des tentacules d’anémone de mer. L’observation des touffes ciliaires, en microscopie électronique à balayage, montre des structures voisines dans l’oreille interne de mammifère, cochlée (organe de l’audition) ou vestibule (organes de l’équilibration) (A), et à la surface des tentacules des anémones de mer (B). Des marquages immunohistochimiques montrent que les touffes ciliaires des cellules sensorielles de l’oreille interne des souris (C) et des tentacules de Nematostella (D) sont constituées de microvillosités (stéréocils) emplies de filaments d’actine (révélés par la phalloïdine, en rouge), d’un kinocil composé de microtubules (marqués par un anticorps anti-tubuline, en vert), et expriment la cadhérine-23, un composant de la machinerie de mécanotransduction dans l’oreille interne des vertébrés (images non publiées © Vincent Michel). |
| Dans le texte | |
 |
Figure 4. La régénération extrême chez Nematostella. A. La régénération orale après amputation sous-pharyngée chez Nematostella (ligne pointillée rouge) est achevée après 120 heures à 22 °C et restitue un organisme pleinement fonctionnel. Les animaux ont été fixés à différents moments au cours de la régénération et colorés à la phalloïdine pour indiquer les filaments d’actine (noirs). B.Modèle actuel du processus de régénération chez Nematostella. Après l’amputation sous le pharynx, une interaction physique entre les mésentères et les épithéliums du site d’amputation est requise pour déclencher la réponse régénérative. Cette réponse implique l’activation de deux populations de cellules souches (jaunes et bleues) qui migrent vers le site d’amputation, où elles se divisent activement et participent à la reformation des structures manquantes. hpa : heures post-amputation (d’après [38, 39]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




