| Issue |
Med Sci (Paris)
Volume 32, Number 4, Avril 2016
|
|
|---|---|---|
| Page(s) | 353 - 361 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20163204013 | |
| Published online | 02 May 2016 | |
L’immunothérapie au service de la chimiothérapie, de nouvelles avancées
The interplay of immunotherapy and chemotherapy, a novel approach
Laboratoire d’Immunobiologie, Université Libre de Bruxelles, Rue des Professeurs Jeener et Brachet, 12 6041 Gosselies, Belgique
De nombreuses évidences expérimentales obtenues ces dernières années mettent en évidence le rôle majeur de l’immunosurveillance des tumeurs. Le système immunitaire reconnaît les tumeurs et peut provoquer leur rejet, mais il est freiné par des mécanismes d’échappement induits par la tumeur elle-même. De façon intéressante, l’efficacité de la chimiothérapie semble dépendre de la réponse immunitaire qui est elle-même potentialisée par les traitements chimiques, créant une boucle de rétroaction positive qui peut conduire à une résistance antitumorale à long terme. Dans cette revue, nous résumons certains mécanismes créant une synergie entre chimio- et immunothérapie.
Abstract
In the last decade, a growing body of evidence has highlighted the major role of cancer immunosurveillance. The immune system can recognize tumor cells and keep them under check for long period of time, but is impeded by escape mechanisms induced by the tumor itself. Interestingly, the efficacy of chemotherapy has been shown to depend on the immune response, which in turn is potentiated by chemical agents, creating a positive feedback loop leading to long term tumor resistance. In this review, we summarize some mechanisms underlying the synergy between chemo- and immuno-therapy.
© 2016 médecine/sciences – Inserm
Les débuts de la chimiothérapie
Le développement des traitements chimiothérapeutiques a connu son essor lors de la Seconde Guerre mondiale. En effet, l’ypérite, mieux connu sous le nom de gaz moutarde à cause de son odeur, et qui tire son nom de la ville d’Ypres en Belgique où elle fût utilisée pour la première fois durant la Grande Guerre, a servi de base aux recherches réalisées à l’université de Yale aux États-Unis [1] en 1943, mais publiées seulement en 1946 pour cause de secret de guerre, qui ont montré la régression de lymphomes à la suite de l’administration de moutarde azotée chez des patients. Ces résultats ont conduit au développement des premiers agents alkylants, incluant des dérivés oraux, comme le cyclophosphamide1 [2].
Le système immunitaire, un acteur clé dans le succès des chimiothérapies
Les premiers travaux réalisés in vitro ou dans des modèles d’animaux immunodéprimés ont suggéré que les agents chimiothérapeutiques cytotoxiques agissaient essentiellement de façon autonome : ils induisent la mort cellulaire en impactant directement ou indirectement l’ADN, l’ARN ou les protéines nécessaires à la division cellulaire, en ajoutant des groupements alkyles aux bases guanines de l’ADN, en interférant avec les enzymes topoisomérases, ou encore en agissant comme analogue des bases azotées ( Tableau I ). Parmi les différents agents cytotoxiques, les agents alkylants sont dits « cycle-dépendants » : ils n’altèrent que des cellules engagées dans le cycle cellulaire, faisant des cellules tumorales une cible privilégiée étant donnée leur capacité de prolifération rapide [3].
Des études récentes ont cependant clairement démontré que le succès des traitements chimiothérapeutiques ne dépend pas uniquement de leur action cytotoxique mais repose également sur la contribution du système immunitaire ( Tableau I ). Une des premières observations a été réalisée en 2007 par l’équipe d’Albelda. Il a montré que le traitement à la gemcitabine inhibait la croissance de tumeurs préétablies et que cet effet ne corrélait pas avec la sensibilité de la tumeur à l’agent chimiothérapeutique in vitro, mais avec son immunogénicité in vivo. L’effet antitumoral du traitement était, de plus, abrogé dans des souris « nude athymiques » dépourvues de lymphocytes T [4]. Ces résultats ont été confirmés dans différents modèles tumoraux par le groupe de Zitvogel, qui a identifié les conditions requises pour créer une mort « immunogénique » : (1) l’expression par les cellules tumorales d’une molécule qui favorise sa capture par les cellules dendritiques (sentinelles du système immunitaire qui initient la réponse), telle la calréticuline ; (2) l’expression de signaux de danger, comme HMGB1 (high-mobility group box 1), qui induisent la maturation des cellules dendritiques et optimisent, dès lors, la présentation antigénique ; (3) l’immunocompétence de l’hôte et, en particulier, sa capacité à reconnaître les cellules tumorales mourantes et à activer une réponse immunitaire de type cytotoxique (pour revue voir [5]). Une question importante est de savoir si le rejet chimioinduit des tumeurs endogènes (donc non transplantées) fait également intervenir le système immunitaire ou si ces observations sont, en fait, restreintes aux tumeurs murines transplantées. Certaines évidences suggèrent que le pronostic, après un traitement chimiothérapeutique, est plus favorable chez les patients présentant une réponse immunitaire efficace [6] et que l’infiltrat avant traitement est un facteur prédictif du résultat clinique (pour revue, voir [7]). L’existence d’une synergie entre chimiothérapie et immunité semble donc également possible dans le cas de tumeurs spontanées.
La réponse immune antitumorale induite par la chimiothérapie pourrait reposer sur la combinaison de plusieurs mécanismes.
1. Certains agents chimiothérapeutiques induisent la mort cellulaire immunogénique des tumeurs. Elles libèrent alors différents médiateurs solubles comme l’ATP (adénosine triphosphate) ou la protéine nucléaire HMGB1, reconnus par des récepteurs (respectivement P2RX7 [purinergic receptor P2X, ligand-gated ion channel, 7] et TLR4 [toll-like receptor 4]) exprimés à la surface des cellules dendritiques, conduisant ainsi à une augmentation de la présentation d’antigènes associés aux tumeurs [5]. Cette augmentation qualitative de la présentation des antigènes tumoraux peut être associée à un accroîssement du nombre de cellules présentatrices d’antigène résultant probablement du contexte inflammatoire [8, 9].
2. La lymphopénie, engendrée par le traitement, peut induire une prolifération homéostatique (faisant suite à une déficience du compartiment des cellules T) et donc l’expansion de ces cellules, provoquée par des taux élevés des cytokines homéostatiques, IL(interleukine)-7 et IL-15. Cette expansion pourrait concerner les lymphocytes T pré-activés qui ont déjà rencontré l’antigène dont ils sont spécifiques, comme les lymphocytes spécifiques de la tumeur. Une contraction du répertoire lymphocytaire, due à une diminution de la thymopoièse, est associée à une réorientation des cellules en prolifération vers un phénotype activé/mémoire qui présente une fonction effectrice ou est capable de répondre rapidement en présence du même antigène [10]. Nos résultats, en accord avec ces observations, mettent en évidence une augmentation de la proportion de lymphocytes T CD8+ spécifiques de la tumeur après chimiothérapie et, parmi ces cellules, de lymphocytes spécifiques de l’antigène tumoral « muté » (P815E, antigène codé par le gène P1E présentant une mutation ponctuelle)2 aux dépens de l’antigène qui est codé par un gène non muté (P815A). Ce changement de répertoire pourrait résulter de différences d’activation des lymphocytes T, d’affinité des TCR (T cell receptor), d’expression de molécules inhibitrices, etc. Jackaman et al. ont par ailleurs montré que la chimiothérapie peut révéler des antigènes tumoraux sous-dominants contre lesquels une réponse n’est induite qu’après un traitement [11]. L’ensemble de ces observations suggèrent une action directe (indépendante de la présentation des antigènes tumoraux) du traitement chimiothérapeutique sur l’activation des lymphocytes T.
3. La chimiothérapie pourrait stimuler indirectement le recrutement de cellules effectrices spécifiques au sein de la tumeur. En effet, Hong et al. ont montré dans un modèle de souris Rag1-/- (dépourvues de lymphocytes T et B) porteuses de mélanome, qu’un traitement chimiothérapeutique augmente l’expression des chimiokines CCL5 (chemokine [C-C motif] ligand 5), CXCL(chemokine [C-X-C motif] ligand) 9 et CXCL10 dans la tumeur, et accroît l’infiltration de lymphocytes T transférés. Chez des patients atteints de mélanome, ces chimiokines sont également augmentées dans les lésions qui sont sensibles à la chimiothérapie [12]. Nos résultats révèlent aussi une forte augmentation du pourcentage de cellules T CD8+ spécifiques qui infiltrent la tumeur dans les souris traitées avec le cyclophosphamide. Cette infiltration est corrélée avec l’expression accrue des chimiokines CXCL9, CXCL10 et CXCL11 au sein de la tumeur. Elle requiert d’une part, l’expression du récepteur CXCR3 (C-X-C chemokine receptor type 3) par les lymphocytes T CD8+ et, d’autre part, la présence de lymphocytes T auxiliaires CD4+. Bien que le mécanisme initiant la synthèse des chimiokines ne soit pas élucidé, l’augmentation de leur production pourrait être reliée à une réaction inflammatoire impliquant les lymphocytes T CD4+ [9].
4. Le traitement peut prévenir la fonction suppressive de certaines populations cellulaires du système immunitaire (voir plus loin - § Mécanismes d’échappement).
L’ensemble de ces observations montre qu’un traitement chimiothérapeutique peut potentialiser la présentation des antigènes tumoraux. Il permet également de favoriser l’activation des lymphocytes T et leur migration au sein de la tumeur (Figure 1).
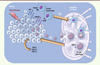 |
Figure 1. Modèle d’activation d’une réponse immunitaire spécifique en réponse à un traitement chimiothérapeutique. Modèle fondé sur des données de la littérature et des résultats obtenus par notre équipe. Des DAMP (damage/danger-associated molecular pattern), molécules de stress telles que l’ATP ou l’HMGB1 (high–mobility group box 1 protein), sont libérées dans l’environnement par les cellules tumorales mourantes suite à l’effet cytotoxique d’une chimiothérapie. 1 . Ces molécules sont reconnues par des récepteurs exprimés à la surface des cellules dendritiques, comme le récepteur purinergique P2RX7 (purinergic receptor P2X, ligand-gated ion channel, 7) ou le TLR4 (toll-like receptor 4). 2 . Cette reconnaissance est déterminante pour l’induction de la maturation des cellules dendritiques et leur migration vers les ganglions drainants. 3 . Au sein de cet organe lymphoïde, les cellules dendritiques présentent les antigènes de la tumeur aux lymphocytes T (LT) spécifiques, déclenchant ainsi leur activation et leur prolifération. 4 . Cette activation, ainsi que la libération de chimiokines (telles que CXCL [chemokine (C-X-C motif) ligand] 9, CXCL10 et CXCL11) dans l’environnement tumoral à la suite de la chimiothérapie, entraînent la migration vers la tumeur des cellules T CD8+ spécifiques qui expriment à leur surface le récepteur spécifique aux chimiokines (le CXCR3 [chemokine (C-X-C motif) receptor 3]). |
Classification des différents types d’agents chimiothérapeutiques selon leur mécanisme d’action.
Rôle de surveillance du système immunitaire
La découverte des premiers antigènes tumoraux par l’équipe de Thierry Boon en 1982, a ouvert la voie à la vaccination antitumorale [13]. Depuis, plusieurs types d’antigènes tumoraux ont été décrits. Ils peuvent être codés par des gènes mutés (antigènes spécifiques des tumeurs) ou non mutés (antigènes associés aux tumeurs) (Tableau II). Il est important de souligner que le système immunitaire semble jouer un rôle de surveillance des tumeurs en formation, avant même l’apparition des premiers signes cliniques. Ceci est soutenu par l’augmentation du nombre de tumeurs que l’on observe chez des patients immunodéprimés et chez des souris qui présentent une déficience immunitaire. Chez l’homme, il a en effet été montré que des patients immunodéprimés, infectés par le VIH (virus de l’immunodéficience humaine) et des patients transplantés après immunosuppression, ont une incidence élevée de cancer. La comparaison, dans une large cohorte, des types de cancers développés par ces deux populations de patients, a permis de conclure que le risque était semblable quelle que soit l’origine de l’immunosuppression et concernait majoritairement des cancers liés à une infection. La similitude du risque conforte donc le rôle majeur de l’immunodéficience et non de l’infection par le VIH dans l’incidence accrue des cancers chez ces patients [14].
Description des différents types d’antigènes tumoraux.
Dans le modèle murin, Robert Schreiber et ses collaborateurs ont rapporté que des souris qui ne possèdent pas de lymphocytes T, développent plus précocement, et à une fréquence plus élevée, des tumeurs induites par le méthylcholantrène (un agent carcinogène) que des souris sauvages [15]. En utilisant ce modèle murin de carcinogenèse chimique, ces auteurs ont démontré que le système immunitaire peut contrôler pendant de longues périodes la croissance tumorale (phase d’équilibre). Ils ont également identifié les facteurs immuns requis pour ce contrôle, en particulier les lymphocytes T CD4+ et CD8+, ainsi que l’IFN(interféron)-γ [16].
Mécanismes d’échappement
De nombreuses observations suggèrent qu’une réponse immunitaire est fréquemment induite chez des patients, ou des rongeurs, atteints de tumeurs. Ainsi, l’activation de lymphocytes T CD8+ cytotoxiques a été mise en évidence dans les organes lymphoïdes de patients atteints de mélanome [17]. Cependant, il est nécessaire que ces cellules tueuses migrent vers la tumeur et soient aptes à lyser les cellules tumorales. Il existe de nombreux freins immunologiques qui inhibent la réponse immunitaire antitumorale, contribuant ainsi à l’échappement des tumeurs [18].
Les lymphocytes T régulateurs
Une déficience, ou une dysfonction, de lymphocytes T régulateurs provoque des maladies auto-immunes comme les syndromes « scurfy », chez la souris, et « IPEX » (immunodysregulation polyendocrinopathy enteropathy X-linked syndrome), chez l’homme, (tous deux dus à des mutations liés au chromosome X), soulignant le rôle indispensable de ces cellules régulatrices dans le maintien de la tolérance du soi. Les lymphocytes T régulateurs thymiques se développent dans le thymus et sont présents naturellement après la naissance. En revanche, les lymphocytes T régulateurs périphériques se différencient à partir des lymphocytes T naïfs, dans un environnement cytokinique suppresseur. Ces cellules (probablement les deux sous-populations) sont capables d’infiltrer de nombreuses tumeurs, attirées en particulier par la chimiokine CCL22 dont elles présentent le récepteur, CCR4 (C-C chemokine receptor type 4), où elles suppriment l’activation des lymphocytes spécifiques des antigènes. Chez la souris naïve, l’injection d’un anticorps anti-CD25 (CD25 est la sous-unité alpha du récepteur à l’IL-2 exprimée par les lymphocytes T régulateurs) permet d’éliminer sélectivement les lymphocytes T régulateurs thymiques et peut conduire au rejet des tumeurs. Chez l’homme, l’éradication de ces cellules est rendue complexe, l’expression de CD25 étant partagée par les lymphocytes T effecteurs. Cependant, d’autres approches permettant leur élimination sont en développement [19].
En 1989, Awwad et North ont montré qu’une seule dose de cyclophosphamide pour le traitement de souris porteuses d’un lymphome favorisait l’élimination des cellules T régulatrices et restaurait l’activité des cellules T effectrices antitumorales et donc le rejet de la tumeur [20]. L’injection d’une faible dose de cyclophosphamide, outre l’élimination sélective des cellules T régulatrices, est également associée à la perte des fonctions immunosuppressives de ces cellules, probablement en modulant l’expression de GITR (glucocorticoid-induced TNFR family related gene) et Foxp3 (forkhead box p3), tous deux spécifiques des lymphocytes T régulateurs [21].
Différentes observations ont confirmé que le cyclophosphamide pouvait affecter sélectivement les lymphocytes T régulateurs humains. En effet, chez des patients atteints d’un cancer rénal, une seule dose de cyclophosphamide (300 mg/m²) permet de diminuer d’environ 20 % (après 3 jours) le nombre de cellules T régulatrices (sans modifier la quantité de lymphocytes T conventionnels) et, en parallèle, les cellules en prolifération [22]. Le cyclophosphamide améliore également l’effet d’un vaccin antitumoral, constitué de plusieurs peptides tumoraux, prolongeant ainsi significativement la vie des patients. Un traitement « métronomique », utilisant de faibles doses de cyclophosphamide, diminue également le nombre et la fonction des lymphocytes T régulateurs chez les patients cancéreux à un stade avancé et favorise un meilleur contrôle de la progression tumorale [23]. La sensibilité des lymphocytes T régulateurs au cyclophosphamide pourrait être liée à une réduction du niveau intracellulaire d’ATP et, par conséquent, à une diminution de la production cytosolique de glutathion nécessaire à la détoxification des cellules [24]. Elle pourrait également provenir d’une expression plus élevée de protéines proapoptotiques, induite par le facteur de transcription Foxp3 [25]. D’autres agents peuvent également éliminer des cellules T régulatrices, en particulier le paclitaxel qui induit leur apoptose via un mécanisme qui dépend du récepteur proapoptotique Fas (CD95, Apo1) [26].
Les points de contrôle (checkpoints)
Les freins immunologiques (ou immune checkpoints) sont présents afin d’éviter une réponse immunitaire inflammatoire (réaction biologique à une infection et à des signaux de stress) excessive et de prévenir le développement de maladies auto-immunes. Ces points de contrôle incluent en particulier CTLA-4 (cytotoxic T lymphocyte-associated protein 4) et PD-1 (programmed cell death receptor 1) qui sont exprimés à la surface des lymphocytes T. La fixation à ces protéines de leurs ligands respectifs, CD80/86 (également appelés B7-1 et B7-2) et PD-L1/2 (PD-ligand 1/2), inhibe la voie de signalisation du récepteur antigénique des lymphocytes T (le TCR).
Cependant, cet effet bénéfique des points de contrôle peut être délétère lorsque ceux-ci sont détournés par les tumeurs à leur avantage, par exemple en exprimant PD-L1/2 à leur surface ou à la surface d’autres cellules présentes dans l’environnement tumoral [52] (→).
(→) Voir le numéro thématique Microenvironnements tumoraux, m/s n° 4, avril 2014
Des études cliniques fondées sur la neutralisation des voies de signalisation induites par les récepteurs PD-1 et/ou CTLA-4 sont en cours. Elles donnent des résultats particulièrement encourageants qui plaident en faveur d’une possible thérapie des cancers basée sur la modulation du système immunitaire [27, 53] (→).
(→) Voir l’Éditorial de J.L. Teillaud, m/s n° 8-9, août-septembre 2015, page 707
L’immunothérapie
Depuis quelques années, diverses approches immunothérapeutiques ont été développées afin de stimuler spécifiquement certains composants de la réponse immunitaire (Figure 2). Ces stratégies incluent notamment la vaccination à l’aide d’antigènes tumoraux et le transfert de cellules adoptives, et, plus récemment, l’utilisation d’anticorps immunomodulateurs [28, 54] (→).
(→) Voir le numéro thématique Anticorps monoclonaux en thérapeutique, m/s n° 12, décembre 2009
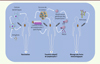 |
Figure 2. Aperçu des approches immunothérapeutiques actuelles. Durant ces dernières années, de nombreuses approches immunothérapeutiques ont été étudiées. Parmi celles-ci, différents types de vaccins utilisant des antigènes tumoraux ont été développés ; par exemple, l’injection de cellules dendritiques du patient « chargées » avec des antigènes tumoraux in vitro (1) . D’autres stratégies visent à injecter des cellules T spécifiques obtenues par clonage des lymphocytes T infiltrant la tumeur du patient ( 2 , côté gauche). Les lymphocytes T peuvent aussi être modifiés pour exprimer à leur surface des récepteurs (CAR, chimeric antigen receptor) capables de reconnaître des protéines exprimées à la surface des cellules tumorales et produire de l’IL-12 favorisant la réponse immune cytotoxique (TRUCK, T cell redirected for universal cytokine-mediated killing) ( 2 , côté droit). Une thérapie très prometteuse consiste à inhiber les freins immunologiques en administrant des anticorps monoclonaux bloquant les récepteurs ayant une fonction négative comme PD-1 (programmed cell death 1) et/ou CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) (3) . |
La vaccination
Ces dernières décennies, diverses thérapies vaccinales ont été testées dans de nombreux centres cliniques. Bien que l’injection d’antigènes tumoraux ait donné des résultats encourageants chez les rongeurs, dans la plupart des cas, la vaccination de patients a effectivement engendré une réponse immunitaire spécifique, mais seulement un contrôle très limité de la croissance tumorale. Différentes classes de vaccins tumoraux ont été testées. Ils incluent l’injection de peptides ou de protéines, de cellules dendritiques, de vecteurs viraux, d’adjuvants, etc. (pour revue, voir [29]). Les résultats cliniques décevants qui ont été obtenus suggèrent qu’une combinaison de thérapies devrait être envisagée.
Le blocage des freins immunologiques
Aujourd’hui, les succès cliniques les plus importants sont liés à l’utilisation d’inhibiteurs de points de contrôle de la réponse immunitaire [30]. L’un d’eux, l’ipilimumab, qui cible le récepteur négatif CTLA-4, exprimé à la surface des cellules T, a montré son efficacité en prolongeant la survie de patients atteints d’un mélanome métastatique pour lesquels les traitements conventionnels n’avaient pas eu d’effet [31]. Plus récemment, l’administration d’un anticorps bloquant la voie de signalisation PD-1/PD-L s’est révélée encourageante pour la régression de différents types de cancers (en particulier de tumeurs solides présentant un infiltrat de cellules immunes) à un stade avancé ainsi que pour la stabilisation prolongée de la maladie, en corrélation avec l’expression du ligand PD-L1 par les cellules tumorales [32].
Les CAR et TRUCK
Très récemment, de nouvelles approches thérapeutiques ont été développées comme l’utilisation de CAR (chimeric antigen receptors) et les TRUCK (T cells redirected for universal cytokine-mediated killing) qui consistent en un transfert adoptif des lymphocytes T du patient après leur modification ex vivo. Les cellules sont transformées par génie génétique afin qu’elles expriment un récepteur antigénique chimérique (CAR) composé (1) d’un fragment d’anticorps ciblant une molécule prédéfinie, exprimée par la tumeur et (2) une chaîne peptidique permettant la transmission du signal (comme la sous-unité CD3ζ du TCR). Les TRUCK utilisent les cellules T modifiées CAR pour véhiculer et produire une molécule transgénique (il s’agit le plus souvent d’une cytokine pro-inflammatoire) au niveau des cellules ciblées, permettant ainsi de modifier le stroma [33].
La chimio-immunothérapie
L’implication du système immunitaire dans la réussite de la chimiothérapie étant suggérée par un nombre croissant d’observations, un intérêt récent est apparu en oncologie pour l’utilisation combinée de traitements chimiothérapeutique et immunothérapeutique. En 2011, une étude utilisant un modèle tumoral cervical murin par transfert de cellules tumorales TC-1, a montré que seule une trithérapie constituée de l’injection d’un anticorps anti-PD-1, d’une vaccination à base de peptides et de l’administration d’une faible dose de cyclophosphamide, induisait le rejet total des tumeurs chez environ 50 % des souris, en stimulant une immunité spécifique vis-à-vis de la tumeur et en maintenant une inhibition prolongée des lymphocytes T régulateurs [34]. Chez l’homme, certaines observations cliniques suggèrent que l’association de la chimiothérapie et de vaccins tumoraux pourrait prévenir l’immunosuppression induite par la tumeur et potentialiser la vaccination (pour revue voir [35]).
Conclusions
Au cours des dernières décennies, de nombreuses études menées en parallèle ont identifié certains des mécanismes cellulaires et moléculaires impliqués dans le contrôle immunitaire de la progression des tumeurs. Elles ont également permis de mettre en évidence des processus immunomodulateurs qui sont induits par les traitements chimiothérapeutiques.
L’induction d’une mort immunogénique, la prolifération homéostatique et l’élimination des cellules T régulatrices, conséquences d’un traitement chimiothérapeutique, sont des mécanismes qui modifient profondément la balance entre réponse effectrice et réponse régulatrice en faveur d’une réponse immunitaire antitumorale efficace. En se basant sur les propriétés du système immunitaire, la combinaison des deux traitements (ou « immunochimiothérapie ») devrait permettre d’induire une protection spécifique de la tumeur (limitant les effets secondaires indésirables) à long terme (phénomène de mémoire) et ubiquitaire (surveillance immunitaire de tout l’organisme). Le contrôle direct - mais partiel - de la croissance tumorale par la chimiothérapie et son effet potentiateur de l’activation des lymphocytes T pourraient avoir un effet bénéfique sur l’action des CAR-T, en particulier pour les tumeurs solides. Similairement, le blocage des molécules inhibitrices PD-1 et CTLA-4 et un traitement chimique pourraient augmenter la réponse cytotoxique en impliquant deux voies distinctes, et donc de façon synergique. On ne peut qu’espérer que la combinaison des thérapies conventionnelles et immunologiques [36] permette de guérir la plupart des cancers dans un futur proche.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Krumbhaar EB, Krumbhaar HD. The blood and bone marrow in yelloe cross gas (mustard gas) poisoning. J Med Res 1919 ; 40 : 497–508. [PubMed] [Google Scholar]
- DeVita VT, Chu E. A history of cancer chemotherapy. Cancer Res 2008 ; 68 : 8643–8653. [CrossRef] [Google Scholar]
- Zitvogel L, Apetoh L, Ghiringhelli F, et al. Immunological aspects of cancer chemotherapy. Nat Rev Immunol 2008 ; 8 : 59–73. [CrossRef] [PubMed] [Google Scholar]
- Suzuki E, Sun J, Kapoor V, et al. Gemcitabine has significant immunomodulatory activity in murine tumor models independent of its cytotoxic effects. Cancer Biol Ther 2007 ; 6 : 880–885. [CrossRef] [PubMed] [Google Scholar]
- Kroemer G, Galluzzi L, Kepp O, et al. Immunogenic cell death in cancer therapy. Annu Rev Immunol 2013 ; 31 : 51–72. [CrossRef] [PubMed] [Google Scholar]
- Denkert C, Loibl S, Noske A, et al. Tumor-associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer. J Clin Oncol 2010 ; 28 : 105–113. [CrossRef] [PubMed] [Google Scholar]
- Fridman WH, Galon J, Pages F, et al. Prognostic and predictive impact of intra- and peritumoral immune infiltrates. Cancer Res 2011 ; 71 : 5601–5605. [CrossRef] [Google Scholar]
- Ma Y, Mattarollo SR, Adjemian S, et al. CCL2/CCR2-dependent recruitment of functional antigen-presenting cells into tumors upon chemotherapy. Cancer Res 2014 ; 74 : 436–445. [CrossRef] [Google Scholar]
- Rahir G, Wathelet N, Hanoteau A, et al. Cyclophosphamide treatment induces rejection of established P815 mastocytoma by enhancing CD4 priming and intratumoral infiltration of P1E/H-2K(d) -specific CD8(+) T cells. Int J Cancer 2014 ; 134 : 2841–2852. [CrossRef] [PubMed] [Google Scholar]
- Williams KM, Hakim FT, Gress RE. T cell immune reconstitution following lymphodepletion. Semin Immunol 2007 ; 19 : 318–330. [CrossRef] [PubMed] [Google Scholar]
- Jackaman C, Majewski D, Fox SA, et al. Chemotherapy broadens the range of tumor antigens seen by cytotoxic CD8+ T cells in vivo. Cancer Immunol Immunother 2012 ; 61 : 2343–2356. [CrossRef] [PubMed] [Google Scholar]
- Hong M, Puaux AL, Huang C, et al. Chemotherapy induces intratumoral expression of chemokines in cutaneous melanoma, favoring T-cell infiltration and tumor control. Cancer Res 2011 ; 71 : 6997–7009. [CrossRef] [Google Scholar]
- Van Pel A, Boon T. Protection against a nonimmunogenic mouse leukemia by an immunogenic variant obtained by mutagenesis. Proc Natl Acad Sci USA 1982 ; 79 : 4718–4722. [CrossRef] [Google Scholar]
- Grulich AE, van Leeuwen MT, Falster MO, et al. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet 2007 ; 370 : 59–67. [CrossRef] [PubMed] [Google Scholar]
- Shankaran V, Ikeda H, Bruce AT, et al. IFNgamma and lymphocytes prevent primary tumour development and shape tumour immunogenicity. Nature 2001 ; 410 : 1107–1111. [CrossRef] [PubMed] [Google Scholar]
- Koebel CM, Vermi W, Swann JB, et al. Adaptive immunity maintains occult cancer in an equilibrium state. Nature 2007 ; 450 : 903–907. [CrossRef] [PubMed] [Google Scholar]
- Coulie PG, Van den Eynde BJ, van der Bruggen P, et al. Tumour antigens recognized by T lymphocytes: at the core of cancer immunotherapy. Nat Rev Cancer 2014 ; 14 : 135–146. [CrossRef] [PubMed] [Google Scholar]
- Igney FH, Krammer PH. Tumor counterattack: fact or fiction ? Cancer Immunol Immunother 2005 ; 54 : 1127–1136. [CrossRef] [PubMed] [Google Scholar]
- Nishikawa H, Sakaguchi S. Regulatory T cells in cancer immunotherapy. Curr Opin Immunol 2014 ; 27 : 1–7. [CrossRef] [PubMed] [Google Scholar]
- Awwad M, North RJ. Cyclophosphamide-induced immunologically mediated regression of a cyclophosphamide-resistant murine tumor: a consequence of eliminating precursor L3T4+ suppressor T-cells. Cancer Res 1989 ; 49 : 1649–1654. [Google Scholar]
- Lutsiak MEC, Semnani RT, de Pascalis R, et al. Inhibition of CD4(+)25+ T regulatory cell function implicated in enhanced immune response by low-dose cyclophosphamide. Blood 2005 ; 105 : 2862–2868. [CrossRef] [PubMed] [Google Scholar]
- Walter S, Weinschenk T, Stenzl A, et al. Multipeptide immune response to cancer vaccine IMA901 after single-dose cyclophosphamide associates with longer patient survival. Nat Med 2012 ; 18 : 1254–1261. [CrossRef] [PubMed] [Google Scholar]
- Ghiringhelli F, Menard C, Puig PE, et al. Metronomic cyclophosphamide regimen selectively depletes CD4+CD25+ regulatory T cells and restores T and NK effector functions in end stage cancer patients. Cancer Immunol Immunother 2007 ; 56 : 641–648. [CrossRef] [PubMed] [Google Scholar]
- Zhao J, Cao Y, Lei Z, et al. Selective depletion of CD4+CD25+Foxp3+ regulatory T cells by low-dose cyclophosphamide is explained by reduced intracellular ATP levels. Cancer Res 2010 ; 70 : 4850–4858. [CrossRef] [Google Scholar]
- Kasprowicz DJ, Droin N, Soper DM, et al. Dynamic regulation of FoxP3 expression controls the balance between CD4+ T cell activation and cell death. Eur J Immunol 2005 ; 35 : 3424–3432. [CrossRef] [PubMed] [Google Scholar]
- Zhang L, Dermawan K, Jin M, et al. Differential impairment of regulatory T cells rather than effector T cells by paclitaxel-based chemotherapy. Clin Immunol 2008 ; 129 : 219–229. [CrossRef] [PubMed] [Google Scholar]
- de Coaña Pico. Y, Choudhury A, Kiessling R. Checkpoint blockade for cancer therapy: revitalizing a suppressed immune system. Trends Mol Med 2015 ; 21 : 482–491. [CrossRef] [PubMed] [Google Scholar]
- Emens L a, Middleton G. The interplay of immunotherapy and chemotherapy: Harnessing potential synergies. Cancer Immunol Res 2015 ; 3 : 436–443. [CrossRef] [PubMed] [Google Scholar]
- Butterfield LH. Cancer vaccines. Br Med J 2015 ; 350 : h988. [CrossRef] [PubMed] [Google Scholar]
- Devaud C, John LB, Westwood JA, et al. Immune modulation of the tumor microenvironment for enhancing cancer immunotherapy. Oncoimmunology 2013 ; 2 : e25961. [CrossRef] [PubMed] [Google Scholar]
- Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010 ; 363 : 711–723. [CrossRef] [PubMed] [Google Scholar]
- Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012 ; 366 : 2443–2454. [Google Scholar]
- Chmielewski M, Hombach A a., Abken H. Of CARs and TRUCKs: Chimeric antigen receptor (CAR) T cells engineered with an inducible cytokine to modulate the tumor stroma. Immunol Rev 2014 ; 257 : 83–90. [CrossRef] [PubMed] [Google Scholar]
- Mkrtichyan M, Najjar YG, Raulfs EC, et al. Anti-PD-1 synergizes with cyclophosphamide to induce potent anti-tumor vaccine effects through novel mechanisms. Eur J Immunol 2011 ; 41 : 2977–2986. [CrossRef] [PubMed] [Google Scholar]
- Moschella F, Proietti E, Capone I, et al. Combination strategies for enhancing the efficacy of immunotherapy in cancer patients. Ann NY Acad Sci 2010 ; 1194 : 169–178. [CrossRef] [Google Scholar]
- Pastore A, Jurinovic V, Kridel R, et al. Integration of gene mutations in risk prognostication for patients receiving first-line immunochemotherapy for follicular lymphoma: a retrospective analysis of a prospective clinical trial and validation in a population-based registry. Lancet Oncol 2015 ; 16 : 1111–1122. [CrossRef] [PubMed] [Google Scholar]
- Tesniere A, Schlemmer F, Boige V, et al. Immunogenic death of colon cancer cells treated with oxaliplatin. Oncogene 2010 ; 29 : 482–491. [CrossRef] [PubMed] [Google Scholar]
- Vacchelli E, Martins I, Eggermont A, et al. Chemotherapy with immunogenic cell death inducers. Oncoimmunology 2012 ; 1 : 1557–1576. [CrossRef] [PubMed] [Google Scholar]
- Suzuki E, Kapoor V, Jassar AS, et al. Gemcitabine selectively eliminates splenic Gr-1+/CD11b+ myeloid suppressor cells in tumor-bearing animals and enhances antitumor immune activity. Clin Cancer Res 2005 ; 11 : 6713–6721. [CrossRef] [PubMed] [Google Scholar]
- Trojandt S, Knies D, Pektor S, et al. The chemotherapeutic agent topotecan differentially modulates the phenotype and function of dendritic cells. Cancer Immunol Immunother 2013 ; 62 : 1315–1326. [CrossRef] [PubMed] [Google Scholar]
- Li JY, Duan XF, Wang LP, et al. Selective depletion of regulatory T cell subsets by docetaxel treatment in patients with nonsmall cell lung cancer. J Immunol Res 2014 ; 2014 : 286170. [PubMed] [Google Scholar]
- Tanaka H, Matsushima H, Nishibu A, et al. Dual therapeutic efficacy of vinblastine as a unique chemotherapeutic agent capable of inducing dendritic cell maturation. Cancer Res 2009 ; 69 : 6987–6994. [CrossRef] [Google Scholar]
- Mattarollo SR, Loi S, Duret H, et al. Pivotal Role of innate and adaptive immunity in anthracycline chemotherapy of established tumors. Cancer Res 2011 ; 71 : 4809–4820. [CrossRef] [Google Scholar]
- Cao C, Han Y, Ren Y, et al. Mitoxantrone-mediated apoptotic B16–F1 cells induce specific anti-tumor immune response. Cell Mol Immunol 2009 ; 6 : 469–475. [CrossRef] [PubMed] [Google Scholar]
- Van den Eynde B, Lethé B, Van Pel A, et al. The gene coding for a major tumor rejection antigen of tumor P815 is identical to the normal gene of syngeneic DBA/2 mice. J Exp Med 1991 ; 173 : 1373–1384. [CrossRef] [PubMed] [Google Scholar]
- Amar-Costesec A, Godelaine D, Van den Eynde B, et al. Identification and characterization of the tumor-specific P1A gene product. Biol cell 1994 ; 81 : 195–203. [CrossRef] [PubMed] [Google Scholar]
- Chen YT, Scanlan MJ, Sahin U, et al. A testicular antigen aberrantly expressed in human cancers detected by autologous antibody screening. Proc Natl Acad Sci USA 1997 ; 94 : 1914–1918. [CrossRef] [Google Scholar]
- Wölfel T, Hauer M, Schneider J, et al. A p16INK4a-insensitive CDK4 mutant targeted by cytolytic T lymphocytes in a human melanoma. Science 1995 ; 269 : 1281–1284. [CrossRef] [PubMed] [Google Scholar]
- Peiper M, Goedegebuure PS, Linehan DC, et al. The HER2/neu-derived peptide p654–662 is a tumor-associated antigen in human pancreatic cancer recognized by cytotoxic T lymphocytes. Eur J Immunol 1997 ; 27 : 1115–1123. [CrossRef] [PubMed] [Google Scholar]
- Keskin DB, Reinhold B, Lee SY, et al. Direct identification of an HPV-16 tumor antigen from cervical cancer biopsy specimens. Front Immunol 2011 ; 2 : 75. [PubMed] [Google Scholar]
- Bloom MB, Perry-Lalley D, Robbins PF, et al. Identification of tyrosinase-related protein 2 as a tumor rejection antigen for the B16 melanoma. J Exp Med 1997 ; 185 : 453–459. [CrossRef] [PubMed] [Google Scholar]
- Teillaud JL. Microenvironnements tumoraux : conflictuels et complémentaires. Med Sci (Paris) 2014 ; 30 : 343–466. [Google Scholar]
- Teillaud JL. Quand les anticorps rencontrent l’immunité antitumorale : fin de partie pour la cellule cancéreuse ? Med Sci (Paris) 2015 ; 31 : 707–708. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Teillaud JL, Watier H, Beck A. Anticorps monoclonaux en thérapeutique. Med Sci (Paris) 2009 ; 25 : 995–1196. [CrossRef] [EDP Sciences] [Google Scholar]
Liste des tableaux
Classification des différents types d’agents chimiothérapeutiques selon leur mécanisme d’action.
Liste des figures
 |
Figure 1. Modèle d’activation d’une réponse immunitaire spécifique en réponse à un traitement chimiothérapeutique. Modèle fondé sur des données de la littérature et des résultats obtenus par notre équipe. Des DAMP (damage/danger-associated molecular pattern), molécules de stress telles que l’ATP ou l’HMGB1 (high–mobility group box 1 protein), sont libérées dans l’environnement par les cellules tumorales mourantes suite à l’effet cytotoxique d’une chimiothérapie. 1 . Ces molécules sont reconnues par des récepteurs exprimés à la surface des cellules dendritiques, comme le récepteur purinergique P2RX7 (purinergic receptor P2X, ligand-gated ion channel, 7) ou le TLR4 (toll-like receptor 4). 2 . Cette reconnaissance est déterminante pour l’induction de la maturation des cellules dendritiques et leur migration vers les ganglions drainants. 3 . Au sein de cet organe lymphoïde, les cellules dendritiques présentent les antigènes de la tumeur aux lymphocytes T (LT) spécifiques, déclenchant ainsi leur activation et leur prolifération. 4 . Cette activation, ainsi que la libération de chimiokines (telles que CXCL [chemokine (C-X-C motif) ligand] 9, CXCL10 et CXCL11) dans l’environnement tumoral à la suite de la chimiothérapie, entraînent la migration vers la tumeur des cellules T CD8+ spécifiques qui expriment à leur surface le récepteur spécifique aux chimiokines (le CXCR3 [chemokine (C-X-C motif) receptor 3]). |
| Dans le texte | |
 |
Figure 2. Aperçu des approches immunothérapeutiques actuelles. Durant ces dernières années, de nombreuses approches immunothérapeutiques ont été étudiées. Parmi celles-ci, différents types de vaccins utilisant des antigènes tumoraux ont été développés ; par exemple, l’injection de cellules dendritiques du patient « chargées » avec des antigènes tumoraux in vitro (1) . D’autres stratégies visent à injecter des cellules T spécifiques obtenues par clonage des lymphocytes T infiltrant la tumeur du patient ( 2 , côté gauche). Les lymphocytes T peuvent aussi être modifiés pour exprimer à leur surface des récepteurs (CAR, chimeric antigen receptor) capables de reconnaître des protéines exprimées à la surface des cellules tumorales et produire de l’IL-12 favorisant la réponse immune cytotoxique (TRUCK, T cell redirected for universal cytokine-mediated killing) ( 2 , côté droit). Une thérapie très prometteuse consiste à inhiber les freins immunologiques en administrant des anticorps monoclonaux bloquant les récepteurs ayant une fonction négative comme PD-1 (programmed cell death 1) et/ou CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) (3) . |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




