| Issue |
Med Sci (Paris)
Volume 30, Number 10, Octobre 2014
|
|
|---|---|---|
| Page(s) | 855 - 863 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20143010012 | |
| Published online | 14 October 2014 | |
La montée en puissance des immunoconjugués en oncologie
Une liaison réussie entre un anticorps et une petite molécule cytotoxique
The growing field of immunoconjugates in oncology. A successful link(er) between antibodies and small cytotoxic molecules
1
Global Biotherapeutics
2
Oncology Division. Sanofi, 13, quai Jules Guesdes, 94403
Vitry-sur-Seine, France
*
emmanuelle.vigne@sanofi.com
**
ingrid.sassoon@sanofi.com
Le nombre croissant d’immunoconjugués en développement clinique pour le traitement du cancer reflète l’intérêt et la confiance des cliniciens et de l’industrie pharmaceutique face au potentiel de cette nouvelle stratégie thérapeutique. À ce jour, outre l’approbation récente du brentuximab vedotin (Adcetris®) et du trastuzumab emtansine (Kadcyla®) par la FDA (Food and drug administration) et l’EMA (European medicines agency), 38 anticorps armés d’agents cytotoxiques font l’objet d’études cliniques pour le traitement de tumeurs solides ou hématologiques, représentant environ 15 % du portefeuille d’anticorps en développement pour le traitement du cancer. Cet essor résulte de la compréhension accrue des facteurs influençant l’efficacité et la toxicité des immunoconjugués, de l’amélioration de l’ingénierie des anticorps, des progrès des technologies de couplage aux agents cytotoxiques, ainsi que d’une meilleure sélection des cibles et des agents cytotoxiques.
Abstract
As evidenced by the recent FDA approvals of brentuximab vedotin (Adcetris®) and trastuzumab emtansine (Kadcyla®), antibody-drug conjugates (ADC) are becoming an important class of biotherapeutics in oncology. In addition, the strong pipeline of ADC in clinical development, bearing 38 ADC for the treatment of both solid and hematological malignancies, emphasizes the interest and confidence of clinicians and pharmaceutical industry in the area. Although the ADC concept looks pretty simple, it took decades before it turned out to be a successful therapeutic solution. Improving the understanding of ADC mechanism of action allowed identifying the most critical factors influencing ADC efficacy and toxicity. This led to still ongoing research efforts in antibody and alternative scaffold engineering, in linker and conjugation chemistry, as well as in the screening and selection of optimal target antigens and cytotoxics.
© 2014 médecine/sciences – Inserm
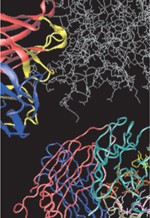
Depuis plus de 30 ans, les anticorps monoclonaux et leurs dérivés ont connu un succès sans précédent dans le traitement de situations pathologiques très variées (cancer, inflammation, transplantation, infections virales, allergies, etc.)1. En oncologie, 19 produits ont obtenu une autorisation de mise sur le marché (AMM) et quelques centaines sont actuellement en développement clinique. Nombre d’entre eux s’attaquent, soit directement aux cellules tumorales en neutralisant des récepteurs impliqués dans les mécanismes de prolifération et de survie cellulaires, soit à la vascularisation tumorale, ou encore visent à (ré)activer la surveillance de la tumeur par le système immunitaire [1, 2]. Comme l’efficacité clinique globale des anticorps nus reste limitée, notamment en monothérapie et dans le traitement de tumeurs solides [3, 4], ces molécules sont classiquement utilisées en combinaison avec la radiothérapie ou la chimiothérapie. Une autre façon d’augmenter le potentiel thérapeutique des anticorps nus est de les conjuguer chimiquement à des toxines protéiques (immunotoxines), à des agents radioactifs (radio-immunoconjugués ou RIC) ou à des molécules cytotoxiques puissantes (antibody-drug conjugates ou ADC). Le concept est simple : combiner la spécificité de l’anticorps à la puissance d’un composé hautement cytotoxique (Figure 1) afin de libérer ce dernier spécifiquement au sein de la tumeur, tout en limitant son impact sur les cellules saines.
 |
Figure 1. Anatomie d’un antibody drug conjugate (ADC) et caractéristiques clés de ses constituants. Un ADC est un anticorps monoclonal couplé à un agent cytotoxique par le biais d’un agent de liaison. Ce modèle 3D réalisé par Cendrine Lemoine (Sanofi, Vitry-sur-Seine, France) est construit à partir de trois éléments indépendants : la structure cristalline de l’IgG1 (immunoglobuline G1) humaine B12 disponible sous le code 1HZH dans la PDB (protein data bank), la représentation de l’agent de liaison SPDB (N-succinimidyl 4-[2-pyridyldithio]butanoate) et la représentation du dérivé de maytansine DM4 (communication personnelle). Dans cette représentation (SPDB-DM4 : jaune ; paratope de l’anticorps : rouge ; lysines de surface de l’anticorps : bleu), l’agent de liaison SPDB associe le maytansinoïde DM4 à quatre lysines de surface de l’anticorps. |
Un développement clinique riche en rebondissements…
À la fin des années 1980, l’évaluation clinique d’immunotoxines à base de toxines bactériennes (exotoxine A de Pseudomonas ou toxine diphtérique) ou végétale (ricine) a démontré une efficacité très limitée, du fait de l’immunogénicité du produit (l’anticorps était alors souvent murin et la toxine immunogène), de sa courte demi-vie plasmatique ou de sa toxicité systémique à très faible dose [5]. De nouvelles générations d’immunotoxines sont actuellement en phase précoce de développement, essentiellement pour le traitement de cancers hématopoïétiques. La radio-immunothérapie, autre domaine d’application du concept d’immunoconjugaison, a fait ses preuves dans le traitement des lymphomes malins non hodgkiniens de phénotype lymphocytaire B. Ainsi, deux anticorps ciblant l’antigène CD20 et vectorisant des radio-isotopes thérapeutiques ont été approuvés en 2002 et 2003 : 90Y-ibritumomab tiuxetan (Zevalin®) et 131I-tositumomab (Bexxar®). Les questions qui se posent aujourd’hui ne concernent donc plus l’efficacité des RIC, mais surtout leur expansion et leur positionnement dans le traitement des tumeurs solides [6].
La première évaluation d’un anticorps conjugué à une molécule cytotoxique dans un modèle tumoral murin a été publiée par G. Mathé et al. en 1958 [7]. Il faudra pourtant attendre plus de 40 ans pour l’enregistrement du premier anticorps conjugué à un agent chimique hautement cytotoxique. En effet, les premiers conjugués basés sur l’utilisation d’anticorps murins liés à des molécules de chimiothérapie classique telles que la doxorubicine, la vinblastine ou le méthotrexate, ont échoué en développement clinique en raison de l’immunogénicité de l’anticorps, de la faible puissance de la molécule cytotoxique ou d’une sélectivité insuffisante pour la tumeur. Les enseignements de cette première génération d’ADC ont permis d’élaborer le gemtuzumab ozogamicin (Mylotarg®), un anticorps humanisé dirigé contre la protéine CD33 et conjugué à la calichéamicine, une molécule 100 à 1 000 fois plus cytotoxique que les agents précédemment utilisés. Le Mylotarg® a été approuvé par la FDA (Food and drug administration) en 2000 pour le traitement des leucémies aiguës myéloïdes (LAM), via une procédure accélérée de mise sur le marché. Ce produit a toutefois été retiré du marché en 2010 à la demande de la FDA, car des études complémentaires avaient conclu à une efficacité insuffisante et démontré une incidence accrue d’effets secondaires au regard des études précédentes (augmentation de la mortalité en phase d’induction et toxicité hépatique sévère, étude SWOG S0106). L’histoire du Mylotarg® ne s’arrête pourtant pas là. Des études récentes de phase III ont démontré un bénéfice clinique chez certaines sous-populations de patients atteints de LAM [8, 9]. Ces résultats, bien qu’associés à l’amélioration du profil de toxicité grâce à l’optimisation du schéma d’administration, sont largement débattus au sein de la communauté des hématologues et avec les agences réglementaires [10].
… et deux succès récents : une nouvelle classe thérapeutique est enfin née !
Adcetris®, un anticorps anti-CD30 couplé à l’auristatine dans le traitement des lymphomes réfractaires ou récidivants
Adcetris® (brentuximab vedotin), un anticorps dirigé contre le CD30 et couplé à l’auristatine, est développé par la société Seattle Genetics. Il a été approuvé en août 2011 aux États-Unis, suite à une procédure accélérée, pour le traitement du lymphome hodgkinien (LH) CD30-positif récidivant ou réfractaire survenant chez l’adulte après une greffe autologue de cellules souches hématopoïétiques, ou après au moins deux traitements antérieurs quand la greffe autologue de cellules souches hématopoïétiques ou une polychimiothérapie ne peuvent être envisagées. Il est également indiqué dans le traitement du lymphome anaplasique à grandes cellules systémique (LAGCs) récidivant ou réfractaire chez l’adulte. Le LH et le LAGCs étant des maladies rares qui souffrent du manque d’alternative thérapeutique validée en cas de rechute ou d’absence de rémission, l’EMA (European medicines agency) a accordé en octobre 2012 une AMM conditionnelle à Adcetris® dans ces indications.
En France, la population cible d’Adcetris® dans ces deux indications est estimée à environ 245 à 275 patients par an [11], ce qui explique que cette molécule ait reçu la désignation de médicament orphelin2. Ainsi, Adcetris® a pu être approuvé sur la base de taux de réponse prometteurs démontrés dans deux essais de phase II non comparatifs. Dans une première étude comprenant 102 patients présentant un LH en rechute après autogreffe et traités par Adcetris®, 75 % des patients ont répondu partiellement ou complètement au traitement (34 % de réponses complètes) [12]. La médiane de survie sans progression a été de 7,8 mois et la survie globale à un an de 89 %. Les effets secondaires les plus fréquents ont été le développement d’une neuropathie périphérique et d’une neutropénie, dont l’évolution a été favorable après adaptation posologique. L’approbation d’Adcetris® pour le traitement du LAGCs récidivant ou réfractaire est, quant à elle, basée sur l’analyse intermédiaire d’une deuxième étude réalisée sur 58 patients et ayant conclu à 86 % de réponse globale (57 % de réponses complètes) [13]. La médiane de survie sans progression était de 14,3 mois et la survie globale à un an de 70 %. Il faut noter que ces études ont été conduites chez des patients lourdement prétraités et en impasse thérapeutique. Dans ce contexte, le taux de réponse et la durée moyenne de réponse observés en monothérapie sont particulièrement élevés. À titre de comparaison, SGN-30 (brentuximab non conjugué) a, lui aussi, fait l’objet d’études de phase II dans les mêmes populations de LH et de LAGCs. Aucune réponse n’avait été observée chez les 38 patients LH et une efficacité bien modeste au regard de celle d’Adcetris® avait été obtenue chez 41 patients LAGCs (17 % de réponses globales, dont 5 % de réponses complètes) [14]. Adcetris® est actuellement évalué dans des études de phase III dans ces indications pour permettre aux agences règlementaires de donner leur approbation définitive. De plus, il poursuit son développement dans d’autres cancers hématologiques exprimant CD30 chez l’adulte et l’enfant, ainsi qu’en première ligne thérapeutique du LH, en combinaison avec la chimiothérapie.
Kadcyla®, un anticorps dérivé de l’herceptin conjugué à la maytansine, efficace dans le cancer du sein métastatique
En 2013, l’approbation de Kadcyla® (ado-trastuzumab emtansine, anticorps dirigé contre HER2 [receptor tyrosine-protein kinase erbB- 2] et couplé à la maytansine) aux États-Unis, en Europe et au Japon pour le traitement du cancer du sein métastatique HER2-positif chez des femmes prétraitées par l’Herceptin® et un taxane est un événement majeur dans le monde des ADC. Développé par Roche/Genentech, Kadcyla® est le premier ADC homologué pour le traitement d’une tumeur solide. Dans le cancer du sein, le récepteur HER2, impliqué dans la croissance, la survie et la différenciation de la cellule, est surexprimé chez 15 à 30 % des patientes, du fait de l’amplification du gène codant pour HER2 ou de la dérégulation de sa transcription. [15]. Plus agressifs et moins sensibles à la chimiothérapie classique, ces cancers HER2-positifs ont longtemps été de mauvais pronostic. À ce jour, le traitement de première ligne des cancers du sein HER2-positifs est un anticorps nu, l’Herceptin® (trastuzumab, anticorps anti-HER2), en association avec une chimiothérapie à base de taxanes. Tyverb®/Tykerb® (lapatinib, petite molécule inhibitrice de HER1 et HER2) est prescrit en association avec Xeloda® (capécitabine) chez les patientes ayant été préalablement traitées par l’Herceptin® pour un cancer du sein avancé ou métastatique. Perjeta® (pertuzumab, anticorps anti-HER2) est un autre anticorps indiqué en association avec l’Herceptin® et le docétaxel chez les patientes atteintes d’un cancer du sein métastatique HER2-positif n’ayant pas reçu de chimiothérapie ou de thérapie ciblée auparavant.
Kadcyla® est un ADC dérivé d’Herceptin®. Des études précliniques suggèrent qu’il conserve les mécanismes d’action d’Herceptin®, l’induction de l’apoptose par inhibition de la voie de signalisation PI3K (phosphoinositide 3-kinase)/AKT (protéine kinase B), l’inhibition du shedding de HER2 et l’induction de la cytotoxicité cellulaire dépendante des anticorps (ADCC) [16]. De plus, il présente une activité antitumorale dans les modèles expérimentaux résistant à l’Herceptin® et au Tyverb® [16, 17].
L’homologation de Kadcyla® s’appuie sur les résultats de l’étude de phase III EMILIA, qui a comparé Kadcyla® utilisé seul au traitement de référence associant Tyverb® et Xeloda®, chez 991 patientes souffrant de cancer du sein HER2-positif avancé ou métastatique et ayant été précédemment traitées par l’Herceptin® et un taxane [18]. Un bénéfice significatif de Kadcyla® sur la survie sans progression (médiane : 9,6 mois versus 6,4 mois) et la survie globale (médiane : 30,9 versus 25,1 mois) a été démontré. De plus, le profil de toxicité de Kadcyla® est favorable : les effets indésirables sévères étaient moins fréquents chez les patientes traitées par Kadcyla® (40,8 % versus 57 %), faisant de cet ADC une thérapeutique de choix en deuxième ligne dans les cancers métastatiques. De nombreuses études cliniques sont en cours pour évaluer son profil de toxicité à long terme ainsi que son efficacité dans les cancers du sein localisés ou métastatiques, lorsqu’il est utilisé seul ou en association avec d’autres thérapies ciblées ou cytotoxiques. D’autre part, Kadcyla® est également testé dans le cancer gastrique HER2-positif, en comparaison avec un taxane.
Construire un ADC : un simple jeu de construction ?
La conception d’un ADC repose sur quatre éléments fondateurs : une cible, un anticorps, une molécule cytotoxique et un agent de liaison (Figure 1) [19]. Après fixation sur son antigène cible, l’ADC est internalisé par la cellule ; le cytotoxique libéré sous sa forme active s’y accumule, provoquant sa mort (Figure 2). L’efficacité de l’ADC est directement liée à la concentration de cytotoxique actif dans le cytoplasme de la cellule tumorale ; elle dépend ainsi d’un grand nombre d’éléments incluant la densité d’antigènes à la surface de la cellule tumorale, leur dynamique d’internalisation et de recyclage, les paramètres pharmacocinétiques de l’ADC et sa capacité de pénétration dans le tissu tumoral, le mode d’action du cytotoxique et sa puissance, le nombre de molécules de ce cytotoxique liées à l’anticorps et les caractéristiques de l’agent de liaison.
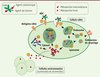 |
Figure 2. Mécanisme d’action d’un antibody drug conjugate (ADC). Suite à la fixation de l’ADC sur son antigène cible (1) , le complexe antigène/ADC est internalisé par endocytose (2) . Le trafic intracellulaire et la fusion successive des vésicules endosomales (3) , leur acidification progressive, ainsi que la fusion avec les lysosomes (compartiments subcellulaires riches en enzymes protéolytiques) permettent la dégradation protéolytique de l’ADC (4a) . L’antigène peut être dégradé dans le lysosome (4a) ou recyclé à la membrane plasmique (4b) . L’agent cytotoxique est ensuite libéré dans le cytosol de la cellule tumorale sous la forme de métabolites dont la composition dépend de l’agent de liaison (5) [25–27]. Les métabolites peuvent alors inhiber la polymérisation de la tubuline (6a) ou induire des cassures double brin de l’ADN après migration au noyau (6b) , ce qui conduit à l’arrêt du cycle cellulaire, puis à la mort par apoptose. Certains métabolites, de par leurs propriétés physicochimiques, sont libérés par la cellule tumorale et peuvent diffuser dans l’espace extracellulaire, pénétrer les cellules environnantes et les tuer par effet bystander (7). |
La cible tumorale
La conception d’un ADC repose dans un premier temps sur l’identification d’un antigène exprimé spécifiquement à la surface de la cellule tumorale et accessible à l’anticorps circulant. Idéalement, la cible est absente des tissus normaux et son niveau d’expression est élevé à la surface des cellules cancéreuses tout au long de la progression tumorale. Toutefois, nombre d’ADC ciblent des antigènes exprimés à la surface de cellules de quelques organes ou tissus sains. Le profil de toxicité dans ces tissus est alors en partie dicté par le niveau d’expression de l’antigène, et par la nature et la fonction de l’organe exprimant la cible et, plus précisément, par le type cellulaire exprimant la cible ainsi que son état prolifératif ou quiescent. Ainsi, malgré l’expression dans quelques tissus sains de l’antigène reconnu, certains ADC sont bien tolérés chez le patient, causant une toxicité minimale ou réversible et gérable. C’est le cas de Kadcyla®, dont la cible HER2 est exprimée sur certains types cellulaires normaux tels que les cardiomyocytes. À l’inverse, le développement clinique du bivatuzumab mertansine a été stoppé en phase I à la suite d’un cas mortel de nécrolyse épidermique toxique liée à l’expression de CD44v6 dans les kératinocytes de la peau [20].
Les propriétés d’internalisation et de trafic intracellulaire de l’antigène après la liaison de l’anticorps sont également déterminantes dans le choix de la cible. Idéalement, après internalisation par endocytose puis transit dans les endosomes, le complexe antigène/ADC est dirigé vers les lysosomes, compartiments subcellulaires acides riches en enzymes protéolytiques permettant la dégradation de l’ADC et, in fine, la libération de l’agent cytotoxique à l’intérieur du cytosol de la cellule tumorale. L’efficacité de l’ADC est également dépendante de la dynamique de recyclage de l’antigène à la membrane plasmique. Pour autant, les caractéristiques structurales et fonctionnelles de la cible peuvent être extrêmement variées (Tableau I). Des antigènes aussi divers que des récepteurs à un ou plusieurs domaines transmembranaires ou des protéines à ancre GPI (glycosylphosphatidylinositol) se sont avérés relayer efficacement l’internalisation d’un ADC et son « activation intracellulaire », provoquant un effet thérapeutique dans des modèles précliniques murins [20, 21].
ADC en développement clinique et approuvés au 31 mars 2014. Consulter [22] pour une comparaison avec 2009.
L’anticorps
L’efficacité de l’ADC nécessite une sélection rigoureuse de l’anticorps. Les critères de choix reposent sur les caractéristiques de liaison de l’anticorps à la cible (affinité, spécificité, sélectivité), sa pharmacocinétique et sa prise en charge par le système immunitaire du patient, tant du point de vue de l’immunogénicité que de l’activation des mécanismes effecteurs de l’immunité.
L’agent cytotoxique
L’efficacité intrinsèque de l’agent cytotoxique est le troisième élément essentiel du succès d’un ADC. Actuellement, la plupart des ADC en évaluation clinique font usage de petites molécules naturelles 100 à 1000 fois plus puissantes que les drogues de chimiothérapie classiques, qui agissent par inhibition de la polymérisation de la tubuline ou par induction de cassures double-brin de l’ADN. Les dérivés d’auristatines (monométhyl auristatine E [MMA] et F [MMAF] développés par la société Seattle Genetics) [36] ou de maytansines (DM1 et DM4, développés par la société ImmunoGen), des inhibiteurs de la polymérisation de la tubuline, ont démontré leur potentiel respectif avec Adcetris® et Kadcyla® et sont actuellement utilisés dans la plupart des ADC en développement (Tableau I). D’autres cytotoxiques puissants ciblant l’ADN ont également fait preuve d’efficacité dans différentes indications. Le Mylotarg® et l’inotuzumab ozogamicin, auxquels est conjugué un dérivé de la calichéamicine, sont actuellement en phase III dans le traitement de leucémies (LAM et LAL [leucémies aiguës lymphoblastiques]). Plus récemment, des ADC intégrant des agents très puissants alkylants de l’ADN, les pyrrolobenzodiazépines (PBD, développés par la société Spirogen), ont démontré une activité antitumorale remarquable dans divers modèles précliniques [23]. Ainsi, une étude de phase I du SGN-CD33A, un anticorps dirigé contre CD33 couplé à un dimère de PBD, a démarré en 2013 dans le traitement de la leucémie aiguë myéloïde (LAM) [24].
L’agent de liaison
L’agent de liaison entre l’anticorps et le cytotoxique joue lui aussi un rôle primordial et doit présenter deux caractéristiques essentielles. Il doit être suffisamment stable pour éviter la libération par l’ADC de l’agent cytotoxique dans le sang, qui conduirait à la perte de l’activité de l’ADC et à la survenue d’éventuelles toxicités indésirables associées. En parallèle, il doit permettre de délivrer l’agent cytotoxique sous sa forme active dans la cellule tumorale [25–27]. Ces agents de liaison peuvent être classés en deux catégories selon leur capacité à être hydrolysés ou non dans la cellule.
-
Les liaisons hydrazones, relativement stables à pH sanguin, sont hydrolysées à pH acide dans les endosomes tardifs, puis dans les lysosomes. On les retrouve dans quelques ADC entrés en développement dans les années 2000. Leur association à une libération prématurée et non spécifique de l’agent cytotoxique dans la circulation [28] explique qu’ils soient désormais délaissés au profit de liaisons hydrolysables, peptidiques ou disulfures, ou de liaisons non clivables. Les liaisons peptidiques sont constituées d’une séquence sensible aux protéases. La plus connue, le dipeptide valine-citrulline (présent sur Adcetris®), est hydrolysée spécifiquement par la cathepsine B et la plasmine, présentes à des taux élevés dans certaines tumeurs [26]. Les liaisons disulfures exploitent l’environnement réducteur du cytosol dû au niveau intracellulaire élevé de glutathion. Les ADC comportant ce type d’agents de liaison sont donc métabolisés de façon séquentielle. Après internalisation, l’anticorps est dégradé dans le lysosome, puis des métabolites constitués du cytotoxique encore lié à un acide aminé résiduel de l’anticorps sont libérés dans le cytosol où le pont disulfure du bras de liaison est réduit. Les métabolites actifs ainsi libérés peuvent diffuser dans l’espace extracellulaire, pénétrer les cellules environnantes et les tuer (Figure 2). On parle d’effet bystander, particulièrement recherché lorsque l’expression de l’antigène au sein de la tumeur est hétérogène.
-
Contrairement aux précédentes, les liaisons thioéther (exemple avec Kadcyla®) ne sont pas hydrolysables dans la cellule. Il devient critique que la voie d’internalisation permette l’adressage au lysosome où l’ADC sera dégradé pour libérer une forme active du cytotoxique, qui retiendra l’agent de liaison et un acide aminé de l’anticorps. La capacité de ce type de métabolites à traverser les membranes est restreinte, limitant sa libération dans l’espace extracellulaire et, par conséquent, l’effet « bystander ».
Le choix de l’agent de liaison et du cytotoxique s’accompagne de celui de la méthode de conjugaison. Classiquement, celle-ci se fait par couplage à certains acides aminés de l’anticorps, tels que les lysines de surface ou les cystéines. Dans ces conditions, l’ADC est un mélange hétérogène complexe d’anticorps conjugués à un nombre variable d’agents cytotoxiques sur des positions variables, défini par un nombre moyen de cytotoxiques par anticorps (DAR, drug antibody ratio), où chaque espèce peut avoir des propriétés fonctionnelles, physicochimiques et pharmacocinétiques distinctes [25].
L’histoire des ADC ne fait que commencer
Bien que d’une grande complexité, les ADC sont devenus une classe importante de biomédicaments en oncologie. Le portefeuille des ADC en développement clinique témoigne de la vigueur du domaine (Tableau I). La majorité des laboratoires pharmaceutiques mondiaux ont investi, tant en recherche pour acquérir et développer des technologies clés pour la genèse des ADC du futur, que dans des outils de production industrielle de ces molécules complexes.
L’essentiel des efforts de recherche actuels vise à améliorer l’index thérapeutique. En effet, la dose clinique recommandée est souvent proche de la dose maximale tolérée, et les effets secondaires, notamment la toxicité oculaire pour les ADC à base de maytansine, ou la neuropathie périphérique pour les ADC à base d’auristatine, restent difficiles à gérer. Plusieurs axes de recherche sont poursuivis en ce sens :
-
Développer des méthodologies de couplage dirigé permettant de contrôler le nombre moyen de cytotoxiques par anticorps et la position de conjugaison sur l’anticorps (sur des acides aminés naturels ou non). Cet axe d’amélioration des ADC est en pleine expansion (exemple avec SGN-CD33A) et a un double objectif : l’obtention de lots cliniques d’ADC homogènes plus faciles à caractériser analytiquement, et l’amélioration de l’index thérapeutique des ADC [29, 30]. De plus, certaines méthodologies permettent la conjugaison de plusieurs cytotoxiques différents sur le même anticorps, le but étant d’obtenir une synergie entre ces cytotoxiques afin d’améliorer le taux de réponse clinique [31].
-
Développer des ADC basés sur des cytotoxiques porteurs d’un mécanisme d’action différent de celui des agents ciblant le cytosquelette microtubulaire, afin d’obtenir un profil de toxicité ou de résistance différent de celui des générations actuelles d’ADC. Des ADC basés sur des agents ciblant l’ADN (dimères de PBD, duocarmycine) ou sur l’ARN polymérase II (alpha-amanitine) sont en développement clinique et préclinique [24, 32].
-
Développer des métabolites intracellulaires ayant des propriétés améliorées, comme une moindre sensibilité aux pompes à efflux ou une élimination plus rapide de l’organisme, grâce à la connaissance accrue du métabolisme et du catabolisme des ADC [33].
-
Améliorer la spécificité du ciblage de l’ADC quand l’antigène est exprimé sur des tissus sains. À titre d’exemple, la technologie « probody » permet de masquer le paratope3 de l’anticorps, qui sera mis à nu par des protéases spécifiques de l’environnement tumoral, permettant ainsi de restreindre la fixation de l’ADC aux seules cellules tumorales exprimant l’antigène [34].
-
Améliorer la pénétration tumorale de l’ADC en jouant sur la taille et la nature de l’élément de ciblage, à ce jour le plus souvent un anticorps. Le défi devient alors de trouver le bon compromis entre poids moléculaire, pharmacocinétique, voie d’élimination et efficacité [35].
La classe thérapeutique des ADC est en pleine effervescence. Son futur repose sur une meilleure compréhension des mécanismes d’action et de toxicité des molécules actuellement en développement. De nouvelles générations d’ADC intégrant des solutions technologiques innovantes ont pour objectif une meilleure efficacité antitumorale et une toxicité amoindrie, ainsi qu’un élargissement à de nouvelles indications et populations de patients grâce à l’utilisation de cibles inédites.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Un médicament est dit orphelin lorsqu’il est destiné au traitement de maladies rares (en France, < 5 personnes/10 000). Afin de stimuler la recherche et le développement de ces médicaments, les pouvoirs publics ont mis en place des mesures incitatives à l’attention des industriels de la santé et des biotechnologies.
Références
- Deligne C, Teillaud JL. Le double visage des anticorps monoclonaux en oncologie. Immunité passive et vaccination. Med Sci (Paris) 2013 ; 29 : 57–63. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Watier H. De la sérothérapie aux anticorps recombinants « nus » : plus d’un siècle de succès en thérapie ciblée. Med Sci (Paris) 2009 ; 25 : 999–1009. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Amar S, Moreno-Aspitia A, Perez EA. Issues and controversies in the treatment of HER2 positive metastatic breast cancer. Breast Cancer Res Treat 2008 ; 109 : 1–7. [CrossRef] [PubMed] [Google Scholar]
- Garrett CR, Eng C. Cetuximab in the treatment of patients with colorectal cancer. Expert Opin Biol Ther 2011 ; 11 : 937–949. [CrossRef] [PubMed] [Google Scholar]
- Hertler AA, Frankel AE. Immunotoxins: a clinical review of their use in the treatment of malignancies. J Clin Oncol 1989 ; 7 : 1932–1942. [PubMed] [Google Scholar]
- Barbet J, Chatal JF, Kraeber-Bodéré F. Les anticorps radiomarqués pour le traitement des cancers. Med Sci (Paris) 2009 ; 25 : 1039–1045. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Mathé G, Loc TB, Bernard J. Effet sur la leucémie 1210 de la souris d’une combinaison par diazotation d’A-méthoptérine et de gamma-globulines de hamsters porteurs de cette leucémie par hétérogreffe. CR Acad Sci Paris 1958 ; 246 : 1626–1628. [Google Scholar]
- Burnett AK, Russell NH, Hills RK, et al. Addition of gemtuzumab ozogamicin into induction chemotherapy improves survival in older patients with acute myeloid leukemia. J Clin Oncol 2012 ; 30 : 3924–3931. [CrossRef] [PubMed] [Google Scholar]
- Castaigne S, Pautas C, Terre C, et al. Effect of gemtuzumab ozogamicin on survival of adult patients with de-novo acute myeloid leukaemia (ALFA-0701): a randomised, open-label, phase 3 study. Lancet 2012 ; 379 : 1508–1516. [CrossRef] [PubMed] [Google Scholar]
- Przepiorka D, Deisseroth A, Kane R, et al. Gemtuzumab ozogamicin. J Clin Oncol 2013 ; 31 : 1699–1701. [CrossRef] [PubMed] [Google Scholar]
- Haute autorité de santé. Commission de la transparence. Avis du 6 mars 2013 sur ADCETRIS 50 mg, poudre pour solution à diluer pour perfusion. Displonible à http://www.has-sante.fr/portail/jcms/c_1517924/fr/adcetris [Google Scholar]
- Younes A, Gopal AK, Smith SE, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol 2012 ; 30 : 2183–2189. [CrossRef] [PubMed] [Google Scholar]
- Pro B, Advani R, Brice P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. J Clin Oncol 2012 ; 30 : 2190–2196. [CrossRef] [PubMed] [Google Scholar]
- Forero-Torres A, Leonard JP, Younes A, et al. A Phase II study of SGN-30 (anti-CD30 mAb) in Hodgkin lymphoma or systemic anaplastic large cell lymphoma. Br J Haematol 2009 ; 146 : 171–179. [CrossRef] [PubMed] [Google Scholar]
- Hynes NE, Stern DF. The biology of erbB-2/neu/HER-2 and its role in cancer. Biochim Biophys Acta 1994 ; 1198 : 165–184. [PubMed] [Google Scholar]
- Junttila TT, Li G, Parsons K, et al. Trastuzumab-DM1 (T-DM1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer. Breast Cancer Res Treat 2011 ; 128 : 347–356. [CrossRef] [PubMed] [Google Scholar]
- Barok M, Tanner M, Köninki K, et al. Trastuzumab-DM1 causes tumour growth inhibition by mitotic catastrophe in trastuzumab-resistant breast cancer cells in vivo. Breast Cancer Res 2011 ; 13 : R46. [CrossRef] [PubMed] [Google Scholar]
- Verma S, Miles D, Gianni L, et al. EMILIA study group trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012 ; 367 : 1783–1791. [CrossRef] [PubMed] [Google Scholar]
- Sassoon I, Blanc V. Antibody-drug conjugate (ADC) clinical pipeline: a review. Methods Mol Biol 2013 ; 1045 : 1–27. [CrossRef] [PubMed] [Google Scholar]
- Mathur R, Weiner GJ. Picking the optimal target for antibody-drug conjugates. Am Soc Clin Oncol Educ Book 2013 ; 2013 : 103–107. [CrossRef] [Google Scholar]
- Teicher BA. Antibody-drug conjugate targets. Curr Cancer Drug Targets 2009 ; 9 : 982–1004. [CrossRef] [PubMed] [Google Scholar]
- Haeuw JF, Caussanel V, Beck A. Les immunoconjugués, anticorps « armés » pour combattre le cancer. Med Sci (Paris) 2009 ; 25 : 1046–1052. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Jeffrey SC, Burke PJ, Lyon RP, et al. A potent anti-CD70 antibody-drug conjugate combining a dimeric pyrrolobenzodiazepine drug with site-specific conjugation technology. Bioconjug Chem 2013 ; 24 : 1256–1263. [CrossRef] [PubMed] [Google Scholar]
- Kung Sutherland MS, Walter RB, Jeffrey SC, et al. SGN-CD33A: a novel CD33-targeting antibody-drug conjugate using a pyrrolobenzodiazepine dimer is active in models of drug-resistant AML. Blood 2013 ; 122 : 1455–1463. [CrossRef] [PubMed] [Google Scholar]
- Senter PD. Potent antibody drug conjugates for cancer therapy. Curr Opin Chem Biol 2009 ; 13 : 235–244. [CrossRef] [PubMed] [Google Scholar]
- Ducry L, Stump B. Antibody-drug conjugates: linking cytotoxic payloads to monoclonal antibodies. Bioconjug Chem 2010 ; 21 : 5–13. [CrossRef] [PubMed] [Google Scholar]
- Erickson HK, Park PU, Widdison WC, et al. Antibody-maytansinoid conjugates are activated in targeted cancer cells by lysosomal degradation and linker-dependent intracellular processing. Cancer Res 2006 ; 66 : 4426–4433. [CrossRef] [PubMed] [Google Scholar]
- Doronina SO, Toki BE, Torgov MY, et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy. Nat Biotechnol 2003 ; 21 : 778–784. [CrossRef] [PubMed] [Google Scholar]
- Panowski S, Bhakta S, Raab H, et al. Site-specific antibody drug conjugates for cancer therapy. mAbs 2014 ; 6 : 34–45. [Google Scholar]
- Behrens CR, Liu B. Methods for site-specific drug conjugation to antibodies. MAbs 2014 ; 6 : 46–53. [CrossRef] [PubMed] [Google Scholar]
- Klinguer-Hamour C, Strop P, Shah DK, et al. World antibody-drug conjugate summit, October 15–16, 2013, San Francisco, CA. MAbs 2014 ; 6 : 18–29. [CrossRef] [PubMed] [Google Scholar]
- Moldenhauer G, Salnikov AV, Lüttgau S, et al. Therapeutic potential of amanitin-conjugated anti-epithelial cell adhesion molecule monoclonal antibody against pancreatic carcinoma. J Natl Cancer Inst 2012 ; 104 : 622–634. [CrossRef] [PubMed] [Google Scholar]
- Zhao RY, Wilhelm SD, Audette C, et al. Synthesis and evaluation of hydrophilic linkers for antibody-maytansinoid conjugates. J Med Chem 2011 ; 54 : 3606–3623. [CrossRef] [PubMed] [Google Scholar]
- Polu KR, Lowman HB. Probody™ therapeutics for targeting antibodies to diseased tissue. Expert Opin Biol Ther 2014 ; 20 : 1–5. [Google Scholar]
- Simon M, Frey R, Zangemeister-Wittke U, Plückthun A. Orthogonal assembly of a designed ankyrin repeat protein-cytotoxin conjugate with a clickable serum albumin module for half-life extension. Bioconjug Chem 2013 ; 24 : 1955–1966. [CrossRef] [PubMed] [Google Scholar]
- Da Silva PPJ, Bendjeddou LZ, Meijer L. Recherche de substances naturelles à activité thérapeutique (2) : George R. Pettit. Med Sci (Paris) 2014 ; 30 : 319–328. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des tableaux
ADC en développement clinique et approuvés au 31 mars 2014. Consulter [22] pour une comparaison avec 2009.
Liste des figures
 |
Figure 1. Anatomie d’un antibody drug conjugate (ADC) et caractéristiques clés de ses constituants. Un ADC est un anticorps monoclonal couplé à un agent cytotoxique par le biais d’un agent de liaison. Ce modèle 3D réalisé par Cendrine Lemoine (Sanofi, Vitry-sur-Seine, France) est construit à partir de trois éléments indépendants : la structure cristalline de l’IgG1 (immunoglobuline G1) humaine B12 disponible sous le code 1HZH dans la PDB (protein data bank), la représentation de l’agent de liaison SPDB (N-succinimidyl 4-[2-pyridyldithio]butanoate) et la représentation du dérivé de maytansine DM4 (communication personnelle). Dans cette représentation (SPDB-DM4 : jaune ; paratope de l’anticorps : rouge ; lysines de surface de l’anticorps : bleu), l’agent de liaison SPDB associe le maytansinoïde DM4 à quatre lysines de surface de l’anticorps. |
| Dans le texte | |
 |
Figure 2. Mécanisme d’action d’un antibody drug conjugate (ADC). Suite à la fixation de l’ADC sur son antigène cible (1) , le complexe antigène/ADC est internalisé par endocytose (2) . Le trafic intracellulaire et la fusion successive des vésicules endosomales (3) , leur acidification progressive, ainsi que la fusion avec les lysosomes (compartiments subcellulaires riches en enzymes protéolytiques) permettent la dégradation protéolytique de l’ADC (4a) . L’antigène peut être dégradé dans le lysosome (4a) ou recyclé à la membrane plasmique (4b) . L’agent cytotoxique est ensuite libéré dans le cytosol de la cellule tumorale sous la forme de métabolites dont la composition dépend de l’agent de liaison (5) [25–27]. Les métabolites peuvent alors inhiber la polymérisation de la tubuline (6a) ou induire des cassures double brin de l’ADN après migration au noyau (6b) , ce qui conduit à l’arrêt du cycle cellulaire, puis à la mort par apoptose. Certains métabolites, de par leurs propriétés physicochimiques, sont libérés par la cellule tumorale et peuvent diffuser dans l’espace extracellulaire, pénétrer les cellules environnantes et les tuer par effet bystander (7). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




