| Issue |
Med Sci (Paris)
Volume 30, Number 5, Mai 2014
|
|
|---|---|---|
| Page(s) | 514 - 517 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20143005013 | |
| Published online | 13 June 2014 | |
KCC2 : nouvelle cible thérapeutique pour le traitement de pathologies neurologiques
KCC2: a new therapeutical target for the treatment of neurological diseases
Centre de recherche de l’Institut universitaire en santé mentale de Québec, 2601, de la Canardière, G1J 2G3 Québec, Canada
*
yves.dekoninck@neuro.ulaval.ca
**
marc.bergeron.2@ulaval.ca
La famille SLC12 (solute carrier, transporteurs de solutés) des cotransporteurs cation-Cl- représente les produits de neuf gènes dont sept qui codent pour des protéines dont la fonction et les rôles physiologiques sont bien caractérisés. Parmi ces molécules, les cotransporteurs Na+-K+-Cl- isoforme 1 (NKCC1), et plus particulièrement K+-Cl- isoforme 2 (KCC2), jouent un rôle clé dans la régulation de l’activité des neurones du système nerveux central (SNC) en modulant principalement la concentration de Cl- intracellulaire ([Cl-]i).
Dans les neurones immatures, la [Cl-]i est élevée conséquemment à une forte expression de NKCC1 qui couple le mouvement des ions Na+ et K+ à celui du Cl- vers l’intérieur des neurones. Cela crée un effet dépolarisant voire, à la limite, excitateur en réponse au neurotransmetteur acide γ-aminobutyrique (GABA) qui laisse passer le Cl- par ses canaux de type A ouverts (Figure 1). En revanche, dans les neurones matures, la [Cl-]i est maintenue basse par une forte expression de KCC2 qui couple le mouvement des ions K+ à celui du Cl- vers l’extérieur des neurones, induisant un effet hyperpolarisant et fortement inhibiteur du GABA (Figures 1 et 2A). Ainsi, KCC2 joue un rôle physiologique très important chez l’adulte dans le maintien de l’inhibition post-synaptique, qui prévient une surexcitabilité neuronale [1].
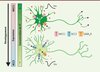 |
Figure 1. Effet du GABA sur les neurones immatures et matures. Au stade embryonnaire (en haut), l’activation des récepteurs GABAA et de la glycine (GABAA/Gly) engendre une dépolarisation (+) dûe à une forte expression de NKCC1 (rouge) qui importe le Cl- à l’intérieur de la cellule, et une expression quasi-nulle de KCC2 (bleu), qui exporte le Cl- hors de la cellule. Cette forte [Cl-]i (vert) entraîne une dépolarisation du potentiel membranaire (Vm) lors de l’ouverture des canaux Cl-. Cela confère un rôle trophique au GABA et stimule l’interconnectivité neuronale (flèches). En revanche, à l’âge adulte (en bas), l’activation des récepteurs GABAA/Gly induit une hyperpolarisation (-) dûe à une forte expression de KCC2 et une expression quasi-nulle de NKCC1. Ceci entraîne une baisse de la [Cl-]i et une hyperpolarisation du Vm lors de la stimulation des récepteurs GABAA/Gly ; d’où leur rôle principalement inhibiteur. |
Un dérèglement de l’activité (et/ou de l’expression) de KCC2 entraînera donc un dysfonctionnement du contrôle de l’activité neuronale. D’ailleurs, il semble que la perte d’activité (et/ou d’expression) de KCC2 sous-tende plusieurs désordres neurologiques et psychiatriques tels que l’épilepsie, le stress, l’anxiété, la spasticité motrice, l’hyper-algésie paradoxale induite par la morphine, la douleur chronique, la schizophrénie, voire même l’autisme [2].
Expression de KCC2 et blessure nerveuse périphérique
Dans un modèle animal de douleur chronique (constriction du nerf sciatique de rat avec un tube constricteur) (Figure 2B), nous avons démontré que la blessure nerveuse périphérique induisait une baisse d’expression de KCC2 et une perturbation de l’homéostasie du Cl- dans les neurones de la corne dorsale superficielle de la moelle épinière [3]. Nous avons par la suite montré que cette baisse d’expression de KCC2 dans la corne dorsale superficielle de la moelle épinière était le résultat de la libération du facteur neurotrophique brain-derived neurotrophic factor (BDNF) par la microglie activée (Figure 2B) [4]. Nous savons aussi que le BDNF produit ses effets en se liant spécifiquement aux récepteurs à activité tyrosine kinase de type B (TrkB). Cette liaison déclenche l’activation de différentes voies de signalisation intracellulaires qui agissent en modulant l’expression/activité de KCC2 principalement au niveau transcriptionnel et de la synthèse protéique (Figure 3A) [5]. Lors de douleurs neuropathiques chroniques, le BDNF joue donc un rôle prépondérant dans la régulation de KCC2 et, par conséquent, sur l’efficacité de l’inhibition neuronale via la modulation du gradient transmembranaire de Cl-.
 |
Figure 2. Effet du CLP257 dans un modèle animal de douleur chronique. A. En condition normale, la microglie est inactive et le neurone possède des propriétés synaptiques inhibitrices (-), une concentration intracellulaire basse en Cl- ([Cl-]i ; vert) et un potentiel membranaire (Vm) hyperpolarisé lors de l’ouverture des canaux Cl-. B. Chez un rat avec une blessure nerveuse périphérique (BNP), la constriction du nerf sciatique induit une activation de la microglie qui sécrète du BDNF. La liaison du BDNF au récepteur TrkB induit une baisse d’expression membranaire de KCC2 et conséquemment une hausse de la [Cl-]i. Cette hausse cause la dépolarisation du potentiel d’équilibre du Cl- ; il s’ensuit une hyperexcitabilité neuronale (+) responsable d’une hyperalgésie. C. Chez un rat ayant une blessure, la molécule CLP257 contrecarre le déficit d’extrusion de Cl- via une augmentation de l’expression membranaire de KCC2, qui entraîne une baisse de la [Cl-]i, et un retour à une excitabilité normale. |
 |
Figure 3. Mécanismes moléculaires impliqués dans la régulation de KCC2. A. Voies de signalisation diminuant l’activité et/ou l’expression de KCC2. La signalisation TrkB/BDNF modulerait l’expression de KCC2 à la baisse en recrutant deux cascades intracellulaires : (1) la voie de la phospholipase Cγ (PLCγ) et (2) la voie de la Src homology 2 domain containing transforming protein (Shc). La voie de la PLCγ modulerait la biosynthèse (transcription génique et traduction protéique) en stimulant en aval le facteur de transcription cAMP responses element-binding protein (CREB), alors que la voie de la Shc le ferait en stimulant les voies des protéines kinases Akt et Erk 1/2. Ces dernières activeraient en aval une (ou des) protéine(s) « X » qui modulerai(en)t la biosynthèse directement ou via le facteur CREB. L’entrée de Ca2+ via les récepteurs NMDA cause une baisse de l’activité de transport de KCC2 due à sa déphosphorylation par la Ser/Thr protéine phosphatase 1 (PP1), et une perte de son activité/expression due à sa protéolyse par une calpaïne. B. Voies de signalisation augmentant l’activité et/ou l’expression de KCC2. La phosphorylation (PO4 2-) de KCC2 par une PKC activée via les récepteurs 5-HT de type 2A (5-HT2A) de la sérotonine, par exemple, stabilise son expression fonctionnelle à la membrane plasmique par l’inhibition de son endocytose. La phosphorylation (PO4 2-) de KCC2 par une protéine tyrosine kinase (TyrK) induit son oligomérisation et sa translocation dans des radeaux lipidiques pour augmenter sa fonction. |
Activer KCC2 pour restaurer le potentiel d’inhibition neuronale
Dans ce contexte, il était intéressant de développer des activateurs du KCC2, dans le but de restaurer les propriétés inhibitrices de la transmission GABA/glycine liées à un défaut de l’homéostasie du Cl-. C’est ce que notre équipe a cherché à faire. Dans un récent travail [2], nous avons développé un test nous permettant de déterminer l’efficacité d’activateurs de KCC2 à l’aide de lignées cellulaires exprimant de manière stable le senseur ratiométrique de Cl- Cloméléon1 [6]. Plus de 95 000 composés ont été testés pour leur capacité à restaurer l’extrusion de Cl-. Parmi ceux-ci, 78 ont été sélectionnés, puis de nouveau testés, pour leur sélectivité envers KCC2 et leur faible toxicité, menant à l’identification d’un composé prometteur : le CL-058. Plus de 300 analogues de CL-058 ont alors été synthétisés afin d’améliorer son efficacité envers KCC2, ses caractéristiques pharmacologiques et sa biodisponibilité. La molécule CLP257 a été retenue, principalement grâce à sa meilleure stabilité chimique et ses propriétés générales compatibles avec l’élaboration de médicaments (voir [2]).
Dans ce travail, nous avons d’abord caractérisé CLP257 in vitro du point de vue fonctionnel et moléculaire sur des tranches de corne dorsale superficielle de la moelle épinière de rats naïfs, traitées ou non avec du BDNF, et de rats chez lesquels une blessure nerveuse périphérique a été faite (Figures 2A-C). Dans ces tranches, nous avons montré, par électrophysiologie et imagerie (durée de vie de fluorescence de l’indicateur de Cl- MQAE), que le CLP257 améliore l’efficacité d’extrusion du Cl- par KCC2 et restaure le potentiel d’inhibition neuronal du Cl- à des niveaux comparables à ceux qui sont observés chez des animaux naïfs non traités. De plus, des manipulations biochimiques (par exemple la biotinylation de surface cellulaire et l’immunobuvardage de type Western) ont permis de montrer que le CLP257 exerce ses effets en stimulant l’expression de KCC2 à la membrane plasmique (Figure 2C) sans changer l’expression totale de cette protéine, suggérant l’implication de mécanismes post-traductionnels plus que transcriptionnels et traductionnels (biosynthèse).
Nous avons par la suite évalué in vivo l’efficacité et la pharmacocinétique de CLP257, administré à des rats naïfs et soumis à une blessure nerveuse périphérique. Les réponses électrophysiologiques évoquées par la stimulation mécanique de la patte et enregistrées au niveau de la corne dorsale superficielle de la moelle épinière d’animaux naïfs et soumis à une blessure nerveuse périphérique (Figure 2A-C) ont montré que le CLP257 restaure l’inhibition des circuits impliqués [2]. Toutefois, la très faible biodisponibilité du CLP257 ne permettait pas d’obtenir des effets analgésiques suffisants et prolongés. Nous avons contourné ce problème en synthétisant une prodrogue, le CLP290. Celle-ci libère graduellement le métabolite actif CLP257 et permet d’améliorer significativement la pharmacocinétique. L’administration orale de CLP290 a un effet analgésique comparable à celui de la prégabaline (un analgésique très employé pour soigner les douleurs neuropathiques). À des doses analgésiques équipotentielles, le CLP290 provoque cependant moins d’effets secondaires moteurs que la prégabaline [2]. Ces travaux in vivo ont donc permis, d’une part, de corroborer nos résultats obtenus in vitro et, d’autre part, de démontrer clairement le potentiel analgésique des molécules CLP257 et CLP290.
Conclusion et perspectives
Les mécanismes moléculaires qui sous-tendent l’effet du CLP257 sur KCC2 demeurent toutefois méconnus. Plusieurs mécanismes de régulation connus pour baisser ou augmenter l’activité et/ou l’expression de KCC2 méritent d’être explorés. La Figure 3 résume certains mécanismes de signalisation endogènes qui ont été récemment mis en lumière [5, 7–10]. Il reste néanmoins beaucoup de travail à faire pour bien cerner toute la complexité des mécanismes impliqués dans la régulation du KCC2, notamment en conditions normales et pathologiques.
L’aspect le plus prometteur de nos travaux récents présentés ci-dessus, et de ceux d’autres groupes [7], est la démonstration qu’il est possible de corriger un déficit d’activité du KCC2 et non seulement d’en prévenir la perte d’activité. Il est donc possible d’envisager des traitements curatifs et non plus simplement préventifs. En outre, l’absence d’effets secondaires néfastes lorsque l’on augmente l’activité du KCC2 montre qu’il s’agit d’une cible adaptée au développement de nouveaux médicaments destinés au traitement de maladies neurologiques et mentales. La caractérisation plus approfondie des mécanismes moléculaires qui sous-tendent la régulation du KCC2 constitue donc une étape importante vers l’élaboration de cette nouvelle génération de médicaments.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Clomeleon est une protéine de fusion associant deux fluorophores : la protéine yellow fluorescent protein (YFP) sensible au chlore, et la protéine cyan fluorescent protein (CFP), insensible au Cl-. La proximité physique des deux fluorophores entraîne un transfert d’énergie (fluorescence resonance energy transfer [FRET]). La fluorescence YFP étant abolie (quenching) par le Cl−, l’émission calculée par le rapport FRET (YFP/CFP) est inversement proportionnelle à la concentration de Cl-.
Références
- Doyon N, Prescott SA, Castonguay A, et al. Efficacy of synaptic inhibition depends on multiple, dynamically interacting mechanisms implicated in chloride homeostasis. PLoS Comput Biol 2011 ; 7 : e1002149. [CrossRef] [PubMed] [Google Scholar]
- Gagnon M, Bergeron MJ, Lavertu G, et al. Chloride extrusion enhancers as novel therapeutics for neurological diseases. Nat Med 2013 ; 19 : 1524–1528. [CrossRef] [PubMed] [Google Scholar]
- Coull JA, Boudreau D, Bachand K, et al. Trans-synaptic shift in anion gradient in spinal lamina I neurons as a mechanism of neuropathic pain. Nature 2003 ; 424 : 938–942. [CrossRef] [PubMed] [Google Scholar]
- Coull JA, Beggs S, Boudreau D, et al. BDNF from microglia causes the shift in neuronal anion gradient underlying neuropathic pain. Nature 2005 ; 438 : 1017–1021. [CrossRef] [PubMed] [Google Scholar]
- Rivera C, Voipio J, Thomas-Crusells J, et al. Mechanism of activity-dependent downregulation of the neuron-specific K-Cl cotransporter KCC2. J Neurosci 2004 ; 24 : 4683–4691. [CrossRef] [PubMed] [Google Scholar]
- Kuner T, Augustine GJ. A genetically encoded ratiometric indicator for chloride: capturing chloride transients in cultured hippocampal neurons. Neuron 2000 ; 27 : 447–459. [CrossRef] [PubMed] [Google Scholar]
- Bos R, Sadlaoud K, Boulenguez P, et al. Activation of 5-HT2A receptors upregulates the function of the neuronal K-Cl cotransporter KCC2. Proc Natl Acad Sci USA 2013 ; 110 : 348–353. [CrossRef] [Google Scholar]
- Lee HH, Walker JA, Williams JR, et al. Direct protein kinase C-dependent phosphorylation regulates the cell surface stability and activity of the potassium chloride cotransporter KCC2. J Biol Chem 2007 ; 282 : 29777–29784. [CrossRef] [PubMed] [Google Scholar]
- Lee HH, Deeb TZ, Walker JA, et al. NMDA receptor activity downregulates KCC2 resulting in depolarizing GABAA receptor-mediated currents. Nat Neurosci 2011 ; 14 : 736–743. [CrossRef] [PubMed] [Google Scholar]
- Watanabe M, Wake H, Moorhouse AJ, et al. Clustering of neuronal K+-Cl- cotransporters in lipid rafts by tyrosine phosphorylation. J Biol Chem 2009 ; 284 : 27980–27988. [CrossRef] [PubMed] [Google Scholar]
© 2014 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Effet du GABA sur les neurones immatures et matures. Au stade embryonnaire (en haut), l’activation des récepteurs GABAA et de la glycine (GABAA/Gly) engendre une dépolarisation (+) dûe à une forte expression de NKCC1 (rouge) qui importe le Cl- à l’intérieur de la cellule, et une expression quasi-nulle de KCC2 (bleu), qui exporte le Cl- hors de la cellule. Cette forte [Cl-]i (vert) entraîne une dépolarisation du potentiel membranaire (Vm) lors de l’ouverture des canaux Cl-. Cela confère un rôle trophique au GABA et stimule l’interconnectivité neuronale (flèches). En revanche, à l’âge adulte (en bas), l’activation des récepteurs GABAA/Gly induit une hyperpolarisation (-) dûe à une forte expression de KCC2 et une expression quasi-nulle de NKCC1. Ceci entraîne une baisse de la [Cl-]i et une hyperpolarisation du Vm lors de la stimulation des récepteurs GABAA/Gly ; d’où leur rôle principalement inhibiteur. |
| Dans le texte | |
 |
Figure 2. Effet du CLP257 dans un modèle animal de douleur chronique. A. En condition normale, la microglie est inactive et le neurone possède des propriétés synaptiques inhibitrices (-), une concentration intracellulaire basse en Cl- ([Cl-]i ; vert) et un potentiel membranaire (Vm) hyperpolarisé lors de l’ouverture des canaux Cl-. B. Chez un rat avec une blessure nerveuse périphérique (BNP), la constriction du nerf sciatique induit une activation de la microglie qui sécrète du BDNF. La liaison du BDNF au récepteur TrkB induit une baisse d’expression membranaire de KCC2 et conséquemment une hausse de la [Cl-]i. Cette hausse cause la dépolarisation du potentiel d’équilibre du Cl- ; il s’ensuit une hyperexcitabilité neuronale (+) responsable d’une hyperalgésie. C. Chez un rat ayant une blessure, la molécule CLP257 contrecarre le déficit d’extrusion de Cl- via une augmentation de l’expression membranaire de KCC2, qui entraîne une baisse de la [Cl-]i, et un retour à une excitabilité normale. |
| Dans le texte | |
 |
Figure 3. Mécanismes moléculaires impliqués dans la régulation de KCC2. A. Voies de signalisation diminuant l’activité et/ou l’expression de KCC2. La signalisation TrkB/BDNF modulerait l’expression de KCC2 à la baisse en recrutant deux cascades intracellulaires : (1) la voie de la phospholipase Cγ (PLCγ) et (2) la voie de la Src homology 2 domain containing transforming protein (Shc). La voie de la PLCγ modulerait la biosynthèse (transcription génique et traduction protéique) en stimulant en aval le facteur de transcription cAMP responses element-binding protein (CREB), alors que la voie de la Shc le ferait en stimulant les voies des protéines kinases Akt et Erk 1/2. Ces dernières activeraient en aval une (ou des) protéine(s) « X » qui modulerai(en)t la biosynthèse directement ou via le facteur CREB. L’entrée de Ca2+ via les récepteurs NMDA cause une baisse de l’activité de transport de KCC2 due à sa déphosphorylation par la Ser/Thr protéine phosphatase 1 (PP1), et une perte de son activité/expression due à sa protéolyse par une calpaïne. B. Voies de signalisation augmentant l’activité et/ou l’expression de KCC2. La phosphorylation (PO4 2-) de KCC2 par une PKC activée via les récepteurs 5-HT de type 2A (5-HT2A) de la sérotonine, par exemple, stabilise son expression fonctionnelle à la membrane plasmique par l’inhibition de son endocytose. La phosphorylation (PO4 2-) de KCC2 par une protéine tyrosine kinase (TyrK) induit son oligomérisation et sa translocation dans des radeaux lipidiques pour augmenter sa fonction. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




