| Numéro |
Med Sci (Paris)
Volume 40, Numéro 5, Mai 2024
|
|
|---|---|---|
| Page(s) | 428 - 436 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024050 | |
| Publié en ligne | 31 mai 2024 | |
« Fort comme la mort »,* où comment l’efferocytose contrôle la résolution de l’inflammation
Strong as death or how efferocytotic macrophages promote the resolution of inflammation
1
Université de Franche-Comté, Établissement Français du Sang (EFS), Inserm, UMR 1098 RIGHT Besançon, France
2
LabEx LipSTIC, Besançon, France
3
Établissement Français du Sang, Recherche et développement, Grenoble, France
4
Université Grenoble Alpes, Inserm U1209, CNRS UMR5309, Institute for Advanced Biosciences, Grenoble, France
L’arrêt de la réponse inflammatoire, ou résolution de l’inflammation, est considéré aujourd’hui comme un processus actif lié à la production (ou à la libération) de composés anti-inflammatoires aussi appelés composés pro-résolutifs. L’évènement permettant d’enclencher la résolution de l’inflammation est l’élimination des cellules immunitaires apoptotiques par les macrophages, un processus nommé efferocytose, dont l’altération est à l’origine de différentes maladies. Dans cette synthèse, nous décrivons les étapes de cette efferocytose et les mécanismes qui en résultent et permettent de stopper l’inflammation. Nous évoquerons également de nouvelles pistes thérapeutiques fondées sur les facteurs pro-résolutifs : la thérapie résolutive.
Abstract
The resolution of inflammation is an active process leading to the restoration of tissue homeostasis. A critical step in the initiation of this process is the elimination of apoptotic immune cells by macrophages. This well-organized process, called efferocytosis, involves four different steps, namely the attraction of macrophages to the site where the cells die, the recognition of apoptotic cells, their internalization and their digestion leading to the activation of different metabolic pathways. All these steps are responsible for the reprogramming of macrophages towards a pro-resolving profile. Efferocytic macrophages produce several factors involved in the resolution of inflammation. These factors include lipids (i.e., specialized pro-resolving mediators such as lipoxins), and proteins (e.g., IL-10 or TGF-β). Here, we describe the different steps of efferocytosis and the mechanisms responsible for both macrophage reprogramming and the release of pro-resolving factors. These factors may represent a new therapeutic approach, called resolution therapy.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.

Vignette © Philippe Saas).
Rôle de l’inflammation : les différentes étapes de l’inflammation
L’inflammation est une réponse immédiate de l’organisme à une agression. La réponse inflammatoire et la mobilisation du système immunitaire permettent en effet l’élimination de l’agression et le retour à l’homéostasie tissulaire. Ces agressions peuvent être exogènes, comme l’exposition à des agents pathogènes (bactéries, virus, champignons, etc.), ou endogènes, comme l’émergence de cellules endommagées ou la transformation maligne aboutissant à des cellules cancéreuses [1]. De multiples agressions peuvent endommager les tissus : des radiations ionisantes, des produits chimiques, des toxines végétales ou bactériennes, etc. Cliniquement, l’inflammation est caractérisée par quatre signes cardinaux : rougeur, fièvre (chaleur), œdème (gonflement) et douleur [2]. Ces signes cardinaux de l’inflammation sont connus depuis l’antiquité ; leur description est attribuée à Aulus Cornelius Celsus (francisé sous le nom de Celse), contemporain de l’empereur Auguste (fin du 1er siècle avant Jésus Christ - début du 1er siècle).
L’inflammation est déclenchée par la reconnaissance de dommages (plus précisément de signaux de danger) par les cellules immunitaires résidentes du tissu agressé, comme les macrophages et les mastocytes. Ces signaux de danger sont de deux types en fonction de leur origine : les motifs moléculaires associés aux agents pathogènes (PAMP pour pathogen-associated molecular pattern) et, par analogie, les motifs moléculaires associés aux dommages tissulaires (DAMP pour damage-associated molecular pattern) [1]. Ces motifs sont reconnus par les récepteurs de reconnaissance des pathogènes (PRR pour pathogen recognition receptors) exprimés principalement par les cellules de l’immunité innée, et ils entraînent l’activation de diverses voies de signalisation, la plus connue étant la voie impliquant le facteur de transcription NF-κB (nuclear factor-kappa B). Ainsi, l’interaction entre le lipopolysaccharide (LPS) de la paroi des bactéries à Gram négatif avec le récepteur TLR4 (toll-like receptor-4) active la voie NF-κB et induit la synthèse de médiateurs inflammatoires, comme des cytokines (l’interleukine-1β [IL-1β], l’IL-6 et le TNF-α [tumor necrosis factor-α]) ou des chimiokines (l’IL-8) [1,3] (→).
(→) Voir la Nouvelle de E. Daguindau et al., m/s n° 5, mai 2023, page 418
Sécrétée par les cellules endothéliales activées en réponse au TNF-α libéré par les macrophages résidents, la chimiokine IL-8 va permettre, dans un premier temps, le recrutement des polynucléaires (ou granulocytes) neutrophiles. Ces polynucléaires neutrophiles sont recrutés depuis le flux sanguin par un mécanisme de diapédèse leur permettant une migration à travers les cellules endothéliales qui constituent la paroi vasculaire. Ils migrent ensuite vers le site endommagé, où ils s’opposent à l’agression [4].
Les polynucléaires neutrophiles sont les principales cellules de l’immunité innée luttant contre les infections bactériennes [4]. Ces cellules sont douées de phagocytose, c’est-à-dire de la capacité d’engloutissement des agents pathogènes dans des vésicules, les phagosomes, formées par invagination de leur membrane plasmique. Les phagosomes fusionnent ensuite avec des lysosomes1, permettant l’élimination du pathogène grâce à différentes enzymes apportées par ces organites, ainsi que la production d’espèces réactives de l’oxygène (ROS pour reactive oxygen species). Les polynucléaires neutrophiles peuvent également émettre des NET (neutrophil extracellular trap), de véritables filets composés de chromatine recouverte de nombreux peptides antimicrobiens et d’enzymes qui permettent la capture et la dégradation des agents pathogènes, en particulier ceux ayant une taille empêchant leur internalisation dans la cellule phagocytaire, comme les champignons [5] (→) ; le polynucléaire neutrophile se comporte ainsi comme un rétiaire, un gladiateur armé d’un trident et d’un filet dans lequel il cherche à envelopper son adversaire. Ces cellules produisent également des médiateurs pro-inflammatoires, dont la chimiokine MCP1 (monocyte chemoattractant protein-1), qui va permettre, dans un second temps, le recrutement à partir du sang périphérique de monocytes, qui se différencieront en macrophages pro-inflammatoires, une fois parvenus dans les tissus [6]. Ces macrophages, comme les polynucléaires neutrophiles, phagocytent les agents pathogènes et produisent des ROS et des médiateurs pro-inflammatoires permettant le maintien du processus inflammatoire. Les macrophages peuvent également présenter, via les molécules du complexe majeur d’histocompatibilité (CMH) de classe II qu’ils expriment, les peptides dérivés de l’agent pathogène ingéré et dégradé, afin d’induire une réponse immunitaire adaptative. La présentation des peptides microbiens aux lymphocytes par les macrophages est cependant considérée comme marginale, celle-ci étant plutôt l’apanage des cellules dendritiques conventionnelles (cDC). Les macrophages sont en effet très riches en protéases lysosomiques qui procèdent à la dégradation complète de l’agent internalisé [7].
(→) Voir la Synthèse de V. Granger et al., m/s n° 5, mai 2014, page 544
Cette description de la réponse inflammatoire que nous venons de proposer est celle que l’on nomme réponse inflammatoire « simple », mais les macrophages interviennent également au cours de la réponse inflammatoire dite « complexe » (Figure 1). Le rôle des macrophages est en effet primordial dans la résolution de la réponse inflammatoire. Si la mise en place de la réponse immunitaire spécifique, impliquant les cDC, les lymphocytes T et les lymphocytes B, est nécessaire pour contrôler l’agression et y remédier, le macrophage interviendra plus tard pour stopper l’inflammation et restaurer l’homéostasie. Alors pro-résolutif, le macrophage dialoguera avec le fibroblaste (l’autre artisan de la réparation tissulaire), et pourra recruter et stimuler les cellules souches afin de reconstituer le tissu lésé.
 |
Figure 1. Les différentes étapes de la réponse inflammatoire. A. Cinétique de recrutement des polynucléaires neutrophiles (PNN) et des macrophages (Mφ) intervenant dans la réponse inflammatoire « simple » ou « basique » (sans l’intervention de l’immunité spécifique). Une première vague de PNN intervient pour lutter contre l’agression. Ces cellules entrent en apoptose après la production de radicaux oxygénés (ROS) consé- cutive à la phagocytose. Les macrophages sont attirés sur le site de l’agression par la chimiokine MCP1 produite par les PNN activés, mais aussi par les signaux « trouvez- moi » (« find-me ») libérés par les PNN apoptotiques (PNN A). L’efferocytose des PNN apoptotiques déclenche la résolution de l’inflammation et permet la reprogrammation des macrophages pro-inflammatoires (phénotype M1) vers le profil de macrophage pro-résolutif ou efferocytique (Meff). B. Cinétique de recrutement des cellules impliquées dans une réponse inflammatoire « complexe » (impliquant l’immunité spécifique). Les défenses mises en place par les PNN et les macrophages ne suffisent pas à contrôler l’agression. Les cellules dendritiques conventionnelles (cDC) sont activées par les signaux de danger, migrent dans les ganglions les plus proches, où elles déclenchent la réponse immunitaire spécifique. Les lymphocytes T activés (L) arrivent sur le site de l’agression et l’éliminent avec la collaboration de la réponse humorale (lymphocytes B, se différenciant en plasmocytes, sécréteurs d’anticorps). Ces lymphocytes entrent en apoptose sur le site endommagé, et sont éliminés par les macrophages qui, comme dans le graphique en A, sont attirés par les signaux « trouvez-moi » (« find-me ») des lymphocytes apoptotiques (LA) et sont reprogrammés vers le profil pro-résolutif (Meff) pour déclencher la résolution. Les temps indiqués sont arbitraires. |
Rôle de l’efferocytose dans la résolution de l’inflammation
Il est aujourd’hui admis que la résolution de l’inflammation ne résulte pas de la simple disparition des facteurs et des cellules pro-inflammatoires, mais représente bien un processus actif. L’un des éléments clés de la résolution de l’inflammation est l’efferocytose (du grec efferre signifiant « emporter dans la tombe/enterrer »). Ce processus correspond à l’élimination par les macrophages des cellules (polynucléaires neutrophiles ou lymphocytes) apoptotiques (Figure 1). L’efferocytose joue aussi un rôle important dans un contexte non inflammatoire. Chaque jour, plusieurs milliards de cellules meurent par apoptose et sont rapidement éliminées par les cellules phagocytaires résidentes : les macrophages ou, dans certains tissus peu accessibles aux macrophages, des cellules spécialisées, comme les cellules de Sertoli de l’épithélium des tubes séminifères ou les cellules de l’épithélium pigmentaire de la rétine [8]. L’apoptose est une mort cellulaire programmée considérée comme silencieuse, non immunogène, voire tolérogène [9]. Cette absence d’immunogénicité est liée à l’absence de rupture de la membrane plasmique des cellules lors de ce processus de mort cellulaire ; certains DAMP intracellulaires ne seront pas libérés dans le milieu extracellulaire et n’induiront donc pas d’inflammation. Pour que cette mort cellulaire reste silencieuse, les cellules apoptotiques doivent être éliminées rapidement afin de ne pas entrer en nécrose secondaire, un processus au cours duquel la membrane plasmique se rompt, permettant alors la libération des DAMP dans le milieu extracellulaire [9] (→).
(→) Voir la Synthèse de L. Cabon et al., m/s n° 12, décembre 2013, page 1117
En plus de leur rapide élimination, deux mécanismes de sûreté supplémentaires préviennent l’immunogénicité des cellules apoptotiques : leur « désarmement » par l’activation de caspases, des protéases qui inactivent certains DAMP et préparent la cellule mourante à être éliminée ; et la libération et l’expression transitoires de facteurs anti-inflammatoires (Figure 2) [8,10,11].
 |
Figure 2. Les mécanismes à l’origine de la réponse silencieuse voire anti-inflammatoire de la mort par apoptose. Un des évènements majeurs de l’apoptose est l’activation des caspases, qui vont permettre, d’une part, de désarmer les cellules apoptotiques en inactivant les signaux de danger endogènes (DAMP), comme HMGB1 [high mobility group box 1]) [8,10,11,44], et rendre ainsi moins inflammatoires les cellules mourantes. D’autre part, l’activation des caspases va préparer la cellule apoptotique à être éliminée par les phagocytes (dont le macrophage) en produisant des signaux d’attraction (signaux « trouvez-moi », comme les nucléotides ATP/UTP et la lysophosphatidylcholine [LPC]), en facilitant la reconnaissance de la cellule apoptotique grâce à l’expression de signaux « mangez-moi » (comme les phosphatidylsérines [PS] passant du feuillet interne vers le feuillet externe de la membrane plasmique), tout en éliminant certains signaux repoussoirs (« ne me mangez pas ») comme le CD46. Ces signaux ne sont pas tous dépendants des caspases, comme l’émission des signaux « trouvez-moi », tels que CX3CL1 ou S1P (sphingosine-1-phosphate), ou la perte ou la modification des signaux « ne me mangez pas », tels que CD47 et CD31. Les cellules apoptotiques vont produire un environnement anti-inflammatoire ou immunosuppresseur transitoire par la libération de métabolites (dihydroxy-acétone phosphate [DHAP], fructose-1, 6-biphosphate [FBP], guanosine-5’-monophosphate [GMP], inosine-5’-monophosphate [IMP], ou spermidine), de cytokines (IL-10 et TGF-β), et de médiateurs pro-résolutifs (annexine-A1 [Anx-A1], thrombospondine-1 [Thbs1] [19,45]). |
Historiquement, trois travaux ont permis de révéler le rôle majeur de l’efferocytose médiée par les macrophages dans la résolution de l’inflammation. Le premier, publié à la fin des années 1980, rapportait le rôle des macrophages dans l’élimination des polynucléaires neutrophiles apoptotiques au cours de l’inflammation [12]. Les deux autres, publiés presque 10 ans plus tard, démontraient que les macrophages éliminant les leucocytes apoptotiques libéraient des médiateurs anti-inflammatoires, tels que l’IL-10 ou le TGF-β (transforming growth factor β) [13,14]. Ces observations attestaient ainsi du rôle anti-inflammatoire des macrophages capables d’éliminer les cellules apoptotiques, que nous appellerons « macrophages efferocytiques ». S’appuyant sur ces travaux, notre laboratoire a proposé, pour la première fois, l’administration de leucocytes apoptotiques comme approche thérapeutique pour moduler les réponses immunitaires [15].
En plus de son rôle dans la réponse inflammatoire, l’efferocytose intervient également lorsqu’un grand nombre de cellules apoptotiques sont produites, comme pendant la mise en place de structures tissulaires, lors du développement embryonnaire ou lors du renouvellement cellulaire de certains tissus, processus que l’on désigne par « life after death »2 [16].
Les quatre étapes de l’efferocytose
L’efferocytose repose sur la reprogrammation du macrophage, d’un phénotype pro-inflammatoire (M1) vers un profil anti-inflammatoire (Meff). Elle comporte quatre étapes : la libération de médiateurs dits « trouvez-moi » (« find-me ») par les cellules apoptotiques, qui attirent les macrophages sur le site inflammatoire où meurent les cellules immunitaires (polynucléaires neutrophiles ou lymphocytes) ; la phase « mangez-moi » (« eat-me ») correspondant à la reconnaissance de la cellule apoptotique par le macrophage ; la phase d’ingestion de la cellule apoptotique par le phagocyte ; et la digestion des constituants de la cellule apoptotique ingérée qui activeront diverses voies métaboliques participant à l’efficacité de l’efferocytose et la reprogrammation du macrophage [17] (Figure 3).
 |
Figure 3. Les quatre étapes de l’efferocytose conduisant à la reprogrammation du macrophage pro-inflammatoire vers un profil pro-résolutif. L’efferocytose se déroule en 4 étapes : 1) l’attraction du macrophage par l’émission des signaux « trouvez-moi » (« find-me ») par la cellule apoptotique (ici le polynucléaire neutrophile) ; 2) la reconnaissance par le macrophage de la cellule apoptotique grâce aux signaux « mangez-moi » (« eat-me ») comme les phosphatidylsérines (PS) pouvant être reconnues de manière directe (via la stabiline-2 [Stab2]) ou indirecte via des molécules de pontage (growth arrest-specific 6 [GAS6] se fixant sur les récepteurs MerTK ou Axl) ; 3) l’ingestion, qui implique un remaniement du cytosquelette (microfilaments d’actine) sous le contrôle de Rac-1, appartenant à la famille des GTPases Ras ; puis 4) la digestion des composés des cellules apoptotiques (lipides dégradés en cholestérol et acides gras à l’origine de l’activation des récepteurs nucléaires LXR et PPARδ et γ ; protéines dégradées en acides aminés, comme l’arginine transformée en putrescine par l’arginase-1 [Arg-1] et l’ornithine décarboxylase [ODC] ; les acides nucléiques, dégradés en nucléotides par la DNAse II, qui activent la protéine kinase dépendante de l’ADN [DNA-PK]). L’efferocytose aboutit à la reprogrammation du macrophage d’un profil pro-inflammatoire vers un profil pro-résolutif. Ces deux profils se distinguent, entre autres, par l’activation de la voie NF-κB dans le macrophage pro-inflammatoire et son inhibition dans le macrophage pro-résolutif. Le profil pro-résolutif est caractérisé par la synthèse de cytokines anti-inflammatoires (IL-10 et TGF-β), de médiateurs lipidiques pro-résolutifs (SPM comme les lipoxines ou les résolvines) et de facteurs de croissance (IGF-1 et VEGF). Les abréviations sont définies dans le texte (figure réalisée avec le logiciel BioRender). |
La première étape correspond à l’étape d’attraction des macrophages (par les signaux « trouvez-moi »). Les polynucléaires neutrophiles ou les lymphocytes, recrutés pendant l’inflammation ou participant à la réponse immunitaire adaptative (Figure 1), subissent une mort par apoptose, ceci afin d’éviter la libération de leurs contenus intracellulaires toxiques [18]. Ces cellules apoptotiques produisent différentes molécules, comme la fractalkine (ou CX3CL1 pour C-X3-C motif chemokine ligand 1) ou la sphingosine-1-phosphate (S1P), qui permettent le recrutement des macrophages au site de l’inflammation [19] (Figure 2 et Figure 3). Elles sécrètent également des signaux, appelés « keep out »3, comme la lactoferrine, qui empêchent le recrutement de nouveaux polynucléaires neutrophiles afin de limiter la réponse inflammatoire [20].
L’étape suivante, dans laquelle le macrophage va reconnaître la cellule cible comme étant apoptotique, se met alors en place. L’une des caractéristiques du processus d’apoptose est l’externalisation, sur les feuillets externes de la membrane plasmique des cellules mourantes, des phosphatidylsérines (PS) (mais également l’expression des protéines calréticuline et annexine-1) [9,17]. Ces PS, qui sont le signe que la cellule est mourante, sont reconnues par le macrophage soit directement, soit indirectement, grâce aux récepteurs « mangez-moi » qu’il exprime, comme les protéines MerTK (MER receptor tyrosine kinase), Axl et Tyro3, des membres de la famille des récepteurs à activité tyrosine kinase, aussi appelés récepteurs TAM (pour Tyro, Axl, MerTK). Les TAM reconnaissent indirectement les PS. Ces récepteurs ne s’activent en effet que lorsqu’ils interagissent avec des protéines de pontage, Gas6 (growth-arrest-specific 6) ou S, qui sont sécrétées par le macrophage et réalisent la jonction avec la PS [21,22]. L’activation de ces récepteurs stimule différentes voies de signalisation dans le macrophage, ce qui entraîne l’inhibition de la voie pro-inflammatoire NF-κB, et le remaniement du cytosquelette, permettant l’ingestion de la cellule apoptotique par un mécanisme dépendant de Rac1 [8,23]. D’autres protéines de pontage, comme la lactadhérine, ou MFG-E8 (pour milk fat globule-EGF Factor 8), établissent le lien entre les PS des cellules apoptotiques et l’intégrine αVβ3 présente à la surface du macrophage. Le macrophage reconnaît également directement les PS grâce à des récepteurs présents à sa surface, comme BAI-1 (brain angiogenesis inhibitor-1), la stabiline-2 ou TIM-4 (T cell immunoglobulin mucin protein-4) [8].
Les signaux « mangez-moi » ne se limitent pas aux PS. D’autres mécanismes de reconnaissance par le macrophage ont également été décrits, comme la modification des sucres ou l’oxydation des lipides de la membrane des cellules apoptotiques, ou encore la reconnaissance des résidus thrombospondine-1 exprimés par la cellule apoptotique, reconnus par le CD36 associé à des intégrines [8,24,25]. Après avoir été reconnue, la cellule apoptotique va être ingérée par le macrophage dans des efferosomes, des vésicules comparables aux phagosomes (Figure 3).
Certains signaux modulent la reconnaissance par le macrophage des signaux « mangez-moi » des cellules apoptotiques. Il s’agit des signaux « ne me mangez pas » (« don’t eat-me »), qui se comportent comme de véritables repoussoirs empêchant ainsi la reconnaissance et l’élimination de cellules vivantes. Ces signaux disparaissent généralement lorsque la cellule entre en apoptose. Citons par exemple le CD31, le CD47 ou encore le CD46, qui sont reconnus par des récepteurs spécifiques exprimés par le macrophage, comme SIRP-α (signal-regulatory protein alpha) (Figure 2). En particulier, le couple formé par CD47 et SIRP-α, respectivement exprimés par la cellule vivante et par le macrophage, a été décrit comme une cible thérapeutique favorisant l’élimination de cellules tumorales apoptotiques « récalcitrantes » [26].
Après que les cellules apoptotiques ont été ingérées et dégradées, leurs différents métabolites (lipides, protéines, acides nucléiques) activent diverses voies métaboliques, induisant un changement transcriptomique à l’origine de la reprogrammation du macrophage, du phénotype pro-inflammatoire M1 au phénotype pro-résolutif Meff (Figure 3). Ainsi, le cholestérol et les acides gras, produits de dégradation des lipides issus de la cellule apoptotique, activent respectivement les récepteurs nucléaires LXR (liver x receptor) et PPAR (peroxisome proliferator-activated receptor) γ et δ [19,27], qui induisent la transcription du gène codant le récepteur MerTK, favorisant la mise en place d’une efferocytose continue. Ainsi nommée par Ira Tabas (Department of Medicine, Columbia University, New York, États-Unis), cette efferocytose continue permet aux macrophages d’éliminer les cellules apoptotiques jusqu’à leur totale disparition [27,28]. La reprogrammation M1/Meff du macrophage s’accompagne également d’un changement de son sécrétome, passant de la production de médiateurs pro-inflammatoires à des médiateurs anti-inflammatoires ou pro-résolutifs (Figure 3 et Figure 4).
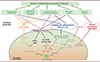 |
Figure 4. Les mécanismes pro-résolutifs du macrophage efferocytique faisant suite à la digestion des cellules apoptotiques. L’étape de digestion des cellules apoptotiques (polynucléaires neutrophiles ou lymphocytes) par le macrophage est centrale dans la production de facteurs pro-résolutifs du fait de l’activation de différentes voies métaboliques. Ainsi, la dégradation des lipides des cellules apoptotiques induit, via la voie LXR, l’enzyme arachidonate 15-lipoxygénase (Alox15) impliquée dans la synthèse de lipides pro-résolutifs (SPM), mais aussi l’expression de récepteurs « eat-me », MerTK et la transglutaminase 2 [TGM2], ainsi que, via les voies PPAR δ et γ, Axl, MerTK, CD36, et de molécules de pontage comme MFG-E8. Ceci va stimuler l’efferocytose continue favorisant l’élimination des cellules apoptotiques sur une longue durée. Les acides gras vont aussi stimuler, via la forme oxydée du nicotinamide adénine dinucléotide (NAD+), la voie de la sirtuine-1 (SIRT1) à l’origine de la production d’IL-10 [27]. La dégradation des protéines des cellules apoptotiques en acides aminés permet aussi d’exercer des fonctions pro-résolutives comme c’est le cas de la putrescine, issue de la dégradation de l’arginine, qui va stimuler l’efferocytose continue. Les SPM possèdent des propriétés pro-résolutives avec l’induction de l’arrêt du recrutement des cellules inflammatoires, l’apoptose des polynucléaires neutrophiles, la stimulation de l’efferocytose, et la reprogrammation des macrophages vers le profil Meff (macrophage efferocytique). Les facteurs de croissance libérés par les macrophages efferocytiques, comme le VEGF ou l’IGF1, stimulent la réparation tissulaire. Toutes ces propriétés pro-résolutives (notées dans les rectangles verts sur la figure) vont aboutir au retour à l’homéostasie cellulaire et tissulaire. À noter que les signaux « find-me » émis par les cellules mourantes et la reconnaissance des cellules apoptotiques peuvent aussi induire la synthèse de facteurs pro-résolutifs (voir [19]). Ainsi, les récepteurs « eat-me » induisent la synthèse de cytokines anti-inflammatoires (flèche violette) et, de manière indirecte via ces cytokines, participent à la reprogrammation des macrophages et à l’arrêt du recrutement des cellules inflammatoires (flèches violettes en tirets). L’astérisque identifie des voies qui peuvent différer entre les macrophages efferocytiques humains et murins : l’arginase [Arg-1], marqueur prototypique des macrophages anti-inflammatoires murins, est absente dans les mêmes macrophages humains, et la voie LXR n’est pas toujours anti-inflammatoire dans les macrophages humains (pour plus de détail, voir la référence [46]). Les flèches en trait pointillé représentent un lien faisant intervenir des intermédiaires non précisés dans cette figure (figure réalisée en partie avec le logiciel BioRender). |
Les mécanismes de l’efferocytose participant à la résolution de l’inflammation
L’efferocytose et la reprogrammation du macrophage efferocytique vont conduire à la libération ou à la production de facteurs pro-résolutifs qui permettront de stopper la réponse inflammatoire. Ces facteurs peuvent correspondre à des protéines, des lipides ou même des gaz [29]. Tous n’ont pas pour origine le macrophage. Dans cette revue, nous nous limiterons cependant à ceux impliquant le macrophage efferocytique (Figure 4).
Parmi les fonctions définissant les facteurs pro-résolutifs, certaines paraissent plus importantes, comme leur capacité d’arrêter la migration des leucocytes (polynucléaires neutrophiles et monocytes) vers le site inflammatoire, leur effet pro-apoptotique sur les polynucléaires neutrophiles, leur capacité à stimuler l’efferocytose (dont l’efferocytose continue), ou encore leur rôle dans la stimulation de la réparation tissulaire, qui permet le retour à l’état d’homéostasie. Les cellules apoptotiques elles-mêmes possèdent des propriétés pro-résolutives transitoires, comme l’expression du récepteur CCR5 (C-C motif chemokine receptor 5), qui lie et séquestre les chimiokines pro-inflammatoires CCL (C-C motif chemokine ligand) 3 et 5, ou la lactoferrine (un signal « keep out »), empêchant le recrutement de nouveaux leucocytes [20,30]. Les cellules apoptotiques peuvent également libérer des cytokines anti-inflammatoires aux propriétés immunosuppressives, comme l’IL-10 et le TGF-β (Figure 2) [19].
Après leur reprogrammation, les macrophages efferocytiques vont produire ces mêmes cytokines, mais aussi des lipides pro-résolutifs, ou SPM (specialized pro-resolving mediators), comme la lipoxine A4 (LxA4) ou la résolvine D5 (RvD5), qui dérivent des acides gras ω3 (pour les résolvines, protectines et marésines) et ω6 (pour les lipoxines) [31]. La LxA4, par exemple, favorise l’efferocytose des cellules apoptotiques par les macrophages, réduit la production de ROS par les monocytes, inhibe le recrutement des polynucléaires neutrophiles et accélère leur apoptose [32]. Des facteurs de croissance qui stimulent la réparation tissulaire, comme le VEGF (vascular endothelial growth factor) ou l’IGF-1 (insulin-growth factor-1), sont également produits par les macrophages efferocytiques [33]. Tous ces médiateurs anti-inflammatoires ou résolutifs (Figure 4) ont comme finalité d’induire un retour à l’homéostasie tissulaire, en inhibant tous les processus induits par l’inflammation pour éliminer l’agression, et en stimulant la réparation du tissu agressé. Une dérégulation de ces mécanismes d’efferocytose ou de résolution aboutit donc à des situations pathologiques.
Le concept de l’inflammation non résolutive
Le concept d’inflammation non résolutive, énoncé par Carl Nathan et Aihao Ding (Department of Microbiology and Immunology, Cornell University, New York, États-Unis), permet d’expliquer des conditions pathologiques aussi diverses que les maladies auto-immunes, l’athérosclérose, l’obésité, l’asthme et même l’inflammation chronique associée aux cancers [34]. En effet, lorsque les différentes étapes de la résolution de l’inflammation sont altérées, il en résulte une inflammation chronique non résolutive associée à une fibrose.
Comme nous l’avons vu, l’efferocytose médiée par les macrophages est un processus essentiel pour le maintien de l’homéostasie : elle prévient en effet la libération de DAMP intracellulaires, qui sont susceptibles d’induire une réponse auto-immune [21,27]. Le lupus érythémateux systémique (LES) est un bon exemple de maladie auto-immune liée à une efferocytose altérée [21,35]. Dans cette maladie, l’accumulation de cellules apoptotiques est provoquée par une diminution des capacités d’efferocytose des macrophages, et des auto-anticorps dirigés contre des antigènes nucléaires, l’ADN double brin ou des phospholipides, sont alors produits. De nombreux modèles murins chez lesquels des gènes codant un récepteur impliqué dans l’efferocytose, comme MerTK, ont été invalidés, développent spontanément une maladie de type lupique [35]. De même, une altération de la digestion des cellules apoptotiques par les lysosomes, notamment la digestion des acides nucléiques provenant de ces cellules dans le cas d’un déficit en DNAse II, est à l’origine d’une polyarthrite associée à une anémie [36]. L’altération de l’une des différentes phases de l’efferocytose peut ainsi conduire à une inflammation non résolutive. L’induction d’une efferocytose efficace chez les patients chez lesquels celle-ci est altérée pourrait donc constituer une solution thérapeutique pour ces maladies.
Applications thérapeutiques
La compréhension des mécanismes de la résolution de l’inflammation et de l’efferocytose a conduit au développement de ce qui est nommé « pharmacologie résolutive ». Cette « pharmacologie » consiste à cibler, non pas la phase pro-inflammatoire de l’inflammation (qui est nécessaire pour contrôler l’agression), mais à accélérer la phase de résolution. Elle s’adresse donc aux maladies associées à l’inflammation non résolutive et s’appuie sur des facteurs pro-résolutifs protéiques, tels que l’annexine-1 ou DEL-1 [developmental endothelial locus-1] [37,38], ou sur des facteurs lipidiques, les SPM, comme les lipoxines, les résolvines, les protectines et les marescines [31]. Récemment, la liste des candidats pour ce type de traitement s’est étendue à des anticorps (anticorps anti-CD3 par exemple) [39] (→), à des produits biologiques complexes (comme le sécrétome de macrophages efferocytiques) [40], ou à des médicaments de thérapie innovante (ou MTI), comme des leucocytes apoptotiques (tels que l’Allocetra™) [41]. Le terme « thérapie résolutive », remplaçant celui de « pharmacologie résolutive », devient ainsi préférable pour décrire cette nouvelle approche thérapeutique.
(→) Voir la Nouvelle de S. Perruche et P. Saas, m/s n° 4, avril 2009, page 325
Conclusion
La résolution de l’inflammation est un processus actif organisé avec précision. La compréhension de ce processus, et de la place centrale de l’efferocytose impliquant le macrophage, a permis d’identifier de nouveaux dérèglements physiopathologiques. Elle laisse désormais entrevoir, avec les « thérapies résolutives », de nouvelles pistes thérapeutiques prometteuses. Un des défis de ces thérapies résolutives reste cependant la nécessité de définir, pour les facteurs pro-résolutifs, la bonne cinétique et le meilleur site d’injection au cours de la réponse inflammatoire. Certains de ces facteurs sont en effet très labiles et se dégradent rapidement [19]. En conditions physiologiques, ces facteurs sont produits transitoirement, sur une période définie, jusqu’à l’arrêt de l’inflammation. Un risque de sur-immunosuppression pourrait donc apparaître avec ces traitements, même si cela ne semble pas être le cas dans les modèles expérimentaux [40]. Il semblerait même que « le contrôle raisonné » de la réponse inflammatoire par les thérapies résolutives dans des modèles tumoraux puisse permettre d’accroître les réponses immunitaires anti-tumorales [42,43]. Reste également à déterminer l’importance de chaque facteur pro-résolutif utilisé. Malgré ces questions, d’importantes applications thérapeutiques sont à prévoir.
Liens d’intérêts
Philippe Saas a déposé un brevet européen et international décrivant l’utilisation du sécrétome des macrophages efferocytiques comme produit biologique complexe stimulant la résolution de l’inflammation. Il détient des parts dans la biotech MED’INN Pharma développant ce médicament.
Mathieu Vetter déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les travaux de recherche menés autour de la résolution de l’inflammation ont bénéficié d’une aide de l’État gérée par l’Agence nationale de la recherche (ANR) au titre du programme « Investissements d’avenir » (ANR-11-LABX-0021-01). Mathieu Vetter dispose d’une bourse de thèse Établissement.
Références
- Chen L, Deng H, Cui H, et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget 2017 ; 9 : 7204–7218. [Google Scholar]
- Evans SS, Repasky EA, Fisher DT. Fever and the thermal regulation of immunity: the immune system feels the heat. Nat Rev Immunol 2015 ; 15 : 335–349. [CrossRef] [PubMed] [Google Scholar]
- Daguindau E, Chagué C, Saas P. Maladie du greffon contre l’hôte - Les bienfaits du « bon » cholestérol. Med Sci (Paris) 2023; 39 : 418–21. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Kolaczkowska E, Kubes P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol 2013 ; 13 : 159–175. [CrossRef] [PubMed] [Google Scholar]
- Granger V, de Chaisemartin L, Chollet-Martin S. La pêche miraculeuse des filets du neutrophile. Med Sci (Paris) 2014 ; 30 : 544–549. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Watanabe S, Alexander M, Misharin AV, et al. The role of macrophages in the resolution of inflammation. J Clin Invest 2019 ; 129 : 2619–2628. [CrossRef] [PubMed] [Google Scholar]
- Delamarre L, Pack M, Chang H, et al. Differential lysosomal proteolysis in antigen-presenting cells determines antigen fate. Science 2005 ; 307 : 1630–1634. [CrossRef] [PubMed] [Google Scholar]
- Arandjelovic S, Ravichandran KS. Phagocytosis of apoptotic cells in homeostasis. Nat Immunol 2015 ; 16 : 907–917. [CrossRef] [PubMed] [Google Scholar]
- Cabon L, Martinez-Torres A-C, Susin SA. La mort cellulaire programmée ne manque pas de vocabulaire. Med Sci (Paris) 2013 ; 29 : 1117–1124. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Rongvaux A, Jackson R, Harman CCD, et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell 2014 ; 159 : 1563–1577. [CrossRef] [PubMed] [Google Scholar]
- White MJ, McArthur K, Metcalf D, et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell 2014 ; 159 : 1549–1562. [CrossRef] [PubMed] [Google Scholar]
- Savill JS, Wyllie AH, Henson JE, et al. Macrophage phagocytosis of aging neutrophils in inflammation. Programmed cell death in the neutrophil leads to its recognition by macrophages. J Clin Invest 1989 ; 83 : 865–875. [CrossRef] [PubMed] [Google Scholar]
- Voll RE, Herrmann M, Roth EA, et al. Immunosuppressive effects of apoptotic cells. Nature 1997 ; 390 : 350–351. [CrossRef] [PubMed] [Google Scholar]
- Fadok VA, Bratton DL, Konowal A, et al. Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory cytokine production through autocrine/paracrine mechanisms involving TGF-beta, PGE2, and PAF. J Clin Invest 1998 ; 101 : 890–898. [CrossRef] [PubMed] [Google Scholar]
- Bittencourt MC, Perruche S, Contassot E, et al. Intravenous injection of apoptotic leukocytes enhances bone marrow engraftment across major histocompatibility barriers. Blood 2001 ; 98 : 224–230. [CrossRef] [PubMed] [Google Scholar]
- Golpon HA, Fadok VA, Taraseviciene-Stewart L, et al. Life after corpse engulfment: phagocytosis of apoptotic cells leads to VEGF secretion and cell growth. FASEB J 2004 ; 18 : 1716–1718. [CrossRef] [PubMed] [Google Scholar]
- Green DR, Oguin TH, Martinez J. The clearance of dying cells: table for two. Cell Death Differ 2016 ; 23 : 915–926. [CrossRef] [PubMed] [Google Scholar]
- Kono H, Rock KL. How dying cells alert the immune system to danger. Nat Rev Immunol 2008 ; 8 : 279–289. [CrossRef] [PubMed] [Google Scholar]
- Saas P, Vetter M, Maraux M, et al. Resolution therapy: Harnessing efferocytic macrophages to trigger the resolution of inflammation. Front Immunol 2022; 13 : 1021413. [CrossRef] [PubMed] [Google Scholar]
- Bournazou I, Pound JD, Duffin R, et al. Apoptotic human cells inhibit migration of granulocytes via release of lactoferrin. J Clin Invest 2009 ; 119 : 20–32. [PubMed] [Google Scholar]
- Kawano M, Nagata S. Efferocytosis and autoimmune disease. Int Immunol 2018 ; 30 : 551–558. [CrossRef] [PubMed] [Google Scholar]
- Lemke G.. How macrophages deal with death. Nat Rev Immunol 2019 ; 19 : 539–549. [CrossRef] [PubMed] [Google Scholar]
- Martin CJ, Peters KN, Behar SM. Macrophages Clean Up: Efferocytosis and Microbial Control. Curr Opin Microbiol 2014 ; 0 : 17–23. [CrossRef] [PubMed] [Google Scholar]
- Elliott MR, Koster KM, Murphy PS. Efferocytosis Signaling in the Regulation of Macrophage Inflammatory Responses. J Immunol 2017 ; 198 : 1387–1394. [CrossRef] [PubMed] [Google Scholar]
- Savill J, Hogg N, Ren Y, et al. Thrombospondin cooperates with CD36 and the vitronectin receptor in macrophage recognition of neutrophils undergoing apoptosis. J Clin Invest 1992 ; 90 : 1513–1522. [CrossRef] [PubMed] [Google Scholar]
- Majeti R, Chao MP, Alizadeh AA, et al. CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells. Cell 2009 ; 138 : 286–299. [CrossRef] [PubMed] [Google Scholar]
- Doran AC, Yurdagul A, Tabas I. Efferocytosis in health and disease. Nat Rev Immunol 2020; 20 : 254–67. [CrossRef] [PubMed] [Google Scholar]
- Arif Yurdagul J, Subramanian M, Wang X, et al. Macrophage Metabolism of Apoptotic Cell-Derived Arginine Promotes Continual Efferocytosis and Resolution of Injury. Cell metabolism 2020; 31 : 518. [CrossRef] [PubMed] [Google Scholar]
- Perretti M, Leroy X, Bland EJ, et al. Resolution Pharmacology: Opportunities for Therapeutic Innovation in Inflammation. Trends Pharmacol Sci 2015 ; 36 : 737–755. [CrossRef] [PubMed] [Google Scholar]
- Ariel A, Fredman G, Sun Y-P, et al. Apoptotic neutrophils and T cells sequester chemokines during immune response resolution through modulation of CCR5 expression. Nat Immunol 2006 ; 7 : 1209–1216. [CrossRef] [PubMed] [Google Scholar]
- Serhan CN. Pro-resolving lipid mediators are leads for resolution physiology. Nature 2014 ; 510 : 92–101. [CrossRef] [PubMed] [Google Scholar]
- Perretti M, Cooper D, Dalli J, et al. Immune resolution mechanisms in inflammatory arthritis. Nat Rev Rheumatol 2017 ; 13 : 87–99. [CrossRef] [PubMed] [Google Scholar]
- Martin-Rodriguez O, Gauthier T, Bonnefoy F, et al. Pro-Resolving Factors Released by Macrophages After Efferocytosis Promote Mucosal Wound Healing in Inflammatory Bowel Disease. Front Immunol 2021; 12 : 754475. [CrossRef] [PubMed] [Google Scholar]
- Nathan C, Ding A. Nonresolving inflammation. Cell 2010 ; 140 : 871–882. [CrossRef] [PubMed] [Google Scholar]
- Cohen PL, Caricchio R, Abraham V, et al. Delayed Apoptotic Cell Clearance and Lupus-like Autoimmunity in Mice Lacking the c-mer Membrane Tyrosine Kinase. J Exp Med 2002 ; 196 : 135–140. [CrossRef] [PubMed] [Google Scholar]
- Kawane K, Tanaka H, Kitahara Y, et al. Cytokine-dependent but acquired immunity-independent arthritis caused by DNA escaped from degradation. Proc Natl Acad Sci U S A 2010 ; 107 : 19432–19437. [CrossRef] [PubMed] [Google Scholar]
- Perretti M, D’Acquisto F. Annexin A1 and glucocorticoids as effectors of the resolution of inflammation. Nat Rev Immunol 2009 ; 9 : 62–70. [CrossRef] [PubMed] [Google Scholar]
- Kourtzelis I, Li X, Mitroulis I, et al. DEL-1 promotes macrophage efferocytosis and clearance of inflammation. Nat Immunol 2019 ; 20 : 40–49. [CrossRef] [PubMed] [Google Scholar]
- Perruche S, Saas P. « Mort sur ordonnance » ou comment l’anticorps anti-CD3 utilise l’apoptose pour induire la tolérance. Med Sci (Paris) 2009 ; 25 : 325–327. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Bonnefoy F, Gauthier T, Vallion R, et al. Factors Produced by Macrophages Eliminating Apoptotic Cells Demonstrate Pro-Resolutive Properties and Terminate Ongoing Inflammation. Front Immunol 2018 ; 9 : 2586. [CrossRef] [PubMed] [Google Scholar]
- Mevorach D, Zuckerman T, Reiner I, et al. Single infusion of donor mononuclear early apoptotic cells as prophylaxis for graft-versus-host disease in myeloablative HLA-matched allogeneic bone marrow transplantation: a phase I/IIa clinical trial. Biol Blood Marrow Transplant 2014 ; 20 : 58–65. [CrossRef] [PubMed] [Google Scholar]
- Sulciner ML, Serhan CN, Gilligan MM, et al. Resolvins suppress tumor growth and enhance cancer therapy. J Exp Med 2018 ; 215 : 115–140. [CrossRef] [PubMed] [Google Scholar]
- Wetzel A, Bonnefoy F, Chagué C, et al. Pro-Resolving Factor Administration Limits Cancer Progression by Enhancing Immune Response Against Cancer Cells. Front Immunol 2021; 12 : 812171. [Google Scholar]
- Kazama H, Ricci J-E, Herndon JM, et al. Induction of immunological tolerance by apoptotic cells requires caspase-dependent oxidation of high-mobility group box-1 protein. Immunity 2008 ; 29 : 21–32. [CrossRef] [PubMed] [Google Scholar]
- Medina CB, Mehrotra P, Arandjelovic S, et al. Metabolites released from apoptotic cells act as tissue messengers. Nature 2020; 580 : 130–5. [CrossRef] [PubMed] [Google Scholar]
- Saas P, Chagué C, Maraux M, et al. Toward the Characterization of Human Pro-Resolving Macrophages? Front Immunol 2020; 11 : 593300. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Les différentes étapes de la réponse inflammatoire. A. Cinétique de recrutement des polynucléaires neutrophiles (PNN) et des macrophages (Mφ) intervenant dans la réponse inflammatoire « simple » ou « basique » (sans l’intervention de l’immunité spécifique). Une première vague de PNN intervient pour lutter contre l’agression. Ces cellules entrent en apoptose après la production de radicaux oxygénés (ROS) consé- cutive à la phagocytose. Les macrophages sont attirés sur le site de l’agression par la chimiokine MCP1 produite par les PNN activés, mais aussi par les signaux « trouvez- moi » (« find-me ») libérés par les PNN apoptotiques (PNN A). L’efferocytose des PNN apoptotiques déclenche la résolution de l’inflammation et permet la reprogrammation des macrophages pro-inflammatoires (phénotype M1) vers le profil de macrophage pro-résolutif ou efferocytique (Meff). B. Cinétique de recrutement des cellules impliquées dans une réponse inflammatoire « complexe » (impliquant l’immunité spécifique). Les défenses mises en place par les PNN et les macrophages ne suffisent pas à contrôler l’agression. Les cellules dendritiques conventionnelles (cDC) sont activées par les signaux de danger, migrent dans les ganglions les plus proches, où elles déclenchent la réponse immunitaire spécifique. Les lymphocytes T activés (L) arrivent sur le site de l’agression et l’éliminent avec la collaboration de la réponse humorale (lymphocytes B, se différenciant en plasmocytes, sécréteurs d’anticorps). Ces lymphocytes entrent en apoptose sur le site endommagé, et sont éliminés par les macrophages qui, comme dans le graphique en A, sont attirés par les signaux « trouvez-moi » (« find-me ») des lymphocytes apoptotiques (LA) et sont reprogrammés vers le profil pro-résolutif (Meff) pour déclencher la résolution. Les temps indiqués sont arbitraires. |
| Dans le texte | |
 |
Figure 2. Les mécanismes à l’origine de la réponse silencieuse voire anti-inflammatoire de la mort par apoptose. Un des évènements majeurs de l’apoptose est l’activation des caspases, qui vont permettre, d’une part, de désarmer les cellules apoptotiques en inactivant les signaux de danger endogènes (DAMP), comme HMGB1 [high mobility group box 1]) [8,10,11,44], et rendre ainsi moins inflammatoires les cellules mourantes. D’autre part, l’activation des caspases va préparer la cellule apoptotique à être éliminée par les phagocytes (dont le macrophage) en produisant des signaux d’attraction (signaux « trouvez-moi », comme les nucléotides ATP/UTP et la lysophosphatidylcholine [LPC]), en facilitant la reconnaissance de la cellule apoptotique grâce à l’expression de signaux « mangez-moi » (comme les phosphatidylsérines [PS] passant du feuillet interne vers le feuillet externe de la membrane plasmique), tout en éliminant certains signaux repoussoirs (« ne me mangez pas ») comme le CD46. Ces signaux ne sont pas tous dépendants des caspases, comme l’émission des signaux « trouvez-moi », tels que CX3CL1 ou S1P (sphingosine-1-phosphate), ou la perte ou la modification des signaux « ne me mangez pas », tels que CD47 et CD31. Les cellules apoptotiques vont produire un environnement anti-inflammatoire ou immunosuppresseur transitoire par la libération de métabolites (dihydroxy-acétone phosphate [DHAP], fructose-1, 6-biphosphate [FBP], guanosine-5’-monophosphate [GMP], inosine-5’-monophosphate [IMP], ou spermidine), de cytokines (IL-10 et TGF-β), et de médiateurs pro-résolutifs (annexine-A1 [Anx-A1], thrombospondine-1 [Thbs1] [19,45]). |
| Dans le texte | |
 |
Figure 3. Les quatre étapes de l’efferocytose conduisant à la reprogrammation du macrophage pro-inflammatoire vers un profil pro-résolutif. L’efferocytose se déroule en 4 étapes : 1) l’attraction du macrophage par l’émission des signaux « trouvez-moi » (« find-me ») par la cellule apoptotique (ici le polynucléaire neutrophile) ; 2) la reconnaissance par le macrophage de la cellule apoptotique grâce aux signaux « mangez-moi » (« eat-me ») comme les phosphatidylsérines (PS) pouvant être reconnues de manière directe (via la stabiline-2 [Stab2]) ou indirecte via des molécules de pontage (growth arrest-specific 6 [GAS6] se fixant sur les récepteurs MerTK ou Axl) ; 3) l’ingestion, qui implique un remaniement du cytosquelette (microfilaments d’actine) sous le contrôle de Rac-1, appartenant à la famille des GTPases Ras ; puis 4) la digestion des composés des cellules apoptotiques (lipides dégradés en cholestérol et acides gras à l’origine de l’activation des récepteurs nucléaires LXR et PPARδ et γ ; protéines dégradées en acides aminés, comme l’arginine transformée en putrescine par l’arginase-1 [Arg-1] et l’ornithine décarboxylase [ODC] ; les acides nucléiques, dégradés en nucléotides par la DNAse II, qui activent la protéine kinase dépendante de l’ADN [DNA-PK]). L’efferocytose aboutit à la reprogrammation du macrophage d’un profil pro-inflammatoire vers un profil pro-résolutif. Ces deux profils se distinguent, entre autres, par l’activation de la voie NF-κB dans le macrophage pro-inflammatoire et son inhibition dans le macrophage pro-résolutif. Le profil pro-résolutif est caractérisé par la synthèse de cytokines anti-inflammatoires (IL-10 et TGF-β), de médiateurs lipidiques pro-résolutifs (SPM comme les lipoxines ou les résolvines) et de facteurs de croissance (IGF-1 et VEGF). Les abréviations sont définies dans le texte (figure réalisée avec le logiciel BioRender). |
| Dans le texte | |
 |
Figure 4. Les mécanismes pro-résolutifs du macrophage efferocytique faisant suite à la digestion des cellules apoptotiques. L’étape de digestion des cellules apoptotiques (polynucléaires neutrophiles ou lymphocytes) par le macrophage est centrale dans la production de facteurs pro-résolutifs du fait de l’activation de différentes voies métaboliques. Ainsi, la dégradation des lipides des cellules apoptotiques induit, via la voie LXR, l’enzyme arachidonate 15-lipoxygénase (Alox15) impliquée dans la synthèse de lipides pro-résolutifs (SPM), mais aussi l’expression de récepteurs « eat-me », MerTK et la transglutaminase 2 [TGM2], ainsi que, via les voies PPAR δ et γ, Axl, MerTK, CD36, et de molécules de pontage comme MFG-E8. Ceci va stimuler l’efferocytose continue favorisant l’élimination des cellules apoptotiques sur une longue durée. Les acides gras vont aussi stimuler, via la forme oxydée du nicotinamide adénine dinucléotide (NAD+), la voie de la sirtuine-1 (SIRT1) à l’origine de la production d’IL-10 [27]. La dégradation des protéines des cellules apoptotiques en acides aminés permet aussi d’exercer des fonctions pro-résolutives comme c’est le cas de la putrescine, issue de la dégradation de l’arginine, qui va stimuler l’efferocytose continue. Les SPM possèdent des propriétés pro-résolutives avec l’induction de l’arrêt du recrutement des cellules inflammatoires, l’apoptose des polynucléaires neutrophiles, la stimulation de l’efferocytose, et la reprogrammation des macrophages vers le profil Meff (macrophage efferocytique). Les facteurs de croissance libérés par les macrophages efferocytiques, comme le VEGF ou l’IGF1, stimulent la réparation tissulaire. Toutes ces propriétés pro-résolutives (notées dans les rectangles verts sur la figure) vont aboutir au retour à l’homéostasie cellulaire et tissulaire. À noter que les signaux « find-me » émis par les cellules mourantes et la reconnaissance des cellules apoptotiques peuvent aussi induire la synthèse de facteurs pro-résolutifs (voir [19]). Ainsi, les récepteurs « eat-me » induisent la synthèse de cytokines anti-inflammatoires (flèche violette) et, de manière indirecte via ces cytokines, participent à la reprogrammation des macrophages et à l’arrêt du recrutement des cellules inflammatoires (flèches violettes en tirets). L’astérisque identifie des voies qui peuvent différer entre les macrophages efferocytiques humains et murins : l’arginase [Arg-1], marqueur prototypique des macrophages anti-inflammatoires murins, est absente dans les mêmes macrophages humains, et la voie LXR n’est pas toujours anti-inflammatoire dans les macrophages humains (pour plus de détail, voir la référence [46]). Les flèches en trait pointillé représentent un lien faisant intervenir des intermédiaires non précisés dans cette figure (figure réalisée en partie avec le logiciel BioRender). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




