| Issue |
Med Sci (Paris)
Volume 41, Number 2, Février 2025
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 195 - 197 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2025019 | |
| Published online | 03 March 2025 | |
Le microbiote, un nouvel acteur dans le diagnostic de la maladie d’Alzheimer
Gut microbiome, a new tool for Alzheimer diagnosis
Master 2 Infectiologie, Immunité, Vaccinologie et Biomédicaments, Université de Tours, Tours, France
Physiopathologie de la maladie d’Alzheimer
La maladie d’Alzheimer (MA) est une maladie neurodégénérative qui affecte différentes fonctions, telles que la mémoire et des fonctions cognitives comme le langage, le raisonnement et l’apprentissage, menant progressivement à une perte d’autonomie. Dans le monde, 55 millions de personnes (Organisation Mondiale de la Santé) sont atteintes de la MA, avec près de 10 millions de nouveaux cas chaque année. La MA est la cause de troubles démentiels la plus fréquente (65 % des cas) dans le monde, atteignant principalement les personnes de plus de 65 ans [1] avec une plus forte prévalence chez les femmes (55 % des cas). Au-delà de son impact économique (1 300 milliards de dollars en 2019 dans le monde), la MA engendre un impact social majeur pour les patients et leur entourage.
Deux protéines sont impliquées dans la physiopathologie de la maladie : la protéine Tau et le peptide bêta amyloïde. La protéine Tau, protéine structurale des neurones est hyper phosphorylée et s’agglomère en formant des fibrilles PHF (paires de filaments de la protéine tau hyper phosphorylées en hélice) [2, 3] (→) dans le cytoplasme des neurones, provoquant leur désorganisation et leur mort. Quant au peptide bêta amyloïde, le métabolisme de son précurseur est altéré, ce qui conduit à la formation d’agrégats fibrillaires peptidiques. Dans ces dépôts sont également retrouvés des astrocytes et des cellules gliales. Les plaques, ainsi formées, entraînent une perte des synapses et des neurones associés [1].
(→) Voir m/s n° 6-7, 2002, page 727
Il n’existe, à l’heure actuelle, aucun traitement curatif. La prise en charge repose sur un diagnostic précoce de la maladie, associé à des traitements permettant de ralentir son évolution ou d’améliorer certains troubles du comportement. Le diagnostic repose également sur des questionnaires permettant de mettre en évidence la démence progressive ainsi que les pertes de fonctions cognitives.
Depuis plusieurs années, un diagnostic au stade pré-clinique est possible grâce à la mise en évidence des plaques bêta amyloïde par PET scan [4] (tomographie par émission de positons), mais également par mesure des protéines Tau totales et hyper-phosphorylées et du peptide Aβ1-42 dans le liquide céphalorachidien (LCR) [5]. Cependant, ces diagnostics nécessitent des examens invasifs et coûteux au sein d’infrastructures adaptées à ces méthodes, complexifiant le dépistage précoce de la MA (Figure 1). Malgré l’absence de traitement curatif, le dépistage précoce de la MA permet une amélioration de la prise en charge des patients et de la qualité de vie à long terme, c’est pourquoi il est nécessaire de trouver d’autres approches non invasives et moins coûteuses.
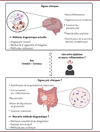 |
Figure 1 Mécanismes et enjeu de la maladie d’Alzheimer (MA) et de son diagnostic. La MA se caractérise par la formation au niveau cérébral de dépôts neurofibrillaires composé d’axones en dégénérescence, de protéines Tau et de peptides bêta amyloïdes. Ces dépôts induisent une neuro-inflammation ainsi qu’une déstabilisation de la barrière hémato-encéphalique ayant pour conséquence une dégénérescence cérébrale et la perte de fonction motrice et cognitive chez les patients. Le diagnostic est réalisé à la suite des premiers signes cliniques mis en évidence par imagerie cérébrale et analyse du liquide céphalo-rachidien. Des signes précliniques de la MA se caractérisent par une dysbiose avec une augmentation de la proportion relative du genre Bactéroïdes ainsi qu’une diminution de la voie du glutamate. Cette dysbiose induit une modification de la barrière intestinale et la mise en place d’un environnement proinflammatoire. L’ensemble de ces altérations cérébrales et intestinales sont liées par l’axe intestin-cerveau qui est peu caractérisé et suscite de nombreuses interrogations. En caractérisant la dysbiose associée à la MA, Ferreiro et al. proposent une nouvelle méthode diagnostique non invasive, peu coûteuse et plus sensible de la MA. |
Le microbiote, un acteur dans la maladie d’Alzheimer ?
Il demeure des zones d’ombres quant à la physiopathologie de la MA, dans la mesure où ni les protéines Tau et le peptide bêta amyloïde, ni des facteurs comme la génétique, l’âge ou encore l’environnement ne suffisent à expliquer l’apparition de la maladie. Ces dernières années, de nombreuses publications [6] ont mis en évidence l’implication de l’axe intestin-cerveau dans la maladie. Le microbiote intestinal regroupe l’ensemble des microorganismes, dits commensaux, présents au niveau du système intestinal et capables de communiquer avec l’hôte et de réguler certaines de ses fonctions (immunitaires, métaboliques) [7]. Lorsque la quantité ou la diversité des micro-organismes présents dans l’intestin est modifiée par une infection, la prise de médicaments ou certaines pathologies, on parle de dysbiose. Une telle dysbiose a été observée chez les patients atteints de la MA bien qu’il n’ait pas encore été déterminé si celleci était une conséquence ou une cause de la maladie. Par ailleurs, il a été montré que le microbiote pouvait être à l’origine d’un syndrome inflammatoire chez son hôte [8], comme dans le cas de la MA [9]. Des perturbations au niveau du microbiote ont également été associées à une augmentation de la perméabilité de la barrière hémato-encéphalique, laissant passer des molécules inflammatoires et des métabolites bactériens contribuant potentiellement aux processus neuroinflammatoires. Des inflammations similaires ont également été retrouvées dans des maladies telles que la sclérose en plaque, la maladie de Parkinson ou encore des troubles dépressifs [10].
Le diagnostic, le facteur initial de la prise en charge
Dans cet article [11], les chercheurs se sont intéressés au microbiote de sujets sains ainsi qu’à celui de patients au stade clinique ou pré-clinique de la MA, dont le stade a été déterminé à l’aide des méthodes diagnostiques actuelles [4]. Par analyse transcriptomique, à partir des ADN génomiques et bactériens issus des selles des patients, les chercheurs ont pu caractériser la diversité ainsi que la composition relative du microbiote des patients.
Cette étude a permis de révéler des différences significatives dans le profil microbiotique des patients au stade pré-clinique par rapport à celui des individus sains. Parmi ces variations, on observe une modification de la bêta diversité (diversité propre au microbiote humain) avec une diminution de la proportion de certaines espèces de Bactéroïdes, ainsi qu’une augmentation de Methanobrevibacter smithii, une bactérie associée à la neuro-inflammation et à un défaut de dégradation des plaques de peptide bêta-amyloïde. Les patients au stade pré-clinique présentaient également une augmentation des voies de production du succinate, qui joue un rôle dans l’inflammation lié à la MA, ainsi qu’une diminution des voies de dégradation du glutamate, responsable de l’excitotoxicité.
Par ailleurs, ces altérations du microbiome ne sont pas corrélées aux marqueurs de la neurodégénérescence tels que le volume de l’hippocampe ou la modification de la matière blanche. Ceci suggère que la perturbation du microbiome pourrait constituer un signe prématuré de la MA et donc un outil de dépistage précoce.
En effet, bien que le microbiome puisse varier d’un individu à l’autre, la mise en évidence des modifications du métabolisme du succinate, du glutamate ainsi que la variation de la bêta-diversité semblent spécifiquement associés à la MA. Par conséquent, les patients au stade pré-clinique présentent dans l’ensemble un profil microbiotique distinct de celui des individus sains.
Pour évaluer si le profil microbiotique pouvait contribuer au diagnostic de la MA, les chercheurs de cette étude [11] ont utilisé le modèle “Random Forest” (RF) reposant sur une logique d’arbre décisionnel. Pour entraîner ce modèle, les chercheurs ont utilisé les données obtenues de patients possédant un diagnostic établi (clinique ou pré-clinique) de la MA, en prenant en compte l’ensemble des paramètres biologiques (âge, sexe, antécédents…), analyses du LCR, et imageries cérébrales. Afin d’évaluer l’apport que pourrait avoir l’analyse transcriptomique du microbiote dans la sensibilité diagnostique de la MA, ces données ont été ajoutées au modèle RF.
Il a ainsi été montré que l’analyse transcriptomique du microbiote permettait d’améliorer la spécificité diagnostique, en dépistant des patients au stade préclinique de la MA, qui avaient été précédemment classés comme sains par le modèle RF utilisant uniquement les données issues des méthodes diagnostiques actuelles (Figure 1). Par ailleurs, cette amélioration de la spécificité est conservée en l’absence de marqueurs lié à l’analyse du LCR ou d’imagerie.
Ainsi, l’utilisation du profil microbiotique dans le diagnostic précoce de la MA pourrait être complémentaire aux méthodes actuelles, et limiter le recours à des examens complexes et coûteux.
Le microbiote, la voie vers une meilleure prise en charge
Si cette étude permet une ouverture vers l’amélioration du diagnostic pré-clinique de la MA, ce modèle n’en est qu’a son initiation et il est important de garder une vision critique sur ce qu’il apporte. La recherche de biomarqueurs du microbiote, pour le diagnostic ou le suivi des patients, est en plein essor pour de nombreuses maladies, et son analyse transcriptomique permet de caractériser les dysbioses et leur signature dans de nombreuses maladies (immunitaires [12], cérébrales [13] ou encore dans le cancer [14]). Etant peu coûteuse et ne nécessitant pas d’examen invasif, l’analyse transcriptomique du microbiote est de plus en plus envisagée comme outil diagnostic, et pourrait être une révolution dans le dépistage de nombreuses maladies.
L’analyse transcriptomique est également un moyen de mieux comprendre les implications de ces dysbioses associées à ces maladies, ce qui pourrait conduire à l’identification de nouvelles cibles thérapeutiques. C’est pourquoi, l’étude est la caractérisation du microbiote représente un enjeu pour une meilleure compréhension et prise en charge [10] de nombreuses maladies.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Frisoni GB, Altomare D, Thal DR, et al. The probabilistic model of Alzheimer disease : the amyloid hypothesis revised. Nat Rev Neurosci 2022 ; 23 : 53–66. [CrossRef] [PubMed] [Google Scholar]
- Buée L, Delacourte A. La maladie d’Alzheimer : une tauopathie parmi d’autres ? Med Sci (Paris) 2002 ; 18 : 727–736. [CrossRef] [EDP Sciences] [Google Scholar]
- Molin P, Rockwood K. Les nouveaux critères de la Maladie d’Alzheimer - Perspective gériatrique. Can Geriatr J 2016 ; 19 : 74–82. [CrossRef] [PubMed] [Google Scholar]
- Graff-Radford J, Yong KXX, Apostolova LG, et al. New Insights into Atypical Alzheimer’s Disease in the Era of Biomarkers. Lancet Neurol 2021 ; 20 : 222–234. [CrossRef] [PubMed] [Google Scholar]
- Bjerke M, Engelborghs S. Cerebrospinal Fluid Biomarkers for Early and Differential Alzheimer’s Disease Diagnosis. JAD 2018 ; 62 : 1199–1209. [CrossRef] [PubMed] [Google Scholar]
- Megur A, Baltriukiene. D, Bukelskiene. V, et al. The Microbiota-Gut-Brain Axis and Alzheimer’s Disease : Neuroinflammation Is to Blame? Nutrients 2020 ; 13: 37. [CrossRef] [PubMed] [Google Scholar]
- Zhao Q, Maynard CL. Mucus, commensals, and the immune system. Gut Microbes 2022 ; 14 : 2041342. [CrossRef] [PubMed] [Google Scholar]
- Guzman-Bautista ER, Suzuki K, Asami S, et al. Bacteria-immune cells dialog and the homeostasis of the systems. Curr Opin Immunol 2020 ; 66 : 82–89. [CrossRef] [PubMed] [Google Scholar]
- Varesi A, Pierella E, Romeo M, et al. The Potential Role of Gut Microbiota in Alzheimer’s Disease : From Diagnosis to Treatment. Nutrients 2022 ; 14 : 668. [CrossRef] [PubMed] [Google Scholar]
- Rutsch A, Kantsjö JB, Ronchi F. The Gut-Brain Axis : How Microbiota and Host Inflammasome Influence Brain Physiology and Pathology. Front Immunol 2020 ; 11 : 604179. [CrossRef] [PubMed] [Google Scholar]
- Ferreiro AL, Choi J, Ryou J, et al. Gut microbiome composition may be an indicator of preclinical Alzheimer’s disease. Sci Transl Med 2023 ; 15 : eabo2984. [CrossRef] [PubMed] [Google Scholar]
- Yao Q, Tan W, Bai F. Gut microbiome and metabolomics in systemic sclerosis : feature, link and mechanisms. Front. Immunol 2024 ; 15 : 1475528. [CrossRef] [Google Scholar]
- Borrego-Ruiz A, Borrego JJ. An updated overview on the relationship between human gut microbiome dysbiosis and psychiatric and psychological disorders. Prog Neuropsychopharmacol Biol Psychiatry 2023 ; 128 : 110861. [Google Scholar]
- Qasem HH, El-Sayed WM. The bacterial microbiome and cancer : development, diagnosis, treatment, and future directions. Clin Exp Med 2024 ; 25 : 12. [CrossRef] [PubMed] [Google Scholar]
© 2025 médecine/sciences – Inserm
Liste des figures
 |
Figure 1 Mécanismes et enjeu de la maladie d’Alzheimer (MA) et de son diagnostic. La MA se caractérise par la formation au niveau cérébral de dépôts neurofibrillaires composé d’axones en dégénérescence, de protéines Tau et de peptides bêta amyloïdes. Ces dépôts induisent une neuro-inflammation ainsi qu’une déstabilisation de la barrière hémato-encéphalique ayant pour conséquence une dégénérescence cérébrale et la perte de fonction motrice et cognitive chez les patients. Le diagnostic est réalisé à la suite des premiers signes cliniques mis en évidence par imagerie cérébrale et analyse du liquide céphalo-rachidien. Des signes précliniques de la MA se caractérisent par une dysbiose avec une augmentation de la proportion relative du genre Bactéroïdes ainsi qu’une diminution de la voie du glutamate. Cette dysbiose induit une modification de la barrière intestinale et la mise en place d’un environnement proinflammatoire. L’ensemble de ces altérations cérébrales et intestinales sont liées par l’axe intestin-cerveau qui est peu caractérisé et suscite de nombreuses interrogations. En caractérisant la dysbiose associée à la MA, Ferreiro et al. proposent une nouvelle méthode diagnostique non invasive, peu coûteuse et plus sensible de la MA. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




