| Issue |
Med Sci (Paris)
Volume 41, Number 2, Février 2025
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 191 - 194 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2025018 | |
| Published online | 03 March 2025 | |
Formes graves de maladie à virus West-Nile: Le rôle de l’auto-immunité anti-IFN de type I
Severe forms of West-Nile Virus disease : the role of anti-type I IFN autoimmunity
Master 2 Infectiologie, Immunité, Vaccinologie et Biomédicaments, Université de Tours, Tours, France
*
n.lepine8@laposte.net
**
hanane.bahnes@hotmail.com
Le master I2VB se propose d’offrir une formation complète et pratique en infectiologie/cancérologie, immunologie et développement de biomédicaments. Il repose sur une coopération exemplaire entre les équipes de recherche en infectiologie et en immunologie de l’Université de Tours, et celles, entre autres, de l’Unité Infectiologie et Santé Publique (ISP) du Centre INRAE de Tours-Nouzilly, concrétisée par une profonde interaction entre chercheurs et enseignants-chercheurs. Cette formation aborde aussi bien les aspects fondamentaux et appliqués de l’infectiologie, de la cancérologie et de l’immunologie, en couvrant l’étude moléculaire des interactions entre le pathogène et son hôte ou entre la cellule cancéreuse et son environnement. Elle s’étend jusqu’à la conception, l’évaluation et la mise sur le marché de produits innovants en vaccinologie, de biothérapies anti-infectieuses et d’anticorps immunothérapeutiques. Le master I2VB niveau M1 donne lieu aux parcours : Infectiologie Cellulaire et Moléculaire (ICM) et Immunité et biomédicaments (I&B) de niveau M2 et affiche deux objectifs principaux : 1) former à la recherche pour une poursuite en doctorat ; 2) préparer à l’insertion professionnelle immédiate en tant que cadre principalement dans les secteurs touchant à la santé humaine et animale.
© 2025 médecine/sciences – Inserm
L’actualité scientifique vue par les étudiants du Master Biologie Santé, module physiopathologie de la signalisation, Université Paris-Saclay

Responsables pédagogiques
Anne di Tommaso et Isabelle Dimier-Poisson Université de Tours
Série coordonnée par Claire Deligne
Le virus West-Nile, un flavivirus neurotrope transmis par les moustiques, a été identifié pour la première fois en Ouganda en 1937 [1]. Il est endémique en Afrique, en Europe, au Moyen Orient, en Asie et a présenté une expansion rapide en Amérique du Nord depuis 1999, devenant l’une des arboviroses les plus répandues aux États-Unis [1].
Son expansion dans des zones géographiques de plus en plus vastes à travers le monde ainsi que les formes cliniques potentiellement mortelles qu’il engendre font du virus West-Nile un véritable enjeu de santé publique, d’autant qu’aucun traitement spécifique ni vaccin ne sont disponibles. La prévention dépend d’une lutte organisée et durable contre les moustiques vecteurs et de l’éducation du public [2].
Asymptomatique dans la majorité des cas, l’infection par le virus West-Nile peut provoquer un syndrome pseudogrippal bénin chez 20 à 30 % des patients [3] et, dans de rares cas, être à l’origine de pathologies potentiellement mortelles : moins de 1 % des patients infectés développent des formes neuro-invasives, telles qu’une encéphalite (50-70 %), une méningite (15-35 %) et/ou une paralysie flasque aiguë (3-20 %), entraînant le décès dans 5 à 20 % de ces cas [4].
Cette importante variabilité clinique interindividuelle est actuellement largement inexpliquée [5]. D’autres flavivirus tels que la dengue ou la fièvre jaune peuvent causer des atteintes neurologiques, mais les mécanismes pathogéniques à l’origine de ce tropisme ne sont pas connus.
L’âge semble être un facteur prédictif fort de maladie neuro-invasive et de décès, tout comme le sexe masculin dans une moindre mesure [6]. L’immunodépression est quant à elle le seul facteur significativement associé à une issue fatale [7], suggérant le rôle indispensable d’un système immunitaire fonctionnel dans le contrôle de l’infection. Cependant, selon les études, jusqu’à 40 % des animaux immunocompétents infectés par des souches virulentes de virus West-Nile développent des formes neuro-invasives létales [8].
Lorsque des cellules sont infectées par un virus, elles produisent des interférons (IFN), dont les IFN de type I. Ces cytokines jouent un rôle clé dans l’immunité innée antivirale, en activant des voies de signalisation permettant de limiter la réplication virale. Ils induisent l’expression de plusieurs centaines de gènes (Interferon-stimulated genes ou ISG) et renforcent l’activité des cellules immunitaires comme les cellules NK et T. Leur importance réside dans leur capacité à déclencher rapidement des réponses pour contrôler les infections virales avant que l’immunité adaptative ne prenne le relais.
Des études ont déjà montré l’existence d’auto-anticorps circulants neutralisant les IFN de type I (l’IFN-α2, l’IFN-β et/ou l’IFN-ω) dans la maladie due à l’infection par le SARS-CoV-2 (COVID-19), et qui seraient responsables d’environ 15 % des cas graves, potentiellement mortels [9]. Ces anticorps précèdent l’infection et leur présence augmente considérablement le risque de développer une forme sévère de la maladie. Les auto-anticorps dirigés contre les IFN de type I sont également à l’origine d’environ 25 % des hospitalisations pour pneumonie due au Coronavirus du syndrome respiratoire du Moyen-Orient (MERS-CoV) et d’environ 5 % des cas de pneumonie grippale grave [10, 11].
Gervais et al. ont récemment émis l’hypothèse que des auto-anticorps circulants neutralisant les IFN de type I pourraient également être responsables de la sévérité des atteintes cliniques chez certains patients infectés par le virus West-Nile, expliquant en partie les disparités cliniques interindividuelles [12]. Ils ont pour cela étudié six cohortes indépendantes incluant un total de 663 patients infectés provenant d’Europe et des États-Unis, toutes formes cliniques confondues (asymptomatiques, paucisymptomatiques et formes sévères neuro-invasives).
Prévalence des auto-anticorps neutralisant les IFN de type I
Les auteurs ont montré qu’environ 35 % des patients atteints de formes graves de la maladie à virus West-Nile avaient des auto-anticorps détectables dirigés contre au moins un interféron de type I (Figure 1), une prévalence beaucoup plus élevée que celle rapportée dans la population générale (environ 1 %) et chez les patients atteints de formes sévères de COVID-19 (environ 15 %) ou de pneumonie due au MERS-CoV (environ 25 %), mais similaire à celle retrouvée dans une très petite série de huit patients ayant présenté des réactions sévères au vaccin vivant atténué contre le virus de la fièvre jaune, un autre flavivirus [13]. Être âgé de plus de 65 ans et, dans une moindre mesure, être de sexe masculin, étaient les principaux facteurs associés à une plus grande probabilité de présence d’auto-anticorps anti-IFN de type I chez les personnes atteintes de formes sévères de la maladie à virus West-Nile. Ces résultats sont cohérents avec les observations précédentes concernant la distribution de ces auto-anticorps dans la population générale et chez les patients atteints de COVID-19 grave [9]. Des auto-anticorps neutralisant des concentrations physiologiques d’IFN-α2 et/ou d’IFN-ω ont été retrouvés dans le liquide céphalo-rachidien (LCR) de 35 % des patients atteints de formes encéphalitiques pour lesquelles un échantillon de LCR était disponible (Figure 1).
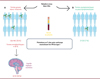 |
Figure 1 La prévalence des auto-anticorps neutralisant les IFN de type I chez les patients atteints de maladie à virus West-Nile augmente de manière significative avec la gravité de la maladie. La maladie à virus West-Nile transmise par les moustiques est bénigne chez la plupart des individus, mais peut provoquer des atteintes graves neuro-invasives (encéphalites, méningites, paralysie flasque aigüe) chez moins de 1 % des personnes infectées. A. Trente-cinq % des patients atteints de formes neuro-invasives sont porteurs d’auto-anticorps neutralisant l’IFN-α et/ou l’IFN-ω. La prévalence de ces anticorps est plus élevée chez les patients atteints d’encéphalite (environ 40 %). B. Chez les individus présentant une infection silencieuse par le virus West-Nile, la prévalence du portage d’auto-anticorps neutralisant l’IFN-α et/ou l’IFN-ω est aussi faible que dans la population générale. Elle est de moins de 10 % chez l’ensemble des individus atteints de formes asymptomatiques et paucisymptomatiques. |
La présence d’auto-anticorps anti-IFN augmente le risque de formes cliniques symptomatiques
Les auteurs n’ont retrouvé aucune différence significative concernant la prévalence de ces auto-anticorps entre les patients atteints de formes asymptomatiques et la population générale, quelle que soit la nature ou la combinaison des auto-anticorps considérés. En revanche, elle était significativement plus élevée dans tous les groupes de formes symptomatiques, et augmentait avec la gravité de la maladie. La présence d’auto-anticorps neutralisants l’IFN-α2 et/ou l’IFN-ω était associée à un risque plus élevé de forme symptomatique (odds-ratio [OR] = 7,3 ; intervalle de confiance à 95 % [IC] : 4,1-12,8), le risque étant le plus élevé pour le sous-groupe d’individus atteints de maladies neuro-invasives (OR = 19,0 ; IC à 95 % : 15,0-24,0). L’impact des auto-anticorps sur le risque de maladie symptomatique était plus important chez les sujets d’âge inférieur ou égal à 65 ans.
Les auto-anticorps anti-IFN ne sont pas induits par l’infection
Gervais et al. rapportent également que les auto-anticorps anti-IFN de type I ne sont pas transitoires et ne sont pas induits par l’infection par le West-Nile virus. En effet, le prélèvement de 79 échantillons de patients issus de la cohorte à des stades très précoces de la pathologie (moins de 7 jours après le début des signes cliniques) a montré la présence d’auto-anticorps IgG dirigés contre les IFN de type I dans les premières phases de l’infection. Soixante-et-un % des individus positifs pour les auto-anticorps n’avaient pas encore développé de réponse IgG spécifique au virus West-Nile au moment du prélèvement sanguin, ce qui suggère que les auto-anticorps détectés étaient déjà présents avant l’infection.
Quinze individus sans auto-anticorps neutralisant les IFN de type I à des stades précoces post-infection n’ont développé aucun auto-anticorps jusqu’à 30 mois après le diagnostic de l’infection par le virus West-Nile. Ces observations sont là encore concordantes avec les études précédentes chez les patients atteints de pneumonie grippale critique ou de formes graves de COVID-19 [9, 10].
Les auto-anticorps neutralisent l’effet protecteur de l’IFN-α2 contre le virus West-Nile
Les auteurs ont montré in vitro qu’ajouter de l’IFN-α2 avant infection par le virus West-Nile protégeait les cellules Vero E6 (une lignée de cellules épithéliales) contre son effet cytopathique. En revanche, les sérums positifs en auto-anticorps étaient capables de bloquer les fonctions antivirales protectrices de l’IFN-α2 (et probablement de l’IFN-β et de l’IFN-ω, bien que ces derniers n’aient pas été testés) à des dilutions allant jusqu’à 1/300, permettant une réplication virale non restreinte.
Les auto-anticorps anti-IFN de type I peuvent donc être à l’origine, ou du moins contribuer à la forme grave de la maladie à virus West-Nile, et en particulier de formes neuro-invasives dans une proportion significative, leur impact étant le plus fort chez les sujets de moins de 65 ans. Cela suggère également qu’une immunité IFN de type I altérée est un déterminant majeur du développement de formes graves. Ces résultats encouragent le développement de thérapie à l’IFN-α2 chez les patients atteints de formes graves de maladie à virus West-Nile sans auto-anticorps dirigés contre l’IFN-α2, d’autant que de telles thérapies sont déjà utilisées en pratique clinique dans le traitement de certaines infections virales (hépatite B et C notamment) [14]. Des options de traitement similaires pourraient être envisagées chez les patients porteurs d’auto-anticorps dirigés contre les IFN de type I, par exemple de thérapie à l’IFN-β chez les patients porteurs d’auto-anticorps dirigés contre l’IFN-α2 et/ou l’IFN-ω mais pas contre l’IFN-β.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Campbell GL, Marfin AA, Lanciotti RS, et al. West Nile virus. Lancet Infect Dis 2002 ; 2 : 519–29. [CrossRef] [PubMed] [Google Scholar]
- Petersen LR, Brault AC, Nasci RS. West Nile virus : review of the literature. JAMA 2013 ; 310 : 308–15. [CrossRef] [PubMed] [Google Scholar]
- Sewgobind S, McCracken F, Schilling M. JMM Profile : West Nile virus. J Med Microbiol 2023 ; 72 : 001730. [CrossRef] [Google Scholar]
- Santini M, Haberle S, Židovec-Lepej S, et al. Severe West Nile Virus neuroinvasive disease : clinical characteristics, short- and long-term outcomes. Pathogens 2022 ; 11:52. [CrossRef] [PubMed] [Google Scholar]
- Lim SM, Koraka P, Osterhaus ADME, Martina BEE. West Nile virus : immunity and pathogenesis. Viruses 2011 ; 3 : 811–28. [CrossRef] [PubMed] [Google Scholar]
- Sutinen J, Fell DB, Sander B, Kulkarni MA. Comorbid conditions as risk factors for West Nile neuroinvasive disease in Ontario, Canada : a population-based cohort study. Epidemiol Infect 2022 ; 150 : e103. [CrossRef] [PubMed] [Google Scholar]
- Lindsey NP, Staples JE, Lehman JA, Fischer M. Medical risk factors for severe West Nile virus disease, United States, 2008-2010. Am J Trop Med Hyg 2012 ; 87 : 179–84. [CrossRef] [PubMed] [Google Scholar]
- Beasley DWC, Li L, Suderman MT, Barrett ADT. Mouse neuroinvasive phenotype of West Nile virus strains varies depending upon virus genotype. Virology 2002 ; 296 : 17–23. [CrossRef] [Google Scholar]
- Bastard P, Gervais A, Le Voyer T, et al. Autoantibodies neutralizing type I IFNs are present in ~4 % of uninfected individuals over 70 years old and account for ~20 % of COVID-19 deaths. Sci Immunol 2021 ; 6 : eabl4340. [CrossRef] [PubMed] [Google Scholar]
- Zhang Q, Pizzorno A, Miorin L, et al. Autoantibodies against type I IFNs in patients with critical influenza pneumonia. J Exp Med 2022219e20220514. [Google Scholar]
- Alotaibi F, Alharbi NK, Rosen LB, et al. Type I interferon autoantibodies in hospitalized patients with Middle East respiratory syndrome and association with outcomes and treatment effect of interferon beta-1β in MIRACLE clinical trial. Influenza Other Respir Viruses 2023 ; 17 : e13116. [CrossRef] [PubMed] [Google Scholar]
- Gervais A, Rovida F, Avanzini MA, et al. Autoantibodies neutralizing type I IFNs underlie West Nile virus encephalitis in ∼ 40 % of patients. J Exp Med 2023 ; 220 : e20230661. [CrossRef] [PubMed] [Google Scholar]
- Bastard P, Michailidis E, Hoffmann H-H, et al. Auto-antibodies to type I IFNs can underlie adverse reactions to yellow fever live attenuated vaccine. J Exp Med 2021 ; 218 : e20202486. [CrossRef] [PubMed] [Google Scholar]
- Mieli-Vergani G, Bansal S, Daniel JF, et al. Peginterferon alfa-2a (40KD) plus lamivudine or entecavir in children with immune-tolerant chronic hepatitis B. J Pediatr Gastroenterol Nutr 2021 ; 73 : 156–60. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 La prévalence des auto-anticorps neutralisant les IFN de type I chez les patients atteints de maladie à virus West-Nile augmente de manière significative avec la gravité de la maladie. La maladie à virus West-Nile transmise par les moustiques est bénigne chez la plupart des individus, mais peut provoquer des atteintes graves neuro-invasives (encéphalites, méningites, paralysie flasque aigüe) chez moins de 1 % des personnes infectées. A. Trente-cinq % des patients atteints de formes neuro-invasives sont porteurs d’auto-anticorps neutralisant l’IFN-α et/ou l’IFN-ω. La prévalence de ces anticorps est plus élevée chez les patients atteints d’encéphalite (environ 40 %). B. Chez les individus présentant une infection silencieuse par le virus West-Nile, la prévalence du portage d’auto-anticorps neutralisant l’IFN-α et/ou l’IFN-ω est aussi faible que dans la population générale. Elle est de moins de 10 % chez l’ensemble des individus atteints de formes asymptomatiques et paucisymptomatiques. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




