| Issue |
Med Sci (Paris)
Volume 41, Number 1, Janvier 2025
|
|
|---|---|---|
| Page(s) | 12 - 15 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024186 | |
| Published online | 31 January 2025 | |
Détection immunitaire des toxines bactériennes inhibitrices de la traduction dans les cellules épithéliales
Innate immune detection of bacterial virulence-induced translation shut down
Institut de pharmacologie et de biologie structurale, université de Toulouse, CNRS UMR5089, France
Inactivation du fonctionnement des ribosomes par les bactéries pathogènes
Les organismes vivants sont continuellement exposés à des agents microbiens, dont certains sont pathogènes et déclenchent une réponse immunitaire à l’infection. Parmi les nombreuses stratégies développées par les bactéries pathogènes pour échapper à une réponse immunitaire efficace, nous nous sommes intéressés à l’inhibition de la traduction, par les ribosomes, des ARN messagers (ARNm) cellulaires en protéines, vecteurs essentiels des fonctions cellulaires et immunitaires. La traduction des ARNm comporte trois processus successifs : l’initiation, l’élongation des peptides, et la terminaison [1]. De nombreux facteurs cellulaires sont impliqués dans chacun de ces processus, et constituent des cibles de choix pour de nombreux agents infectieux.
Pendant la phase d’initiation, le complexe moléculaire de pré-initiation balaye l’ARNm de 5’ vers 3’ jusqu’à ce qu’il « rencontre » un codon initiateur AUG. Cette rencontre indique le début de la synthèse protéique. Le ribosome se déplace ensuite le long de l’ARNm en ajoutant successivement, codon après codon, les acides aminés à la protéine en formation [1]. La GTPase eEF2 (eukaryotic elongation factor 2) joue un rôle primordial dans le déplacement du ribosome d’un codon au codon suivant. Pour être active, eEF2 doit subir une modification post-traductionnelle unique : la transformation d’un résidu histidine (en position 715 dans la séquence de la protéine humaine) en diphtamide [2], un processus qui nécessite cinq protéines DPH (diphthamide biosynthesis proteins) différentes [3] (Figure 1). La diphtamide a été conservée durant l’évolution des eucaryotes et des archées, mais elle est absente chez les bactéries, ce qui en fait une cible de choix pour les agents pathogènes bactériens.
 |
Figure 1. Schéma de la translocation des ribosomes des cellules eucaryotes sur l’ARN messager et des toxines bactériennes ciblant le facteur d’élongation eEF2. Pendant l’élongation des protéines en cours de synthèse, le ribosome (constitué de ses sous-unités 60S et 40S) se déplace le long de l’ARN messager (ARNm), codon par codon (du site A vers le site E), en ajoutant, grâce aux différents ARN de transfert (ARNt), les acides aminés successifs à la protéine en formation. Le facteur d’élongation eEF2 est impliqué dans la translocation du ribosome au codon suivant. Certaines toxines bactériennes (toxine cholérique, exotoxine A, toxine diphtérique) sont capables de bloquer cette translocation des ribosomes par ADP-ribosylation du facteur eEF2 sur son résidu diphtamide, situé en position 715 de la séquence des acides aminés (Diph715). (Figure créée avec le logiciel Biorender.com). |
Dans ce contexte, les bactéries pathogènes Corynebacterium diphtheriae (C. diphtheriae) [4], Pseudomonas aeruginosa (P. aeruginosa) [2] et Vibrio cholerae (V. cholerae) [5] sécrètent respectivement la toxine diphtérique, l’exotoxine A et la toxine cholix, qui ciblent toutes les trois le résidu diphtamide de eEF2. Cela conduit à une modification de ce résidu par ADP-ribosylation, ce qui inactive eEF2 et bloque totalement la synthèse des protéines (Figure 1). Une conséquence majeure de l’inactivation de la traduction des ARNm est la mise en place d’une réponse cellulaire au « stress ribotoxique », déclenchée par la collision entre les ribosomes incapables de poursuivre le processus de traduction. Cette collision est détectée par la protéine kinase de stress ZAKα, appartenant à la famille des MAP kinases (mitogen-activated protein kinases) [6]. Dans ce contexte, un changement de conformation de ZAKα et son interaction avec d’autres molécules ZAKα conduisent à son activation par autophosphorylation et à l’activation de deux voies de stress primordiales impliquant les MAP kinases p38 et JNK (c-Jun N-terminal kinase) [6]. Il en résulte, d’une part, la mise en place d’un programme transcriptionnel caractérisé par l’activation du facteur de transcription ATF4 (activating transcription factor 4), permettant de réparer les dommages cellulaires causés par la collision des ribosomes, et d’autre part, la mise en place d’un programme de mort cellulaire programmée non inflammatoire (apoptose) [6]. Récemment, il a été découvert que la collision des ribosomes à la suite d’un stress environnemental (exposition aux rayons ultra-violets B, UVB) avait pour conséquence l’activation d’un troisième programme cellulaire induit par ZAKα et la kinase p38 : l’activation de l’inflammasome NLRP1 (nucleotide-binding domain and leucine-rich repeat containing protein 1), conduisant à un programme de mort cellulaire inflammatoire (pyroptose), et à la libération de cytokines pro-inflammatoires, les interleukines 1β et 18 [7]. Ce troisième programme cellulaire est absent dans de nombreuses cellules tumorales et dans les cellules des rongeurs couramment utilisés pour la recherche (souris et rat), ce qui explique pourquoi les études précédentes n’ont pas pu le mettre en évidence. Cela suggère que l’inflammasome NLRP1 pourrait également avoir un rôle dans la mise en place d’une réponse inflammatoire et immunitaire au cours d’infections par les bactéries V. cholerae, C. diphtheriae ou P. aeruginosa, dont les toxines inhibent le fonctionnement des ribosomes dans les cellules infectées.
Rôle de l’inflammasome NLRP1 dans la réponse au stress ribotoxique
Les inflammasomes sont des complexes multiprotéiques activés par divers signaux infectieux ou stress environnementaux [7, 8]. L’inflammasome est composé d’un récepteur cellulaire, d’une protéine adaptatrice ASC (apoptosis-associated speck-like protein containing a CARD domain) et de l’effecteur de ce complexe, la protéase caspase-1. Une fois l’inflammasome activé, la caspase-1 active à son tour l’interleukine-1β et l’interleukine-18 (cytokines pro-inflammatoires) par clivage enzymatique. En parallèle, la caspase-1 clive également la protéine gasdermine D, dont le fragment N-terminal forme des pores dans la membrane cellulaire, conduisant ainsi à la libération des interleukines et à la pyroptose. L’inflammasome NLRP1 se distingue des autres inflammasomes par son expression dans divers épithéliums de revêtement, comme ceux de la peau, de la cornée de l’œil, ou encore des voies respiratoires. De plus, de rares mutations de NLRP1 sont associées à une sensibilité accrue aux infections, à des maladies inflammatoires de la peau, de l’intestin et de la cornée, ainsi qu’à une susceptibilité à l’asthme chez l’homme, ce qui témoigne de l’importance du rôle joué par NLRP1 dans divers épithéliums [8]. Nous nous sommes intéressés au rôle de l’exotoxine A produite par P. aeruginosa dans l’activation de l’inflammasome NLRP1, et à son implication dans le contexte pathologique de la mucoviscidose [9]. P. aeruginosa est une bactérie pathogène opportuniste, qui peut infecter les cellules de la majorité des organes et tissus chez l’homme (notamment, voies respiratoires, voies urinaires, peau, œil). Elle provoque des infections nosocomiales chroniques, notamment chez les patients atteints de mucoviscidose, de dyskinésie ciliaire, ou encore de bronchectasie1. De plus, en raison de la résistance croissante de cette bactérie aux antibiotiques, les infections par P. aeruginosa constituent un problème de santé publique.
Dans ce contexte, nous avons montré que P. aeruginosa est capable d’induire, dans les cellules épithéliales humaines nasales et de la cornée, une mort lytique et inflammatoire (pyroptose), caractérisée par la libération d’interleukine-1β, d’interleukine-18, et de LDH (lactate déshydrogénase). En utilisant différentes souches de P. aeruginosa déficientes ou non pour ses différentes toxines, nous avons montré que l’exotoxine A, par son action inhibitrice sur le facteur d’élongation eEF2, induit un stress ribotoxique qui active les kinases ZAKα et p38, et que cette dernière active l’inflammasome NLRP1, ce qui induit la pyroptose et la production d’interleukine-1β (Figure 2). De plus, l’utilisation de cellules déficientes pour DPH1 inhibe l’activation de l’inflammasome NLRP1 en réponse à l’exotoxine A, confirmant l’action de cette toxine sur l’acide aminé diphthamide de eEF2 [9]. Il convient de noter que des déficiences en DPH1 liées à des mutations génétiques ont été découvertes récemment chez certaines personnes, ce qui pose la question de la réponse immunitaire de ces patients face aux infections par les bactéries dont les toxines ciblent le résidu diphtamide de eEF2 (P. aeruginosa, V. cholerae, C. diphtheriae) [10].
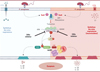 |
Figure 2. Mécanisme d’action de l’exotoxine A de Pseudomonas aeruginosa dans l’épithélium des voies respiratoires. L’exotoxine A (ExoA), libérée par la bactérie P. aeruginosa, inhibe la traduction des ARN messagers cellulaires en protéines via l’ADP-ribosylation du facteur d’élongation eEF2. Cette inhibition induit la collision des ribosomes et l’activation de la réponse au stress ribotoxique, impliquant l’activation et la phosphorylation de la kinase ZAKα qui à son tour active et phosphoryle la kinase p38. Ces deux kinases sont capables d’activer l’inflammasome NLRP1 par phosphorylation et d’induire une mort cellulaire inflammatoire, avec libération de cytokines IL(interleukine)-1β et IL-18 (schéma de gauche). Cette mort cellulaire par pyroptose est exacerbée dans le contexte de la mucoviscidose (schéma de droite). CFTR : cystic fibrosis transmembrane conductance regulator ; Cl- : ion chlorure ; PYD : pyrin domain ; NACHT : NACHT domain ; LRR : leucine-rich repeats ; CARD : caspase recruitment domain ; ZU5 : found in ZO-1 and UNC5 ; UPA : conserved in UNC5, PIDD and ankyrin domain ; DPP8 : dipeptidylpeptidase 8. (Figure créée avec le logiciel Biorender.com). |
Par la suite, nous nous sommes intéressés aux conséquences physiologiques et pathologiques de l’activation de l’inflammasome NLRP1 au cours d’une infection par P. aeruginosa dans des cellules issues de patients atteints de mucoviscidose et porteurs de la mutation Phe508del dans la protéine CFTR (cystic fibrosis transmembrane conductance regulator), la mutation la plus fréquente dans cette maladie. Nous avons montré que la pyroptose est exacerbée dans les cellules épithéliales des voies respiratoires provenant de patients atteints de mucoviscidose en réponse à l’exotoxine A ou à l’infection par P. aeruginosa. De plus, nous avons mis en évidence que cette exacerbation de la pyroptose implique une suractivation de la protéine kinase p38 à l’état basal dans les cellules de ces patients. Ce processus est réversible grâce à l’utilisation in vitro des « correcteurs du CFTR » issus de la trithérapie Kaftrio® [11] (→).
(→) Voir la Synthèse de E. Bardin et al., m/s n° 3, mars 2024, page 258
Dans ce contexte, l’utilisation d’inhibiteurs de la kinase ZAKα, mais également de p38, a entraîné une inhibition totale de la mort par pyroptose des cellules nasales ou de la cornée provenant d’individus sains, mais aussi des cellules provenant des patients atteints de mucoviscidose (Figure 2). L’équipe de recherche dirigée par Franklin Zhong a également montré, dans un modèle cutané 3D d’infection par C. diphtheriae, que la toxine diphtérique perturbe l’intégrité de la barrière épidermique via le stress ribotoxique des kératinocytes et la pyroptose induite par l’inflammasome NLRP1 [12].
Conclusion
Plusieurs bactéries pathogènes perturbent le fonctionnement des cellules de l’organisme qu’elles infectent en ciblant les différents acteurs de la traduction des ARNm cellulaires en protéines, notamment le facteur d’élongation eEF2. Elles stimulent ainsi leur propre réplication, ce qui favorise leur propagation dans l’organisme. L’inflammasome NLRP1 joue un rôle central dans l’activation de la réponse immunitaire innée des épithéliums de revêtement face à l’agresseur, en induisant la mort lytique et pro-inflammatoire (pyroptose) des cellules épithéliales.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Jackson RJ, Hellen CUT, Pestova TV. The mechanism of eukaryotic translation initiation and principles of its regulation. Nat Rev Mol Cell Biol 2010 ; 11 : 113–27. [CrossRef] [PubMed] [Google Scholar]
- Jørgensen R, Merrill AR, Yates SP, et al. Exotoxin A-eEF2 complex structure indicates ADP ribosylation by ribosome mimicry. Nature 2005 ; 436 : 979–84. [CrossRef] [PubMed] [Google Scholar]
- Liu S, Milne GT, Kuremsky JG, et al. Identification of the proteins required for biosynthesis of diphthamide, the target of bacterial ADP-ribosylating toxins on translation elongation factor 2. Mol Cell Biol 2004 ; 24 : 9487–97. [CrossRef] [PubMed] [Google Scholar]
- Holmes RK. Biology and molecular epidemiology of diphtheria toxin and the tox gene. J Infect Dis 2000 ; 181 : S156–67. [CrossRef] [PubMed] [Google Scholar]
- Jørgensen R, Purdy AE, Fieldhouse RJ, et al. Cholix toxin, a novel ADP-ribosylating factor from Vibrio cholerae. J Biol Chem 2008 ; 283 : 10671–8. [CrossRef] [PubMed] [Google Scholar]
- Vind AC, Snieckute G, Blasius M, et al. ZAKα recognizes stalled ribosomes through partially redundant sensor domains. Mol Cell 2020 ; 78 : 700–13. [CrossRef] [PubMed] [Google Scholar]
- Robinson KS, Toh GA, Rozario P, et al. ZAKα-driven ribotoxic stress response activates the human NLRP1 inflammasome. Science 2022 ; 377 : 328–35. [CrossRef] [PubMed] [Google Scholar]
- Bauernfried S, Hornung V. Human NLRP1: From the shadows to center stage. J Exp Med 2021 ; 219 : e20211405. [Google Scholar]
- Pinilla M, Mazars R, Vergé R, et al. EEF2-inactivating toxins engage the NLRP1 inflammasome and promote epithelial barrier disruption. J Exp Med 2023 ; 220 : e20230104. [CrossRef] [PubMed] [Google Scholar]
- Urreizti R, Mayer K, Evrony G, et al. DPH1 syndrome: two novel variants and structural and functional analyses of seven missense variants identified in syndromic patients. Eur J Hum Genet 2020 ; 28 : 64–75. [CrossRef] [PubMed] [Google Scholar]
- Bardin E, Pranke I, Hinzpeter A, Sermet-Gaudelus I. Traitements de la mucoviscidose : révolution clinique et nouveaux défis. Med Sci (Paris) 2024 ; 40 : 258–67. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Robinson KS, Toh GA, Firdaus MJ, et al. Diphtheria toxin activates ribotoxic stress and NLRP1 inflammasome-driven pyroptosis. J Exp Med 2023 ; 220 : e20230105. [CrossRef] [PubMed] [Google Scholar]
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Schéma de la translocation des ribosomes des cellules eucaryotes sur l’ARN messager et des toxines bactériennes ciblant le facteur d’élongation eEF2. Pendant l’élongation des protéines en cours de synthèse, le ribosome (constitué de ses sous-unités 60S et 40S) se déplace le long de l’ARN messager (ARNm), codon par codon (du site A vers le site E), en ajoutant, grâce aux différents ARN de transfert (ARNt), les acides aminés successifs à la protéine en formation. Le facteur d’élongation eEF2 est impliqué dans la translocation du ribosome au codon suivant. Certaines toxines bactériennes (toxine cholérique, exotoxine A, toxine diphtérique) sont capables de bloquer cette translocation des ribosomes par ADP-ribosylation du facteur eEF2 sur son résidu diphtamide, situé en position 715 de la séquence des acides aminés (Diph715). (Figure créée avec le logiciel Biorender.com). |
| Dans le texte | |
 |
Figure 2. Mécanisme d’action de l’exotoxine A de Pseudomonas aeruginosa dans l’épithélium des voies respiratoires. L’exotoxine A (ExoA), libérée par la bactérie P. aeruginosa, inhibe la traduction des ARN messagers cellulaires en protéines via l’ADP-ribosylation du facteur d’élongation eEF2. Cette inhibition induit la collision des ribosomes et l’activation de la réponse au stress ribotoxique, impliquant l’activation et la phosphorylation de la kinase ZAKα qui à son tour active et phosphoryle la kinase p38. Ces deux kinases sont capables d’activer l’inflammasome NLRP1 par phosphorylation et d’induire une mort cellulaire inflammatoire, avec libération de cytokines IL(interleukine)-1β et IL-18 (schéma de gauche). Cette mort cellulaire par pyroptose est exacerbée dans le contexte de la mucoviscidose (schéma de droite). CFTR : cystic fibrosis transmembrane conductance regulator ; Cl- : ion chlorure ; PYD : pyrin domain ; NACHT : NACHT domain ; LRR : leucine-rich repeats ; CARD : caspase recruitment domain ; ZU5 : found in ZO-1 and UNC5 ; UPA : conserved in UNC5, PIDD and ankyrin domain ; DPP8 : dipeptidylpeptidase 8. (Figure créée avec le logiciel Biorender.com). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




