| Issue |
Med Sci (Paris)
Volume 40, Number 12, Décembre 2024
Épigénétique : développement et destin cellulaire
|
|
|---|---|---|
| Page(s) | 985 - 988 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024170 | |
| Published online | 20 December 2024 | |
La zonula adherens matura, une nouvelle jonction intercellulaire de l’épithélium intestinal
Zonula adherens matura: A new intestinal cell junction
1
Aix Marseille Université, CNRS, Institut de biologie du développement de Marseille, UMR7288, Marseille, France
2
Aix Marseille Université, Inserm, Dynamique et nano-environnement des membranes biologiques, (DyNaMo), Centre Turing des systèmes vivants, Marseille, France
3
Aix Marseille Université, CNRS, Institut de biologie du développement de Marseille, UMR7288, Centre Turing des systèmes vivants, Marseille, France
a
pierre.mangeol@univ-amu.fr
b
pierre-francois.lenne@univ-amu.fr
c
andre.le-bivic@cnrs.fr
La surface du corps, ses cavités et ses tubes sont tapissés par un épithélium de revêtement. La face interne de l’intestin, par exemple, est couverte par des cellules épithéliales, dont la plupart sont impliquées dans l’absorption de l’eau et des nutriments. Ces cellules sont reliées entre elles par différents types de jonctions qui remplissent différentes fonctions, allant de la filtration sélective de certains ions au maintien mécanique de l’épithélium. La communauté scientifique tente de comprendre les mécanismes du maintien et du contrôle des épithéliums de revêtement, car ils sont à l’origine de la majorité des cancers humains.
Les jonctions apicales entre les cellules épithéliales ont été découvertes dans les années 1960 par Farquhar et Palade, en observant l’épithélium d’intestin de rat par microcopie électronique. Ils définirent alors trois types de jonctions qui coexistent : la jonction serrée, la zonula adherens et la macula adherens [1]. La jonction serrée joue un rôle central dans la formation d’une barrière épithéliale, en filtrant sélectivement les ions qui peuvent passer entre les cellules. La zonula adherens est connectée au réseau intracellulaire d’actomyosine, et joue ainsi un rôle important dans la tension apicale de la cellule, qui gouverne sa forme et qui intervient dans la morphogenèse des épithéliums. La macula adherens a un rôle passif en préservant l’intégrité de la couche épithéliale lorsqu’elle est soumise à une force mécanique, en particulier grâce à ses connexions avec des filaments intermédiaires.
La zonula adherens : un modèle datant des années 1990
Le zonula adherens a été beaucoup étudiée, notamment en raison de son rôle au cours du développement. Son organisation moléculaire a été formulée dans les années 1990, avec la découverte de la E-cadhérine, de l’α-caténine et de la β-caténine [2–4]. Le modèle datant de cette époque suppose que ces protéines forment, autour de la membrane plasmique, une ceinture (zonula signifie « petite ceinture » en latin), reliée au réseau des filaments d’actine par l’intermédiaire de l’α-caténine (Figure 1). Les jonctions entre les cellules intestinales sont souvent utilisées pour illustrer ce paradigme.
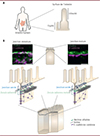 |
Figure 1 L’épithélium intestinal et la jonction intercellulaire zonula adherens. A. La surface interne de l’intestin est couverte par un épithélium de revêtement. Les cellules souches, situées au fond des cryptes, donnent naissance à des cellules qui migrent vers les villosités. B. L’organisation des jonctions intercellulaires apicales dépend de l’état de maturation des cellules. En haut : exemples de marquages des protéines afadine et β-caténine dans des cellules de la lignée Caco-2 en culture depuis 6 jours (à gauche) ou depuis 14 jours (à droite). Les images proviennent de l’observation par microscopie STED, et sont centrées sur les jonctions apicales observées le long de leur axe apico-basal. Lorsqu’une cellule est mature, elle présente une zonula adherens dans laquelle les ceintures de nectine et de E-cad-hérine sont ségrégées. Barres d’échelle : 1 µm (figure adaptée de [7]). |
Redéfinir la zonula adherens dans les cellules intestinales
Alors que nous déterminions la localisation de protéines présentes aux jonctions apicales entre les cellules épithéliales dans des biopsies intestinales humaines, nous avons fait une observation surprenante : la E-cadhérine, l’α-caténine et la β-caténine étaient localisées plus bas que la ceinture d’actine le long de l’axe apico-basal de la cellule, les protéines de la jonction serrée étaient localisées plus haut que cette ceinture, et aucune de ces protéines n’était abondante à la hauteur de la ceinture. Quelles autres protéines étaient donc présentes à cet endroit, et pouvaientelles se connecter à l’actine à la place de la E-cadhérine et des caténines ?
Presque deux décennies après la découverte de la E-cadhérine, un autre complexe reliant des protéines transmembranaires à l’actine fut découvert dans la même région que la E-cadhérine : celui associant les protéines transmembranaires nectines [5] et la protéine adaptatrice afadine [6]. Après un marquage des protéines de ce complexe par immunofluorescence, nous avons pu confirmer, par la méthode de microscopie de super-résolution STED (déplétion par émission stimulée)1, qu’il est situé à la hauteur de la ceinture d’actine, entre le complexe E-cadhérine-caténine et la jonction serrée [7].
Comment expliquer ce résultat surprenant ? Pourquoi avions-nous observé une telle différence dans l’organisation de la zonula adherens, alors que personne ne l’avait signalée auparavant malgré tant de travaux consacrés à cette structure pendant 40 ans ? Une première réponse provient de la maturation des cellules. Alors que la plupart des recherches sur les épithéliums sont effectuées en culture cellulaire lorsque les cellules atteignent la confluence, un état obtenu après quelques jours, nous avons pris en compte des observations faites sur la lignée cellulaire intestinale Caco-22 dans les années 1980, selon lesquelles deux à trois semaines sont nécessaires pour que ces cellules se différencient en entérocytes [8]. Nous avons observé par la suite que l’organisation de la zonula adherens telle qu’elle est généralement décrite correspond à une forme immature de cette jonction intercellulaire, alors que dans sa forme mature, celle des cellules recouvrant les villosités intestinales (Figure 1A), la position des nectines et de l’afadine coïncide avec la ceinture d’actine (Figure 1B). Nous avons appelé zonula adherens matura la jonction mature, afin de distinguer cette nouvelle description de son organisation de celle de la zonula adherens connue jusqu’alors. Une suppression de l’afadine par la méthode d’édition génomique CRISPR a permis de comprendre le rôle de cette protéine : sans afadine, la ceinture d’actine existe toujours, mais elle est localisée plus loin de la jonction, tandis que la tension apicale est plus faible [7].
Pourquoi cette organisation caractérise-t-elle les cellules épithéliales matures ?
La façon dont les caténines et l’afadine interagissent avec l’actine pourrait aider à comprendre la ségrégation observée. Les deux complexes nectineafadine et E-cadhérine-caténine sont tous deux présents et se lient à l’actine lorsqu’une jonction intercellulaire est établie. Cependant, comme le complexe E-cadhérine-caténine ne se lie efficacement aux filaments d’actine que lorsque ceux-ci sont sous tension, son association avec la ceinture d’actine est probablement transitoire [9]. Par conséquent, des complexes protéiques autres que E-cadhérine-caténine et ayant une interaction plus stable avec l’actine pourraient prendre le relais au fur et à mesure de la maturation de la jonction. Cette interaction plus stable pourrait également fournir le nombre suffisant de points d’ancrage pour la maturation du réseau d’actine, comme le suggèrent les anomalies de ce réseau constatées dans les cellules privées d’afadine. Alors que le complexe E-cadhérine-caténine a été présenté comme le principal complexe adhésif de la zonula adherens des cellules épithéliales, et des cellules intestinales en particulier, notre analyse apporte un nouvel éclairage sur la maturation de cette jonction intercellulaire en montrant que le complexe nectine-afadine est également un complexe adhésif majeur de la zonula adherens, qui transmet la tension dans des cellules intestinales matures. Ces deux complexes adhésifs peuvent transmettre la tension, soit par un lien direct avec la ceinture de filaments d’actine, soit par leur possible interaction à la frontière entre les deux ceintures qu’ils forment. Cependant, ces résultats ne remettent pas en cause le fait que l’essentiel de l’adhérence entre les cellules de l’épithélium intestinal a lieu tout le long de la membrane latérale où la E-cadhérine est présente, et non uniquement dans sa partie la plus apicale. La jonction serrée participe très probablement elle aussi à la transmission de la tension entre les cellules épithéliales : il est vraisemblable que son implication dans cette transmission dépende également de l’état de maturation des cellules épithéliales.
Perspectives
Cette étude ouvre de nouvelles voies pour comprendre la maturation des jonctions intercellulaires apicales et leur maintien malgré des contraintes mécaniques. Nos résultats indiquent que le rôle de la E-cadhérine en tant que lien mécanique entre la membrane plasmique et le cytosquelette d’actine dans les épithéliums n’est peut-être pas aussi général qu’on le pensait. Nous espérons qu’ils permettront également de préciser l’implication des nectines en pathologie humaine [10].
Remerciements
Nous remercions l’Institut de biologie du développement de Marseille (IBDM), membre de l’infrastructure nationale France-BioImaging soutenue par l’Agence nationale de la recherche (ANR-10-INBS-04). PM a été subventionné par les Instituts thématiques multi-organismes (ITMO) Cancer (Plan Cancer), la Ligue nationale contre le cancer, et l’Agence nationale de la recherche (ANR-T-JUST, ANR-17-CE14-0032, ANR-EvolAj, et ANR-21-CE13-0013-01). Le projet de recherche s’est développé dans des instituts soutenus par le LabEx INFORM (ANR-11-LABX-0054) et le projet A*MIDEX (ANR-11-IDEX-0001-02), financés par les Investissements d’avenir. PM est subventionné par Aix-Marseille Université, DM-H et MS le sont par l’Inserm, et ALB et P-FL par le CNRS.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Le principe de la microscopie STED (stimulated-emission-depletion) est d’illuminer l’échantillon successivement avec un laser d’excitation et un laser de déplétion. Le laser de déplétion, en forme d’anneau, force la fluorescence rapide des fluorophores qu’il illumine par émission stimulée. Après cette émission forcée, il reste la fluorescence spontanée des fluorophores situés au centre de l’anneau, qui est alors détectée.
Références
- Farquhar MG, Palade GE. Junctional complexes in various epithelia. J Cell Biol 1963 ; 17 : 375–412. [CrossRef] [PubMed] [Google Scholar]
- Hyafil F, Morello D, Babinet C, et al. A cell surface glycoprotein involved in the compaction of embryonal carcinoma cells and cleavage stage embryos. Cell 1980 ; 21 : 927–34. [CrossRef] [PubMed] [Google Scholar]
- Yoshida C, Takeichi M. Teratocarcinoma cell adhesion: Identification of a cell-surface protein involved in calcium-dependent cell aggregation. Cell 1982 ; 28 : 217–24. [CrossRef] [PubMed] [Google Scholar]
- Ozawa M, Baribault H, Kemler R. The cytoplasmic domain of the cell adhesion molecule uvomorulin associates with three independent proteins structurally related in different species. EMBO J 1989 ; 8 : 1711–7. [CrossRef] [PubMed] [Google Scholar]
- Takahashi K, Nakanishi H, Miyahara M, et al. Nectin/PRR: An immunoglobulin-like cell adhesion molecule recruited to cadherin-based adherens junctions through interaction with afadin, a PDZ domain-containing protein. J Cell Biol 1999 ; 145 : 539–49. [CrossRef] [PubMed] [Google Scholar]
- Mandai K, Nakanishi H, Satoh A, et al. Afadin: A novel actin filament-binding protein with one PDZ domain localized at cadherin-based cell-to-cell adherens junction. J Cell Biol 1997 ; 139 : 517–28. [CrossRef] [PubMed] [Google Scholar]
- Mangeol P, Massey-Harroche D, Sebbagh M, et al. The zonula adherens matura redefines the apical junction of intestinal epithelia. Proc Natl Acad Sci USA 2024 ; 121 : e2316722121. [CrossRef] [PubMed] [Google Scholar]
- Pinto M, Robine-Leon S, Appay M-D, et al. Enterocyte-like differentiation and polarization of the human colon carcinoma cell line Caco-2 in culture. Biol Cell 1983 ; 47 : 323–30. [Google Scholar]
- Buckley CD, Tan J, Anderson KL, et al. The minimal cadherin-catenin complex binds to actin filaments under force. Science 2014 ; 346 : 1254211. [CrossRef] [PubMed] [Google Scholar]
- Mandai K, Rikitake Y, Mori M, et al. Chapter 6. Nectins and nectin-like molecules in development and disease. In : Yap AS, editor. Curr Top Dev Biol Cellular adhesion in development and disease. Cambridge, Massachusetts, États-Unis : Academic Press, 2015 : pp. 197–231. [CrossRef] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1 L’épithélium intestinal et la jonction intercellulaire zonula adherens. A. La surface interne de l’intestin est couverte par un épithélium de revêtement. Les cellules souches, situées au fond des cryptes, donnent naissance à des cellules qui migrent vers les villosités. B. L’organisation des jonctions intercellulaires apicales dépend de l’état de maturation des cellules. En haut : exemples de marquages des protéines afadine et β-caténine dans des cellules de la lignée Caco-2 en culture depuis 6 jours (à gauche) ou depuis 14 jours (à droite). Les images proviennent de l’observation par microscopie STED, et sont centrées sur les jonctions apicales observées le long de leur axe apico-basal. Lorsqu’une cellule est mature, elle présente une zonula adherens dans laquelle les ceintures de nectine et de E-cad-hérine sont ségrégées. Barres d’échelle : 1 µm (figure adaptée de [7]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




