| Issue |
Med Sci (Paris)
Volume 40, Number 12, Décembre 2024
Épigénétique : développement et destin cellulaire
|
|
|---|---|---|
| Page(s) | 982 - 985 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024169 | |
| Published online | 20 December 2024 | |
L’interleukine 27
Un élément clé de la réponse immunitaire contre l’infection par le virus d’Epstein-Barr
Interleukin 27: a key factor of the immune response to Epstein-Barr virus
Laboratoire Activation lymphocytaire et susceptibilité au virus Epstein Barr, Inserm UMR 1163, Institut Imagine, université Paris Cité, Paris, France
Le virus d’Epstein Barr (EBV) ou virus de l’herpès 4 (HHV-4) est un virus ubiquitaire caractérisé par une infection latente et persistante chez l’homme. EBV est un virus oncogénique responsable de l’apparition de tumeurs malignes d’origine lymphocytaire ou épithéliale, comme le lymphome de Hodgkin, le lymphome de Burkitt et les carcinomes nasopharyngés ou gastriques, contribuant à 1,5 % des cas de cancer dans le monde [1]. On estime que plus de 90 % de la population mondiale adulte est séropositive pour EBV. Ce virus véhiculé par la salive a un tropisme particulier pour les cellules épithéliales et les lymphocytes B de l’oropharynx. Dans les lymphocytes B, EBV déclenche une forte prolifération cellulaire et persiste à l’état latent après la résolution de l’infection primaire. L‘expansion polyclonale des lymphocytes B infectés par EBV est principalement contenue par le système immunitaire adaptatif, en particulier par une réponse impliquant les lymphocytes T CD8+ cytotoxiques. Ces derniers se multiplient fortement pour contrer l’expansion des lymphocytes B infectés par EBV [2]. L’infection primaire chez l’enfant est généralement asymptomatique, mais lorsqu’elle survient à l’adolescence ou chez de jeunes adultes, elle peut provoquer une mononucléose infectieuse, une maladie lymphoproliférative associant fièvre transitoire, pharyngite et lymphadénopathie, et reflétant une réponse immunitaire exacerbée chez ces individus [3]. La maladie se résout spontanément dans la plupart des cas, mais il existe des formes plus sévères associées à un syndrome inflammatoire ou au développement d’une prolifération maligne ou non maligne des lymphocytes B. Ces formes surviennent généralement chez des individus immunodéprimés ou souffrant d’un déficit immunitaire. Ainsi, certaines maladies héréditaires, comme les immunodéficiences primaires, peuvent conférer aux porteurs de ces mutations génétiques une forte susceptibilité à développer des infections sévères à EBV, dont l’issue peut être fatale [4]. Notre laboratoire est impliqué depuis une quinzaine d’années dans la caractérisation de ces déficits immunitaires.
Une nouvelle déficience primaire de l’immunité anti-EBV due à des mutations dans le gène IL27RA
Notre étude a porté sur trois enfants (issus de deux familles) atteints d’une infection sévère par EBV [5]. Ces enfants présentaient des symptômes précoces d’une mononucléose infectieuse sévère, caractérisée par une fièvre persistante, une hépatite et une splénomégalie accompagnées d’un syndrome inflammatoire, nécessitant l’hospitalisation de deux d’entre eux. L’analyse immunologique a révélé des anomalies dans l’effectif de sous-populations de lymphocytes T et B, suggérant une déficience immunitaire d’origine génétique. L’analyse des séquences nucléotidiques des exons du génome (whole exome sequencing) a révélé la présence, chez ces enfants, de variants bialléliques rares du gène IL27RA, codant la sous-unité a du récepteur de l’interleukine-27. Ces variants bialléliques entraînent une absence de la protéine correspondante à la surface de leurs lymphocytes T et B [5].
La protéine IL27RA forme un hétérodimère avec la sous-unité gp130 (glycoprotéine de 130 kDa) pour former le récepteur de l’interleukine-27 (Figure 1), responsable des effets de cette interleukine sur le système immunitaire. L’interleukine-27 est principalement produite par des cellules présentatrices d’antigènes, comme les macrophages et les cellules dendritiques, en réponse aux infections. Elle stimule la réponse immunitaire via la différenciation des lymphocytes T auxiliaires de type Th1 et l’expansion des lymphocytes CD8+ dans le contexte d’infections virales [6]. Par ailleurs, elle limite l’inflammation en activant les fonctions effectrices des lymphocytes T régulateurs et en inhibant la différenciation des lymphocytes T auxiliaires de type Th17 [7].
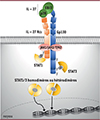 |
Figure 1 Schéma de la voie de signalisation de l’interleukine 27. L’interleukine-27 (IL-27) comporte deux sous-unités, constituées par les protéines P28 et EBI3. Elle se lie à son récepteur, qui comporte également deux sousunités, constituées par la glycoprotéine Gp130 et la chaîne a du récepteur de l’IL-27 (IL27RA). Cette liaison entraîne l’activation, dans le cytoplasme, des Janus kinases (JAK1, JAK2 ou TYK2) associées au récepteur, ce qui permet la phosphorylation et le recrutement des protéines STAT1 et STAT3 via leur domaine SH2, et la formation d’homodimères ou hétérodimères des molécules STAT activées. Ces dimères sont ensuite transloqués dans le noyau cellulaire. |
La liaison de l’interleukine-27 à son récepteur active la voie de signalisation impliquant les protéines JAK (Janus kinases) et STAT (signal transducers and activators of transcription) (Figure 1). Chez les individus porteurs des mutations délétères de IL27RA, la phosphorylation de STAT1 et STAT3 dans les lymphocytes T en réponse à l’interleukine-27 est faible ou inexistante. De même, la prolifération des lymphocytes T naïfs en réponse à une stimulation de leur récepteur de l’antigène (T cell receptor, TCR) en présence d’interleukine-27 est altérée, ce qui suggère que cette cytokine agit comme un costimulateur pour amplifier la prolifération lymphocytaire. Afin d’étudier le rôle spécifique de cette interleukine dans la réponse contre EBV, nous avons réalisé des expériences de coculture de lymphocytes T spécifiques de ce virus, provenant des patients ou de donneurs sains, et de lymphocytes B autologues infectés par le virus. Nous avons alors constaté que les lymphocytes T provenant des patients avaient une expansion et une différenciation altérées, un épuisement accéléré et une activité cytotoxique réduite. La restauration de l’expression du récepteur IL27RA dans les lymphocytes T des patients permet de corriger ces dysfonctionnements, ce qui confirme que les mutations de IL27RA en sont responsables. Ces résultats montrent que la signalisation impliquant ce récepteur est nécessaire à l’expansion et la différenciation de lymphocytes CD8+, ce qui explique le défaut de contrôle de l’infection par EBV chez des patients.
Par ailleurs, des résultats de recherches précédentes ont montré que l’interleukine-27 sécrétée par les lymphocytes B joue un rôle essentiel dans le contrôle des infections virales persistantes [8]. L’interleukine-27 est constituée des sous-unités p28 et EBI3 (Figure 1), et a été initialement identifiée dans des lignées de lymphocytes B transformés par EBV [9]. Nous avons formulé l’hypothèse que les lymphocytes B pourraient être une source d’interleukine-27 après une infection par EBV. Nous avons constaté que l’infection des lymphocytes B par EBV active en effet leur production de cette interleukine, laquelle s’accumule dans le milieu de culture au cours du temps. Il convient de noter que la prolifération et les phosphorylations de STAT1 et STAT3 en réponse à l’interleukine-27 sont réduites dans les lymphocytes B déficients en IL27RA. De plus, le blocage de l’interleukine-27 par des anticorps spécifiques réduit considérablement la croissance des lignées de lymphocytes B transformés par EBV, et l’inactivation du gène IL27 par la technique CRISPR-Cas9 provoque leur mort cellulaire rapide [5]. Cette interleukine joue donc un rôle crucial dans la prolifération et la survie des lymphocytes B transformés par EBV via une boucle autocrine (Figure 2). Ces résultats expérimentaux pourraient expliquer pourquoi les patients génétiquement déficients en IL-27RA, malgré un contrôle immunitaire défectueux de l’infection par EBV, ne développent pas de lymphome B dû à cette infection, comme cela survient pourtant fréquemment dans d’autres déficits immunitaires prédisposant à des infections sévères par EBV [4].
 |
Figure 2 Schéma du double rôle de l’interleukine-27 dans la réponse immunitaire contre le virus d’Epstein-Barr. L’interleukine-27 (IL-27) sécrétée par les lymphocytes B infectés par le virus d’Epstein-Barr (EBV) active les fonctions cytotoxiques des lymphocytes T spécifiques de ce virus, telles que la sécrétion d’interférons (IFN) et de la perforine. Parallèlement, IL-27 induit des signaux de survie pour les lymphocytes B infectés par le virus grâce à une boucle autocrine. |
Mononucléose infectieuse associée à la présence d’auto-anticorps neutralisants dirigés contre l’interleukine-27
Il existe des auto-anticorps qui ciblent et neutralisent des cytokines (ou interleukines) essentielles à la réponse immunitaire. La présence de certains de ces auto-anticorps peut être considérée comme une phénocopie d’immunodéficiences génétiques affectant les voies des interférons de type I et II, ou de cytokines, telles que l’interleukine- 17A/F et l’interleukine-6 [10]. Elle peut être associée à des syndromes auto-inflammatoires ou à une susceptibilité accrue à certaines infections. La présence d’auto-anticorps neutralisant les interférons de type I est notamment associée à de graves maladies virales, comme la pneumopathie sévère de la COVID-19 [11].
Nous avons émis l’hypothèse de l’implication d’auto-anticorps dirigés contre l’interleukine-27 dans des cas graves et sporadiques de mononucléose infectieuse liée à une infection primaire par EBV chez certains adolescents et adultes, mimant les effets de l’immunodéficience primaire par déficit de IL27RA. Nous avons effectivement découvert des auto-anticorps spécifiques de l’interleukine-27, avec des titres élevés, dans la majorité des échantillons de sang de patients atteints de mononucléose infectieuse, sévère dans la plupart des cas. Ces auto-anticorps sont aussi présents chez des patients souffrant du syndrome d’infection chronique par EBV, une maladie lymphoproliférative rare associée à l’infection de lymphocytes T ou NK (natural killer) par le virus EBV [10]. En revanche, peu ou pas d’auto-anticorps dirigés contre cette interleukine ont été détectés dans les échantillons provenant des individus témoins sans infection en cours. La présence de ces auto-anticorps était fortement corrélée à de fortes concentrations de l’interleukine-27 dans le sérum, avec formation de complexes interleukine-27/auto-anticorps, suggérant la possibilité que ces auto-anticorps soient déjà présents à des taux faibles chez les patients avant l’infection par EBV et induits par la production d’interleukine-27 lors de l’infection. La concentration de ces auto-anticorps anti-interleukine-27 diminuait chez les patients atteints de mononucléose infectieuse à distance des premiers symptômes, tandis qu’elle restait stable dans le sérum des patients ayant une infection chronique par EBV. Nous avons également montré que ces anticorps avaient une activité neutralisante sur la phosphorylation de STAT1/3 et sur la prolifération des lymphocytes T induites par l’interleukine-27. Cet effet neutralisant semble corrélé au titre d’auto-anticorps présents dans le sérum des patients, ainsi qu’à la gravité ou la persistance de l’infection par EBV [5].
Perspectives
La découverte d’une déficience immunitaire due à des mutations du gène IL27RA chez des enfants atteints de mononucléose infectieuse sévère ainsi que l’identification d’auto-anticorps neutralisants dirigés contre l’interleukine-27 chez des individus présentant une infection sévère par le virus EBV ont révélé le rôle protecteur de cette interleukine dans l’infection primaire par EBV. La présence des auto-anticorps neutralisants pourraient représenter une phénocopie de la déficience en IL27RA. Cependant, la corrélation entre la présence de ces auto-anticorps neutralisants et la sévérité des symptômes de l’infection ne constitue pas une preuve de causalité, et d’autres recherches seront nécessaires pour déterminer le rôle de ces auto-anticorps dans la réponse immunitaire contre EBV, ainsi que les mécanismes de leur apparition chez ces patients. Nous avons aussi montré l’implication de l’interleukine-27 dans la survie des lymphocytes B transformés par EBV, une possible cible thérapeutique pour inhiber la croissance de lymphomes B induits par le virus. Enfin, nous avons mis en évidence le rôle critique de l’interleukine-27 dans l’expansion et la différenciation des lymphocytes T spécifiques de EBV. Nous suggérons que ce rôle prédomine au début de la réponse immunitaire à l’infection, ou pour déclencher cette réponse lorsque la charge virale est encore faible. Il convient de considérer aussi le rôle anti-inflammatoire connu de l’interleukine-27, qui pourrait également limiter l’inflammation associée à la réponse immunitaire contre le virus en agissant sur les cellules proinflammatoires mobilisées dans cette réponse. Cette double action de l’interleukine-27, pro-immunitaire et anti-inflammatoire, permettrait d’éviter des dommages excessifs aux tissus tout en limitant la propagation du virus au début de l’infection.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Shannon-Lowe C, Rickinson A. The global landscape of EBV-associated tumors. Front Oncol 2019 ; 9 : 713. [CrossRef] [PubMed] [Google Scholar]
- Hislop AD, Taylor GS, Sauce D, et al. Cellular responses to viral infection in humans: Lessons from Epstein-Barr virus. Annu Rev Immunol 2007 ; 25 : 587–617. [CrossRef] [PubMed] [Google Scholar]
- Naughton P, Enright F, Lucey B. Infectious mononucleosis: new concepts in clinical presentation, epidemiology, and host response. Curr Opin Infect Dis 2024 ; 37 : 157–63. [CrossRef] [PubMed] [Google Scholar]
- Tangye SG, Latour S. Primary immunodeficiencies reveal the molecular requirements for effective host defense against EBV infection. Blood 2020 ; 135 : 644–55. [CrossRef] [PubMed] [Google Scholar]
- Martin E, Winter S, Garcin C, et al. Role of IL-27 in Epstein-Barr virus infection revealed by IL-27RA deficiency. Nature 2024 ; 628 : 620–9. [CrossRef] [PubMed] [Google Scholar]
- Beizavi Z, Zohouri M, Asadipour M, et al. IL-27, a pleiotropic cytokine for fine-tuning the immune response in cancer. Int Rev Immunol 2021 ; 40 : 319–29. [CrossRef] [PubMed] [Google Scholar]
- Mei Y, Lv Z, Xiong L, et al. The dual role of IL-27 in CD4+ T cells. Mol Immunol 2021 ; 138 : 172–80. [CrossRef] [PubMed] [Google Scholar]
- Pratumchai I, Zak J, Huang Z, et al. B cell-derived IL-27 promotes control of persistent LCMV infection. Proc Natl Acad Sci USA 2022 ; 119 : e2116741119. [CrossRef] [PubMed] [Google Scholar]
- Devergne O, Hummel M, Koeppen H, et al. A novel interleukin-12 p40-related protein induced by latent Epstein-Barr virus infection in B lymphocytes. J Virol 1996 ; 70 : 1143–53. [CrossRef] [PubMed] [Google Scholar]
- Sun R, Wang Y, Abolhassani H. Cellular mechanisms and clinical applications for phenocopies of inborn errors of immunity: infectious susceptibility due to cytokine autoantibodies. Expert Rev Clin Immunol 2023 ; 19 : 771–84. [CrossRef] [PubMed] [Google Scholar]
- Bastard P, Gervais A, Le Voyer T, et al. Human autoantibodies neutralizing type I IFNs: From 1981 to 2023. Immunol Rev 2024 ; 322 : 98–112. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1 Schéma de la voie de signalisation de l’interleukine 27. L’interleukine-27 (IL-27) comporte deux sous-unités, constituées par les protéines P28 et EBI3. Elle se lie à son récepteur, qui comporte également deux sousunités, constituées par la glycoprotéine Gp130 et la chaîne a du récepteur de l’IL-27 (IL27RA). Cette liaison entraîne l’activation, dans le cytoplasme, des Janus kinases (JAK1, JAK2 ou TYK2) associées au récepteur, ce qui permet la phosphorylation et le recrutement des protéines STAT1 et STAT3 via leur domaine SH2, et la formation d’homodimères ou hétérodimères des molécules STAT activées. Ces dimères sont ensuite transloqués dans le noyau cellulaire. |
| Dans le texte | |
 |
Figure 2 Schéma du double rôle de l’interleukine-27 dans la réponse immunitaire contre le virus d’Epstein-Barr. L’interleukine-27 (IL-27) sécrétée par les lymphocytes B infectés par le virus d’Epstein-Barr (EBV) active les fonctions cytotoxiques des lymphocytes T spécifiques de ce virus, telles que la sécrétion d’interférons (IFN) et de la perforine. Parallèlement, IL-27 induit des signaux de survie pour les lymphocytes B infectés par le virus grâce à une boucle autocrine. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




