| Issue |
Med Sci (Paris)
Volume 40, Novembre 2024
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 46 - 51 | |
| Section | Prix SFM | |
| DOI | https://doi.org/10.1051/medsci/2024138 | |
| Published online | 18 November 2024 | |
La microdystrophine pour le traitement de la dystrophie musculaire de Duchenne
Avancées, défis et voies d’amélioration
Advances and Challenges in Microdystrophin gene therapy for Duchenne Muscular Dystrophy: progress and future directions
1
Genethon, 91000 Evry, France
2
Université Paris-Saclay, Université Évry, Inserm, Généthon, Integrare research unit UMR_S951, 91000 Évry-Courcouronnes, France
La dystrophie musculaire de Duchenne (DMD) est une maladie musculaire génétique dégénérative sévère affectant principalement les jeunes garçons, caractérisée par une altération significative ou une absence d’expression de la dystrophine. Des avancées significatives ont été réalisées dans la compréhension et le traitement de la DMD, notamment avec l’autorisation récente de la première thérapie génique utilisant un vecteur adéno-associé recombinant (AAVr) pour délivrer une forme raccourcie de la dystrophine (microdystrophine). Malgré ces progrès, des défis majeurs persistent pour améliorer les résultats thérapeutiques. L’utilisation des vecteurs AAVr est entravée par des limitations majeures, notamment les risques d’immunotoxicité et d’hépatotoxicité associés aux hautes doses injectées. De plus, la microdystrophine présente des limites fonctionnelles intrinsèques ainsi que des risques immunologiques. Cet article examine ces défis et explore les perspectives d’amélioration de la thérapie génique pour la DMD.
Abstract
Duchenne muscular dystrophy (DMD) is a severe degenerative genetic muscle disease affecting mainly young boys, characterized by a significant alteration or absence of dystrophin expression. Significant strides have been made in comprehending and treating DMD, particularly with the recent approval of the first gene therapy using a recombinant adeno-associated vector (rAAV) to deliver a shortened form of dystrophin (microdystrophin). Nevertheless, major challenges remain in improving therapeutic outcomes. The use of rAAV vectors is hindered by major limitations, notably the risks of immunotoxicity and hepatotoxicity, linked to high-dose administration. Additionally, microdystrophin exhibits inherent functional limitations and immunological risks. This article examines these challenges and explores the avenues for enhancing gene therapy for DMD.
© 2024 médecine/sciences – Inserm
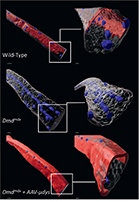
© A. Jaber
Vignette : Images 3D reconstruites de myofibres isolées provenant de muscles de souris de type sauvage (Wild-Type) et de souris dystrophiques (Dmdmdx). La couleur rouge indique l’immunomarquage de la dystrophine chez la souris sauvage ou de la microdystrophine chez la souris traitée avec la thérapie génique.
Introduction
La dystrophie musculaire de Duchenne (DMD) est une maladie musculaire liée au chromosome X et due à l’absence ou au dysfonctionnement de la dystrophine, une protéine encodée par le gène DMD. Elle affecte environ 1/5 000 garçons [1] et elle est considérée comme la dystrophie musculaire la plus fréquente chez l’enfant. La perte de la dystrophine dans le muscle entraine une déstabilisation du complexe glycoprotéique associé à la dystrophine (DAGC pour Dystrophin-associated glycoprotein complex), qui relie le cytosquelette à la matrice extracellulaire. Cette perturbation déclenche une série de mécanismes pathologiques, notamment une perte de l’homéostasie calcique, un stress oxydatif, un dysfonctionnement mitochondrial, une inflammation chronique, une transformation fibro-adipocytaire et, enfin, une perte de la fonction mécanique musculaire [2].
Traitements de la DMD, où est-on?
La prise en charge de la DMD nécessite une approche multidisciplinaire précoce, prenant en compte les manifestations musculaires (muscles squelettique et cardiaque) ainsi que les aspects extra-musculaires de la maladie, dans le but de ralentir sa progression et d’améliorer la qualité de vie des patients. Actuellement, le traitement par glucocorticoïdes (deflazacort, prednisone et vamorolone) est recommandé précocément [3], ayant montré une amélioration significative de la fonction motrice et un retard de la perte de l’ambulation [4]. En parallèle, différentes stratégies thérapeutiques sont explorées pour restaurer une forme fonctionnelle de la dystrophine. Bien que des oligonucléotides antisens qui permettent de restaurer le cadre de lecture des transcrits de la dystrophine [5] aient été approuvés pour certaines mutations, leur efficacité reste limitée avec un taux de restauration de la dystrophine relativement bas (~ 1,74 % pour le casimersen par exemple) et des améliorations fonctionnelles modestes [6].
L’approche la plus prometteuse à ce jour, visant théoriquement tous les patients atteints de DMD, consiste à apporter une version raccourcie de la dystrophine – aussi appelée microdystrophine – à l’aide d’un vecteur adéno-associé recombinant (AAVr pour adeno-associated virus recombinant). En effet, le cadre de lecture ouvert de l’ARNm du gène DMD est long d’environ 11,5 kb, ce qui dépasse largement la capacité d’encapsidation des AAVr. Pour contourner cette limitation, différentes microdystrophines ont été conçues en conservant des domaines essentiels de la dystrophine [7,8]. Cette stratégie s’appuie notamment sur des observations faites chez des patients atteints de la dystrophie musculaire de Becker (BMD), une forme allélique de la DMD, chez lesquels l’expression de formes courtes de dystrophine semble atténuer la sévérité du phénotype [9].
Plusieurs essais cliniques sont en cours, sponsorisés par différentes entreprises pharmaceutiques, notamment Sarepta Therapeutics, Pfizer, Solid Biosciences et Regenxbio aux États-Unis, ainsi que Généthon en Europe. Chaque essai utilise une construction de microdystrophine légèrement différente (Figure 1C). Bien que le médicament développé par Sarepta Therapeutics (Elevidys) ait obtenu une autorisation accélérée de commercialisation de la FDA (Food and drug administration) en juin 2023, pour les patients âgés de 4 à 5 ans, des débats persistent quant à son efficacité, notamment concernant les améliorations fonctionnelles chez les patients pour lesquels les objectifs fixés n’ont pas été atteints [10, 11].
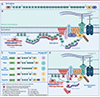 |
Figure 1 La dystrophine et les constructions de microdystrophine en expérimentation clinique. A. Séquence protéique complète de la dystrophine. Elle peut être divisée en 4 domaines principaux : le domaine en N-terminal qui se lie aux filaments d’actine (ABD pour Actin-binding domain), encodé par les exons 1 à 8 ; le domaine rod (R) encodé par les exons 8 à 64, ce domaine est lui-même divisé en 24 répétitions de type spectrine et 4 charnières (hinge) entrecoupées ; le domaine riche en cystéine (CR) encodé par les exons 64 à 70 ; le domaine C-terminal encodé par les exons 71 à79. B. Localisation de la dystrophine et de ses domaines de liaison. C. Produits de thérapie génique par transfert de microdystrophine. Cinq produits avec des constructions différentes sont actuellement en essais cliniques. Les promoteurs utilisés dans ces constructions (en vert) sont spécifiques du muscle et du cœur. Le choix du sérotype d’AAV repose également sur le tropisme tissulaire, les sérotypes sélectionnés ciblant particulièrement le muscle et le cœur. Le transgène de toute construction contient les séquences codantes pour les domaines considérés biologiquement pertinents et fonctionnels. La microdystrophine de Regenxbio inclut en plus les éléments fonctionnels du domaine C-terminal (CT). D. Localisation de la microdystrophine MD1 et ses domaines de liaison. La microdystrophine MD1, utilisée par Sarepta et Généthon, lie les filaments d’actine au complexe glycoprotéique associé à la dystrophine. Plusieurs domaines de liaison au sarcolemme et aux microtubules manquent, ainsi que le domaine de liaison à la neuronal nitric oxide synthase (nNOS), à la syntrophine et à la dystrobrevine. (Figures créées avec Biorender.com.) |
Ci-après, nous explorons les défis majeurs de la thérapie génique par transfert de la microdystrophine, ainsi que les voies potentielles d’amélioration.
Obstacles et défis pour une thérapie réussie
Le traitement des maladies musculaires par thérapie génique utilisant des vecteurs AAVr se fait principalement par voie systémique, avec pour objectif de cibler le muscle squelettique qui représente environ 40 % de la masse corporelle. Cependant, cette approche requiert l’administration de doses très élevées de vecteurs (souvent ≥ 1E14 vg/kg pour la DMD), afin d’atteindre une efficacité thérapeutique significative [12]. Elle soulève plusieurs problèmes, celui du risque potentiel d’hépatotoxicité dû au tropisme naturel des AAVr pour le foie, mais également le défi industriel du coût et de la production à grande échelle de ces vecteurs. Par ailleurs, l’efficacité de la microsdytrophine est limitée, car il lui manque certains domaines fonctionnels de la dystrophine. Enfin, des réponses immunitaires dirigées contre les vecteurs AAVr ainsi que contre certains épitopes de la microdystrophine représentent un obstacle supplémentaire à surmonter.
Dystrophine versus microdystrophine
L’isoforme musculaire de la dystrophine (Dp427m) se compose de multiples domaines de liaison qui lui confèrent la capacité d’établir une connexion mécanique cruciale entre la matrice extracellulaire et le cytosquelette, ainsi que des interactions avec les protéines du DAGC (Figure 1A-B). Cette fonction est essentielle pour protéger le muscle contre le stress mécanique lors de la contraction.
Outre son rôle mécanique, la dystrophine interagit avec diverses protéines impliquées dans des voies de signalisation critiques. Par exemple, les spectrines R16 et R17 contiennent le site de liaison à nNOS (pour neuronal Nitric oxide synthase), nécessaire à la localisation précise de nNOS au niveau du sarcolemme [13]. Une localisation correcte permet à nNOS d’exercer une fonction de signalisation paracrine en diffusant l’oxyde nitrique vers les vaisseaux sanguins, favorisant ainsi la vasodilatation dans les muscles contractiles.
Le domaine riche en cystéine (CR pour Cysteine-rich) interagit avec la calmoduline, jouant un rôle crucial dans les voies de signalisation du calcium. Le domaine C-terminal (CT) possède un site de liaison direct au sarcolemme et interagit avec la dystrobrevine et la syntrophine. L’α-syntrophine, en particulier, joue un rôle majeur dans la signalisation, en se liant à plusieurs canaux ioniques (tels que les canaux de sodium Na1.4 et Na1.5, de potassium Kiv2, Kiv4.1 et de calcium transcient receptor potential C1 et C4), et sert également d’ancrage pour la nNOS en association avec la dystrophine [14].
Depuis la génération des premières constructions réduites de dystrophine en 1995 [15,16], plus de 30 configurations de microdystrophines ont été publiées. Plusieurs optimisations ont été faites au fur et à mesure de la caractérisation des domaines de liaisons de la dystrophine et des fonctions assurées par chaque domaine. Cependant, la capacité d’encapsidation limitée des vecteurs AAVr oblige à ne conserver que les parties les plus essentielles de la dystrophine. La plupart des conceptions de microdystrophines incluent le domaine de liaison à l’actine, responsable de l’ancrage au cytosquelette, ainsi que le domaine riche en cystéine, essentiel pour l’interaction avec la β-dystroglycane et, par conséquent, le DAGC (Figure 1C-D).
Cependant, les résultats prometteurs observés dans les études précliniques avec les microdystrophines n’ont pas été reproduits dans les essais cliniques. Une telle disparité soulève des interrogations sur l’importance des domaines absents dans les microdystrophines. En effet, ces constructions peuvent manquer de domaines d’interaction cruciaux, tels que le domaine central rod et le domaine C-terminal. Cela suggère que l’expression d’une dystrophine de taille plus importante pourrait être nécessaire pour obtenir une correction plus complète du phénotype.
AAVr et réponse immunitaire contre la capside
L’une des limites majeures à la thérapie génique utilisant des vecteurs AAVr réside dans la réponse immunitaire dirigée contre la capside virale. En effet, l’immunogénicité des AAVr pourrait venir d’une réponse immunitaire préexistante contre la capside. Il est estimé que près de 80 % de la population humaine est séropositive aux AAV [17]. Une réponse humorale médiée par des anticorps anti-capsides peut donc survenir chez les patients, tout comme une réponse cytotoxique médiée par les lymphocytes T CD8+. Généralement, tous les patients participant aux essais cliniques sont soumis à un examen préalable pour détecter une éventuelle réponse humorale et sont traités par de fortes doses de glucocorticoïdes afin de contrer la réaction immunitaire contre les capsides virales. Les patients présentant des anticorps neutralisants dirigés contre les AAVr sont exclus de ces études, ce qui restreint le nombre de patients éligibles aux traitements.
De plus, des réponses immunitaires peuvent également survenir après injection, avec notamment des réactions sévères se manifestant par une microangiopathie thrombotique ou une insuffisance rénale aiguë liées à l’activation de la voie du complément. Une réaction immunitaire innée peut s’installer directement après l’injection, par reconnaissance de motifs moléculaires associés aux agents pathogènes (qui peuvent être des composants protéiques de la capside, du contenu en ADN des rAAV ou encore des contaminants de protéines ou d’ADN dans le lot d’AAVr). Une réponse immunitaire adaptative peut également se mettre en place, avec une activation des lymphocytes B et T, limitant l’efficacité de la transduction. La génération de lymphocytes B et T mémoires empêchera en outre la possibilité de réinjection dans le futur avec le même vecteur.
Transgènes et immunogénicité
En plus de la réponse immunitaire dirigée contre les capsides des AAVr, il est désormais reconnu que des réactions immunitaires peuvent également se produire contre le transgène chez certains patients. Récemment, une collaboration entre les quatre entreprises menant les essais cliniques a permis de mieux comprendre les effets graves observés chez certains malades traités avec une microdystrophine.
En effet, il a été constaté que certains épitopes présents dans les constructions de la microdystrophine (notamment ceux encodés par les exons 8 à 11) pourraient déclencher une réponse immunitaire cytotoxique dirigée contre le non-soi, chez les patients présentant des délétions dans les exons codant pour ces épitopes (les effets graves sont observés chez les patients ayant des délétions de l’exon 8 à l’exon 21) [18].
Cette meilleure compréhension de la réponse immunitaire contre le transgène ouvre la voie à des mesures plus ciblées pour éviter les effets indésirables et à l’exclusion de patients présentant des mutations spécifiques. À titre d’exemple, dans le cas de l’autorisation délivrée par la FDA à Sarepta Therapeutics, les malades ayant des délétions des exons 8 et/ou 9 ont été exclus. Cependant, il reste nécessaire de mener des études immunologiques plus approfondies sur les épitopes des microdystrophines et de mieux prédire le risque immunologique chez les patients présentant des délétions génomiques dans ces régions.
Perspectives d’amélioration
De nombreux efforts ont été récemment consacrés pour optimiser les vecteurs AAVr pour la thérapie génique dans le muscle. Dans le but de mieux cibler les muscles et d’éviter le transfert vers d’autres tissus tels que le foie, notre laboratoire et d’autres équipes ont développé plusieurs capsides hybrides myotropiques [19,20]. Ces capsides hybrides sont conçues pour réduire la quantité de vecteurs nécessaire pour une transduction musculaire efficace, minimisant ainsi les risques d’immunotoxicité et d’hépatotoxicité. Bien que ces nouveaux vecteurs soient encore en phase de développement et d’études précliniques, leur progression vers les essais cliniques offrira l’opportunité non seulement d’améliorer l’efficacité de la thérapie génique pour les maladies musculaires, mais également d’en renforcer la sécurité.
Actuellement, le traitement par microdystrophine intervient à un stade où la dystrophie est déjà installée, avec une fibrose musculaire significative. Cette approche est confrontée à la complexité d’inverser tous les mécanismes pathologiques, d’autant plus que la microdystrophine ne pourra pas remplacer entièrement la fonction de la dystrophine et ne sera pas exprimée dans toutes les fibres musculaires, comme l’ont démontré les résultats cliniques à ce jour. En outre, de récentes recherches menées dans notre laboratoire ont révélé que même en parvenant à exprimer la microdystrophine dans près de 100 % des fibres musculaires chez des souris dystrophiques, le profil transcriptomique n’est pas complètement restauré [20], suggérant que la microdystrophine en elle-même ne serait pas suffisante pour rétablir tous les mécanismes moléculaires perturbés dans le muscle dystrophique.
Amélioration des constructions de microdystrophine/dystrophine
La thérapie génique utilisant la microdystrophine ne peut qu’atténuer la maladie qui évoluera théoriquement vers une dystrophie musculaire de Becker, de forme moins sévère, mais toujours invalidante. Un des défis majeurs est donc de pouvoir délivrer une version plus longue que la microdystrophine. Pour cela, une approche avec plusieurs vecteurs AAVr contenant chacun un fragment du gène DMD peut être utilisée. Une reconstitution du gène thérapeutique complet est possible lorsque les vecteurs infectent simultanément la même myofibre (Figure 2A). Différents mécanismes de reconstitution peuvent être utilisés en fonction de la séquence du gène, notamment le trans-épissage de l’ADN, la recombinaison homologue (RH) et le trans-épissage des protéines. Des études ont établi la preuve du principe du transfert de formes plus longues de dystrophine par trans-épissage de l’ADN [21] et par RH [22] chez des souris modèles de la DMD. Cependant, ces approches ont montré une efficacité limitée de reconstitution du transgène et nécessitent donc des doses plus élevées d’AAVr. L’approche par trans-épissage de protéines en utilisant le système des intéines scindées (split-inteins) représente une piste intéressante pour la DMD : ce sont deux polypeptides dont le processus post-traductionnel permet de fusionner deux protéines en une seule protéine fonctionnelle. Cette approche fait l’objet de premiers travaux [23] montrant une efficacité chez des souris modèles de DMD jeunes et âgées. Le principal facteur limitant de ces approches est la nécessité de doses encore plus élevées pour obtenir une efficacité thérapeutique. C’est pourquoi il est essentiel d’atteindre la plus grande efficacité de reconstitution possible et de tester ces approches avec des vecteurs myotropiques plus efficaces.
 |
Figure 2 Perspectives d’amélioration de la thérapie génique pour la DMD. A. Stratégies d’expression de constructions plus longues que la microdystrophine, utilisant plusieurs vecteurs AAVr. B. Principe de la thérapie combinée pour le traitement de la DMD. La thérapie génique serait combinée à une correction complémentaire des mécanismes physiopathologiques dans le muscle dystrophique. (Figures créées avec Biorender.com) |
Vers des thérapies combinées
La DMD est une maladie complexe, caractérisée non seulement par une déstabilisation mécanique des fibres musculaires, mais aussi par une dérégulation de plusieurs voies physiologiques et métaboliques du muscle. Beaucoup d’efforts ont été consacrés, ces 25 dernières années, au développement d’une thérapie génique pour la DMD, et un moindre intérêt a été donné à l’étude des mécanismes pathologiques secondaires de la maladie. Or, certains d’entre eux ne seront pas corrigés par le transfert de la microdystrophine, il est donc intéressant de les étudier plus profondément et de les cibler dans le cadre de thérapies combinées (Figure 2B). Cela permettra de réduire les doses nécessaires en AAVr pour obtenir un effet thérapeutique significatif, tout en améliorant la correction moléculaire de la dystrophie. Certaines approches thérapeutiques ont déjà été envisagées, notamment celles visant à réduire la dégénérescence musculaire et à stimuler la régénération (par activation du facteur Insuline-like growth factor 1 – IGF-1 par exemple) [24], ou encore à atténuer la fibrose [25]. Toutefois, il faut encore approfondir notre compréhension des mécanismes pathologiques secondaires de la DMD, déterminer quel mécanisme présente le plus d’intérêt à cibler dans le contexte de la DMD, et évaluer à quel point un tel traitement complémentaire pourrait agir de manière synergique avec la microdystrophine.
Conclusion
Malgré les progrès significatifs réalisés dans le traitement de la DMD depuis l’identification du gène en cause jusqu’à l’autorisation de la première thérapie génique basée sur le transfert de la microdystrophine, un vaste champ d’améliorations reste à explorer. Les premières évaluations issues des essais cliniques soulignent le besoin de résultats thérapeutiques plus efficaces pour les patients. Bien que la théorie prédominante mettant en avant le rôle central de la déstabilisation mécanique des myofibres squelettiques dans la pathologie de la DMD soit convaincante, une exploration plus approfondie d’autres mécanismes physiopathologiques au sein du muscle est justifiée. Une meilleure compréhension de la cascade pathologique entre la déstabilisation du DAGC et la dégénérescence musculaire pourrait ouvrir la voie au développement de nouvelles stratégies thérapeutiques, venant en complément des approches de thérapie génique existantes. Des efforts substantiels sont actuellement déployés pour relever les défis technologiques et immunologiques associés aux thérapies géniques utilisant des vecteurs AAVr. Parallèlement, les progrès réalisés dans le développement de la microdystrophine et des constructions allongées de la dystrophine incomplète offrent des perspectives prometteuses pour améliorer les résultats thérapeutiques chez les patients atteints de DMD.
Prix SFM
Abbass Jaber a reçu le prix de la Meilleure communication orale lors des journées de la Société française de myologie (SFM) 2023.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Duan D, Goemans N, Takeda S, et al. Duchenne muscular dystrophy. Nat Rev Dis Primers 2021; 7 (1): 13. [CrossRef] [PubMed] [Google Scholar]
- Allen DG, Whitehead NP, Froehner SC. Absence of Dystrophin Disrupts Skeletal Muscle Signaling: Roles of Ca2+, Reactive Oxygen Species, and Nitric Oxide in the Development of Muscular Dystrophy. Physiol Rev 2016; 96: 253–305. [CrossRef] [PubMed] [Google Scholar]
- Birnkrant DJ, Bushby K, Bann CM, et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol 2018; 17 (3): 251–267. [CrossRef] [PubMed] [Google Scholar]
- Schreiber A, Brochard S, Rippert P, et al. Corticosteroids in Duchenne muscular dystrophy: impact on the motor function measure sensitivity to change and implications for clinical trials. Dev Med Child Neurol 2018; 60 (2): 185–191. [CrossRef] [PubMed] [Google Scholar]
- Wilton-Clark H, Yokota T. Recent Trends in Antisense Therapies for Duchenne Muscular Dystrophy. Pharmaceutics 2023; 15: 778. [CrossRef] [PubMed] [Google Scholar]
- Iannaccone S, Phan H, Straub V, et al. P.132 Casimersen in patients with Duchenne muscular dystrophy amenable to exon 45 skipping: Interim results from the Phase 3 ESSENCE trial. Neuromuscul Disord 2022; 32 Suppl 1: S102. [CrossRef] [Google Scholar]
- Scott JM, Li S, Harper SQ, et al. Viral vectors for gene transfer of micro-, mini-, or full-length dystrophin. Neuromuscular Disorders 2002; 12 Suppl 1: S23–S29. [CrossRef] [PubMed] [Google Scholar]
- Le Guiner C, Servais L, Montus M, et al. Long-term microdystrophin gene therapy is effective in a canine model of Duchenne muscular dystrophy. Nat Commun 2017; 8: 16105. [CrossRef] [PubMed] [Google Scholar]
- Davies KE, Vogt J. Long-term clinical follow-up of a family with Becker muscular dystrophy associated with a large deletion in the DMD gene. Neuromuscul Disord 2024; 39: 5–9. [CrossRef] [PubMed] [Google Scholar]
- Mullard A. FDA approves first gene therapy for Duchenne muscular dystrophy, despite internal objections. Nat Rev Drug Discov 2023; 22 (8): 610–610. [CrossRef] [PubMed] [Google Scholar]
- Rind DM. The FDA and Gene Therapy for Duchenne Muscular Dystrophy. JAMA 2024; 331 (20): 1705–1706. [CrossRef] [PubMed] [Google Scholar]
- Birch SM, Lawlor MW, Conlon TJ, et al. Assessment of systemic AAV-microdystrophin gene therapy in the GRMD model of Duchenne muscular dystrophy. Sci Transl Med 2023; 15 (677): eabo1815. [CrossRef] [PubMed] [Google Scholar]
- Lai Y, Thomas GD, Yue Y, et al. Dystrophins carrying spectrin-like repeats 16 and 17 anchor nNOS to the sarcolemma and enhance exercise performance in a mouse model of muscular dystrophy. J Clin Invest 2009; 119 (3): 624–635. [CrossRef] [PubMed] [Google Scholar]
- Constantin B. Dystrophin complex functions as a scaffold for signalling proteins. Biochim Biophys Acta 2014; 1838 (2): 635–642. [CrossRef] [PubMed] [Google Scholar]
- Phelps SF, Hauser MA, Cole NM, et al. Expression of full-length and truncated dystrophin mini-genes in transgenic mdx mice. Hum Mol Genet 1995; 4 (8): 1251–1258. [CrossRef] [PubMed] [Google Scholar]
- Wells DJ, Wells KE, Asante EA, et al. Expression of human full-length and minidystrophin in transgenic mdx mice: implications for gene therapy of Duchenne muscular dystrophy. Hum Mol Genet 1995; 4 (8): 1245–1250. [CrossRef] [PubMed] [Google Scholar]
- Calcedo R, Vandenberghe LH, Gao G, et al. Worldwide Epidemiology of Neutralizing Antibodies to Adeno-Associated Viruses. J Infect Dis 2009; 199 (3): 381–390. [CrossRef] [PubMed] [Google Scholar]
- Bönnemann CG, Belluscio BA, Braun S, et al. Dystrophin Immunity after Gene Therapy for Duchenne’s Muscular Dystrophy. N Engl J Med 2023; 388 (24): 2294–2296. [CrossRef] [PubMed] [Google Scholar]
- Tabebordbar M, Lagerborg KA, Stanton A, et al. Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species. Cell 2021; 184 (19): 4919–4938.e22. [CrossRef] [PubMed] [Google Scholar]
- Hong AV, Suel L, Poupiot J, et al. An integrin-targeting AAV developed using a novel computational rational design methodology presents improved targeting of the skeletal muscle and reduced liver tropism. Preprint Hal-04310212 2023. [Google Scholar]
- Lai Y, Yue Y, Liu M, et al. Efficient in vivo gene expression by trans-splicing adeno-associated viral vectors. Nat Biotechnol 2005; 23 (11): 1435–1439. [CrossRef] [PubMed] [Google Scholar]
- Albini S, Palmieri L, Dubois A, et al. Assessment of Therapeutic Potential of a Dual AAV Approach for Duchenne Muscular Dystrophy. Int J Mol Sci 2023; 24 (14): 11421. [CrossRef] [PubMed] [Google Scholar]
- Tasfaout H, Halbert CL, McMillen TS, et al. Split intein-mediated protein trans-splicing to express large dystrophins. Nature 2024; 632 (8023): 192–200. [CrossRef] [PubMed] [Google Scholar]
- Abmayr S, Gregorevic P, Allen JM, et al. Phenotypic Improvement of Dystrophic Muscles by rAAV/Microdystrophin Vectors Is Augmented by Igf1 Codelivery. Mol Ther 2005; 12 (3): 441–450. [CrossRef] [PubMed] [Google Scholar]
- Heller KN, Mendell JT, Mendell JR, et al. MicroRNA-29 overexpression by adeno-associated virus suppresses fibrosis and restores muscle function in combination with micro-dystrophin. JCI Insight 2017; 2 (9) [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 La dystrophine et les constructions de microdystrophine en expérimentation clinique. A. Séquence protéique complète de la dystrophine. Elle peut être divisée en 4 domaines principaux : le domaine en N-terminal qui se lie aux filaments d’actine (ABD pour Actin-binding domain), encodé par les exons 1 à 8 ; le domaine rod (R) encodé par les exons 8 à 64, ce domaine est lui-même divisé en 24 répétitions de type spectrine et 4 charnières (hinge) entrecoupées ; le domaine riche en cystéine (CR) encodé par les exons 64 à 70 ; le domaine C-terminal encodé par les exons 71 à79. B. Localisation de la dystrophine et de ses domaines de liaison. C. Produits de thérapie génique par transfert de microdystrophine. Cinq produits avec des constructions différentes sont actuellement en essais cliniques. Les promoteurs utilisés dans ces constructions (en vert) sont spécifiques du muscle et du cœur. Le choix du sérotype d’AAV repose également sur le tropisme tissulaire, les sérotypes sélectionnés ciblant particulièrement le muscle et le cœur. Le transgène de toute construction contient les séquences codantes pour les domaines considérés biologiquement pertinents et fonctionnels. La microdystrophine de Regenxbio inclut en plus les éléments fonctionnels du domaine C-terminal (CT). D. Localisation de la microdystrophine MD1 et ses domaines de liaison. La microdystrophine MD1, utilisée par Sarepta et Généthon, lie les filaments d’actine au complexe glycoprotéique associé à la dystrophine. Plusieurs domaines de liaison au sarcolemme et aux microtubules manquent, ainsi que le domaine de liaison à la neuronal nitric oxide synthase (nNOS), à la syntrophine et à la dystrobrevine. (Figures créées avec Biorender.com.) |
| Dans le texte | |
 |
Figure 2 Perspectives d’amélioration de la thérapie génique pour la DMD. A. Stratégies d’expression de constructions plus longues que la microdystrophine, utilisant plusieurs vecteurs AAVr. B. Principe de la thérapie combinée pour le traitement de la DMD. La thérapie génique serait combinée à une correction complémentaire des mécanismes physiopathologiques dans le muscle dystrophique. (Figures créées avec Biorender.com) |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




