| Issue |
Med Sci (Paris)
Volume 40, Number 6-7, Juin-Juillet 2024
|
|
|---|---|---|
| Page(s) | 492 - 494 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024061 | |
| Published online | 08 July 2024 | |
Rôle de la petite GTPase ARL5b dans l’inhibition de la clairance bactérienne par le rhinovirus humain 16
HRV16 inhibits bacterial clearance in a ARL5b-dependent manner
Université Paris Cité, Institut Cochin, Inserm U1016, CNRS UMR8104, Paris, France
Les rhinovirus humains (HRV) causent le rhume. Pour les personnes souffrant de maladies pulmonaires chroniques, notamment la bronchopneumopathie chronique obstructive, l’infection par les rhinovirus humains est le facteur le plus communément associé aux exacerbations de la maladie, principalement dues aux surinfections bactériennes pulmonaires [1]. Dans les prochaines décennies, les exacerbations de la bronchopneumopathie chronique obstructive pourraient devenir l’une des premières causes de mortalité dans le monde [2].
Les macrophages alvéolaires du poumon sont responsables de la détection, de la phagocytose, et donc de l’élimination des bactéries. Ainsi, la fréquence des surinfections bactériennes pulmonaires survenant après une infection par le rhinovirus humain suggère que le virus perturbe les fonctions des macrophages alvéolaires. Tenter d’en comprendre les mécanismes est un premier pas vers la mise en place de thérapies ciblées limitant les exacerbations de la maladie pulmonaire chronique par la surinfection bactérienne consécutive à un rhume. Notre équipe a précédemment découvert que les macrophages alvéolaires exposés au rhinovirus humain 16 (HRV16) présentent un phénotype « paralysé » qui pourrait être à l’origine de ces surinfections [1, 3, 4]. Nous avons notamment montré que les macrophages mis en contact avec HRV16 ont une capacité d’internalisation des bactéries amoindrie, par un mécanisme dépendant de la protéine Arpin [3]. Cependant, l’étendue des modifications des fonctions des macrophages induites par HRV16, notamment l’effet du virus sur la maturation des phagosomes et la clairance bactérienne, reste à déterminer.
Pour comprendre l’impact de ce virus sur la clairance des bactéries, nous avons exposé des macrophages dérivés de monocytes humains (hMDM) au virus intact ou au virus inactivé par des rayons ultraviolets (HRV16-UV). Les hMDM ont alors été infectés avec différents types de bactéries, Gram positives ou Gram négatives. Nous avons montré que HRV16, mais pas HRV16-UV, inhibe fortement la clairance bactérienne par les macrophages, indépendamment du type de bactéries [3]. Ce phénotype est associé à une inhibition de l’activité hydrolytique et de la production d’espèces réactives de l’oxygène dans les macrophages exposés à HRV16, mais pas dans ceux exposés à HRV16-UV.
Après leur internalisation par les macrophages, les bactéries sont localisées dans des vésicules appelées phagosomes. Ces phagosomes passent par plusieurs états de maturation : les phagosomes précoces, caractérisés par la présence de la protéine EEA1 (early endosome antigen 1), les phagosomes tardifs, caractérisés par la présence de la protéine CD63, et finalement les phagolysosomes, caractérisés par la présence de la protéine LAMP1 (lysosome-associated membrane protein 1) [5]. C’est dans les phagolysosomes que les bactéries internalisées vont être dégradées. Afin de déterminer si le virus peut bloquer la maturation des phagosomes dans les macrophages, nous avons suivi le processus de maturation des phagosomes à différents temps après la phagocytose de globules rouges opsonisés1. Nous avons constaté que dans les macrophages exposés à HRV16, les phagosomes restent positifs aux marqueurs EEA1 et CD63 longtemps après la phagocytose, tandis que le marqueur LAMP1 est détecté avec du retard [3]. Ce constat indique un défaut de maturation des phagosomes, qui restent bloqués en phase précoce ou tardive sans parvenir au stade de phagolysosome (Figure 1), ce qui explique le défaut de clairance bactérienne.
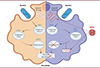 |
Figure 1. Schéma des effets de HRV16 sur la clairance bactérienne et la maturation des phagosomes des macrophages. Les effets du rhinovirus humain 16 (HRV16) sur le macrophage sont représentés dans la moitié droite de l’image (colorée en bleu). Les phagosomes expriment plus longtemps la protéine EEA1 (EEA1+), le marqueur des phagosomes précoces, car le virus empêche leur maturation en phagolysosomes. Par conséquent, la clairance bactérienne est inhibée. Ce phénotype est dû à l’augmentation de l’expression de la petite GTPase ARL5b par le virus. L’augmentation d’ARL5b perturbe également la structure de l’appareil de Golgi. |
Afin de déterminer si ces modifications sont dues à un défaut de trafic intracellulaire, nous avons analysé les macrophages exposés à HRV16 par microscopie électronique. Étonnamment, nous n’avons pas constaté de différence majeure dans la répartition des endosomes, mais plutôt une altération de la structure de l’appareil de Golgi [3]. En effet, les citernes de l’appareil de Golgi apparaissaient moins bien définies, suggérant que le virus perturbe ce compartiment cellulaire.
Pour tenter de comprendre le lien entre cette modification de l’appareil de Golgi et l’inhibition de la maturation des phagosomes, nous avons réalisé une analyse transcriptomique comparative par séquençage de l’ARN des macrophages exposés soit à HRV16, soit à HRV16-UV, ou non exposés au virus (témoins de référence). Parmi les transcrits dont la quantité avait augmenté en présence de HRV16, mais pas de HRV16-UV, un gène en particulier a retenu notre attention : celui codant la petite GTPase ARL5b. La quantité de cette protéine avait, elle aussi, augmenté dans les macrophages en présence de HRV16 [3]. ARL5b est connue pour contrôler le trafic intracellulaire vers et depuis l’appareil de Golgi [6, 7]. D’autres expériences ont permis de montrer que la déplétion de cette protéine permet de prévenir l’inhibition de la clairance bactérienne par HRV16 et de restaurer le recrutement de LAMP1 sur les phagosomes (Figure 1). Ces résultats indiquent que l’augmentation de l’expression de ARL5b induite dans les macrophages par HRV16 est impliquée dans le défaut de maturation des phagosomes et dans l’inhibition de la clairance bactérienne opérée par ces cellules.
Finalement, la protéine ARL5b étant impliquée dans le trafic intracellulaire, nous avons analysé son rôle dans l’infection par HRV16. Pour cela, nous avons surexprimé ARL5b dans les cellules de la lignée HeLa Ohio, qui est permissive à l’infection par le virus. Nous avons montré que dans ces cellules, ARL5b est un facteur de restriction de la propagation du virus en inhibant la sécrétion des virions. A contrario, la répression de ARL5b favorise la propagation virale. De plus, l’infection par HRV16 inhibe l’expression de ARL5b dans les cellules permissives à la réplication. Ainsi, ARL5b joue un double rôle dans l’infection par HRV16 [3].
Nous avons donc identifié ARL5b comme un facteur clé de la « paralysie » des macrophages après leur exposition au HRV16 (Figure 1). Cette petite GTPase perturbe la maturation des phagosomes ainsi que le trafic intracellulaire, ce qui entraîne un défaut de clairance bactérienne. Ces résultats permettent d’expliquer, au moins en partie, les surinfections bactériennes fréquemment observées chez les patients atteints de bronchopneumopathie chronique obstructive après une infection par HRV16. Cependant, il reste à comprendre les mécanismes employés par HRV16 pour augmenter l’expression de ARL5b dans les macrophages et pour la réprimer dans les cellules permissives, afin d’être en mesure de concevoir des médicaments efficaces contre les surinfections bactériennes. En effet, bien que ARL5b représente une cible attrayante, sa répression dans le poumon aurait un effet ambivalent : alors que dans les macrophages, la répression de ARL5b permettrait de réactiver la clairance bactérienne, dans les cellules permissives, elle entraînerait une augmentation de la sécrétion des virions et donc de la propagation virale. De plus, il conviendra également d’établir les mécanismes moléculaires du défaut de sécrétion de cytokines dans les macrophages exposés à HRV16 [4].
Ces résultats récents, combinés aux résultats précédents concernant l’inhibition de l’internalisation des bactéries par les macrophages et l’inhibition de la sécrétion des cytokines après un contact avec le virus, nous éclairent sur les mécanismes responsables des surinfections bactériennes pulmonaires consécutives aux infections par les rhinovirus. Il est cependant nécessaire de poursuivre leur exploration avant d’envisager des traitements spécifiques pour les patients atteints de bronchopneumopathie chronique obstructive.
Liens d’intérêt
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Jubrail J, Africano-Gomez K, Herit F, et al. Arpin is critical for phagocytosis in macrophages and is targeted by human rhinovirus. EMBO Rep 2020; 21 : e47963. [CrossRef] [PubMed] [Google Scholar]
- Viniol C, Vogelmeier CF. Exacerbations of COPD. Eur Respir Rev 2018 ; 27 : 170103. [CrossRef] [PubMed] [Google Scholar]
- Faure-Dupuy S, Jubrail J, Depierre M, et al. ARL5b inhibits human rhinovirus 16 propagation and impairs macrophage-mediated bacterial clearance. EMBO Rep 2024 ; 25 : 1156–75. [CrossRef] [PubMed] [Google Scholar]
- Jubrail J, Africano-Gomez K, Herit F, et al. HRV16 impairs macrophages cytokine response to a secondary bacterial trigger. Front Immunol 2018 ; 9 : 2908. [CrossRef] [PubMed] [Google Scholar]
- Depierre M, Jacquelin L, Niedergang F. Phagocytosis. In: Bradshaw RA, Hart GW, Stahl PD, editors. Encyclopedia of Cell Biology (Second Edition). Oxford : Academic Press, 2023 : pp. 286–95. [CrossRef] [Google Scholar]
- Matsumoto K, Inoue H. Viral infections in asthma and COPD. Respir Investig 2014 ; 52 : 92–100. [CrossRef] [PubMed] [Google Scholar]
- Houghton FJ, Bellingham SA, Hill AF, et al. Arl5b is a Golgi-localised small G protein involved in the regulation of retrograde transport. Exp Cell Res 2012 ; 318 : 464–477. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Schéma des effets de HRV16 sur la clairance bactérienne et la maturation des phagosomes des macrophages. Les effets du rhinovirus humain 16 (HRV16) sur le macrophage sont représentés dans la moitié droite de l’image (colorée en bleu). Les phagosomes expriment plus longtemps la protéine EEA1 (EEA1+), le marqueur des phagosomes précoces, car le virus empêche leur maturation en phagolysosomes. Par conséquent, la clairance bactérienne est inhibée. Ce phénotype est dû à l’augmentation de l’expression de la petite GTPase ARL5b par le virus. L’augmentation d’ARL5b perturbe également la structure de l’appareil de Golgi. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




