| Issue |
Med Sci (Paris)
Volume 40, Number 5, Mai 2024
|
|
|---|---|---|
| Page(s) | 417 - 419 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024056 | |
| Published online | 31 May 2024 | |
Le récepteur de la ryanodine, un acteur central dans les désordres multi-systémiques associés à l’insuffisance cardiaque
The ryanodine receptor, a central player in the multi-systemic disorders associated with heart failure
PhyMedExp, Université de Montpellier, Inserm U1046, CNRS UMR9214, CHU de Montpellier, France
L’insuffisance cardiaque : une maladie multi-systémique
L’insuffisance cardiaque est en pleine expansion, affectant des millions de personnes dans le monde, avec un taux de mortalité élevé (9 millions de décès recensés en 2019). Selon les chiffres de l’assurance maladie, on compte en France plus de 1,5 million de personnes atteintes d’insuffisance cardiaque, dont l’âge est généralement supérieur à 60 ans. Ce nombre est d’ailleurs en constante augmentation en raison du vieillissement de la population. L’insuffisance cardiaque engendre des coûts de santé élevés, avec notamment près de 200 000 hospitalisations par an en France, liées en premier lieu au dysfonctionnement du muscle cardiaque, dont la fonction de pompe est déficiente et ne permet plus de distribuer aux autres organes l’oxygène et les nutriments qui leur sont nécessaires. Ainsi, l’insuffisance cardiaque provoque une situation complexe, dans laquelle s’ajoute au dysfonctionnement du cœur, celui d’autres organes ou tissus, avec un impact considérable sur la qualité de vie des patients. Parmi les dysfonctionnements associés à l’insuffisance cardiaque, on notera en particulier l’intolérance à l’effort ou la fatigue musculaire exacerbée, et une dyspnée (essoufflement) qui apparaît d’abord lors d’efforts physiques, puis, lorsque l’insuffisance cardiaque progresse, qui devient présente même au repos. Quant au diabète de type 2, il est souvent décrit comme une cause de l’insuffisance cardiaque, mais la diminution de l’activité physique qu’elle entraîne à cause de la fatigue et de l’essoufflement aggrave en retour le diabète.
L’insuffisance cardiaque est également associée à des déficits cognitifs, tels que des troubles de la mémoire et de l’attention. Des études récentes suggèrent que la démence de certains patients atteints d’insuffisance cardiaque, connue sous le nom de « démence cardiogénique », lui est imputable, avec une prévalence de 20 à 80 % [1]. La démence cardiogénique inclut des symptômes tels que l’oubli et une faible capacité d’apprentissage, pouvant entraver les soins personnels, entraîner une non-conformité thérapeutique, ou encore retarder la reconnaissance d’une situation de santé critique, ce qui augmente le risque de morbidité et de mortalité de l’insuffisance cardiaque.
Rôle des récepteurs de la ryanodine dans l’insuffisance cardiaque
Les récepteurs de la ryanodine (RyR) sont des canaux calciques situés dans la membrane du réticulum sarcoplasmique1 des cellules musculaires cardiaques (cardiomyocytes). Leur fonction principale est de libérer dans le cytosol la quantité appropriée d’ions calcium (Ca2+) contenus dans le réticulum sarcoplasmique nécessaire à la contraction des cardiomyocytes. L’isoforme cardiaque de ce canal, RyR2, est un homotétramère comprenant quatre sous-unités formant un pore pour le passage des ions Ca2+. Chaque sous-unité est étroitement associée à des protéines régulatrices, telles que la calstabine 2 (FKBP12.6), la calmoduline, la protéine kinase A (PKA), la protéine kinase dépendante de Ca2+ et de la calmoduline (CamKII), la calséquestrine, et forme ainsi un complexe macromoléculaire, dont l’intégrité joue un rôle critique dans certaines conditions pathologiques [2] ((→)).
(→) Voir la Synthèse de A. Lacampagne et al., m/s n° 4, avril 2008, page 399
Dans l’insuffisance cardiaque, les RyR peuvent être dysfonctionnels en raison de modifications post-traductionnelles consécutives à divers facteurs, notamment une élévation du tonus sympathique, le stress oxydant ou l’inflammation. Ce dysfonctionnement des RyR, décrit pour la première fois au début des années 2000 [3], entraîne une fuite d’ions Ca2+ du réticulum sarcoplasmique vers le cytosol, perturbant le cycle de contraction-relaxation cardiaque. Ainsi, cette fuite intracellulaire chronique de Ca2+ affaiblit la capacité contractile du myocarde et perturbe sa capacité énergétique, contribuant ainsi à la progression de l’insuffisance cardiaque. De plus, les ions Ca2+ libérés anormalement dans le cytosol peuvent activer des enzymes protéolytiques capables de dégrader le tissu myocardique ou d’induire des perturbations électrophysiologiques à l’origine d’arythmies cardiaques potentiellement mortelles [2].
Dans le muscle strié squelettique, l’isoforme spécifique RyR1 présente les mêmes modifications post-traductionnelles que l’isoforme cardiaque, ce qui, au cours de l’insuffisance cardiaque, contribue au dysfonctionnement des muscles locomoteurs impliqués dans l’intolérance à l’effort, et à celui des muscles respiratoires impliqués dans la dyspnée [4, 5]. Une modification analogue de l’isoforme RyR2 dans les cellules b du pancréas est responsable d’un défaut de sécrétion d’insuline pouvant ainsi rendre compte de l’apparition d’un diabète de type 2 chez les personnes en insuffisance cardiaque [6] (Figure 1).
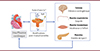 |
Figure 1. Le récepteur de la ryanodine: un acteur central dans les atteintes multi-systémiques de l’insuffisance cardiaque. Le récepteur de la ryanodine (RyR) est un canal calcique intracellulaire homotétramérique. Dans les cardiomyocytes, au cours de l’insuffisance cardiaque, ce canal subit des modifications post-traductionnelles comme une phosphorylation (P), une oxydation (O), et la dissociation de la protéine régulatrice calstabin (C). Ces modifications conduisent à une fuite chronique d’ions Ca2+ du compartiment sarcoplasmique (ou endoplasmique) vers le cytosol, qui contribue à la physiopathologie de l’insuffisance cardiaque. Le RyR présent dans les cellules d’autres organes que le cœur (cerveau, muscles locomoteurs et respiratoires, pancréas) subit les mêmes modifications post-traductionnelles engendrant des dysfonctionnements propres à chacun de ces organes (démence cardiogénique, intolérance à l’effort, dyspnée, diabète de type 2). Ces dysfonctionnements multi-systémiques contribuent, par un cercle vicieux, à aggraver les symptômes de l’insuffisance cardiaque. |
Mécanismes physiopathologiques des démences cardiogéniques
L’isoforme RyR2 est également présente dans la membrane du réticulum endoplasmique des neurones. Des études cliniques ont lié les maladies cardiovasculaires, la démence et la maladie d’Alzheimer par le biais de déclencheurs communs, notamment l’inflammation, le stress oxydant, l’hypoxie et la signalisation par l’adrénaline. La noradrénaline est un neuromédiateur important du système nerveux central qui module les mécanismes du stress, de la vigilance et de l’attention, mais aussi l’humeur et l’activité cognitive. Le système nerveux sympathique (adrénergique et noradrénergique) est continuellement activé chez les personnes atteintes d’insuffisance cardiaque. Or, son activation est connue pour modifier l’homéostasie intracellulaire du Ca2+, ce qui peut affecter le fonctionnement, voire la survie neuronale. Cependant, les mécanismes précis de ces dérèglements de l’homéostasie calcique restaient très mal connus.
Une étude récente propose une analyse détaillée du lien entre l’insuffisance cardiaque et les dysfonctionnements cognitifs qui peuvent l’accompagner (Figure 1). Par une approche multidisciplinaire, combinant des techniques d’imagerie, de biochimie et d’analyse du comportement chez la souris, les auteurs ont examiné l’impact de l’insuffisance cardiaque sur RyR2 dans le cerveau. Ils ont constaté une augmentation notable de la fuite intracellulaire de Ca2+ à travers RyR2 dans des neurones du système nerveux central des souris atteintes d’insuffisance cardiaque par rapport aux souris témoins, ce qui était associé à un déficit cognitif dans des tests comportementaux. Par analogie avec les observations déjà faites sur le myocarde, une voie de signalisation impliquée dans cette fuite de calcium a été identifiée : l’activation de la PKA et l’augmentation du stress oxydant, qui induisent une modification post-traductionnelle de RyR2 [7].
La perturbation de l’homéostasie du calcium est une caractéristique des maladies neurodégénératives, telles que la maladie d’Alzheimer [8, 9] ou la maladie de Huntington [10]. Dans cette étude, l’état hyperadrénergique et la réponse inflammatoire renforcée dans l’insuffisance cardiaque ont été associés à une fuite intracellulaire du Ca2+ neuronal via RyR2, affectant la cognition et la mémoire. Cette perturbation du Ca2+ neuronal conduit à un cercle vicieux se manifestant par une accumulation de Ca2+ dans les mitochondries, qui augmente le stress oxydant et amplifie le dysfonctionnement des RyR2. Cette perturbation contribue par ailleurs à modifier l’expression de gènes essentiels pour la fonction cognitive. L’utilisation d’un agent pharmacologique capable de stabiliser la fonction des canaux RyR2 défaillants semble prévenir les déficits cognitifs liés à l’insuffisance cardiaque de ces souris [7].
Cette étude met donc en lumière le rôle crucial du calcium intracellulaire, en particulier de la fuite de Ca2+ contenu dans le réticulum endoplasmique via RyR2, dans la dysfonction cognitive associée à l’insuffisance cardiaque, ce qui ouvre la voie à de nouvelles stratégies pour prévenir ou traiter les déficits cognitifs chez les personnes atteintes d’insuffisance cardiaque afin d’améliorer leur qualité de vie.
Perspectives thérapeutiques
Selon l’Organisation mondiale de la santé (OMS), les maladies cardiaques représentent à elles seules 16 % du total des décès, toutes causes confondues. Pour autant, les études épidémiologiques montrent une augmentation de la longévité au cours des dernières années : l’espérance de vie a augmenté de six ans entre 2000 et 2019 dans le monde. Les gens vivent plus longtemps et pourtant, ils sont davantage touchés par des incapacités et une altération de leur qualité de vie. Toujours selon l’OMS, on estime que seules cinq de ces six années supplémentaires (en moyenne) sont vécues en bonne santé. Au regard des interactions fortes existant entre maladies cardiaques, diabète sucré, démences et maladies respiratoires, qui figurent également parmi les causes principales de mortalité, il importe d’avoir une vision holistique de la prise en charge thérapeutique d’un patient en insuffisance cardiaque afin de limiter la progression d’autres dysfonctionnements, et ainsi d’améliorer sa qualité de vie. Dans ce contexte, les récepteurs de la ryanodine représentent une cible thérapeutique d’intérêt, et la découverte d’un nouvel agent pharmacologique capable de restaurer une fonction normale de ce canal lorsqu’elle est altérée par l’insuffisance cardiaque représente un défi majeur.
Liens d’intérêt
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Levin SN, Hajduk AM, McManus DD, et al. Cognitive status in patients hospitalized with acute decompensated heart failure. Am Heart J 2014 ; 168 : 917–923. [CrossRef] [PubMed] [Google Scholar]
- Lacampagne A, Fauconnier J, Richard S. Récepteur de la ryanodine et dysfonctionnement myocardique. Med Sci (Paris) 2008 ; 24 : 399–405. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Marx SO, Reiken S, Hisamatsu Y, et al. PKA phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defective regulation in failing hearts. Cell 2000 ; 101 : 365–376. [CrossRef] [PubMed] [Google Scholar]
- Ward CW, Reiken S, Marks AR, et al. Defects in ryanodine receptor calcium release in skeletal muscle from post-myocardial infarct rats. FASEB J 2003 ; 17 : 1517–1519. [PubMed] [Google Scholar]
- Reiken S, Lacampagne A, Zhou H, et al. PKA phosphorylation activates the calcium release channel (ryanodine receptor) in skeletal muscle: defective regulation in heart failure. J Cell Biol 2003 ; 160 : 919–928. [CrossRef] [PubMed] [Google Scholar]
- Santulli G, Pagano G, Sardu C, et al. Calcium release channel RyR2 regulates insulin release and glucose homeostasis. J Clin Invest 2015 ; 125 : 1968–1978. [CrossRef] [PubMed] [Google Scholar]
- Dridi H, Liu Y, Reiken S, et al. Heart failure-induced cognitive dysfunction is mediated by intracellular Ca2+ leak through ryanodine receptor type 2. Nat Neurosci 2023 ; 26 : 1365–78. [CrossRef] [PubMed] [Google Scholar]
- Lacampagne A, Liu X, Reiken S, et al. Post-translational remodeling of ryanodine receptor induces calcium leak leading to Alzheimer’s disease-like pathologies and cognitive deficits. Acta Neuropathol 2017 ; 134 : 749–67. [CrossRef] [PubMed] [Google Scholar]
- Bussiere R, Lacampagne A, Reiken S, et al. Amyloid β production is regulated by β2-adrenergic signaling-mediated post-translational modifications of the ryanodine receptor. J Biol Chem 2017 ; 292 : 10153–10168. [CrossRef] [PubMed] [Google Scholar]
- Dridi H, Liu X, Yuan Q, et al. Role of defective calcium regulation in cardiorespiratory dysfunction in Huntington’s disease. JCI Insight 2020; 5 : e140614. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Le récepteur de la ryanodine: un acteur central dans les atteintes multi-systémiques de l’insuffisance cardiaque. Le récepteur de la ryanodine (RyR) est un canal calcique intracellulaire homotétramérique. Dans les cardiomyocytes, au cours de l’insuffisance cardiaque, ce canal subit des modifications post-traductionnelles comme une phosphorylation (P), une oxydation (O), et la dissociation de la protéine régulatrice calstabin (C). Ces modifications conduisent à une fuite chronique d’ions Ca2+ du compartiment sarcoplasmique (ou endoplasmique) vers le cytosol, qui contribue à la physiopathologie de l’insuffisance cardiaque. Le RyR présent dans les cellules d’autres organes que le cœur (cerveau, muscles locomoteurs et respiratoires, pancréas) subit les mêmes modifications post-traductionnelles engendrant des dysfonctionnements propres à chacun de ces organes (démence cardiogénique, intolérance à l’effort, dyspnée, diabète de type 2). Ces dysfonctionnements multi-systémiques contribuent, par un cercle vicieux, à aggraver les symptômes de l’insuffisance cardiaque. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




