| Issue |
Med Sci (Paris)
Volume 40, Number 1, Janvier 2024
La cavité orale et les dents au cœur de la santé
|
|
|---|---|---|
| Page(s) | 92 - 97 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023202 | |
| Published online | 01 February 2024 | |
Impression 3D et bioimpression pour la régénération osseuse en chirurgie orale
Uses of 3D printing and Bioprinting for pre-implant bone reconstruction in Oral Surgery
1
Université de Bordeaux, Laboratory for the Bioengineering of Tissues (BIOTIS), UMR 1026 Inserm, F-33076 Bordeaux, France
2
Service de chirurgie orale, Pôle de médecine et chirurgie bucco-dentaire, CHU de Bordeaux, Bordeaux, France
3
Université de Bordeaux, Laboratory for the Bioengineering of Tissues (BIOTIS), UMR1026 Inserm, ART BioPrint, F-33076 Bordeaux, France
4
Complex Tissue Regeneration department, MERLN Institute for Technology-Inspired Regenerative Medicine, Maastricht University, Maastricht, Pays-Bas
*
jean-christophe.fricain@inserm.fr
**
sylvain.catros@u-bordeaux.fr
La chirurgie osseuse pré-implantaire en chirurgie orale permet de reconstruire les atrophies des maxillaires en rapport avec des processus traumatiques, infectieux ou tumoraux. Dans ce contexte, le biomatériau idéal reste l’os autogène mais les biomatériaux (d’origine naturelle ou synthétique) permettent de limiter la morbidité liée aux prélèvements osseux et de simplifier ces interventions chirurgicales. Dans cet article, nous illustrons l’apport récent de l’impression 3D dans ce contexte pour traiter des défauts osseux de forme complexe ou pour créer des modèles anatomiques servant à planifier les interventions. Enfin, les perspectives apportées par l’ingénierie tissulaire et la bioimpression (création de modèles in vitro complexes) sont détaillées.
Abstract
Pre-implant bone surgery in oral surgery allows to reconstruct maxillary atrophies related to traumatic, infectious or tumoral processes. In this context, the ideal biomaterial remains autogenous bone, but biomaterials (of natural or synthetic origin) allow to limit the morbidity linked to bone harvesting, and to simplify these surgical procedures. In this article, we illustrate how 3D printing technologies can be used as an adjuvant to treat bone defects of complex shape or to create anatomical models used to plan interventions. Finally, some perspectives brought by tissue engineering and bioprinting (creation of complex in vitro models) are presented.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Thibault Canceill).
La régénération osseuse pré-implantaire en chirurgie orale : indications, applications, limites
L’os alvéolaire constitue la zone d’ancrage des dents dans les maxillaires et la mandibule. Lorsque les dents sont extraites, une résorption osseuse physiologique de plusieurs millimètres est observée dans les trois dimensions de l’espace dans les mois qui suivent [1], notamment en raison d’une diminution de la vascularisation locale et de la perte des contraintes mécaniques exercées. La résorption de l’os alvéolaire peut par ailleurs faire suite à des processus locaux d’origines infectieuse, traumatique ou tumorale.
Une des techniques de remplacement des dents est fondée sur l’utilisation d’implants dentaires : ce sont des racines artificielles (en titane de grade 4 ou 5), insérées dans l’os résiduel afin de supporter et stabiliser les prothèses. Dans le domaine de l’implantologie dentaire, le volume osseux résiduel est donc un élément crucial qui va conditionner la faisabilité et la pérennité du traitement. Quelle que soit l’étiologie de la perte osseuse, la problématique est alors de disposer d’un volume osseux suffisant pour placer les implants dentaires dans une position adaptée à la réalisation des prothèses. On considère que l’épaisseur osseuse en périphérie de l’implant doit être comprise entre 1 et 2 mm afin de limiter la résorption osseuse péri-implantaire et l’apparition de complications à long terme. Plusieurs études cliniques ont montré que le volume osseux disponible avant la pose d’un implant dentaire est insuffisant dans 50 % à 80 % des cas [2–4] et que le recours à une greffe osseuse de plus ou moins grande étendue est alors nécessaire.
De nombreuses techniques chirurgicales sont utilisées pour reconstruire les pertes osseuses alvéolaires. Elles reposent sur l’utilisation d’os autogène, de biomatériaux ou de leur association.
Le principal intérêt de l’os autogène est lié à ses propriétés biologiques (ostéoconducteur, ostéogénique et ostéoinducteur) qui en font le matériau de choix dans de nombreuses indications. Son utilisation permet également de réduire le coût des interventions. Ses limites sont liées à la morbidité associée au site de prélèvement, qui peut être intra-oral (zone rétro-molaire ou symphyse mentonnière) ou extra-oral (calvaria, os iliaque). Il s’agit de complications fonctionnelles (douleurs, paresthésies) ou infectieuses. De plus, ces greffons doivent être mis en forme avant implantation, ce qui est parfois difficile techniquement et ce qui allonge le temps opératoire (Figure 1).
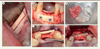 |
Figure 1. Greffe osseuse autogène avec prélèvement ramique. Un prélèvement osseux est réalisé sur le ramus mandibulaire (A). Après préparation du greffon, une lamelle corticale est fixée pour reconstruire le site résorbé en externe (B). Un espace persiste entre le site receveur et la lamelle corticale (C). D. Préparation de copeaux osseux. E. Comblement des espaces résiduels avec des copeaux osseux. |
Les biomatériaux ont été développés pour résoudre certaines limites des autogreffes, notamment leur faible disponibilité et la difficulté associée aux prélèvements. Ils peuvent être d’origine naturelle ou synthétique et, pour les applications de régénération osseuse, ils comportent souvent une phase minérale (en hydroxyapatite) qui permet de mimer la phase minérale de l’os. Les matériaux d’origine naturelle les plus utilisés dans la reconstruction osseuse pré-implantaire sont composés d’hydroxyapatite d’origine bovine traitée par frittage, mais on retrouve également des allogreffes, déminéralisées ou non. Ils se présentent le plus souvent sous la forme de granules de 250 µm à 2 mm, avec une forte porosité. Leur principal intérêt est leur grande disponibilité et leur facilité d’emploi. Cependant, plusieurs limites sont régulièrement rencontrées. À court terme, on peut observer une réaction inflammatoire initiale excessive liée au biomatériau, ce qui peut induire un processus de remodelage trop rapide du biomatériau et la formation d’un tissu fibro-conjonctif à la place du tissu osseux [5]. À l’inverse, on peut observer une faible résorption avec certains matériaux frittés, ce qui aboutit à un faible pourcentage d’os reconstruit après comblement, en comparaison avec l’os autogène qui sera plus facilement remodelé en totalité [6] : ceci pourrait être un des facteurs expliquant la plus grande prévalence des complications de type péri-implantites dans les sites greffés par rapport aux zones où les implants ont été placés dans l’os natif [7].
Enfin, d’un point de vue technique, quels que soient les matériaux utilisés, ces techniques de chirurgie pré-implantaire ont des taux de complications et d’échecs relativement importants, du fait de l’apprentissage nécessaire pour les maîtriser parfaitement d’un point de vue chirurgical [8].
Pour obtenir des résultats plus prédictibles avec ces techniques d’augmentation du volume osseux, il est aujourd’hui nécessaire de mettre au point des biomatériaux qui seraient plus faciles à utiliser d’un point de vue chirurgical et avec des propriétés biologiques plus adaptées à la cinétique de remodelage osseux.
Apports de l’impression 3D pour la régénération osseuse pré-implantaire
Considérant les limites techniques des méthodes traditionnelles de régénération osseuse, de nouveaux outils ont été utilisés pour développer des dispositifs médicaux sur mesure pour la régénération osseuse, notamment dans le domaine de la chirurgie pré-implantaire.
Les méthodes d’usinage sont les premières qui ont été utilisées pour fabriquer des pièces sur mesure. Il s’agit d’utiliser une fraiseuse 5 axes pour préparer la pièce sur mesure à partir d’un bloc de biomatériau macroporeux [9]. Cette technique est efficace mais elle nécessite des équipements coûteux et il peut être difficile de réaliser des pièces de forme complexe ; une autre limite est liée à la perte importante de matière lors de la préparation de ces greffes. Elle est aujourd’hui utilisée de façon commerciale pour préparer des greffons osseux sur mesure à partir d’allogreffes osseuses ou de blocs de phosphate de calcium synthétiques.
Plus récemment, l’application des méthodes d’impression en trois dimensions (3D) dans le domaine biomédical a permis d’ouvrir de nouvelles perspectives dans la création d’implants osseux sur mesure. Le principe est de fabriquer ce matériau couche par couche, sur la base d’un fichier informatique spécifique. Plusieurs techniques d’impression 3D existent. Elles sont fondées soit sur l’extrusion de matière (extrusion à chaud de polymères, extrusion de ciments phospho-calciques), soit sur l’utilisation d’un agent physique (un laser) permettant de réticuler des polymères (poudres ou liquides) ou d’assembler par frittage des matériaux phosphocalciques ou métalliques [10].
L’impression 3D a donc permis d’améliorer la précision des pièces imprimées et de limiter la quantité de matériau utilisé. De plus, des greffons de forme complexe peuvent être produits avec cette méthode. Ainsi, plusieurs séries de cas publiées ont montré la possibilité de fabriquer ces échafaudages (scaffolds) sur mesure pour la reconstruction osseuse, soit à base de polymères [11], soit avec des ciments phosphocalciques [12, 13]. Cependant, les biomatériaux utilisés traditionnellement pour la régénération osseuse sont souvent inadaptés pour l’impression 3D et doivent donc être modifiés pour être imprimables. L’insertion d’agents réticulants ou de méthodes d’assemblage spécifiques permet la fabrication de ces matériaux sur mesure, mais cela provoque parfois des effets indésirables concernant la biocompatibilité et l’effet biologique des matériaux.
On peut donc considérer que le biomatériau imprimable « idéal » pour la fabrication de greffons sur mesure pour la régénération osseuse reste aujourd’hui à développer.
Certaines applications commerciales sont néanmoins disponibles. On retrouve principalement des membranes en titane sur mesure qui peuvent être utilisées pour stabiliser les matériaux de greffe dans le cadre de reconstructions osseuse de grande étendue (Figure 2). Cette technique est limitée dans ses indications par son coût important et la nécessité de retirer la grille après cicatrisation, au moment de l’insertion des implants dentaires endo-osseux. Dans ce cas, il y aura un intérêt à développer des matériaux résorbables pour remplacer le titane dans cette indication.
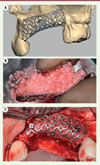 |
Figure 2. Régénération osseuse guidée avec membrane en titane sur mesure. A. Modélisation de la membrane en fonction de l’anatomie du patient (système Reoss®). B..Préparation de la greffe : 50 % d’os autogène et 50 % de xénogreffe bovine (BioOss®). C. Mise en place de la greffe soutenue par la membrane sur mesure. |
L’utilisation actuelle la plus courante de l’impression 3D pour la chirurgie orale consiste à utiliser des résines biocompatibles pour fabriquer des guides chirurgicaux ou des modèles anatomiques permettant de simuler l’intervention et de guider le chirurgien lors de l’exérèse de tumeurs, de la préparation de greffons, ou de la mise en forme de plaques d’ostéosynthèse [14] (Figure 3).
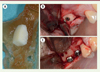 |
Figure 3. Modèle anatomique pour la préparation d’un bloc osseux allogénique. A. Préparation d’un greffon allogénique sur un modèle anatomique imprimé. B. Fixation du greffon après préparation sur modèle anatomique. C. Pose des implants dans le site greffé (quatre mois après la greffe). |
Perspectives : voies d’amélioration des biomatériaux et apport de l’ingénierie tissulaire
La principale perspective à court terme concerne donc la mise au point de biomatériaux de régénération osseuse imprimables en 3D afin de fabriquer des greffons sur mesure, qui posséderaient une cinétique de dégradation plus adaptée aux étapes naturelles de régénération osseuse. On peut citer, par exemple, le développement de matériaux composites imprimables associant un polymère et un phosphate de calcium [15]. Ces matériaux sont imprimables en 3D, possèdent des propriétés mécaniques adaptées à la chirurgie osseuse ; ils sont biocompatibles et ils peuvent favoriser la formation osseuse du fait de la présence de phosphate de calcium inclus (Figure 4).
 |
Figure 4. Scaffolds réalisés avec un matériau composite d’acide poly(lactiqueco-glycolique) (PLGA) mixé ou non avec des nanoparticules d’hydroxyapatite (nHA). Les matériaux fabriqués sous forme de filament ont été utilisés pour l’impression 3D par extrusion à chaud (fused deposition modeling) de scaffolds. Les images présentées ont été réalisées en microscopie électronique à balayage (bar : 2 mm). |
La fabrication de pièces sur mesure permet d’envisager le traitement de défauts de forme complexe [16], en associant plusieurs biomatériaux différents pour traiter des défauts osseux et parodontaux. Il est également possible de fabriquer des membranes de régénération osseuse alliant différents matériaux et différentes porosités afin de répondre aux contraintes spécifiques de chaque tissu concerné (os alvéolaire et gencive). En effet, ces tissus ont des propriétés différentes et l’utilisation de ces membranes multicouches permet de s’adapter au mieux aux propriétés de chaque tissu [17].
Dans les cas de pertes osseuses de grande étendue ou d’altération locale du métabolisme osseux (après irradiation cervico-faciale, par exemple), les biomatériaux seuls ne sont pas efficaces pour obtenir une régénération osseuse. Se pose alors l’indication de greffe autologue. Lorsque celle-ci est impossible par manque de site donneur, il a été proposé de produire un néo-tissu vivant par ingénierie tissulaire. Il s’agit d’associer un biomatériau (scaffold) à des cellules souches autologues (cellules souches mésenchymateuses isolées de la moelle osseuse ou du tissu adipeux), éventuellement à des facteurs de croissance et de différenciation. Des résultats cliniques très satisfaisants ont été publiés dans plusieurs séries de cas de reconstruction osseuse après des cancers ou des traumatismes de grande étendue [18], mais également en chirurgie pré-implantaire pour l’implantologie orale [19]. Cependant, cette approche utilisant des cellules souches est aujourd’hui difficilement applicable en routine en implantologie, en raison d’obstacles techniques et de coûts trop importants par rapport aux méthodes de référence.
Enfin, pour faciliter la cellularisation des matériaux, plusieurs méthodes ont été décrites, comme la culture en conditions dynamiques [20], l’optimisation de la taille et forme des porosités, ou l’assemblage multicouches de scaffolds permettant d’insérer les éléments cellulaires au sein de la construction [21].
Des méthodes alternatives applicables en implantologie dentaire reposent sur l’utilisation de concentrés plaquettaires issus du sang périphérique. Des centrifugeuses utilisables en pratique de ville existent, mais même si cette technique permet de faciliter la cicatrisation des tissus mous (la gencive) [22], il n’existe pas encore de preuve de l’efficacité de cette approche pour la reconstruction osseuse [23].
La fabrication de modèles de tissus cultivés in vitro a été envisagée sur la base de résultats cliniques. Ces tissus peuvent être utilisés pour mieux comprendre les processus physiologiques ou pathologiques, ou pour suivre les étapes d’intégration d’un biomatériau. Cette approche est aujourd’hui particulièrement intéressante puisque qu’elle pourrait permettre à terme de limiter le recours à l’expérimentation animale dans un certain nombre de situations. En effet, l’utilisation d’animaux à des fins de recherche pose un certain nombre de questions actuellement, comme des limites éthiques, de coût et de reproductibilité des résultats. Les modèles d’étude des implants dentaires font actuellement largement appel aux modèles intra-oraux chez le gros animal (cochon, chien, etc.), à la fois pour l’évaluation de l’ostéo-intégration de nouvelles surfaces ou formes implantaires, mais également pour mieux comprendre et développer des traitements pour les péri-implantites. Ainsi, plusieurs équipes travaillent au développement de modèles in vitro d’implants dentaires dans leur microenvironnement osseux et gingival [24, 25] (Figure 5).
 |
Figure 5. Projet de fabrication d’un modèle in vitro d’implant dentaire dans son environnement osseux et gingival (ANR IDEAL-3D 2022-2026). A. Scaffold imprimé en 3D (acide poly(lactique-co-glycolique), PLGA). B. Ensemencement du scaffold avec des ostéoblastes pour la partie osseuse du modèle. C, D..Ensemencement avec des fibroblastes et des kératinoctyes pour la partie gingivale du modèle. E. Mise en place de l’implant (en titane). F. Maturation du modèle in vitro dans un bioréacteur, sous perfusion. |
Conclusions
Les besoins cliniques de régénération osseuse en chirurgie orale sont nombreux, notamment dans le domaine de l’implantologie dentaire. Les progrès dans le domaine des biomatériaux imprimables en 3D permettent de réaliser des interventions moins invasives, plus rapides et précises.
La principale perspective dans ce domaine repose sur l’apport de l’ingénierie tissulaire et de la bioimpression pour prendre en charge les défauts osseux qui ne répondent pas bien aux techniques de reconstruction conventionnelles. Par ailleurs, la mise au point in vitro de modèles d’études physiopathologiques permettra de limiter l’expérimentation animale pour la mise au point de nouveaux traitements, notamment dans le domaine des péri-implantites.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Couso-Queiruga E, Stuhr S, Tattan M, et al. Post-extraction dimensional changes: A systematic review and meta-analysis. J Clin Periodontol 2021; 48 : 126–44. [Google Scholar]
- Bornstein MM, Halbritter S, Harnisch H, et al. A retrospective analysis of patients referred for implant placement to a specialty clinic: indications, surgical procedures, and early failures. Int J Oral Maxillofac Implants 2008 ; 23 : 1109–1116. [PubMed] [Google Scholar]
- Heimes D, Schiegnitz E, Kuchen R, et al. Buccal Bone Thickness in Anterior and Posterior Teeth-A Systematic Review. Healthc Basel Switz 2021; 9 : 1663. [Google Scholar]
- Muñoz S, Johnson TM, Dutner JM, et al. Implant site development requirements in an advanced dental education program: A series of 290 implants. J Dent Educ 2022; 86 : 1425–34. [CrossRef] [PubMed] [Google Scholar]
- Zhang Y, Al-Maawi S, Wang X, et al. Biomaterial-induced multinucleated giant cells express proinflammatory signaling molecules: A histological study in humans. J Biomed Mater Res A 2019 ; 107 : 780–790. [CrossRef] [PubMed] [Google Scholar]
- Danesh-Sani SA, Loomer PM, Wallace SS. A comprehensive clinical review of maxillary sinus floor elevation: anatomy, techniques, biomaterials and complications. Br J Oral Maxillofac Surg 2016 ; 54 : 724–730. [CrossRef] [PubMed] [Google Scholar]
- Shatta A, Bissada NF, Ricchetti P, et al. Impact of Implant and Site Characteristics on the Pattern of Bone Loss in Peri-implantitis. Int J Oral Maxillofac Implants 2019 ; 34 : 1475–1481. [CrossRef] [PubMed] [Google Scholar]
- Esposito M, Grusovin MG, Felice P, et al. The efficacy of horizontal and vertical bone augmentation procedures for dental implants - a Cochrane systematic review. Eur J Oral Implantol 2009 ; 2 : 167–184. [PubMed] [Google Scholar]
- Mangano C, Luongo G, Luongo F, et al. Custom-made computer-aided-design/ computer-assisted-manufacturing (CAD/CAM) synthetic bone grafts for alveolar ridge augmentation: A retrospective clinical study with 3 years of follow-up. J Dent 2022; 127 : 104323. [CrossRef] [PubMed] [Google Scholar]
- van der Heide D, Cidonio G, Stoddart MJ, et al. 3D printing of inorganic-biopolymer composites for bone regeneration. Biofabrication 2022; 14. doi: 10.1088/1758-5090/ac8cb2. [Google Scholar]
- Backes EH, Harb SV, Beatrice CAG, et al. Polycaprolactone usage in additive manufacturing strategies for tissue engineering applications: A review. J Biomed Mater Res B Appl Biomater 2022; 110 : 1479–503. [CrossRef] [PubMed] [Google Scholar]
- Anderson M, Dubey N, Bogie K, et al. Three-dimensional printing of clinical scale and personalized calcium phosphate scaffolds for alveolar bone reconstruction. Dent Mater 2022; 38 : 529–39. [CrossRef] [PubMed] [Google Scholar]
- Park H, Choi JW, Jeong WS. Clinical Application of Three-Dimensional Printing of Polycaprolactone/Beta-Tricalcium Phosphate Implants for Cranial Reconstruction. J Craniofac Surg 2022; 33 : 1394–9. [CrossRef] [PubMed] [Google Scholar]
- Meglioli M, Naveau A, Macaluso GM, et al. 3D-printed bone models for planning and training in oral and cranio-maxillofacial surgery: a systematic review. 3D Print Med 2020; 6 : 30. [CrossRef] [PubMed] [Google Scholar]
- Babilotte J, Guduric V, Le Nihouannen D, et al. 3D printed polymer-mineral composite biomaterials for bone tissue engineering: Fabrication and characterization. J Biomed Mater Res B Appl Biomater 2019 ; 107 : 2579–2595. [CrossRef] [PubMed] [Google Scholar]
- Tavelli L, Barootchi S, Rasperini G, et al. Clinical and patient-reported outcomes of tissue engineering strategies for periodontal and peri-implant reconstruction. Periodontol 2000 ; 2023 ; 91: 217–269. [Google Scholar]
- Liu J, Chen D, Zhu X, et al. Development of a decellularized human amniotic membrane-based electrospun vascular graft capable of rapid remodeling for small-diameter vascular applications. Acta Biomater 2022; 152 : 144–56. [CrossRef] [PubMed] [Google Scholar]
- Sándor GK, Tuovinen VJ, Wolff J, et al. Adipose stem cell tissue-engineered construct used to treat large anterior mandibular defect: a case report and review of the clinical application of good manufacturing practice-level adipose stem cells for bone regeneration. J Oral Maxillofac Surg 2013 ; 71 : 938–950. [CrossRef] [PubMed] [Google Scholar]
- Latimer JM, Maekawa S, Yao Y, et al. Regenerative Medicine Technologies to Treat Dental, Oral, and Craniofacial Defects. Front Bioeng Biotechnol 2021; 9 : 704048. [CrossRef] [PubMed] [Google Scholar]
- Engel N, Fechner C, Voges A, et al. An optimized 3D-printed perfusion bioreactor for homogeneous cell seeding in bone substitute scaffolds for future chairside applications. Sci Rep 2021; 11 : 22228. [CrossRef] [PubMed] [Google Scholar]
- Guduric V, Siadous R, Babilotte J, et al. Layer-by-layer bioassembly of poly(lactic) acid membranes loaded with coculture of HBMSCs and EPCs improves vascularization in vivo. J Biomed Mater Res A 2019 ; 107 : 2629–2642. [CrossRef] [PubMed] [Google Scholar]
- Panda S, Satpathy A, Chandra Das A, et al. Additive Effect of Platelet Rich Fibrin with Coronally Advanced Flap Procedure in Root Coverage of Miller’s Class I and II Recession Defects-A PRISMA Compliant Systematic Review and Meta-Analysis. Mater Basel Switz 2020; 13 : E4314. [Google Scholar]
- Fujioka-Kobayashi M, Miron RJ, Moraschini V, et al. Efficacy of platelet-rich fibrin on bone formation, part 2: Guided bone regeneration, sinus elevation and implant therapy. Int J Oral Implantol Berl Ger 2021; 14 : 285–302. [Google Scholar]
- Sivolella S, Brunello G, Ferroni L, et al. A Novel In Vitro Technique for Assessing Dental Implant Osseointegration. Tissue Eng Part C Methods 2016 ; 22 : 132–141. [CrossRef] [PubMed] [Google Scholar]
- Roffel S, Wu G, Nedeljkovic I, et al. Evaluation of a novel oral mucosa in vitro implantation model for analysis of molecular interactions with dental abutment surfaces. Clin Implant Dent Relat Res. 2019 ; 21(Suppl 1): 25–33. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Greffe osseuse autogène avec prélèvement ramique. Un prélèvement osseux est réalisé sur le ramus mandibulaire (A). Après préparation du greffon, une lamelle corticale est fixée pour reconstruire le site résorbé en externe (B). Un espace persiste entre le site receveur et la lamelle corticale (C). D. Préparation de copeaux osseux. E. Comblement des espaces résiduels avec des copeaux osseux. |
| Dans le texte | |
 |
Figure 2. Régénération osseuse guidée avec membrane en titane sur mesure. A. Modélisation de la membrane en fonction de l’anatomie du patient (système Reoss®). B..Préparation de la greffe : 50 % d’os autogène et 50 % de xénogreffe bovine (BioOss®). C. Mise en place de la greffe soutenue par la membrane sur mesure. |
| Dans le texte | |
 |
Figure 3. Modèle anatomique pour la préparation d’un bloc osseux allogénique. A. Préparation d’un greffon allogénique sur un modèle anatomique imprimé. B. Fixation du greffon après préparation sur modèle anatomique. C. Pose des implants dans le site greffé (quatre mois après la greffe). |
| Dans le texte | |
 |
Figure 4. Scaffolds réalisés avec un matériau composite d’acide poly(lactiqueco-glycolique) (PLGA) mixé ou non avec des nanoparticules d’hydroxyapatite (nHA). Les matériaux fabriqués sous forme de filament ont été utilisés pour l’impression 3D par extrusion à chaud (fused deposition modeling) de scaffolds. Les images présentées ont été réalisées en microscopie électronique à balayage (bar : 2 mm). |
| Dans le texte | |
 |
Figure 5. Projet de fabrication d’un modèle in vitro d’implant dentaire dans son environnement osseux et gingival (ANR IDEAL-3D 2022-2026). A. Scaffold imprimé en 3D (acide poly(lactique-co-glycolique), PLGA). B. Ensemencement du scaffold avec des ostéoblastes pour la partie osseuse du modèle. C, D..Ensemencement avec des fibroblastes et des kératinoctyes pour la partie gingivale du modèle. E. Mise en place de l’implant (en titane). F. Maturation du modèle in vitro dans un bioréacteur, sous perfusion. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




