| Issue |
Med Sci (Paris)
Volume 40, Number 1, Janvier 2024
La cavité orale et les dents au cœur de la santé
|
|
|---|---|---|
| Page(s) | 85 - 87 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023200 | |
| Published online | 01 February 2024 | |
Approche biomimétique des restaurations des tissus dentaires
Quels biomatériaux, quelles perspectives ?
Biomimetic approach to dental tissue restorations: Which biomaterials, which prospects?
1
UFR d’odontologie, Université Paris Cité, Hôpital Rothschild AP-HP, UMR CNRS 5615 Lyon 1, France
2
UFR d’Odontologie, Université Lyon 1, Hospices Civils de Lyon, UMR CNRS 5615 Lyon 1, France
* pierre.colon@u-paris.fr
** brigitte.grosgogeat@univ-lyon1.fr
Les dents constituent un organe particulier. Elles permettent la fonction masticatrice, participent à la phonation et ont un rôle important dans les relations sociales. Elles doivent résister à des variations de température, comprises entre 5 °C et 55 °C, aux contraintes mécaniques de la mastication, et aux acides présents dans l’alimentation.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Thibault Canceill).
Les tissus dentaires calcifiés ou pas présentent des propriétés uniques au sein du corps humain (Figure 1). L’émail, tissu constitué d’hydroxyapatite à plus de 96 %, est le plus dur matériau que l’on peut rencontrer chez l’homme, 300 dans l’échelle Vickers1. Il possède des propriétés optiques complexes (translucidité, indice de réfraction, couleur, luminosité) qui contribuent à la relation sociale, au travers d’un sourire. Il préserve les tissus dentaires minéralisés ou non (dentine et pulpe dentaire) de la pénétration des bactéries.
La dentine, minéralisée à 70 %, est traversée de canalicules occupés par les prolongements cellulaires des cellules pulpaires, les odontoblastes. Mécaniquement moins résistante que l’émail, la dentine se caractérise en particulier par sa perméabilité qui augmente lorsque l’on se rapproche de la pulpe dentaire, et se réduit en direction de la jonction amélodentinaire. Cette perméabilité est plus élevée lors de l’éruption de la dent. Elle se réduit tout au long de la vie selon des processus physiologiques de minéralisation continus. La teinte de la dentine, plus saturée que celle de l’émail, participe à la couleur de la dent en raison de la translucidité de l’émail. L’épaisseur de l’émail dentaire n’étant pas homogène, et l’orientation des prismes d’émail étant différente selon la zone concernée, la couleur de la dentine sous-jacente contribue à des différences de propriétés optiques de la zone cervicale, au bord de la dent, ce qui complexifie son analyse chromatique par l’observateur.
La pulpe dentaire est un bel exemple de tissu conjonctif de volume réduit, contenu dans une cavité rigide au sein de la dent, la chambre pulpaire, qui renferme tous les éléments vasculaires, cellulaires, nerveux. C’est à ce niveau que s’effectue la réponse inflammatoire vis-à-vis des agressions d’origine bactériennes ou des atteintes traumatiques : une pression pulpaire positive favorise les échanges liquidiens entre la pulpe et la dentine. Le cément, tissu plus faiblement minéralisé et riche en fibres, recouvre la dentine des racines dentaires pour permettre une attache élastique de la dent aux tissus de soutien osseux environnants par l’intermédiaire du ligament alvéolodentaire.
Tous ces tissus constitutifs d’une dent permettent de résister à de nombreuses agressions, quelle qu’en soit l’origine, mais ils ne permettent pas une restauration ad integrum, ce qui justifie l’emploi de biomatériaux. Depuis l’antiquité, on a cherché à remplacer tout ou partie d’une dent pour restituer sa fonction et son esthétique. La connaissance des propriétés chimiques et physiques des matériaux permet aujourd’hui de les associer à celle des propriétés biologiques de la dent, afin de poser la juste indication et ainsi évoluer vers des solutions de réparations conservatrices, esthétiques et durables.
Comment comprendre le terme « biomimétisme » dans la réhabilitation dentaire
Les propriétés optiques des biomatériaux s’orientent de plus en plus vers des restaurations esthétiques, ce qui implique, pour de nombreuses familles de matériaux, des choix de teintes, d’opacités, d’état de surface répondant à la demande des patients d’une restauration invisible. Les propriétés physiques des matériaux doivent également répondre à des caractéristiques permettant de se rapprocher de celles des tissus dentaires concernés : dureté, module d’élasticité, résistance à la compression, résistance à la flexion, coefficients de dilatation thermique. Les interfaces biologiques avec l’environnement buccal, la dentine ou la pulpe dentaire, nécessitent que les matériaux utilisés ou leurs produits de dégradation ne présentent pas d’effets délétères. On doit donc prendre en compte les propriétés de cytotoxicité mais également cibler les possibles effets carcinogènes, mutagènes, allergènes, perturbateurs endocriniens des matériaux ou composants afin de valider un comportement biologique « compatible ». Il est possible aujourd’hui d’aller plus loin dans le domaine des interfaces biologiques en proposant des matériaux dits « bioactifs ». Ces matériaux vont interférer avec les cellules pulpaires, les odontoblastes, pour provoquer une stimulation du mode sécrétoire, tout en leur mettant à disposition les éléments ioniques nécessaires à la synthèse dentinaire. Ils peuvent également interagir avec des cellules pulpaires indifférenciées pour générer de nouvelles cellules capables elles aussi d’élaborer de la dentine. La maladie carieuse étant d’origine bactérienne et faisant intervenir une flore polymorphe, certaines molécules antibactériennes, comme le DHAMI (diméthyl-hexadécyl-méthaacryloxyéthyl-amonium iodide) appartenant à la famille des ammoniums quaternaires, pourraient concilier efficacité antibactérienne et faible cytotoxicité [2].
Ces propriétés bioactives focalisent les recherches actuelles en considérant le « matériau de réparation » élaboré par des cellules comme le plus à même de répondre au cahier des charges évoqué précédemment.
Les matériaux biomimétiques
Les matériaux que l’on peut considérer comme biomimétiques se répartissent en plusieurs familles.
Les matériaux organominéraux à base résineuse
Les résines composites sont constituées de chaînes carbonées photopolymérisables chargées de particules de verre. Elles présentent une diversité de teintes, de degrés d’opacité, de luminosité qui permettent, sur le plan esthétique, de faire face à toutes les situations cliniques. Apparues dans les années 1975, ces résines s’améliorent sans cesse sur le plan de leurs propriétés physiques et optiques. À ce jour, les taux élevés de charges2, entre 50 et 70 % en volume, et la très faible granulométrie des particules de verre confèrent à ces matériaux des propriétés optiques et mécaniques très satisfaisantes. Leur principal défaut réside dans une proportion non négligeable de monomères résiduels qui ont un impact sur leurs propriétés biologiques. Il existe aujourd’hui des formulations ne comportant plus de bisphénols, supprimés en raison de leurs effets perturbateurs endocriniens. Les méthodes de mise en œuvre ont aussi considérablement évolué [3]. Les résines composites peuvent toujours s’utiliser en technique directe, au fauteuil, ou indirecte, au laboratoire. Il existe des blocs prépolymérisés destinés à usiner des pièces prothétiques par soustraction ou, depuis récemment, des monomères résineux compatibles avec les techniques d’impression 3D (en 3 dimensions). Ces techniques indirectes présentent deux avantages majeurs : un taux de réticulation beaucoup plus élevé que celui des résines composites conventionnelles, ce qui limite considérablement la libération de monomères résiduels ; et la possibilité de faire varier la composition des matériaux (teinte et propriétés mécaniques) en construisant la restauration, de la profondeur vers la surface.
Les matériaux organominéraux à base de verres fluoroaluminosilicates
Les ciments verres ionomères résultent de la réaction d’un acide organique (polyacrylique principalement) sur des particules de verre pour constituer un hydrogel. Ces matériaux permettent, en raison de leur structure d’hydrogel, la diffusion d’espèces ionisées, le fluor en particulier, du matériau vers les tissus dentaires calcifiés. Disponibles en différentes teintes, ils peuvent être utilisés pour reminéraliser certains tissus dentinaires déminéralisés, lors de l’excision sélective d’une lésion carieuse, permettant une préservation maximale des tissus.
Les céramiques
Ce sont des matériaux minéraux qui présentent une tolérance biologique remarquable. Il en existe de multiples formes permettant leur utilisation, après cuisson, frittage, usinage ou autres méthodes de synthèse plus complexes. Les différentes formules vont de la chimie des verres à des formes cristallines plus ou moins complexes. Leurs propriétés optiques sont remarquables, mais les techniques d’élaboration nécessitent la réalisation des restaurations sur un modèle de laboratoire, physique ou numérique, avant d’être assemblées secondairement sur la dent par l’intermédiaire d’un polymère de collage ou d’un ciment verre ionomère.
Plus récemment, de nouveaux matériaux minéraux classés comme étant très bioactifs sont apparus. Il s’agit d’une part des ciments biosilicates et, d’autre part, des verres bioactifs.
Les ciments biosilicates
Les ciments biosilicates sont rapidement devenus incontournables, en particulier pour les soins pédiatriques [3, 4]. Ces ciments peuvent en effet être placés au contact direct des cellules pulpaires et permettre la formation, à partir des odontoblastes ou à partir de cellules indifférenciées, d’une dentine de réparation dont les caractéristiques morphologiques sont similaires à celles de la dentine physiologique. Lorsque l’exérèse complète des tissus pulpaires radiculaires est nécessaire, ces ciments permettent de sceller de façon étanche l’endodonte avec une compatibilité biologique parfaite des tissus péridentaires (tissus osseux, ligament alvéolodentaire). Ces silicates de calcium résultent d’un mélange entre une poudre composée de trisilicate de calcium et de carbonate de calcium avec de l’eau additionnée d’accélérateurs de prise. Cette prise ne s’arrête jamais totalement, ce qui donne la possibilité de mouvements d’ions au sein du matériau et au niveau des interfaces avec les tissus dentaires.
Les bioverres
Découverts il y a plus de 50 ans par Larry Hench (1938-2015) (Imperial College, Londres, Royaume-Uni) [6], les bioverres, après avoir démontré leurs propriétés biologiques en regard du tissu osseux, voient aujourd’hui leur intérêt grandir en odontologie [7]. Ces matériaux ne nécessitent pas de réaction de prise pour exercer leurs propriétés bioactives. En présence d’eau, ils libèrent les éléments précurseurs de la minéralisation (calcium et phosphates) et stimulent simultanément les odontoblastes. Les particules de bioverres commencent à être proposées comme constituant additionnel des résines composites ou des ciments verres ionomères [8]. Leur intégration dans d’autres matériaux reste encore au stade expérimental avec des résultats prometteurs lors des essais in vitro.
Conclusion
Cette courte présentation permet de comprendre la transversalité d’une approche biomimétique des biomatériaux de restauration dentaire. Les différentes familles de matériaux et leurs multiples possibilités de mise en œuvre, leurs propriétés physiques et biologiques respectives contribuent à répondre quotidiennement à de multiples situations cliniques. Les propriétés bioactives de ces matériaux sont de plus en plus étudiées, jusqu’à entrer dans le cahier des charges de tous les biomatériaux modernes. Il reste à concilier, dans un même matériau, propriétés optiques, mécaniques et biologiques, ce qui reste aujourd’hui un défi.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Union Française pour la Santé Bucco-Dentaire. Anatomie de la dent, nom et fonction des dents, éruption des dents les dents n’auront bientôt plus aucun secret pour vous ! https://www.ufsbd.fr/espace-grand-public/espace-enfants/anatomie-et-fonction-de-la-dent/. [Google Scholar]
- Cherchali FZ, Mouzali M, Tommasino JB, et al. Effectiveness of the DHMAI monomer in the development of an antibacterial dental composite. Dental Materials 2017 ; 33 : 1381–1391. [CrossRef] [PubMed] [Google Scholar]
- Bhargav A, Sanjairaj V, Rosa V, et al. Applications of additive manufacturing in dentistry: A review: Applications of additive manufacturing in dentistry Y. J Biomed Mater Res 2018 ; 106 : 2058–2024. [CrossRef] [PubMed] [Google Scholar]
- Bogen G, Kuttler S. Mineral Trioxide Aggregate Obturation: A Review and Case Series. J Endodontics 2009 ; 35 : 777–790. [CrossRef] [Google Scholar]
- Martens L, Rajasekharan S, Cauwels R. Endodontic treatment of trauma-induced necrotic immature teeth using a tricalcium silicate-based bioactive cement. A report of 3 cases with 24-month follow-up. Eur J Paediatr Dent 2016 ; 17 : 24–28. [PubMed] [Google Scholar]
- Hench LL. The story of Bioglass®. J Mater Sci: Mater Med 2006 ; 17 : 967–978. [CrossRef] [PubMed] [Google Scholar]
- Mocquot C, Attik N, Pradelle-Plasse N, et al. Bioactivity assessment of bioactive glasses for dental applications: A critical review. Dental Materials 2020; 36 : 1116–43. [CrossRef] [PubMed] [Google Scholar]
- Fernando D, Attik N, Pradelle-Plasse N, et al. Bioactive glass for dentin remineralization: A systematic review. Materials Science and Engineering: C 2017 ; 76 : 1369–1377. [CrossRef] [Google Scholar]
Liste des figures
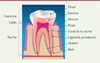 |
Figure 1. Anatomie de la dent (figure adaptée de [1]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




