| Issue |
Med Sci (Paris)
Volume 40, Number 1, Janvier 2024
La cavité orale et les dents au cœur de la santé
|
|
|---|---|---|
| Page(s) | 79 - 84 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023199 | |
| Published online | 01 February 2024 | |
Les enjeux de l’intelligence artificielle en odontologie
The challenges of artificial intelligence in odontology
1
UFR odontologie, université Paris Cité, Paris, France
2
AP-HP, hôpital Pitié-Salpêtrière, service de médecine bucco-dentaire, Paris, France
3
Institut de biomécanique humaine Georges Charpak, école nationale supérieure d’Arts et Métiers, Paris, France
4
Faculté d’odontologie, université Claude Bernard Lyon 1, hospices civils de Lyon, Lyon, France
Les applications potentielles de l’intelligence artificielle, ces algorithmes visant à améliorer l’efficacité et la sécurité de diverses décisions cliniques, sont nombreuses en odontologie. Alors que les premiers logiciels commerciaux commencent à être proposés, la plupart des algorithmes n’ont pas été solidement validés pour une utilisation clinique. Cet article décrit les enjeux entourant le développement de ces nouveaux outils, afin d’aider les praticiens à garder un regard éclairé et critique sur cette nouvelle approche.
Abstract
Artificial intelligence has numerous potential applications in dentistry, as these algorithms aim to improve the efficiency and safety of several clinical situations. While the first commercial solutions are being proposed, most of these algorithms have not been sufficiently validated for clinical use. This article describes the challenges surrounding the development of these new tools, to help clinicians to keep a critical eye on this technology.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Thibault Canceill).
L’intelligence artificielle (IA) est une notion vaste, regroupant un « ensemble de théories et de techniques mises en œuvre en vue de réaliser des machines capables de simuler l’intelligence humaine »1. Dans le domaine médical, les algorithmes utilisés reposent le plus souvent sur l’apprentissage profond supervisé [1]. À partir d’une base de données regroupant des milliers de situations annotées par des experts (par exemple, avec l’information de présence ou non d’un kyste sur une radiographie panoramique), un modèle mathématique est entraîné afin « d’apprendre » le plus finement possible comment déterminer si une situation est saine ou pathologique. Cet entraînement repose sur une présentation répétée des données à l’algorithme, qui cherche à minimiser l’erreur de ses prédictions en ajustant les centaines de millions de paramètres qui sont à sa disposition. Une fois entraîné, l’algorithme a alors la capacité d’annoter seul de nouvelles données. Les résultats obtenus ces dix dernières années par ces algorithmes ont révolutionné de nombreux domaines utilisant de grandes bases de données, et certains de ces algorithmes d’IA commencent à être utilisés en pratique médicale [2]. En dermatologie, les algorithmes sont à même de détecter des lésions cancéreuses sur des photographies avec le même niveau de fiabilité que des dermatologistes expérimentés [3]. En radiologie, le logiciel Chestlink2, intégralement autonome pour détecter l’absence d’atteinte sur une radiographie thoracique, a récemment obtenu un marquage CE (conformité européenne)3, autorisant son utilisation clinique [4].
En odontologie, les recherches privées et académiques portant sur l’utilisation de l’IA se développent fortement car cet outil pourrait potentiellement améliorer l’efficacité et la sécurité des décisions cliniques pour proposer des soins de meilleure qualité à un plus grand nombre de personnes [5, 6]. Les premières grandes applications concernent la vision par ordinateur, qui permet aux machines d’interpréter et de travailler avec les images (Figure 1). Cela offre la possibilité d’automatiser différentes tâches, comme le traitement et l’annotation d’imageries, d’empreintes numériques ou de photographies, avec une fiabilité rapportée pour certaines applications comme équivalente à des cliniciens expérimentés, et une répétabilité améliorée [7–12]. D’autres applications concernent le traitement automatique du langage naturel, qui permet aux machines d’interpréter le sens d’un texte ou d’un discours. Cette approche, qui reste assez nouvelle, a pu être proposée en odontologie pour extraire automatiquement certains contenus de dossiers médicaux numériques [13].
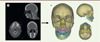 |
Figure 1. Exemples d’utilisation d’algorithmes d’intelligence artificielle fondés sur la vision par ordinateur pour l’automatisation du traitement des imageries. A. Scanner dento-maxillo-facial initial ; B. Automatisation de la reconstruction des tissus durs et de l’analyse céphalométrique tridimensionnelle à partir de méthodes fondées sur l’IA (d’après [8, 9]). |
Différentes sociétés proposent depuis peu des applications commerciales reposant sur des algorithmes de vision par ordinateur pour l’odontologie [6, 7]. Par exemple, dentalXrai (Berlin, Allemagne, www.dentalxr.ai) automatise l’interprétation de radiographies panoramiques ; Relu (Louvain, Belgique, www.relu.eu) automatise la reconstruction d’imageries tridimensionnelles dento-maxillo-faciales ; ou WebCeph (Gyeonggi-do, Corée du Sud, www.webceph.com) automatise le placement de points céphalométriques et l’analyse de radiographies cranio-faciales. Cependant, ces applications restent encore très limitées et ne sont pas toujours solidement validées. Elles peuvent avant tout être considérées comme des preuves de concept.
Ainsi, de nombreux enjeux accompagnent aujourd’hui le développement de l’IA en odontologie. Ceux-là concernent d’abord l’utilisation des données nécessaires au développement des algorithmes, mais également l’évaluation des performances, la compréhension du fonctionnement et les applications cliniques de ces outils.
Dans cette revue, nous présentons ces enjeux et nous discutons des problématiques de l’information des patients, du développement durable et de la formation des praticiens au sujet de l’intelligence artificielle.
L’enjeu des données
Les algorithmes d’IA dépendent intégralement des données utilisées pour les entraîner. Ainsi, les performances des algorithmes ne sont, en principe, valables que sur des données similaires à celles présentées pendant leur entraînement. Cela souligne le très fort risque de biais d’échantillonnage des algorithmes, potentiellement évitable grâce à la constitution de grandes bases de données internationales représentatives de l’ensemble des situations cliniques et des différents outils d’acquisitions [5]. La constitution de telles bases de données est rendue difficile par les contraintes liées à la confidentialité des données de santé, particulièrement en odontologie où de nombreuses données (en particulier les imageries) présentent un haut risque d’identification des individus participant à la recherche [14]. Afin d’entraîner des algorithmes avec des données issues de plusieurs sites, une solution pourrait être le remplacement des entraînements centralisés par des entraînements fédérés sur plusieurs sites [14]. Les données resteraient internes à chaque site et seraient utilisées pour entraîner un modèle d’IA dont seuls les paramètres entraînés seraient partagés entre les différents sites pour obtenir un algorithme final représentatif des multiples sites (Figure 2). Ce type d’approche nécessite une infrastructure spécifique et de nombreuses équipes formées sur le sujet, ce qui reste encore rare aujourd’hui [14]. Dans tous les cas, la présence de biais supplémentaires dans les données devra être interrogée, puisqu’il a été montré que de nombreux algorithmes d’apprentissage profond pouvaient présenter également des biais ethniques ou de genre. Par exemple, les algorithmes initialement proposés en dermatologie permettaient de diagnostiquer avec une très grande fiabilité les lésions cancéreuses sur des peaux claires mais n’incluaient pas de patients avec des peaux foncées [2].
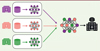 |
Figure 2. Représentation schématique de l’entraînement fédéré sur plusieurs sites d’un algorithme d’intelligence artificielle. Les données restent internes au sein de chaque site, seul le modèle entraîné est partagé afin d’obtenir un algorithme final utilisable par tous les sites. |
L’annotation des données représente également un enjeu important dans les applications de l’IA en odontologie car il n’est souvent pas possible d’accéder à une réelle « référence » (par exemple, une évaluation histologique ex vivo permettant de s’assurer de la présence ou de l’absence d’une carie). En conséquence, il est généralement nécessaire de demander à des experts humains d’annoter les données. Afin de diminuer l’aléa entre les opérateurs, ceux-ci doivent être formés à la tâche en suivant un processus de standardisation des annotations. Ce processus chronophage et coûteux justifie d’autant plus la nécessité de partager les données annotées afin de limiter la redondance inutile d’annotations. Une approche complémentaire vise à inclure en priorité des données utiles à l’amélioration des performances de l’algorithme : la quantité de données ne fait pas tout, l’hétérogénéité de ces données étant la plus importante pour améliorer la performance des algorithmes d’IA [15]. Par exemple, un algorithme de localisation de points céphalométriques devra avoir été entraîné à partir de téléradiographies représentatives de l’hétérogénéité des dysmorphies dento-maxillo-faciales, y compris les dysmorphies les plus rares comme celles d’origine syndromique, pour pouvoir potentiellement s’adapter à toutes les situations cliniques.
L’enjeu de l’évaluation des performances
Une fois l’algorithme d’IA entraîné, il est nécessaire d’évaluer sa performance sur des données dites de test qui ne lui ont jamais été présentées auparavant, pour comparer les prédictions de l’IA à celles d’opérateurs humains (Figure 3). La sélection de ces données de test est importante puisque la performance de l’algorithme en dépend. Les travaux actuellement publiés en odontologie ne reposent pas sur des bases de données de test suffisamment solides. Ils peuvent ainsi présenter des résultats trop optimistes et avec un faible potentiel de généralisation [6, 16]. Plus le jeu de données de test comprend des données hétérogènes et proches des conditions réelles, plus la généralisation de l’algorithme sera grande et son déploiement clinique pourra être envisagé. Idéalement, les critères d’évaluation ne devraient pas uniquement se fonder sur des mesures de précision mais sur d’autres critères plus proches des problématiques cliniques de l’algorithme. Par exemple, dans le cadre de la segmentation de scanners dento-maxillo-faciaux pour la planification de chirurgie orthognathique4, il a été montré que les évaluations quantitatives reposant sur des critères issus de l’ingénierie n’étaient pas directement corrélées à la validation industrielle des résultats [8]. Pour augmenter le niveau de preuve clinique des algorithmes, des essais randomisés pourraient être effectués pour en estimer le bénéfice clinique [17].
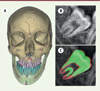 |
Figure 3. Exemple d’évaluation d’algorithmes d’intelligence artificielle. A. Localisation automatique de points céphalométriques tridimensionnels, annotation manuelle (en rouge) et automatisée (en bleu) avec la méthode décrite dans [9]. B. et C. Segmentation des tissus minéralisés d’une troisième molaire à partir d’une radiographie panoramique, annotation manuelle (en rouge) et automatique (en vert), à partir d’un réseau d’apprentissage profond entraîné sur 500 radiographies. |
À l’heure actuelle, la certification d’un algorithme d’apprentissage profond pour une utilisation clinique suit, en Europe, la voie réglementaire des dispositifs médicaux, avec notamment un marquage CE, et aux États-Unis, une approbation par la FDA (Food and Drug Administration) [18]. Le parcours réglementaire dépend du risque attribué à l’algorithme : plus ce risque est fort, plus des preuves importantes de sécurité, de performance et de fiabilité de l’algorithme sont à fournir. Pour les algorithmes considérés à haut risque (influençant la décision clinique), des études cliniques démontrant la sécurité et l’efficacité des dispositifs sont le plus souvent nécessaires [18].
L’enjeu de la compréhension et de la responsabilité des praticiens
Afin de garantir une utilisation sécurisée de l’IA en santé, différents outils sont développés pour améliorer la confiance dans les algorithmes. Pour mieux comprendre le mécanisme de « raisonnement » des modèles d’IA, le champ de « l’intelligence artificielle explicable » s’est développé ces dernières années. L’objectif est de permettre aux utilisateurs de l’outil de savoir sur quels éléments s’est fondé l’algorithme pour effectuer ses prédictions [19]. Ces éléments d’explication permettent aux utilisateurs de développer une analyse critique des résultats, en identifiant les éléments essentiels à la décision de l’algorithme (Figure 4). À l’avenir, il est probable que les algorithmes devront présenter ce type d’explications aux utilisateurs pour pouvoir être commercialisés dans le domaine de la santé [17, 19]. Ces éléments recoupent des questionnement éthiques entourant la responsabilité du praticien lors de l’utilisation clinique d’une solution d’IA [6]. L’utilisation d’algorithmes d’IA ne doit pas réduire la responsabilité des opérateurs humains lorsqu’ils font des choix médicaux, et il faut, par exemple, veiller à ce que le système ne devienne pas une référence pour des cliniciens peu expérimentés. Une étude a récemment montré que des radiologues avec peu d’expérience avaient davantage tendance à suivre les conseils erronés donnés par un algorithme d’IA que les radiologues plus expérimentés [20]. Plus largement, le cadre réglementaire et les conséquences juridiques pour les praticiens de l’utilisation des algorithmes doivent encore être clarifiés, car ce type de dispositif ouvre la porte à de nombreuses situations inédites et à toutes les failles juridiques qui y sont associées [21].
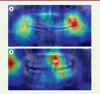 |
Figure 4. Visualisation des zones importantes à la décision d’un algorithme d’IA qui devait initialement localiser des informations au niveau des troisièmes molaires sur des radiographies panoramiques. Il est ainsi possible de savoir si l’algorithme s’intéresse aux bonnes zones de l’image (A) ou s’il est perturbé par des artéfacts (B). |
L’enjeu des applications cliniques
La majorité des informations fournies par les algorithmes d’IA en odontologie ne sont pas suffisantes pour effectuer une décision clinique complexe [17]. Les algorithmes permettent, pour l’instant, uniquement d’automatiser quelques étapes de ce processus de décision : l’interprétation d’une imagerie, le traitement d’une empreinte optique, la recherche d’une lésion carieuse, l’évaluation de la malignité d’une lésion de la muqueuse buccale, etc. Ces éléments peuvent permettre de faire gagner du temps aux praticiens ou d’aider à effectuer un diagnostic en cas de doute, mais ne sont pas encore suffisants pour améliorer significativement la prise en charge des patients. Davantage de travaux de recherche sont nécessaires pour que les algorithmes puissent construire des raisonnements complexes à partir d’un plus grand nombre d’éléments pour accompagner le praticien dans ses décisions thérapeutiques. Par exemple, l’interprétation d’une imagerie pourrait être associée à l’analyse des facteurs de risques spécifiques au patient, à partir de la lecture du dossier médical et des précédents examens.
L’enjeu de l’information des patients
En France, l’article L. 4001-3 du code de la santé publique stipule que « Le professionnel de santé qui décide d’utiliser, pour un acte de prévention, de diagnostic ou de soin, un dispositif médical comportant un traitement de données algorithmique dont l’apprentissage a été réalisé à partir de données massives s’assure que la personne concernée en a été informée et qu’elle est, le cas échéant, avertie de l’interprétation qui en résulte ». Ces dispositions réglementaires clarifient l’obligation d’informer le patient et d’obtenir son consentement libre et éclairé lors de l’utilisation d’algorithmes d’IA. Les preuves cliniques de l’efficacité des algorithmes devront permettre de présenter en toute transparence aux patients ces outils comme une aide pour les praticiens.
L’enjeu du développement durable
Un aspect important, qui a jusqu’à présent reçu peu d’attention, est l’association entre l’intelligence artificielle et le développement d’une odontologie durable, que ce soit dans les décisions en lien avec les soins, mais aussi pour promouvoir des solutions d’IA durables [6, 22]. Cette dynamique est le fruit des nombreuses préoccupations entourant l’odontologie, dont l’impact environnemental est même qualifié « d’actuellement non soutenable » par certains auteurs [23, 24]. Des questions comme le coût carbone des algorithmes, la création d’inégalités liées aux coûts des logiciels, ou encore le gâchis découlant de l’absence d’approche collaborative, sont autant de questions dont notre communauté doit s’emparer pour construire une IA forte, durable et équitable. Ce constat explique que certains auteurs proposent de passer dès maintenant à l’action en intégrant l’IA dans le curriculum de formation en odontologie. L’objectif étant d’améliorer la santé orale en 2030, comme suggéré par l’Organisation mondiale de la santé (OMS) [25].
L’enjeu de la formation des praticiens
Afin de pouvoir comprendre le processus de prise de décision des algorithmes d’IA et rester critiques face aux solutions techniques proposées, les praticiens doivent développer de nouvelles compétences [21]. La création d’unités d’enseignements, que ce soit en formation initiale ou en formation continue, apparaît nécessaire et urgente pour que les praticiens évaluent les algorithmes d’IA de façon éclairée et puissent s’équiper de solutions robustes. Ces enseignements devraient au minimum inclure les grandes lignes du fonctionnement des différents algorithmes d’IA et des explications sur la construction et la validation d’un algorithme d’IA. En France, le quatrième programme d’investissement d’avenir (PIA)5 prévoit dans son volet « santé numérique » de « donner à tous les professionnels de santé et médico-sociaux une formation en santé numérique ». Ces programmes de formations sont en cours d’élaboration au sein des universités, et devraient pouvoir prochainement être proposés.
Conclusion
L’intelligence artificielle se développe rapidement dans notre discipline, et il est important de comprendre que ces nouveaux outils vont faire progressivement évoluer nos pratiques professionnelles, que ce soit lors de nos prises de décisions ou, par exemple, lorsque nous communiquons avec les patients.
Face à ce changement, nous avons la possibilité de le refuser, au risque de se marginaliser, de l’accepter de manière euphorique, au risque de faire preuve de sur-confiance, ou alors d’essayer d’apprendre à comprendre et à évaluer ces outils, avec la justesse et la réflexivité dont nous avons l’habitude de faire preuve dans notre métier.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
En apposant le marquage CE sur un produit, le fabricant déclare sous sa seule responsabilité que le produit est conforme aux exigences essentielles de la législation d’harmonisation de l’Union applicable prévoyant son apposition et que les procédures pertinentes d’évaluation de la conformité ont été respectées.
Références
- LeCun Y, Bengio Y, Hinton G. Deep learning. Nature 2015 ; 521 : 436–444. [Google Scholar]
- Topol EJ. High-performance medicine: the convergence of human and artificial intelligence. Nat Med 2019 ; 25 : 44–56. [CrossRef] [PubMed] [Google Scholar]
- Esteva A, Kuprel B, Novoa RA, et al. Dermatologist-level classification of skin cancer with deep neural networks. Nature 2017 ; 542 : 115–118. [Google Scholar]
- Keski-Filppula T, Nikki M, Haapea M, et al. Using artificial intelligence to detect chest X-rays with no significant findings in a primary health care setting in Oulu, Finland. 2022; https://doi.org/10.48550/arXiv.2205.08123. [Google Scholar]
- Schwendicke F, Krois J. Data Dentistry: How Data Are Changing Clinical Care and Research. J Dent Res 2022; 101 : 21–9. [CrossRef] [PubMed] [Google Scholar]
- Mörch CM, Atsu S, Cai W, et al. Artificial Intelligence and Ethics in Dentistry: A Scoping Review. J Dent Res 2021; 100 : 1452–60. [CrossRef] [PubMed] [Google Scholar]
- Schwendicke F, Chaurasia A, Arsiwala L, et al. Deep learning for cephalometric landmark detection: systematic review and meta-analysis. Clin Oral Invest 2021; 25 : 4299–309. [CrossRef] [PubMed] [Google Scholar]
- Dot G, Schouman T, Dubois G, et al. Fully automatic segmentation of craniomaxillofacial CT scans for computer-assisted orthognathic surgery planning using the nnU-Net framework. Eur Radiol 2022; 32 : 3639–48. [CrossRef] [PubMed] [Google Scholar]
- Dot G, Schouman T, Chang S, et al. Automatic 3-Dimensional Cephalometric Landmarking via Deep Learning. J Dent Res 2022; 101 : 1380–7. [CrossRef] [PubMed] [Google Scholar]
- Hao J, Liao W, Zhang YL, et al. Toward Clinically Applicable 3-Dimensional Tooth Segmentation via Deep Learning. J Dent Res 2022; 101 : 304–11. [CrossRef] [PubMed] [Google Scholar]
- Kühnisch J, Meyer O, Hesenius M, et al. Caries Detection on Intraoral Images Using Artificial Intelligence. J Dent Res 2022; 101 : 158–65. [CrossRef] [PubMed] [Google Scholar]
- Schwendicke F, Golla T, Dreher M, et al. Convolutional neural networks for dental image diagnostics: A scoping review. J Dent 2019 ; 91 : 103226. [CrossRef] [PubMed] [Google Scholar]
- Chen Q, Zhou X, Wu J, et al. Structuring electronic dental records through deep learning for a clinical decision support system. Health Informatics J 2021; 27 : 1460458220980036. [CrossRef] [Google Scholar]
- Rischke R, Schneider L, Müller K, et al. Federated Learning in Dentistry: Chances and Challenges. J Dent Res 2022; 101 : 1269–73. [CrossRef] [PubMed] [Google Scholar]
- Schwendicke F, Cejudo Grano de Oro J, Garcia Cantu A, et al. Artificial Intelligence for Caries Detection: Value of Data and Information. J Dent Res 2022; 101 : 1350–1356. [CrossRef] [PubMed] [Google Scholar]
- Schwendicke F, Singh T, Lee J-H, et al. Artificial intelligence in dental research: Checklist for authors, reviewers, readers. J Dent 2021; 107 : 103610. [CrossRef] [PubMed] [Google Scholar]
- Schwendicke F, Samek W, Krois J. Artificial Intelligence in Dentistry: Chances and Challenges. J Dent Res 2020; 99 : 769–74. [CrossRef] [PubMed] [Google Scholar]
- Muehlematter UJ, Daniore P, Vokinger KN. Approval of artificial intelligence and machine learning-based medical devices in the USA and Europe (2015–20): a comparative analysis. Lancet Digital Health 2021; 3 : e195–e203. [CrossRef] [Google Scholar]
- Ma J, Schneider L, Lapuschkin S, et al. Towards Trustworthy AI in Dentistry. J Dent Res 2022; 101 : 1263–8. [CrossRef] [PubMed] [Google Scholar]
- Gaube S, Suresh H, Raue M, et al. Do as AI say: susceptibility in deployment of clinical decision-aids. npj Digit Med 2021; 4 : 31. [CrossRef] [PubMed] [Google Scholar]
- Ducret M, Mörch C, Richert R, et al. Intelligence artificielle en médecine orale : comprendre les enjeux éthiques et juridiques pour mieux s’y préparer. L’ Information dentaire 2022; 48–53. [Google Scholar]
- Maddahi Y, Kalvandi M, Langman S, et al. RoboEthics in COVID-19: A Case Study in Dentistry. Front Robot AI 2021; 8 : 612740. [CrossRef] [PubMed] [Google Scholar]
- Mulligan S, Smith L, Martin N. Sustainable oral healthcare and the environment: challenges. Dent Update 2021; 48 : 493–501. [CrossRef] [Google Scholar]
- Martin N, Smith L, Mulligan S. Sustainable oral healthcare and the environment: mitigation strategies. Dent Update 2021; 48 : 524–31. [CrossRef] [Google Scholar]
- Hsu L-P, Huang Y-K, Chang Y-C. The implementation of artificial intelligence in dentistry could enhance environmental sustainability. J Dent Sci 2022; 17 : 1081–2. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Exemples d’utilisation d’algorithmes d’intelligence artificielle fondés sur la vision par ordinateur pour l’automatisation du traitement des imageries. A. Scanner dento-maxillo-facial initial ; B. Automatisation de la reconstruction des tissus durs et de l’analyse céphalométrique tridimensionnelle à partir de méthodes fondées sur l’IA (d’après [8, 9]). |
| Dans le texte | |
 |
Figure 2. Représentation schématique de l’entraînement fédéré sur plusieurs sites d’un algorithme d’intelligence artificielle. Les données restent internes au sein de chaque site, seul le modèle entraîné est partagé afin d’obtenir un algorithme final utilisable par tous les sites. |
| Dans le texte | |
 |
Figure 3. Exemple d’évaluation d’algorithmes d’intelligence artificielle. A. Localisation automatique de points céphalométriques tridimensionnels, annotation manuelle (en rouge) et automatisée (en bleu) avec la méthode décrite dans [9]. B. et C. Segmentation des tissus minéralisés d’une troisième molaire à partir d’une radiographie panoramique, annotation manuelle (en rouge) et automatique (en vert), à partir d’un réseau d’apprentissage profond entraîné sur 500 radiographies. |
| Dans le texte | |
 |
Figure 4. Visualisation des zones importantes à la décision d’un algorithme d’IA qui devait initialement localiser des informations au niveau des troisièmes molaires sur des radiographies panoramiques. Il est ainsi possible de savoir si l’algorithme s’intéresse aux bonnes zones de l’image (A) ou s’il est perturbé par des artéfacts (B). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




