| Issue |
Med Sci (Paris)
Volume 39, Number 3, Mars 2023
Néphrologie pédiatrique : de grandes avancées et un futur rempli d’espoir
|
|
|---|---|---|
| Page(s) | 271 - 280 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023034 | |
| Published online | 21 March 2023 | |
Évolution vers l’insuffisance rénale chronique et traitement
Maladie rénale chronique et retard de croissance
Indication et efficacité du traitement par l’hormone de croissance
Chronic kidney disease and growth failure: Efficacy of growth hormone treatment
Pédiatrie 1, CHU de Hautepierre, Hôpitaux universitaires de Strasbourg, 67000 Strasbourg, France
* ariane.zaloszyc@chru-strasbourg.fr
Le retard de croissance est une des complications les plus fréquentes chez l’enfant présentant une maladie rénale chronique. Il est corrélé à une morbi-mortalité importante, augmentée par les désordres métaboliques qui y sont associés. D’origine multifactorielle, une hypothèse régulièrement avancée est celle d’une résistance à l’hormone de croissance (GH), caractérisée par un déficit en IGF1 (insulin-like growth factor 1). L’obtention d’une croissance staturale satisfaisante reste un défi majeur pour les néphropédiatres. La prise en charge du retard statural comprend différents axes thérapeutiques : une nutrition adaptée aux besoins de l’enfant, une correction des troubles métaboliques avec optimisation de la dialyse, et un traitement par hormone de croissance recombinante à dose supra-physiologique, qui permet de lever la résistance.
Abstract
Growth failure is a frequent complication observed in children with chronic kidney disease (CKD) and correlated to increased morbidity and mortality. To achieve a normal growth in children with CKD remains challenging for pediatric nephrologists. Growth failure in the setting of pediatric CKD is multifactorial and related to an impaired sensitivity to growth hormone and to a deficiency of IGF1 (insulin-like growth factor 1).
Growth failure management has improved during the last two decades and consists of correcting any nutritional and metabolic abnormalities, of an improvement of dialysis for children on end-stage renal disease, and of an administration of a supraphysiologic dose of recombinant growth hormone to overcome GH insensitivity.
This article summarizes the causes, outcomes and assessment tools of growth in children with CKD as well as the management of recombinant growth hormone.
© 2023 médecine/sciences – Inserm
Vignette (© iStock).
Le retard de croissance (RC) reste fréquent dans la maladie rénale chronique (MRC) et peut engendrer une petite taille à l’âge adulte (inférieure à – 2 déviations standards [DS] sur les courbes de référence). Le déficit statural et les désordres métaboliques associés sont corrélés à une augmentation de morbi-mortalité [1–3]. Le RC est d’autant plus important que l’insuffisance rénale est sévère et que son âge d’apparition est précoce. Ainsi, une insuffisance rénale terminale précoce et une durée prolongée en dialyse avant transplantation aggravent le RC [4]. Le lien étroit entre la MRC de l’enfant et le RC est connu depuis de nombreuses décennies. On en retrouve, en effet, une première description en 1897 suivie, quelques années plus tard, d’autres publications qui décrivent le « nanisme rénal » [5, 6]. Les premières études rapportant l’utilisation de l’hormone de croissance recombinante (rhGH) dans cette indication datent, quant à elles, de plus de 30 ans [7, 8].
Physiopathologie
Plusieurs facteurs sont à l’origine du retard de croissance lié à la MRC et sont souvent intriqués (Figure 1). Ils retentissent sur le fonctionnement de l’axe somatotrope et doivent être pris en charge de manière adaptée par une équipe pluridisciplinaire. Le retard de croissance intra-utérin (RCIU), plus fréquent chez l’enfant présentant une MRC, et une atteinte rénale dans un cadre syndromique, peuvent aussi l’aggraver [9]. La taille génétique cible (taille des parents) est évidemment un élément modulateur de la taille finale.
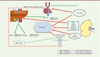 |
Figure 1. Physiopathologie du retard de croissance accompagnant une insuffisance rénale chronique. En cas de MRC, le retard de croissance (RC) est d’origine multifactorielle. Les anomalies métaboliques liées à la MRC influent sur le fonctionnement de l’axe somatotrope, entraînant une résistance ou une insensibilité tissulaire à l’hormone de croissance (GH), notamment au niveau du foie, par diminution du nombre de récepteurs et probablement par diminution de la signalisation qui suit l’activation de ces derniers. Il en résulte une réduction de la production d’IGF1. La quantité d’IGF1 libre, donc capable de fixer son récepteur, diminue également en raison de l’augmentation de la production de certaines protéines de liaison (IGFBP) qui le fixent et diminuent sa biodisponibilité. Cela entraîne, au niveau hypothalamo-hypophysaire, une réduction du rétrocontrôle exercé par l’IGF1, expliquant les taux normaux ou élevés de GH habituellement observés. D’autres facteurs comme le retard de croissance intra-utérin (RCIU), le potentiel génétique ou certaines thérapies, comme les corticoïdes (qui ont un rôle négatif sur la production de GH et le cartilage de croissance) peuvent contribuer au RC. MRC : maladie rénale chronique ; hyperPTH : hyperparathyroïdie. |
Anomalies hormonales
Perturbations de l’axe GH/IGF1
L’hormone de croissance (GH) est une protéine dont le rôle anabolisant favorise la synthèse de protéines, la néoglucogenèse et le métabolisme des lipides. Son action sur la croissance est directe, en stimulant la différenciation des pré-chondrocytes, mais surtout indirecte, relayée par l’IGF1 (insulin-like growth factor 1) qui stimule la prolifération des chondrocytes, l’hyperplasie des ostéoblastes, le remodelage et la minéralisation osseux. L’origine de la quasi totalité de la production d’IGF1 circulant est hépatique, mais il existe également une production autocrine et paracrine au niveau du cartilage de croissance [10]. Lors de la MRC, le retard de croissance n’est pas lié à un déficit en GH mais à des perturbations du fonctionnement de l’axe somatotrope. La GH est secrétée normalement, mais son récepteur n’est pas suffisamment exprimé au niveau hépatique (ce phénomène pouvant être en partie lié à la dénutrition, notamment protéique) et le signal intracellulaire post-récepteur est perturbé, aboutissant à un phénomène de résistance ou d’insensibilité à la GH [11]. Cela entraîne une diminution de la production d’IGF1, dont les taux sont abaissés ou normaux de façon inappropriée en regard des taux de GH produits [12].
Il existe par ailleurs une diminution de la biodisponibilité de l’IGF1 pour son récepteur tissulaire, due à l’accumulation de certaines protéines de transport, les IGFBP(IGF-binding proteins) 1, 2, 4 et 6, en raison de la diminution de leur clairance et de l’augmentation relative de leur production hépatique [13].
C’est l’association d’une GH normale à un IGF1 dont la biodisponibilité est diminuée qui fait évoquer le concept de résistance à la GH [14, 15].
Perturbations de l’axe gonadotrope
Comme dans toute maladie chronique, le retard pubertaire est fréquent en cas de MRC, avec un décalage du début de la sécrétion pulsatile nocturne de LH (luteinising hormone) qui caractérise le début de la puberté [16]. Ces anomalies de la pulsatilité persistent durant la puberté, particulièrement chez l’enfant dialysé. L’altération du pic de croissance pubertaire (début et amplitude) peut ainsi avoir un impact négatif sur la taille finale à l’âge adulte (Figures 2 et 3).
Répercutions nutritionnelles et métaboliques de la MRC
Dénutrition
La MRC conduit fréquemment à un état de dénutrition protéino-énergétique qui a un impact négatif majeur sur la croissance des enfants. Plusieurs études ont montré que les apports nutritionnels spontanés des enfants présentant une MRC sont insuffisants, ce qui peut également contribuer à une diminution de la synthèse de l’IGF1 [13]. Un support nutritionnel doit alors être instauré, parfois une nutrition entérale par sonde nasogastrique ou par gastrostomie1, afin de pourvoir aux apports nutritionnels recommandés pour l’âge, et pour compenser les pertes dialytiques.
Ostéodystrophie rénale et anémie
La MRC conduit à un défaut d’homéostasie du calcium, des phosphates, de l’hormone parathyroïdienne (PTH) et de la vitamine D, à l’origine d’une hyperparathyroïdie secondaire, d’anomalies osseuses et d’anomalies de croissance, et de la présence de calcifications extra-squelettiques vasculaires ou d’autres tissus mous. La MRC est aussi à l’origine d’une anémie qui peut aggraver le RC. Les valeurs de PTH, de vitamine D et d’hémoglobine doivent être corrigées et maintenues dans les normes proposées par les recommandations KDIGO (Kidney Disease: Improving Global Outcomes) [17].
Troubles du métabolisme hydrique et électrolytique
L’acidose métabolique est présente chez la moitié des enfants ayant une MRC de stade 3 à 52 et doit être corrigée lorsque les concentrations de bicarbonates sont inférieures à 22 mmol/l [18]. Elle favorise la dégradation des protéines, la sécrétion endogène de corticoïdes et la résistance à la GH [19]. Les enfants présentant une tubulopathie avec perte de sel et d’eau ont un RC particulièrement important ; une supplémentation hydrique et sodée doit donc être systématique [20].
Croissance et taille finale dans la MRC
Les progrès dans la compréhension des mécanismes physiopathologiques du RC secondaire à la MRC et dans sa prise en charge ont permis une amélioration globale du pronostic de la taille des patients : selon le registre européen, la taille finale des patients qui était de – 2,06 SDS (standard deviation score) en 1990-1995, n’était plus que de – 1,33 SDS en 2006-2011 [2]. Néanmoins, 40 % des patients ayant eu recours à un traitement de suppléance rénale dans l’enfance restent de petite taille. Le retard de croissance s’aggrave avec le degré de la MRC et est maximal pour les patients en dialyse [1, 2, 21]. Le retard de croissance témoigne d’une prise en charge non optimale et peut être le reflet d’un état de santé plus précaire chez ces enfants. Il est corrélé à la morbi-mortalité des patients, à une augmentation du nombre d’hospitalisations et du nombre de jours manqués à l’école [1, 22, 23].
Plus d’un tiers des patients interrogés ne sont pas satisfaits de leur taille finale et une petite taille à l’âge adulte a un impact notable, tant en termes de qualité de vie, que d’estime de soi chez les patients présentant une MRC, comme cela est également le cas dans la population générale [24, 25]. Une petite taille a également été associée à une moins bonne intégration socioprofessionnelle chez ces patients [26]. Il est donc impératif d’optimiser la prise en charge du retard de croissance, ce qui, outre une correction métabolique et une nutrition appropriées, repose aussi sur une prescription adéquate de rhGH.
Hormone de croissance et MRC
Efficacité et population concernée
L’efficacité et l’innocuité du traitement par la rhGH ont été clairement démontrées pour les patients insuffisants rénaux à différents stades. Drube et al., après analyse de 18 études, considèrent que son utilisation pendant une période minimale de deux ans conduit à un gain de taille médian à l’âge adulte de 1,1 DS, soit 7 cm pour les filles et 7,4 cm pour les garçons [20], grâce à une accélération de la vitesse de croissance chez les garçons et chez les filles, comme cela est représenté dans la Figure 2 .
 |
Figure 2. Vitesse de croissance. Courbes représentant la vitesse de croissance des garçons (A) et des filles (B), présentant une insuffisance rénale chronique (IRC) avec (en rouge) ou sans (en bleue) prescription d’hormone de croissance recombinante (rGH). Chaque courbe est comparée à la vitesse de croissance d’un individu sain (en noir). On remarque d’abord le ralentissement progressif de la vitesse de croissance chez les enfants présentant une maladie rénale chronique, puis une accélération de la vitesse de croissance au moment du traitement par la rGH, quel que soit le sexe. À noter que le traitement par rGH n’empêche pas le pic de croissance pubertaire physiologique. |
L’efficacité de la rhGH chez les patients insuffisants rénaux de stade 3 à 5 pré-pubères (soit avant traitement de suppléance) a été démontrée aussi bien dans des études observationnelles que dans des essais randomisés, ainsi que dans une méta-analyse regroupant 809 enfants [27–29]. Le rattrapage statural est maximal lors des deux premières années mais il s’étend également au-delà, ce qui permet d’obtenir une augmentation de taille de 1,1 à 1,9 DS en 5 à 6 ans [20, 30–32], comme cela est illustré dans la Figure 3 qui représente le gain de croissance observé chez deux enfants ayant une insuffisance rénale de stade 4.
 |
Figure 3. Courbes de croissance. Courbes représentant la croissance d’individus garçons (A) et filles (B) présentant une insuffisance rénale chronique (IRC) avant et après prescription d’hormone de croissance recombinante (GH). Remarquons le gain quasi immédiat de la taille avec le changement de couloir après la mise sous hormone de croissance recombinante. HD : hémodialyse ; dgc IRC : diagnostic d’IRC. |
Pour les enfants en dialyse, le traitement par la rhGH a aussi montré un bénéfice, bien que la réponse au traitement semble atténuée [20, 30–32]. La croissance et la réponse au traitement par la rhGH peuvent néanmoins être améliorées par une intensification de la dialyse [33].
Après transplantation, la vitesse de croissance peut continuer à être altérée si la fonction rénale n’est pas redevenue satisfaisante. Cette situation est aggravée par le traitement par les corticoïdes, qui ont un impact négatif sur l’axe GH/IGF. Les schémas d’épargne cortisoniques permettent d’améliorer le pronostic de taille [34]. La taille au moment de la transplantation est un élément pronostique pour la taille à l’âge adulte puisque le rattrapage de croissance est rare après transplantation. Ce rattrapage reste néanmoins plus probable chez les plus jeunes enfants et chez les enfants présentant un retard de croissance plus important au départ [23]. Chez les patients transplantés, le traitement par la rhGH permet d’améliorer la croissance sans qu’il n’ait été observé d’augmentation de perte de fonction du greffon ou de rejet [29, 32, 35]. Bien qu’il n’y ait pas d’autorisation de mise sur le marché (AMM) dans cette indication en France, l’initiation de la rhGH est à considérer pour les enfants qui n’ont pas de rattrapage statural au moins un an après la transplantation rénale, malgré la diminution des corticoïdes, ou lorsque les corticoïdes ne peuvent pas être diminués, particulièrement chez les enfants avec une fonction rénale post-greffe inférieure à 50 ml/min/1,73 m2 [20].
Pour les nourrissons, le retard statural est souvent lié à un apport nutritionnel inadéquat. Plusieurs études ont montré un bénéfice à traiter par rhGH les nourrissons avec un apport nutritionnel adapté si un ralentissement de la vitesse de croissance persiste [36–38]. Des résultats controversés sur la croissance ont été rapportés pour les patients traités après le début de la puberté [39–41].
Le traitement par la rhGH est indiqué depuis de nombreuses années dans la MRC de l’enfant [42, 43]. Néanmoins, force est de constater une sous-utilisation de ce traitement : dans une population d’enfants suivis dans le cadre d’une MRC en Europe, seuls 15 % des enfants présentant un retard de croissance bénéficiaient d’un traitement par la rhGH [4]. Ce faible taux de recours au traitement par la rhGH est retrouvé dans d’autres études concernant des patients en dialyse ou transplantés, en Europe comme aux États-Unis [42, 44]. Les politiques de prescription et de remboursement diffèrent d’un pays à l’autre, y compris en Europe, ce qui explique probablement en partie les variations d’utilisation de la rhGH et de taille finale des enfants ayant une MRC observées entre les pays [45].
D’autres freins à la prescription de la rhGH peuvent être évoqués, comme ceux révélés par une étude rétrospective multicentrique dans laquelle 50 % des enfants ayant une MRC avec une taille requérant le traitement ne recevaient cependant pas de rhGH ; pour 25 % d’entre eux, aucune raison n’était donnée ; pour les 75 % restants, les principales causes invoquées étaient le refus parental, l’hyperparathyroïdie et la non observance du traitement [46].
Des recommandations européennes récentes ont clarifié les indications et les modalités de prescription du traitement par la rhGH, ce qui pourrait permettre un meilleur accès au traitement pour les patients dans les années à venir [20].
Évaluation de l’indication d’un traitement par la rhGH
Dépistage du retard de croissance
La croissance connaît deux périodes rapides : de la naissance à l’âge de quatre ans, avec un gain particulièrement important la première année de vie, puis au cours de la puberté. Tout état de dénutrition ou de perte de croissance pendant ces périodes aura donc un impact particulièrement important sur la taille finale. La première étape de la prise en charge du retard de croissance consiste en une évaluation régulière de la croissance staturale de l’enfant. Cette évaluation doit être réalisée d’autant plus fréquemment que l’enfant est jeune et que son insuffisance rénale est sévère (de bimensuel à trimestriel) [22]. Tous les paramètres anthropométriques (le poids, la taille, mesurée couché avant deux ans et debout après deux ans, le périmètre crânien, l’indice de masse corporelle) doivent être placés sur des courbes de référence à jour afin d’estimer les DS correspondant à l’âge de l’enfant. En France, les courbes actualisées dans le carnet de santé en 2018 (courbes de croissance AFPA-CRESS/Inserm) sont la référence chez l’enfant sain.
Un autre paramètre crucial est le suivi de la vitesse de croissance sur six mois, qui permet de mieux évaluer la dynamique de croissance. Des courbes de références (courbes de croissance de Sempé [47]) permettent d’évaluer précisément ce paramètre, variable en fonction de l’âge et du sexe.
Le calcul de la taille cible3 ainsi que la détermination de l’âge osseux par la radiographie du poignet gauche de face, en utilisant l’atlas de Greulich et Pyle4 ou une lecture automatisée, permettent de renseigner sur le potentiel de croissance de l’enfant.
Poser l’indication du traitement par la rhGH
Un groupe de travail composé de néphropédiatres européens experts s’est constitué afin de définir les modalités d’application du traitement par la rhGH. Il indique que le traitement doit être réfléchi et discuté avec chaque patient et ses parents et que son indication est à évaluer tout particulièrement pour les patients dans des situations de polyhandicap [20]. Il recommande d’initier le traitement après avoir traité les autres facteurs contribuant au retard de croissance :
-
pour les patients âgés de plus de six mois ayant une MRC avec une clairance inférieure à 60 ml/min/1,73 m2 (sauf en cas de cystinose5 : le traitement peut alors être initié à des stades plus précoces d’insuffisance rénale),
-
pour les patients ayant une taille inférieure au 3e percentile, ou un ralentissement persistant de la vitesse de croissance en dessous du 25e percentile au-delà de trois mois pour les nourrissons et au-delà de six mois pour les enfants plus âgés.
-
pour les patients ayant une taille comprise entre les 10e et le 3e percentile, la surveillance de la croissance doit être intensifiée, et un traitement par la rhGH discuté, si la vitesse de croissance reste altérée (en dessous du 25e percentile) malgré le traitement des autres facteurs de risque.
Le traitement par la rhGH n’est pas indiqué chez les patients ayant déjà terminé leur croissance (épiphyses déjà fusionnées), en cas d’hyperparathyroïdie non contrôlée, de rétinopathie diabétique, de maladie maligne active, ou d’allergie connue (très rare), la première année après la transplantation rénale ou en cas de maladie aiguë grave.
En France, l’AMM est plus restrictive. Les critères pour débuter un traitement par la rhGH sont :
-
une taille inférieure ou égale à – 2 DS, selon les données de référence françaises,
-
une vitesse de croissance de moins de 2 cm par an dans les deux dernières années,
-
un âge chronologique supérieur à deux ans,
-
un âge osseux de moins de onze ans chez la fille et moins de treize ans chez le garçon,
-
des enfants prépubères ou en début de puberté (volume testiculaire inférieur à 10 ml ou stade de développement mammaire inférieur ou égal à S36)
-
sous traitement symptomatique de la MRC depuis au moins un an.
Avant de débuter le traitement, il est important de discuter avec l’enfant et sa famille des bénéfices attendus (normalisation de la vitesse de croissance, de la taille, amélioration du pronostic de taille adulte), en prenant en compte le contexte spécifique de l’enfant (potentiel génétique, taille de naissance, maladie rénale sous-jacente et son évolution, retard statural au moment de l’instauration du traitement). L’examen clinique permettra de coter le stade pubertaire selon la classification de Tanner6. Une radiographie du poignet gauche sera pratiquée pour déterminer l’âge osseux et s’assurer que, sous traitement, le potentiel de croissance reste correct.
Outre le bilan biologique, nécessaire à l’évaluation de la fonction rénale, de l’état nutritionnel et du contrôle métabolique et osseux de la MRC, il est indispensable de doser la TSH (thyroid-stimulating hormone) et la T4L (thyroxine libre), en particulier en cas de syndrome néphrotique, pour ne pas méconnaître une hypothyroïdie pouvant, par elle-même, contribuer à l’altération de la croissance. L’évaluation du taux de base de l’IGF1 chez le patient avant traitement donnera une valeur de référence, surtout utile au suivi sous traitement. Les taux d’IGF1 sont à interpréter selon l’âge, le sexe et le stade pubertaire, et en fonction du kit de dosage utilisé.
Amorce et surveillance du traitement par rhGH
La rhGH biosynthétique (ou somatropine recombinante) est produite par la bactérie Escherichia coli ou par des cellules de mammifères depuis la fin des années 1980. Il existe six compagnies dans le monde fournissant une rhGH synthétique ayant reçu une AMM depuis la fin des années 1990, pour la MRC de l’enfant et de l’adolescent (Tableau I). Seul l’Omnitrope® a le statut de médicament biosimilaire : aucune différence d’efficacité ou de sécurité n’a été mise en évidence avec les autres produits disponibles. Le choix sera donc fonction des caractéristiques du produit (reconstitution, stylo jetable ou cartouches, conservation, maniabilité du dispositif d’injection, etc.) et sera discuté avec la famille.
Les différentes hormones de croissance disponibles.
Les injections par voie sous-cutanée sont faites par les parents et/ou l’enfant, à partir de l’âge de huit-dix ans s’il le souhaite, après une formation spécifique (équipe de soin ou programme d’éducation thérapeutique à domicile via un prestataire proposé par certains laboratoires). Elles sont réalisées en fin de journée, mais sans horaire fixe strict, pour respecter la physiologie de la sécrétion de l’hormone de croissance.
Les enfants présentant une MRC ayant un état de résistance à l’hormone de croissance, les doses prescrites sont supra-physiologiques, avec une posologie recommandée allant de 0,045 à 0,050 mg/kg/j.
La recherche d’effets secondaires est systématique : céphalées, rétention hydro-sodée, retentissement osseux, intolérance glucidique et, plus spécifiquement dans ce contexte, dégradation de la fonction rénale et rejet de greffe, bien que ce risque ne soit pas démontré. Ils sont rares, similaires à ceux rapportés dans les autres indications de l’hormone, et surviennent généralement rapidement après l’instauration du traitement. Fine et al. ont comparé la survenue d’effets indésirables dans une population d’enfants présentant une MRC avec et sans traitement par la rhGH, sans pouvoir mettre en évidence de différence de fréquence de survenue d’effets indésirables entre les deux groupes [32]. L’hypertension intracrânienne (HTIC) a été exceptionnellement documentée chez des patients traités pour une MRC [48]. En cas de céphalées inhabituelles sous traitement, il est important de l’interrompre et de réaliser un fond d’œil rapidement pour rechercher un œdème papillaire (en théorie, le fond d’œil est recommandé avant le début du traitement, mais cela n’est pas toujours appliqué en pratique courante). Il s’agit le plus souvent d’une HTIC bénigne qui régresse rapidement. En l’absence d’œdème papillaire, le traitement par la rhGH peut être repris à doses plus faibles progressivement croissantes, avec une surveillance rapprochée.
Les complications orthopédiques de type épiphysiolyse ou nécrose de la tête fémorale pourraient être favorisées par l’hyperparathyroïdie associée à la MRC. C’est pourquoi le traitement ne doit pas être instauré si la concentration sanguine d’hormone parathyroïdienne (PTH) est supérieure à 500 pg/ml [17, 20]. Si ce taux augmente au cours du suivi, le traitement par la rhGH doit être interrompu. En cas de boiterie ou de douleur de hanche ou de genou, il convient de faire des radiographies et de prendre un avis spécialisé si nécessaire.
Une intolérance glucidique modérée et transitoire est habituelle au cours du traitement par la rhGH surtout à la puberté, elle-même associée à une augmentation de l’insulino-résistance. Cette intolérance doit être particulièrement recherchée chez les patients présentant déjà un risque de diabète : obésité, dialysés ou transplantés sous glucocorticoïdes et/ou cyclosporine ainsi qu’en cas de cystinose.
Étant donné le rôle de l’hormone de croissance dans la filtration glomérulaire, la fonction rénale a été particulièrement étudiée au cours des protocoles thérapeutiques. À ce jour, il n’y a aucun argument en faveur d’une dégradation de la fonction rénale chez les patients traités, ni d’une augmentation du taux de rejet ou du risque de néoplasie chez les patients transplantés [49]. Le risque d’augmentation de leucémies et de cancers solides (notamment de carcinomes rénaux) secondaires au traitement par la rhGH a en effet été évoqué sans être démontré et les différentes études ne retrouvent pas de surrisque [50].
Il est recommandé de suivre l’efficacité et le retentissement du traitement par un examen clinique et biologique (au minimum, dosage de l’IGF1 et de la PTH) à 3, 6 et 12 mois la première année, puis au minimum tous les six mois. Le critère principal est évidemment l’accélération de la vitesse de croissance, qui est maximale la première année du traitement, et représente un facteur pronostique de bons résultats à plus long terme. Si l’augmentation de la vitesse n’est pas supérieure à 2 cm par rapport à la vitesse avant traitement, il est nécessaire de revoir la conduite du traitement (observance, dose, taux d’IGF1 et de PTH) et de refaire le point sur le traitement de la MRC. Le traitement sera arrêté en cas :
-
d’inefficacité du traitement malgré sa bonne conduite après au moins six mois,
-
de vitesse de croissance inférieure à 3 cm par an sous traitement, quel que soit l’âge,
-
de soudure des épiphyses sur les radiographies,
-
de transplantation rénale.
Conclusion
La petite taille reste une séquelle fréquente de la MRC et est liée à une augmentation de la morbi-mortalité. Sa prise en charge est essentielle et implique la correction des désordres métaboliques, de l’état nutritionnel et l’utilisation adéquate de la rhGh. Malgré le rôle démontré de la rhGh dans l’amélioration du pronostic de taille des enfants insuffisants rénaux, celle-ci reste sous-utilisée. Il convient donc de bien connaître ses indications et son utilisation pour permettre d’offrir une prise en charge optimisée du retard de croissance dans la MRC.
Liens d’intérêt
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Wong CS, Gipson DS, Gillen DL, et al. Anthropometric measures and risk of death in children with end-stage renal disease. Am J Kidney Dis 2000 ; 36 : 811–819. [CrossRef] [PubMed] [Google Scholar]
- Harambat J, Bonthuis M, van Stralen KJ, et al. Adult height in patients with advanced CKD requiring renal replacement therapy during childhood. Clin J Am Soc Nephrol 2014 ; 9 : 92–99. [CrossRef] [PubMed] [Google Scholar]
- Franke D, Winkel S, Gellermann J, et al. Growth and maturation improvement in children on renal replacement therapy over the past 20 years. Pediatr Nephrol 2013 ; 28 : 2043–2051. [CrossRef] [PubMed] [Google Scholar]
- Behnisch R, Kirchner M, Anarat A, et al. Determinants of Statural Growth in European Children With Chronic Kidney Disease: Findings From the Cardiovascular Comorbidity in Children With Chronic Kidney Disease (4C) Study. Front Pediatr 2019 ; 7 : 278. [CrossRef] [PubMed] [Google Scholar]
- Fletcher HM. Infantilism with Polyuria and Chronic Renal Disease. Proc R Soc Med 1911 ; 4 : 95. [PubMed] [Google Scholar]
- Paterson DH. Three Cases of Renal Dwarfism associated with Curious Bony Changes. Proc R Soc Med 1920 ; 13 : 107–118. [PubMed] [Google Scholar]
- Broyer M. Growth hormone and delayed growth in the chronic renal insufficiency child. Nephrologie 1990 ; 11 : 247. [PubMed] [Google Scholar]
- Tonshoff B, Mehls O, Heinrich U, et al. Growth-stimulating effects of recombinant human growth hormone in children with end-stage renal disease. J Pediatr 1990 ; 116 : 561–566. [CrossRef] [PubMed] [Google Scholar]
- Greenbaum LA, Munoz A, Schneider MF, et al. The association between abnormal birth history and growth in children with CKD. Clin J Am Soc Nephrol 2011 ; 6 : 14–21. [CrossRef] [PubMed] [Google Scholar]
- Ohlsson C, Bengtsson BA, Isaksson OG, et al. Growth hormone and bone. Endocr Rev 1998 ; 19 : 55–79. [PubMed] [Google Scholar]
- Brown DD, Dauber A. Growth Hormone and Insulin-Like Growth Factor Dysregulation in Pediatric Chronic Kidney Disease. Horm Res Paediatr 2021; 94 : 105–14. [CrossRef] [PubMed] [Google Scholar]
- Hokken-Koelega AC, Hackeng WH, Stijnen T, et al. Twenty-four-hour plasma growth hormone (GH) profiles, urinary GH excretion, and plasma insulin-like growth factor-I and -II levels in prepubertal children with chronic renal insufficiency and severe growth retardation. J Clin Endocrinol Metab 1990 ; 71 : 688–695. [CrossRef] [PubMed] [Google Scholar]
- Hartung EA, Furth SL. Growth in children on renal replacement therapy: a shrinking problem?. Pediatr Nephrol 2013 ; 28 : 1905–1908. [CrossRef] [PubMed] [Google Scholar]
- Haffner D, Schaefer F, Girard J, et al. Metabolic clearance of recombinant human growth hormone in health and chronic renal failure. J Clin Invest 1994 ; 93 : 1163–1171. [CrossRef] [PubMed] [Google Scholar]
- Tonshoff B, Blum WF, Wingen AM, Mehls O. Serum insulin-like growth factors (IGFs) and IGF binding proteins 1, 2, and 3 in children with chronic renal failure: relationship to height and glomerular filtration rate. The European Study Group for Nutritional Treatment of Chronic Renal Failure in Childhood. J Clin Endocrinol Metab 1995 ; 80 : 2684–2691. [PubMed] [Google Scholar]
- Giusti M, Perfumo F, Verrina E, et al. Biological activity of luteinizing hormone in uraemic children: spontaneous nocturnal secretion and changes after administration of exogenous pulsatile luteinizing hormone-releasing hormone-preliminary observations. Pediatr Nephrol 1991 ; 5 : 559–565. [CrossRef] [PubMed] [Google Scholar]
- Kidney Disease: Improving Global Outcomes CKDMBDWG. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl 2009 : S1–130. [Google Scholar]
- Harambat J, Kunzmann K, Azukaitis K, et al. Metabolic acidosis is common and associates with disease progression in children with chronic kidney disease. Kidney Int 2017 ; 92 : 1507–1514. [CrossRef] [PubMed] [Google Scholar]
- Mitch WE, Price SR. Mechanisms activating proteolysis to cause muscle atrophy in catabolic conditions. J Ren Nutr 2003 ; 13 : 149–152. [CrossRef] [PubMed] [Google Scholar]
- Drube J, Wan M, Bonthuis M, et al. Clinical practice recommendations for growth hormone treatment in children with chronic kidney disease. Nat Rev Nephrol 2019 ; 15 : 577–589. [CrossRef] [PubMed] [Google Scholar]
- Norman LJ, Coleman JE, Macdonald IA, et al. Nutrition and growth in relation to severity of renal disease in children. Pediatr Nephrol 2000 ; 15 : 259–265. [CrossRef] [PubMed] [Google Scholar]
- Ingulli EG, Mak RH. Growth in children with chronic kidney disease: role of nutrition, growth hormone, dialysis, and steroids. Curr Opin Pediatr 2014 ; 26 : 187–192. [CrossRef] [PubMed] [Google Scholar]
- Fine RN, Martz K, Stablein D. What have 20 years of data from the North American Pediatric Renal Transplant Cooperative Study taught us about growth following renal transplantation in infants, children, and adolescents with end-stage renal disease?. Pediatr Nephrol 2010 ; 25 : 739–746. [CrossRef] [PubMed] [Google Scholar]
- Al-Uzri A, Matheson M, Gipson DS, et al. The impact of short stature on health-related quality of life in children with chronic kidney disease. J Pediatr 2013 ; 163 : 736–41 e1. [CrossRef] [PubMed] [Google Scholar]
- Judge TA, Cable DM. The effect of physical height on workplace success and income: preliminary test of a theoretical model. J Appl Psychol 2004 ; 89 : 428–441. [CrossRef] [PubMed] [Google Scholar]
- Broyer M, Le Bihan C, Charbit M, et al. Long-term social outcome of children after kidney transplantation. Transplantation 2004 ; 77 : 1033–1037. [CrossRef] [PubMed] [Google Scholar]
- Seikaly MG, Waber P, Warady BA, Stablein D. The effect of rhGH on height velocity and BMI in children with CKD: a report of the NAPRTCS registry. Pediatr Nephrol 2009 ; 24 : 1711–1717. [CrossRef] [PubMed] [Google Scholar]
- Powell DR, Liu F, Baker BK, et al. Modulation of growth factors by growth hormone in children with chronic renal failure. The Southwest Pediatric Nephrology Study Group. Kidney Int 1997 ; 51 : 1970–1979. [CrossRef] [PubMed] [Google Scholar]
- Hodson EM, Willis NS, Craig JC. Growth hormone for children with chronic kidney disease. Cochrane Database Syst Rev 2012 : CD003264. [PubMed] [Google Scholar]
- Hokken-Koelega A, Mulder P, De Jong R, et al. Long-term effects of growth hormone treatment on growth and puberty in patients with chronic renal insufficiency. Pediatr Nephrol 2000 ; 14 : 701–706. [CrossRef] [PubMed] [Google Scholar]
- Haffner D, Wuhl E, Schaefer F, et al. Factors predictive of the short- and long-term efficacy of growth hormone treatment in prepubertal children with chronic renal failure. The German Study Group for Growth Hormone Treatment in Chronic Renal Failure. J Am Soc Nephrol 1998 ; 9 : 1899–1907. [CrossRef] [PubMed] [Google Scholar]
- Fine RN, Kohaut E, Brown D, et al. Long-term treatment of growth retarded children with chronic renal insufficiency, with recombinant human growth hormone. Kidney Int 1996 ; 49 : 781–785. [CrossRef] [PubMed] [Google Scholar]
- Fischbach M, Terzic J, Menouer S, et al. Daily on line haemodiafiltration promotes catch-up growth in children on chronic dialysis. Nephrol Dial Transplant 2010 ; 25 : 867–873. [CrossRef] [PubMed] [Google Scholar]
- Zhang H, Zheng Y, Liu L, et al. Steroid Avoidance or Withdrawal Regimens in Paediatric Kidney Transplantation: A Meta-Analysis of Randomised Controlled Trials. PLoS One 2016 ; 11 : e0146523. [CrossRef] [PubMed] [Google Scholar]
- Guest G, Berard E, Crosnier H, et al. Effects of growth hormone in short children after renal transplantation. French Society of Pediatric Nephrology. Pediatr Nephrol 1998 ; 12 : 437–446. [CrossRef] [PubMed] [Google Scholar]
- Santos F, Moreno ML, Neto A, et al. Improvement in growth after 1 year of growth hormone therapy in well-nourished infants with growth retardation secondary to chronic renal failure: results of a multicenter, controlled, randomized, open clinical trial. Clin J Am Soc Nephrol 2010 ; 5 : 1190–1197. [CrossRef] [PubMed] [Google Scholar]
- Mencarelli F, Kiepe D, Leozappa G, et al. Growth hormone treatment started in the first year of life in infants with chronic renal failure. Pediatr Nephrol 2009 ; 24 : 1039–1046. [CrossRef] [PubMed] [Google Scholar]
- Rees L, Azocar M, Borzych D, et al. Growth in very young children undergoing chronic peritoneal dialysis. J Am Soc Nephrol 2011 ; 22 : 2303–2312. [CrossRef] [PubMed] [Google Scholar]
- Haffner D, Schaefer F, Nissel R, et al. Effect of growth hormone treatment on the adult height of children with chronic renal failure. German Study Group for Growth Hormone Treatment in Chronic Renal Failure. N Engl J Med 2000 ; 343 : 923–930. [CrossRef] [PubMed] [Google Scholar]
- Hokken-Koelega AC, Stijnen T, de Ridder MA, et al. Growth hormone treatment in growth-retarded adolescents after renal transplant. Lancet 1994 ; 343 : 1313–1317. [CrossRef] [PubMed] [Google Scholar]
- Gil S, Aziz M, Adragna M, et al. Near-adult height in male kidney transplant recipients started on growth hormone treatment in late puberty. Pediatr Nephrol 2018 ; 33 : 175–180. [CrossRef] [PubMed] [Google Scholar]
- Mahan JD, Warady BA, Consensus C. Assessment and treatment of short stature in pediatric patients with chronic kidney disease: a consensus statement. Pediatr Nephrol 2006 ; 21 : 917–930. [CrossRef] [PubMed] [Google Scholar]
- Group KW. KDOQI Clinical Practice Guideline for Nutrition in Children with CKD: 2008 update. Executive summary. Am J Kidney Dis 2009 ; 53 : S11–104. [Google Scholar]
- Lewis M, Shaw J, Reid C, et al. Growth in children with established renal failure–a Registry analysis (chapter 14). Nephrol Dial Transplant 2007; 22 : vii176–80. [PubMed] [Google Scholar]
- van Huis M, Bonthuis M, Sahpazova E, et al. Considerable variations in growth hormone policy and prescription in paediatric end-stage renal disease across European countries-a report from the ESPN/ERA-EDTA registry. Nephrol Dial Transplant 2016 ; 31 : 609–619. [CrossRef] [PubMed] [Google Scholar]
- Greenbaum LA, Hidalgo G, Chand D, et al. Obstacles to the prescribing of growth hormone in children with chronic kidney disease. Pediatr Nephrol 2008 ; 23 : 1531–1535. [CrossRef] [PubMed] [Google Scholar]
- Sempé M, Pédron G, Roy-Pernot MP. Auxologie méthode et séquences. Paris: Théraplix, 1979. [Google Scholar]
- Noto R, Maneatis T, Frane J, et al. Intracranial hypertension in pediatric patients treated with recombinant human growth hormone: data from 25 years of the Genentech National Cooperative Growth Study. J Pediatr Endocrinol Metab 2011 ; 24 : 627–631. [CrossRef] [PubMed] [Google Scholar]
- Longmore DK, Conwell LS, Burke JR, et al. Post-transplant lymphoproliferative disorder: no relationship to recombinant human growth hormone use in Australian and New Zealand pediatric kidney transplant recipients. Pediatr Transplant 2013 ; 17 : 731–736. [CrossRef] [PubMed] [Google Scholar]
- Nishi Y, Tanaka T. Growth Hormone Treatment and Adverse Events. Pediatr Endocrinol Rev 2017 ; 14 : 235–239. [PubMed] [Google Scholar]
Liste des tableaux
Liste des figures
 |
Figure 1. Physiopathologie du retard de croissance accompagnant une insuffisance rénale chronique. En cas de MRC, le retard de croissance (RC) est d’origine multifactorielle. Les anomalies métaboliques liées à la MRC influent sur le fonctionnement de l’axe somatotrope, entraînant une résistance ou une insensibilité tissulaire à l’hormone de croissance (GH), notamment au niveau du foie, par diminution du nombre de récepteurs et probablement par diminution de la signalisation qui suit l’activation de ces derniers. Il en résulte une réduction de la production d’IGF1. La quantité d’IGF1 libre, donc capable de fixer son récepteur, diminue également en raison de l’augmentation de la production de certaines protéines de liaison (IGFBP) qui le fixent et diminuent sa biodisponibilité. Cela entraîne, au niveau hypothalamo-hypophysaire, une réduction du rétrocontrôle exercé par l’IGF1, expliquant les taux normaux ou élevés de GH habituellement observés. D’autres facteurs comme le retard de croissance intra-utérin (RCIU), le potentiel génétique ou certaines thérapies, comme les corticoïdes (qui ont un rôle négatif sur la production de GH et le cartilage de croissance) peuvent contribuer au RC. MRC : maladie rénale chronique ; hyperPTH : hyperparathyroïdie. |
| Dans le texte | |
 |
Figure 2. Vitesse de croissance. Courbes représentant la vitesse de croissance des garçons (A) et des filles (B), présentant une insuffisance rénale chronique (IRC) avec (en rouge) ou sans (en bleue) prescription d’hormone de croissance recombinante (rGH). Chaque courbe est comparée à la vitesse de croissance d’un individu sain (en noir). On remarque d’abord le ralentissement progressif de la vitesse de croissance chez les enfants présentant une maladie rénale chronique, puis une accélération de la vitesse de croissance au moment du traitement par la rGH, quel que soit le sexe. À noter que le traitement par rGH n’empêche pas le pic de croissance pubertaire physiologique. |
| Dans le texte | |
 |
Figure 3. Courbes de croissance. Courbes représentant la croissance d’individus garçons (A) et filles (B) présentant une insuffisance rénale chronique (IRC) avant et après prescription d’hormone de croissance recombinante (GH). Remarquons le gain quasi immédiat de la taille avec le changement de couloir après la mise sous hormone de croissance recombinante. HD : hémodialyse ; dgc IRC : diagnostic d’IRC. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




