| Issue |
Med Sci (Paris)
Volume 37, Number 12, Décembre 2021
Vésicules extracellulaires
|
|
|---|---|---|
| Page(s) | 1166 - 1168 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2021171 | |
| Published online | 20 December 2021 | |
Réponse antivirale
Rôle de la morphodynamique des mitochondries et de leurs sites de contact avec le réticulum endoplasmique
Role of mitochondrial morphodynamics and contact sites in the antiviral response
1
ENYO Pharma SA, BIOSERRA 1, Bâtiment B, 60 avenue Rockefeller, 69008 Lyon, France
2
Institut Necker-Enfants Malades (INEM), Inserm U1151-CNRS 8253, Université de Paris, 160 rue de Vaugirard, 75015 Paris, France
Les virus sont des agents infectieux intracellulaires obligatoires qui détournent la machinerie des cellules hôtes pour leur propre réplication. L’infection virale contrecarre localement les mécanismes de défense intracellulaires associés à la réponse immunitaire innée, comme le complexe RIG-I (retinoic acid-inducible gene-1) qui, en liaison avec la protéine adaptatrice MAVS (mitochondrial antiviral signaling), est capable d’induire une réponse de type interféron à la suite de la détection d’ARN viral dans le cytosol [1, 2]. La signalisation antivirale associée à RIG-I et MAVS mobilise les membranes mitochondriales ainsi que leurs sites de contact avec le réticulum endoplasmique, des zones d’apposition membranaire dynamiques qui permettent des échanges locaux et la mise en place de complexes multi-protéiques spécialisés [3]. De nombreux virus altèrent le système endomembranaire (appareil de Golgi, autophagie) pour détourner la machinerie cellulaire à leur profit. Dans ce contexte, la dynamique mitochondriale est une cible privilégiée des virus. Certains, comme le cytomégalovirus ou le virus de l’hépatite B, favorisent la fission des mitochondries, alors que d’autres, comme le virus de la dengue, le virus de Sendai, ou certains coronavirus, induisent une hyper-élongation du réseau mitochondrial [4–6].
Les mitochondries contribuent à de nombreuses fonctions cellulaires : homéostasie énergétique, autophagie, équilibre redox (oxydo-réduction), ou encore mort cellulaire programmée [7]. Le contrôle dynamique du réseau mitochondrial, qui détermine le nombre, la taille, et la forme des mitochondries, repose essentiellement sur un équilibre entre fission et fusion, impliquant des protéines spécialisées comme DRP1 (dynamin-related protein) pour la fission, ou OPA1 (optic atrophy protein 1) et la métalloendopeptidase OMA1 (overlapping with the M-AAA protease 1 homolog), pour la fusion [8]. Enfin, les sites de contact membranaire entre réticulum endoplasmique et mitochondries semblent jouer un rôle clé dans les processus de fission et de fusion des mitochondries [9]. Il existe notamment un lien physique entre ces sites de contact et le recrutement de DRP1 à la surface de la mitochondrie lors du déclenchement de la fission mitochondriale [10].
Nous avons analysé les effets de l’infection par certains virus de la famille Influenza (responsables des épidémies de grippe saisonnières) sur l’appareil endomembranaire de la cellule hôte. Outre ses effets marqués sur la fragmentation de l’appareil de Golgi, les autophagosomes et les endosomes précoces, l’infection par le virus grippal H1N1 conduit principalement à une élongation du réseau mitochondrial [11]. Nous avons observé que l’équilibre entre fission et fusion mitochondriales était altéré par l’infection, et que ce phénotype cellulaire était associé à une baisse de l’adressage de DRP1 à la membrane des mitochondries, alors que la protéine OPA1, impliquée dans la fusion, était stabilisée à cette membrane [11]. L’élongation mitochondriale observée lors de l’infection par le virus de la grippe est par ailleurs corrélée à une baisse du nombre et de l’intensité des sites de contact entre réticulum endoplasmique et mitochondries (Figure 1), ce qui contribue à expliquer l’activité fusionnelle du réseau mitochondrial lors de l’infection. L’apport exogène d’ARN double brin d’origine virale reproduit ce comportement cellulaire [5]. Ces ARN viraux sont aussi responsables de l’activation la voie RIG-I au cours de l’infection [5]. Ainsi, nos résultats permettent de suggérer l’existence d’un lien fonctionnel entre la réponse immunitaire innée, les sites de contact entre mitochondries et réticulum endoplasmique, et l’adaptation de la machinerie moléculaire liée à la morphologie mitochondriale.
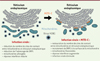 |
Figure 1. La morphodynamique des mitochondries et de leurs sites de contact avec le réticulum endoplasmique au cœur de la réponse antivirale. Lors de l’infection par un virus de la famille Influenza, la densité des sites de contact entre réticulum endoplasmique et mitochondries diminue, ce qui conduit à une réduction de la réponse interféron antivirale et à l’élongation du réseau mitochondrial par fusion des mitochondries. Un traitement par la molécule synthétique MITO-C restaure les sites de contact, ce qui entraîne une augmentation de la réponse interféron et un recrutement de DRP1 à la surface des mitochondries à l’origine de leur fission. |
Nous avons ensuite évalué l’effet d’une molécule synthétique, MITO-C, sur les modifications de l’appareil mitochondrial induites par le virus. MITO-C est une molécule hétérocyclique de petite taille obtenue en mimant les déterminants des protéines virales impliqués dans leur interaction avec les protéines des cellules hôtes [12]. Les cibles de MITO-C sont les trois protéines de la famille des protéines contenant le motif NEET (Asn-Glu-Glu-Thr) : MitoNEET (CDGSH iron sulfur domain 1), NAF-1 (nutrient-deprivation autophagy factor-1) et MiNT (ou CDGSH iron sulfur domain 3) [13]. Ces protéines, localisées à l’interface entre réticulum endoplasmique et mitochondries, contrôlent les transferts d’agrégats atomiques Fe-S oxydables et sont impliquées dans l’apoptose, l’équilibre redox, ou encore l’autophagie. MITO-C induit une fragmentation mitochondriale réversible, sans effet cytotoxique et sans affecter la respiration mitochondriale [12]. Nous avons montré que l’effet pro-fissionnel de MITO-C impliquait une stabilisation artificielle des sites de contact entre réticulum endoplasmique et mitochondries (Figure 1), permettant ainsi le recrutement massif de la protéine DRP1, impliquée dans la fission, à la surface mitochondriale [12]. La molécule MITO-C et l’infection par le virus H1N1 ont donc, séparément, des effets opposés sur le réseau mitochondrial. Nous avons montré que MITO-C est un puissant inhibiteur de la réplication du virus de la grippe [11]. Un effet similaire de MITO-C a par ailleurs été observé dans des cellules infectées par le virus de la dengue qui provoque, lui aussi, une élongation du réseau mitochondrial [14]. De plus, dans les cellules infectées par H1N1, l’ajout de MITO-C au milieu de culture a permis de restaurer le réseau mitochondrial et les sites de contact entre réticulum endoplasmique et mitochondries comme cela est observé dans les cellules non infectées [11]. Ainsi, il semble exister, pour certains virus à ARN, un lien entre l’infection et l’élongation mitochondriale.
Comme nous l’avons rappelé au début de cet article, une partie de l’arsenal cellulaire utilisé dans la lutte contre l’infection virale repose sur certains acteurs de l’immunité innée, comme les protéines RIG-I et MAVS, qui montrent alors une localisation mitochondriale. Nous avons pu montrer que si MITO-C n’avait aucun impact sur la synthèse et la sécrétion d’interférons en l’absence d’infection virale, sa présence dans les cellules infectées par le virus H1N1 permettait d’accroître significativement la sécrétion des interférons λ1 et β [11]. Enfin, il est important de noter que l’action antivirale de MITO-C disparaît lorsque l’expression de la protéine RIG-I (par la technique CRISPR-Cas9) est empêchée. La molécule MITO-C semble donc potentialiser la réponse immunitaire innée et la sécrétion d’interférons provoquées par l’infection virale de manière dépendante de RIG-I [11] (Figure 1).
Ces résultats révèlent les niveaux de complexité de la réponse antivirale, dans laquelle la mitochondrie est un acteur majeur. En particulier, il faut souligner l’importance de la dynamique membranaire du système mitochondrial et des sites de contact entre réticulum endoplasmique et mitochondries pour la mise en place de la réponse antivirale dépendante de RIG-I. Afin de pouvoir se répliquer, les virus ont naturellement évolué pour interférer avec le système de défense innée de l’hôte en établissant des interactions directes avec les protéines humaines, mais aussi en perturbant le système membranaire mitochondrial, plateforme de la réponse antivirale. Ces considérations ouvrent de nouvelles perspectives pour la recherche de thérapies antivirales : elles permettent d’envisager de cibler directement la machinerie cellulaire mitochondriale, et non pas un déterminant du virus. Une telle stratégie pourrait trouver un intérêt immédiat dans le contexte actuel de la pandémie de la COVID-19 (coronavirus disease 2019) car l’infection par le virus SARS-CoV-2 (severe acute respiratory syndrome-coronavirus 2) provoque des effets cellulaires proches de ceux observés au cours de l’infection par le virus de la grippe, notamment sur l’élongation du réseau mitochondrial [15].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Pichlmair A, Schulz O, Tan CP, et al. RIG-I-mediated antiviral responses to single-stranded RNA bearing 5′-phosphates. Science 2006 ; 314 : 997–1001. [CrossRef] [PubMed] [Google Scholar]
- Seth RB, Sun L, Ea C-K, et al. Identification and characterization of MAVS, a mitochondrial antiviral signaling protein that activates NF-kappaB and IRF 3. Cell 2005 ; 122 : 669–682. [CrossRef] [PubMed] [Google Scholar]
- Prinz WA, Toulmay A, Balla T. The functional universe of membrane contact sites. Nat Rev Mol Cell Biol 2020; 21 : 7–24. [CrossRef] [PubMed] [Google Scholar]
- Combs JA, Norton EB, Saifudeen ZR, et al. Human cytomegalovirus alters host cell mitochondrial function during acute infection. J Virol 2020; 94 : e0118319. [CrossRef] [Google Scholar]
- Castanier C, Garcin D, Vazquez A, et al. Mitochondrial dynamics regulate the RIG-I-like receptor antiviral pathway. EMBO Rep 2010 ; 11 : 133–138. [CrossRef] [PubMed] [Google Scholar]
- de Armas-Rillo L, Valera MS, Marrero-Hernández S, et al. Membrane dynamics associated with viral infection. Rev Med Virol 2016 ; 26 : 146–160. [CrossRef] [PubMed] [Google Scholar]
- Galluzzi L, Kepp O, Kroemer G. Mitochondria: master regulators of danger signalling. Nat Rev Mol Cell Biol 2012 ; 13 : 780–788. [CrossRef] [PubMed] [Google Scholar]
- Zemirli N, Morel E, Molino D. Mitochondrial dynamics in basal and stressful conditions. Int J Mol Sci 2018 ; 19 : 564. [CrossRef] [Google Scholar]
- Morel E. ER membrane and contact sites dynamics in autophagy regulation and stress response. Front Cell Dev Biol 2020; 8 : 343. [CrossRef] [PubMed] [Google Scholar]
- Friedman JR, Lackner LL, West M, et al. ER Tubules mark sites of mitochondrial division. Science 2011 ; 334 : 358–362. [CrossRef] [PubMed] [Google Scholar]
- Pila-Castellanos I, Molino D, McKellar J, et al. Mitochondrial morphodynamics alteration induced by influenza virus infection as a new antiviral strategy. PLoS Pathog 2021; 17 : e1009340. [CrossRef] [PubMed] [Google Scholar]
- Molino D, Pila-Castellanos I, Marjault H, et al. Chemical targeting of NEET proteins reveals their function in mitochondrial morphodynamics. EMBO Rep 2020; 21 : e49019. [CrossRef] [PubMed] [Google Scholar]
- Mittler R, Darash-Yahana M, Sohn YS, et al. NEET Proteins: a new link between iron metabolism, reactive oxygen species, and cancer. Antioxid Redox Signal 2019 ; 30 : 1083–1095. [CrossRef] [PubMed] [Google Scholar]
- Moreno-Altamirano MMB, Kolstoe SE, Sánchez-García FJ. Virus control of cell metabolism for replication and evasion of host immune responses. Front Cell Infect Microbiol 2019 ; 9 : 95. [CrossRef] [PubMed] [Google Scholar]
- Shi C-S, Qi HY, Boularan C, et al. SARS-coronavirus open reading frame-9b suppresses innate immunity by targeting mitochondria and the MAVS/TRAF3/TRAF6 signalosome. J Immunol 2014 ; 193 : 3080–3089. [CrossRef] [PubMed] [Google Scholar]
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. La morphodynamique des mitochondries et de leurs sites de contact avec le réticulum endoplasmique au cœur de la réponse antivirale. Lors de l’infection par un virus de la famille Influenza, la densité des sites de contact entre réticulum endoplasmique et mitochondries diminue, ce qui conduit à une réduction de la réponse interféron antivirale et à l’élongation du réseau mitochondrial par fusion des mitochondries. Un traitement par la molécule synthétique MITO-C restaure les sites de contact, ce qui entraîne une augmentation de la réponse interféron et un recrutement de DRP1 à la surface des mitochondries à l’origine de leur fission. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




