| Issue |
Med Sci (Paris)
Volume 37, Number 12, Décembre 2021
Vésicules extracellulaires
|
|
|---|---|---|
| Page(s) | 1168 - 1171 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2021172 | |
| Published online | 20 December 2021 | |
Réactivation de l’épicarde
Un évènement précoce dans la survenue de la fibrillation auriculaire
Epicardium reactivated: An early event in the occurrence of atrial fibrillation
1
Inserm UMRS 1166, Institut de cardiométabolisme et nutrition (ICAN), Sorbonne Université, 91 boulevard de l’Hôpital, 75013 Paris, France
2
Institut de cardiologie, Hôpital Pitié-Salpêtrière, 43-83 boulevard de l’Hôpital, 75013 Paris, France
La fibrillation auriculaire est la plus fréquente des arythmies cardiaques et l’une des premières causes d’accidents vasculaires emboliques et d’insuffisance cardiaque [1]. Elle est le plus souvent l’expression d’une authentique cardiomyopathie des oreillettes qui évolue longtemps à bas bruit, favorisée par les valvulopathies, l’hypertension artérielle, le vieillissement, mais aussi les maladies métaboliques comme l’obésité et le diabète [2, 3]. Ainsi, une augmentation d’un point de l’indice de masse corporelle au-delà de 25 accroît de 4 % le risque de fibrillation auriculaire [4].
Le lien entre les maladies métaboliques et la cardiomyopathie atriale est activement recherché. Il pourrait être constitué par le tissu adipeux viscéral à la surface de l’épicarde et infiltrant les couches sous-épicardiques, et qui, dans certaines circonstances, est remplacé par une infiltration fibreuse du myocarde favorisant la fibrillation auriculaire [5]. La réponse immuno-inflammatoire est un des mécanismes de cette transition du tissu adipeux du sous-épicarde vers un tissu fibreux [6]. Nous avons montré précédemment que les cellules progénitrices résidant dans le feuillet épicardique, normalement quiescentes chez l’adulte, peuvent être réactivées lors d’un stress, se transformer par une transition mésenchymateuse en « cellules dérivées de l’épicarde », se différencier en adipocytes, et contribuer ainsi à l’expansion du tissu adipeux épicardique. Le peptide natriurétique, physiologiquement sécrété par les myocytes atriaux, s’est avéré un puissant facteur adipogénique pour les cellules dérivées de l’épicarde [7].
Afin de préciser le rôle joué par le feuillet épicardique dans l’infiltration fibreuse du sous-épicarde et la formation de la cardiomyopathie atriale, nous avons testé la possibilité que le recrutement et la différenciation en fibroblastes des cellules dérivées de l’épicarde contribuent à l’évolution de l’infiltration adipo-fibreuse du sous-épicarde.
Réactivation de l’épicarde au cours de la cardiomyopathie atriale
Dans une collection d’échantillons d’oreillettes de cœurs humains, nous avons observé que l’épaississement de l’épicarde et l’infiltration fibro-adipeuse du sous-épicarde prédominent chez les patients âgés souffrant d’insuffisance cardiaque ou en fibrillation auriculaire, des situations cliniques associées au développent d’une cardiomyopathie atriale [8]. De même, dans des modèles murins de cardiomyopathie atriale et de fibrillation auriculaire, la réactivation de l’épicarde est un processus précoce survenant dès les premiers jours du remodelage des oreillettes. Chez l’homme, comme chez la souris et le rat, des cellules progénitrices épicardiques exprimant le gène codant la protéine Wilms’ tumor (WT1+) et co-exprimant les marqueurs de pré-adipocytes (preadipocyte factor-1 ou Pref-1) ou de myofibroblastes (a smooth muscle actin ou αSMA, et platelet-derived growth factor receptor α ou PDGFRα), sont détectées dans les zones fibreuses sous-épicardiques, suggérant l’existence d’une migration de cellules dérivées de l’épicarde, leur transformation en cellules mésenchymateuses, suivie de leur différenciation en fibroblastes ou en adipocytes. Cette hypothèse a pu être vérifiée en utilisant un modèle de souris génétiquement modifiées dans lequel la protéine WT1 est étiquetée par un fluorochrome permettant de suivre les cellules progénitrices épicardiques dans le cœur des souris adultes (Figure 1). L’ensemble des résultats obtenus ont indiqué qu’une population de fibroblastes du sous-épicarde est d’origine épicardique. Ces résultats ont alors soulevé la question des mécanismes de réactivation et de différenciation des cellules progénitrices de l’épicarde en adipocytes ou fibroblastes [8].
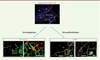 |
Figure 1. Réactivation de l’épicarde : rôles majeurs des cellules dérivées de l’épicarde. L’utilisation des souris génétiquement modifiées WT1Cre/ROSA tdT, chez lesquelles la protéine WT1 est étiquetée par un fluorochrome, permet de suivre les cellules progénitrices épicardiques (colorées en rouge, et dont certaines sont indiquées par des flèches blanches) dans le cœur des souris adultes. Les cellules progénitrices de l’épicarde co-expriment la protéine Pref-1 (preadipocyte factor-1) et se différencient en adipocytes exprimant la protéine périlipine-1 (en vert, voie adipogénique), ou expriment la protéine αSMA (α smooth muscle actin, en vert) et se différenciant en myofibroblastes (voie myofibroblastique). Les noyaux des cellules sont colorés en bleu par le DAPI. Barres d’échelle = 200 µm ou 20 µm (dans les vignettes agrandies). Epi : épicarde ; M : myocarde ; A : atrium (oreillette) (figure adaptée de [7] et [8]). |
Un aiguillage de signalisation contrôlant la différenciation des cellules progénitrices de l’épicarde
À partir d’échantillons d’oreillettes de cœurs humains, les cellules dérivées de l’épicarde ont été recueillies, triées selon l’expression de marqueurs fibroblastiques (PDGFRα) ou pré-adipocytaires (Pref-1), et maintenues en culture. Ces deux populations de cellules dérivées de l’épicarde montrent des capacités de différenciation distinctes : les cellules PDGFRα+ se différencient en fibroblastes, et les cellules Pref-1+ en adipocytes [8]. Plusieurs facteurs solubles sécrétés par les cellules du myocarde sont capables d’induire une différenciation des cellules dérivées de l’épicarde en fibroblastes, notamment le TGF-β (transforming growth factor beta) et l’angiotensine II, qui activent les voies canoniques de signalisation impliquant Smad2/3 et p38-MAPK (mitogen-activated protein kinase). Ces mêmes facteurs inhibent les voies adipogéniques impliquant C/EBPα (CCAAT/enhancer-binding protein alpha), PPARΥ (peroxisome proliferator-activated receptor gamma), et périlipine-1, ce qui constitue une première indication en faveur de l’existence d’un aiguillage de signalisation contrôlant la différenciation des cellules dérivées de l’épicarde.
Il existe aussi un phénomène d’auto-amplification des voies de signalisation fibroblastique et adipogénique, attesté par l’induction de l’expression du récepteur 1 de l’angiotensine II (récepteur AT1) par l’angiotensine II dans les fibroblastes dérivés de cellules progénitrices de l’épicarde. Le récepteur 1 du peptide atrial natriurétique (NPR1) n’y est pas exprimé, tandis que ce peptide induit l’expression de son récepteur NPR1 dans les adipocytes dérivés de ces cellules, et que le récepteur AT1 y est indétectable [8].
Une population hétérogène de cellules progénitrices épicardiques dans les oreillettes
Ces résultats étaient en faveur de l’existence de sous-populations de cellules dérivées de l’épicarde engagées dans des lignages de différenciation différents. Cette hypothèse a été testée en utilisant la technique de séquençage des transcrits sur cellule unique afin d’identifier les différents types cellulaires issus des cellules dérivées de l’épicarde recueillies à partir des oreillettes isolées d’un modèle de cardiomyopathie atriale chez le rat, comparé à un groupe de rats témoins. Il existe un profil hétérogène des cellules dérivées de l’épicarde dans les oreillettes des rats atteints de cardiomyopathie atriale. L’analyse des clusters de cellules (définis d’après les gènes qu’elles expriment) par l’algorithme t-SNE (t-distributed stochastic neighbor embedding) et la distribution spatiale de ces clusters en représentation 3D, notamment la proximité avec les cellules progénitrices de l’épicarde (exprimant Wt1 et Tbx18) dont elles dérivent, a montré une ségrégation entre le groupe de rats et le groupe de rats témoins (Figure 2A). Huit clusters ont été identifiés, parmi lesquels deux se distinguent et expriment soit le marqueur de cellules progénitrices de l’épicarde, Wt1, soit un marqueur mésenchymateux, Pdgfrβ [8]. Nous avons pu également reconstituer les trajectoires de différenciation à partir du cluster initial de cellules progénitrices épicardiques exprimant les gènes Tbx18, Wt1, et Scx [9]. Les transcrits différenciant ces clusters sont notamment ceux des gènes Vegfa, CD44, Npr1 et Npr2, c’est-à-dire des gènes codant des acteurs clés de l’aiguillage de signalisation décrit précédemment. Ainsi, les cellules dérivées de l’épicarde exprimant le gène Npr1 (cellules Npr1+ ) se différencient en adipocytes, alors que celles qui ne l’expriment pas (cellules Npr1- ) se différencient en fibroblastes, comme l’indique la proximité des clusters de cellules adipocytaires avec le cluster des cellules progénitrices de l’épicarde Npr1+ , et celle du cluster des cellules myofibroblastiques et fibroblastiques avec le cluster des cellules Npr1- (Figure 2B). Le cluster de cellules fibroblastiques exprime des gènes codant des marqueurs de fibrose : Col1a1, Ctgf, Vimentine et Acta2 [10]. La proximité d’un cluster de cellules exprimant les gènes marqueurs de cellules musculaires lisses (Acta2, Tagln, Notch2) avec certaines cellules dérivées de l’épicarde a également été montrée. Il convient de noter que des clusters éloignés du cluster d’origine, n’exprimant qu’un petit nombre de gènes communs avec les cellules progénitrices de l’épicarde et qui expriment les gènes de l’inflammation Ccl2, Ccl7 et Il33, sont identifiées comme étant des cellules de l’hématopoïèse, ce qui suggère l’existence d’une migration de cellules immunitaires résidentes ou périphériques vers la zone de remodelage tissulaire [11].
 |
Figure 2. Le destin des cellules dérivées de l’épicarde : adipocytes ou fibroblastes. A. Ségrégation entre le groupe de rats « malades » après induction d’une cardiomyopathie atriale par ischémie et le groupe de rats témoins. Les résultats du séquençage des transcrits sur cellule unique ont été analysés par l’algorithme t-SNE, non linéaire, avec une représentation spatiale en 3D (tsne1, tsne2, tsne3) sous la forme de nuages de points correspondant aux cellules. B. Les oreillettes de rats témoins présentent un cluster « d’origine » de cellules progénitrices de l’épicarde (nuage de points oranges), à partir duquel deux clusters se différencient par l’expression (NPR1+, nuage de points rouges) ou l’absence d’expression (NPR1-, nuage de points bleus) du gène codant le récepteur 1 du peptide natriurétique (NPR1), ce qui aiguille la destinée de ces cellules. Les oreillettes des rats en insuffisance cardiaque présentent des clusters de cellules hétérogènes issues de la différenciation des cellules dérivées de l’épicarde NPR1- (myofibroblastes, nuage de points verts) ou NPR1+ (adipocytes, nuage de points jaunes). Les clusters de cellules éloignés du cluster d’origine proviennent d’une migration de cellules inflammatoires (nuage de points roses) (figure adaptée de [8]). |
Perspectives
Dès le développement embryonnaire, deux catégories de cellules dérivées de l’épicarde sont présentes dans le feuillet épicardique cardiaque, notamment auriculaire : des cellules exprimant Pref-1 et NPR1, destinées à devenir des adipocytes, et d’autres cellules exprimant PDGFRα et le récepteur AT1 de l’angiotensine-II, destinées à se différencier en myofibroblastes. Dans le cœur adulte, ces populations de cellules progénitrices sont quiescentes, et se réactivent lors des changements de conditions de travail du myocarde (surcharge volumique, tachycardie) ou en réponse à des facteurs locaux, comme l’accumulation d’angiotensine-II, ou généraux, comme des changements métaboliques. Ainsi, cette réactivation de l’épicarde peut aboutir à la constitution progressive d’une cardiomyopathie atriale conduisant à la fibrillation auriculaire.
Cette étude ouvre des perspectives nouvelles pour une prise en charge de la cardiomyopathie atriale et de son risque de fibrillation auriculaire, en ciblant, très en amont de l’arythmie, les processus précoces aboutissant au remodelage du myocarde. Elle a notamment permis d’identifier des cibles thérapeutiques potentielles comme l’inhibition du système rénine-angiotensine cardiaque. Désormais, un enjeu médical majeur est de disposer de biomarqueurs de ce remodelage précoce des oreillettes pour tenter de prévenir le risque de fibrillation auriculaire et d’accident vasculaire cérébral par embolie.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Dublin S, Glazer NL, Smith NL, et al. Diabetes mellitus, glycemic control, and risk of atrial fibrillation. J Gen Intern Med 2010 ; 25 : 853–858. [CrossRef] [PubMed] [Google Scholar]
- Thanassoulis G, Massaro JM, O’Donnell CJ, et al. Pericardial fat is associated with prevalent atrial fibrillation: the Framingham heart study. Circ Arrhythm Electrophysiol 2010 ; 3 : 345–350. [CrossRef] [PubMed] [Google Scholar]
- Bohne LJ, Johnson D, Rose RA, et al. The association between diabetes mellitus and atrial fibrillation: clinical and mechanistic insights. Front Physiol 2019 ; 10 : 135. [CrossRef] [PubMed] [Google Scholar]
- Dublin S, French B, Glazer NL, et al. Risk of new-onset atrial fibrillation in relation to body mass index. Arch Intern Med 2006 ; 166 : 2322–2328. [CrossRef] [PubMed] [Google Scholar]
- Al Chekakie MO, Welles CC, Metoyer R, et al. Pericardial fat is independently associated with human atrial fibrillation. J Am Coll Cardiol 2010 ; 56 : 784–788. [CrossRef] [PubMed] [Google Scholar]
- Haemers P, Hamdi H, Guedj K, et al. Atrial fibrillation is associated with the fibrotic remodelling of adipose tissue in the subepicardium of human and sheep atria. Eur Heart J 2017 ; 38 : 53–61. [CrossRef] [PubMed] [Google Scholar]
- Suffee N, Moore-Morris T, Farahmand P, et al. Atrial natriuretic peptide regulates adipose tissue accumulation in adult atria. Proc Natl Acad Sci USA 2017 ; 114 : E771–E780. [CrossRef] [PubMed] [Google Scholar]
- Suffee N, Moore-Morris T, Jagla B, et al. Reactivation of the epicardium at the origin of myocardial fibro-fatty infiltration during the atrial cardiomyopathy. Circ Res 2020; 126 : 1330–42. [CrossRef] [PubMed] [Google Scholar]
- Asli NS, Xaymardan M, Harvey RP. Epicardial origin of resident mesenchymal stem cells in the adult mammalian heart. J Dev Biol 2014 ; 2 : 117–137. [CrossRef] [Google Scholar]
- Kanisicak O, Khalil H, Ivey MJ, et al. Genetic lineage tracing defines myofibroblast origin and function in the injured heart. Nat Commun 2016 ; 7 : 12260. [CrossRef] [PubMed] [Google Scholar]
- Abe I, Teshima Y, Kondo H, et al. Association of fibrotic remodeling and cytokines/chemokines content in epicardial adipose tissue with atrial myocardial fibrosis in patients with atrial fibrillation. Heart Rhythm 2018 ; 15 : 1717–1727. [CrossRef] [PubMed] [Google Scholar]
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Réactivation de l’épicarde : rôles majeurs des cellules dérivées de l’épicarde. L’utilisation des souris génétiquement modifiées WT1Cre/ROSA tdT, chez lesquelles la protéine WT1 est étiquetée par un fluorochrome, permet de suivre les cellules progénitrices épicardiques (colorées en rouge, et dont certaines sont indiquées par des flèches blanches) dans le cœur des souris adultes. Les cellules progénitrices de l’épicarde co-expriment la protéine Pref-1 (preadipocyte factor-1) et se différencient en adipocytes exprimant la protéine périlipine-1 (en vert, voie adipogénique), ou expriment la protéine αSMA (α smooth muscle actin, en vert) et se différenciant en myofibroblastes (voie myofibroblastique). Les noyaux des cellules sont colorés en bleu par le DAPI. Barres d’échelle = 200 µm ou 20 µm (dans les vignettes agrandies). Epi : épicarde ; M : myocarde ; A : atrium (oreillette) (figure adaptée de [7] et [8]). |
| Dans le texte | |
 |
Figure 2. Le destin des cellules dérivées de l’épicarde : adipocytes ou fibroblastes. A. Ségrégation entre le groupe de rats « malades » après induction d’une cardiomyopathie atriale par ischémie et le groupe de rats témoins. Les résultats du séquençage des transcrits sur cellule unique ont été analysés par l’algorithme t-SNE, non linéaire, avec une représentation spatiale en 3D (tsne1, tsne2, tsne3) sous la forme de nuages de points correspondant aux cellules. B. Les oreillettes de rats témoins présentent un cluster « d’origine » de cellules progénitrices de l’épicarde (nuage de points oranges), à partir duquel deux clusters se différencient par l’expression (NPR1+, nuage de points rouges) ou l’absence d’expression (NPR1-, nuage de points bleus) du gène codant le récepteur 1 du peptide natriurétique (NPR1), ce qui aiguille la destinée de ces cellules. Les oreillettes des rats en insuffisance cardiaque présentent des clusters de cellules hétérogènes issues de la différenciation des cellules dérivées de l’épicarde NPR1- (myofibroblastes, nuage de points verts) ou NPR1+ (adipocytes, nuage de points jaunes). Les clusters de cellules éloignés du cluster d’origine proviennent d’une migration de cellules inflammatoires (nuage de points roses) (figure adaptée de [8]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




