| Issue |
Med Sci (Paris)
Volume 37, Number 8-9, Août–Septembre 2021
|
|
|---|---|---|
| Page(s) | 712 - 715 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2021099 | |
| Published online | 07 September 2021 | |
Neuropathie optique héréditaire de Leber
Amélioration bilatérale de la vision après thérapie génique par injection unilatérale
Leber hereditary optic neuropathy: Bilateral improvement of visual acuity following gene therapy by unilateral injection
1
Université de la Sorbonne, Inserm, CNRS, Institut de la vision, Paris, France.
2
Centre hospitalier national d’ophtalmologie des Quinze-Vingts, Paris, France.
3
Fondation ophtalmologique A. de Rothschild, Paris, France.
4
Department of ophthalmology, The university of Pittsburgh school of medicine, Pittsburgh, États-Unis.
5
Cambridge centre for brain repair and MRC mitochondrial biology unit, Department of clinical neurosciences, University of Cambridge, Cambridge, Royaume-Uni.
6
Cambridge eye unit, Addenbrooke’s hospital, Cambridge university hospitals, Cambridge, Royaume-Uni.
7
Moorfields eye hospital, Londres, Royaume-Uni.
8
UCL institute of ophthalmology, University college London, Londres, Royaume-Uni.
9
Departments of ophthalmology, neurology, and neurological surgery, Emory university school of medicine, Atlanta, États-Unis.
10
GenSight Biologics, Paris, France.
Une maladie mitochondriale rare provoquant la perte rapide de la vision centrale
La neuropathie optique héréditaire de Leber (NOHL) est une maladie génétique mitochondriale rare, dont la prévalence est estimée à une personne sur 30 000 à 50 000 en Europe du Nord. Elle se transmet par la mère et cause une perte de vision rapide et irréversible. Typiquement, la NOHL se caractérise par une baisse visuelle bilatérale et séquentielle, un œil étant souvent atteint avant l’autre, quelques semaines plus tard. Elle affecte préférentiellement les cellules ganglionnaires rétiniennes du faisceau interpapillomaculaire concentrées dans la macula, zone centrale de la rétine dont dépend l’acuité visuelle. La dégénérescence de ces cellules entraîne donc une perte de la vision centrale indispensable à des tâches comme la lecture ou la reconnaissance des visages.
Lors du processus de perception visuelle, les différentes couches cellulaires de la rétine traitent et intègrent l’information visuelle : le signal électrique produit par les cellules photoréceptrices, situées dans la couche externe de la rétine, est transmis, après de multiples étapes de traitement aux cellules ganglionnaires rétiniennes, qui sont situées dans la couche interne de la rétine, au contact de l’humeur vitrée de l’œil. Les axones de ces cellules convergent vers la papille pour former le nerf optique, qui transmet l’information visuelle traitée et intégrée dans la rétine vers le cortex cérébral visuel primaire, situé dans le lobe occipital. La dégénérescence des axones des cellules ganglionnaires rétiniennes dans la NOHL provoque par conséquent une atrophie progressive du nerf optique.
Trois mutations ponctuelles de l’ADN mitochondrial sont responsables d’environ 90 % des cas de NOHL [1]. Elles affectent des gènes produisant des protéines impliquées dans le cycle respiratoire cellulaire : ND1, ND4, et ND6. La mutation la plus fréquente et associée au pronostic visuel le moins favorable est m.11778G>A dans le gène ND4. La déficience du cycle respiratoire qui en résulte entraîne une baisse de la production cellulaire d’ATP et une accumulation de radicaux libres, qui déclenche la mort des cellules ganglionnaires rétiniennes par apoptose.
On estime que seuls environ 50 % des hommes et 10 % des femmes porteurs d’une mutation des gènes ND développent la NOHL [1]. Cette pénétrance incomplète de la NOHL est mal comprise, et l’histoire naturelle de la maladie, c’est-à-dire son évolution en l’absence d’intervention thérapeutique, est encore mal connue. De plus, une méta‑analyse récente a montré que 14 % des patients porteurs de la mutation m.11778G>A du gène ND4 présentent une récupération visuelle partielle spontanée [2].
Le seul traitement de la NOHL autorisé actuellement en Europe est l’idébénone, un analogue du coenzyme Q10. Une étude rapportant les résultats du traitement de la NOHL par idébénone en conditions réelles (real-world evidence) a montré son efficacité sur la récupération visuelle dans un groupe de patients traités [3]. Une réponse favorable au traitement, considérée par l’Agence européenne du médicament comme une récupération cliniquement significative (clinically relevant recovery, CRR), a été définie comme un gain d’acuité visuelle d’au moins 10 lettres ETDRS (early‑treatment diabetic retinopathy study) par rapport au nadir (i.e., la moins bonne valeur d’acuité visuelle enregistrée au cours de l’étude), pour les yeux qui pouvaient encore lire les lettres du tableau ETDRS (« on‑chart »), ou, pour les yeux qui ne pouvaient plus lire les lettres de ce tableau (« off-chart »), un passage on-chart avec au moins lecture de la première ligne du tableau (5 lettres) à 1 mètre. Après 25 mois de traitement par idébénone en moyenne, une réponse CRR d’au moins un œil a été rapportée chez 21/54 (39 %) patients porteurs de la mutation m.11778G>A [3].
Lenadogene nolparvovec, une thérapie génique oculaire pour la NOHL
Des stratégies de thérapie génique ont été développées pour traiter la NOHL causée par une mutation de ND4. Le gène thérapeutique est empaqueté dans un vecteur viral non‑réplicatif de type virus adéno-associé (adeno-associated virus, AAV), qui est injecté directement dans l’humeur vitrée afin de cibler les cellules ganglionnaires rétiniennes. Le gène mitochondrial est transcrit de façon allotopique dans le noyau de la cellule transfectée, et son ARN messager est ensuite traduit en protéine fonctionnelle par des ribosomes situés à la surface des mitochondries (Figure 1). Afin d’optimiser le processus d’expression allotopique, on utilise la technique MTS (mitochondrial targeting sequence), qui permet, non seulement d’adresser l’ARN messager thérapeutique directement à la surface mitochondriale (par opposition à un processus stochastique de rencontre entre l’ARN messager et les ribosomes mitochondriaux), mais aussi de favoriser la translocation de la protéine fonctionnelle vers la matrice mitochondriale, où elle peut compenser le dysfonctionnement de la chaîne respiratoire. Lors d’études précliniques, cette technique a permis de rétablir in vitro la production mitochondriale d’ATP dans des cellules de patients atteints de NOHL, et de prévenir l’atrophie du nerf optique chez des rats porteurs de la mutation m.11778G>A [4].
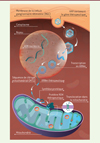 |
Figure 1. Mécanisme d’action de lenadogene nolparvovec. Le vecteur viral lenadonegene nolparvovec (rAAV2/2-ND4) transduit les cellules ganglionnaires de la rétine par endocytose. L’ADN simple brin du vecteur est ensuite transféré dans le noyau cellulaire, où un brin d’ADN complémentaire est synthétisé. L’ADN thérapeutique subsiste alors dans le noyau de la cellule hôte sous forme d’épisome (ADN circulaire), sans s’intégrer à son génome. Le gène thérapeutique est transcrit en ARN messager qui comporte une séquence de ciblage mitochondrial (MTS) à ses deux extrémités. Cette séquence permet d’acheminer l’ARN messager à la surface des mitochondries, où la protéine ND4 thérapeutique est synthétisée, avant d’être importée dans la matrice mitochondriale pour compenser le dysfonctionnement de la chaîne respiratoire. |
Le premier essai clinique de thérapie génique par lenadogene nolparvovec (rAAV2/2-ND4, LUMEVOQ®), REVEAL, a débuté en 2014. Il incluait 15 patients atteints de NOHL due à la mutation m.11778G>A, qui ont été traités par des doses croissantes du virus recombinant thérapeutique. Cet essai de phase I-II a montré une bonne tolérance et une bonne sécurité du lenadogene nolparvovec jusqu’à 5 ans après l’injection intravitréenne [5,6]. La dose de 9 × 1010 génomes viraux (gv) par œil a ainsi été sélectionnée pour les essais cliniques de phase III.
Les études cliniques RESCUE et REVERSE révèlent l’effet controlatéral de lenadogene nolparvovec
Afin d’évaluer l’efficacité du traitement de la NOHL par lenadogene nolparvovec, deux essais cliniques de phase III, RESCUE et REVERSE, ont été menés en parallèle. Dans les deux études, les patients recrutés étaient atteints de NOHL due à la mutation m.11778G>A, et âgés d’au moins 15 ans au début de la baisse visuelle. La seule différence entre les deux études était l’ancienneté de la maladie au moment du recrutement : de 0 à 6 mois dans l’étude RESCUE, et de 6 à 12 mois dans l’étude REVERSE. Chaque patient a reçu une injection intravitréenne de lenadogene nolparvovec dans un œil et une injection simulée (sham injection) dans l’autre. Aucun traitement corticoïde prophylactique n’a été administré avant ou dans les suites immédiates de l’injection intravitréenne. Le critère principal d’évaluation de l’efficacité était la différence de changement d’acuité visuelle mesurée à 48 semaines après administration du traitement, par rapport à la situation basale, entre les yeux ayant reçu lenadogene nolparvovec et ceux ayant reçu l’injection simulée.
Entre février 2016 et juillet 2017, 39 et 37 patients ont été recrutés respectivement dans les études RESCUE et REVERSE par sept centres investigateurs situés aux États-Unis, en France, au Royaume-Uni, en Allemagne, et en Italie. Deux ans après l’injection intravitréenne, le traitement a montré une bonne tolérance et un seul patient a retiré son consentement avant la fin de l’étude. Trois évènements indésirables graves ont été rapportés, mais aucun n’a été considéré comme lié à l’injection intravitréenne de lenadogene nolparvovec : une déchirure de la rétine dans un œil ayant reçu l’injection simulée (avec résolution sans séquelles après traitement au laser) et deux décès à la suite d’une consommation excessive d’alcool (dans les deux cas, la dernière visite a été effectuée à 48 semaines). L’évènement oculaire indésirable le plus fréquent a été l’inflammation intraoculaire, documentée pour 29 (74 %) et 34 (92 %) yeux injectés avec lenadogene nolparvovec dans les études RESCUE et REVERSE, respectivement. Cette inflammation était peu intense dans la grande majorité des cas, et s’est résolue sans séquelle chez tous les patients atteints, avec ou sans traitement corticostéroïde topique ou par voie orale. Par ailleurs, à l’exception de deux patients (3 %), l’ADN du vecteur viral était indétectable dans le sang deux semaines après l’injection intravitréenne [7,8].
L’analyse de l’efficacité du traitement a montré une amélioration significative de l’acuité visuelle dans les yeux injectés avec lenadogene nolparvovec, et étonnamment, une amélioration similaire dans les yeux ayant reçu l’injection simulée. L’amélioration bilatérale de la vision n’a donc pas permis de satisfaire le critère principal d’évaluation de l’efficacité du traitement tel que défini précédemment. Deux ans après l’administration du traitement, la récupération d’acuité visuelle par rapport au nadir était, dans les études RESCUE et REVERSE, respectivement de +26,5 et +28,5 lettres EDTRS en moyenne pour les yeux injectés avec lenadogene nolparvovec, et de +23,0 et +24,5 lettres ETDRS pour les yeux ayant reçu une injection simulée. Par ailleurs, 27 (71 %) patients de l’étude RESCUE et 30 (81 %) patients de l’étude REVERSE avaient une réponse CRR d’au moins un œil (Figure 2) [7,8]. Une autre réponse visuelle a été définie comme une amélioration par rapport au nadir équivalente à au moins 15 lettres ETDRS (– 0.3 LogMAR)1, représentant un gain d’acuité visuelle considéré comme significatif par les agences réglementaires. Deux ans après l’administration du traitement, 27 (71 %) patients de RESCUE et 28 (76 %) patients de REVERSE avaient une réponse CRR d’au moins un œil selon ce critère (Figure 2) [8].
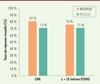 |
Figure 2. Taux de patients répondeurs dans les études RESCUE et REVERSE. Le taux de patients ayant une réponse visuelle dans au moins un œil, deux ans après l’injection intravitréenne unilatérale de lenadogene nolparvovec (LUMEVOQ®) est présenté pour les réponses suivantes : 1) CRR (clinically relevant recovery), définie comme un gain d’acuité visuelle, par rapport au nadir, d’au moins 10 lettres ETDRS pour les yeux qui pouvaient lire les lettres du tableau ETDRS (on-chart) à leur nadir, ou, pour les yeux qui ne pouvaient plus lire les lettres de ce tableau (off-chart), un passage on-chart avec au moins la première ligne du tableau (5 lettres) lue à 1 mètre ; 2) une amélioration de l’acuité visuelle par rapport au nadir équivalente à au moins 15 lettres ETDRS (-0,3 LogMAR). |
Dernièrement, les résultats à 5 ans de l’étude de phase I/II REVEAL ont confirmé l’effet controlatéral de lenadogene nolparvovec à long terme. Chez les 6 patients traités avec une dose de 9 x 1010 gv/œil, l’amélioration de l’acuité visuelle comparée à la situation basale était équivalente à +34 lettres ETDRS dans les yeux ayant reçus une injection intravitréenne, et +32 lettres dans les yeux non traités [6].
À la suite de cette découverte inattendue de l’amélioration bilatérale de la vision après l’injection unilatérale du gène thérapeutique, le mécanisme de l’effet controlatéral de lenadogene nolparvovec a été étudié chez un primate non humain. Trois mois après une injection unilatérale de lenadogene nolparvovec, l’ADN du vecteur thérapeutique a été détecté et quantifié dans l’œil et les tissus visuels controlatéraux à l’œil injecté [7]. Ce résultat indique la possibilité d’un transfert interoculaire du matériel thérapeutique, même s’il reste encore beaucoup de questions à élucider. Les patients inclus dans les études RESCUE et REVERSE ont par conséquent été considérés a posteriori comme ayant bénéficié d’un traitement des deux yeux par lenadogene nolparvovec.
En raison de l’effet controlatéral inattendu de l’injection intravitréenne de lenadogene nolparvovec, les résultats des essais cliniques RESCUE et REVERSE devront être confrontés à l’histoire naturelle de la maladie pour évaluer le bénéfice de cette thérapie génique de la NOHL due à la mutation m.11778G>A [9,10]. Cette stratégie thérapeutique prometteuse pourrait également se révéler efficace, non seulement chez les patients atteints de neuropathie optique héréditaire de Leber (NOHL) porteurs d’une des deux autres mutations les plus fréquentes dans cette maladie, mais aussi chez d’autres patients atteints de maladies mitochondriales affectant la rétine.
Liens d’intérêt
J.A.S. : soutenu par l’Agence Nationale de la Recherche au sein du Programme Investissements d’Avenir, Institut Hospitalo Universitaire FOReSIGHT [ANR-18-IAHU-0001] et LabEx LIFESENSES (ANR-10- LABX-65) ; co-fondateur et actionnaire de GenSight Biologics; et co-auteur du brevet sur le transport allotopique.
C.V.-C. : Consultante pour Santhera Pharmaceuticals et GenSight Biologics.
P.Y.W.M. : Consultant pour GenSight Biologics, Stealth BioTherapeutics; Aides à la recherche de la part de GenSight et Santhera Pharmaceuticals; Lauréat du Clinician Scientist Fellowship Award (G1002570) attribué par le Medical Research Council (Royaume-Uni) ; Financements de la part de Fight for Sight, Isaac Newton Trust, Moorfields Eye Charity, Addenbrooke’s Charitable Trust, National Eye Research Centre, National Institute of Health Research (NIHR) dans le cadre du programme Rare Diseases Translational Research Collaboration, et NIHR Biomedical Research Centre basé au Moorfields Eye Hospital NHS Foundation Trust et UCL Institute of Ophthalmology. V.B. : Consultante pour GenSight Biologics, Santhera Pharmaceuticals, et Stealth BioTherapeutics ; Aides à la recherche de la part de GenSight et Santhera Pharmaceuticals ; Subventions de la part du NIH/NEI ((P30 EY006360).
L.B. et M.T.: Employées de GenSight Biologics.
Références
- Carelli V Carbonelli M de Coo IF et al. International consensus statement on the clinical and therapeutic management of Leber hereditary optic neuropathy. J Neuroophthalmol 2017 ; 37 : 371–381. [CrossRef] [PubMed] [Google Scholar]
- Newman NJ, Carelli V, Taiel M, Yu-Wai-Man P. Visual outcomes in Leber hereditary optic neuropathy patients with the m.11778G>A (MTND4) mitochondrial DNA mutation. J Neuroophthalmol 2020; 40 : 547–57. [CrossRef] [PubMed] [Google Scholar]
- Catarino CB, von Livonius B, Priglinger C, et al. Real-world clinical experience with Idebenone in the treatment of Leber hereditary optic neuropathy. J Neuroophthalmol 2020; 40 : 558–65. [CrossRef] [PubMed] [Google Scholar]
- Cwerman-Thibault H Augustin S Lechauve C et al. Nuclear expression of mitochondrial ND4 leads to the protein assembling in complex I and prevents optic atrophy and visual loss. Mol Ther Methods Clin Dev 2015 ; 2 : 15003. [CrossRef] [PubMed] [Google Scholar]
- Vignal C Uretsky S Fitoussi S et al. Safety of rAAV2/2-ND4 gene therapy for Leber hereditary optic neuropathy. Ophthalmology 2018 ; 125 : 945–947. [CrossRef] [PubMed] [Google Scholar]
- Vignal-Clermont C, Girmens JF, Audo I, et al. Safety of intravitreal gene therapy for treatment of subjects with Leber hereditary optic neuropathy due to mutations in the mitochondrial ND4 gene: the Reveal study. BioDrugs 2021; 35 : 201–14. [CrossRef] [PubMed] [Google Scholar]
- Yu-Wai-Man P, Newman NJ, Carelli V, et al. Bilateral visual improvement with unilateral gene therapy injection for Leber hereditary optic neuropathy. Sci Transl Med 2020; 12 : eaaz7423. [CrossRef] [PubMed] [Google Scholar]
- Newman NJ, Yu-Wai-Man P, Carelli V, el al. Efficacy and safety of intravitreal gene therapy for Leber hereditary optic neuropathy treated within 6 months of disease onset. Ophthalmology 2021; S0161–6420 : 31187–8. [PubMed] [Google Scholar]
- Yu-Wai-Man P, Newman NJ, Carelli V, et al. Natural history of patients with Leber hereditary optic neuropathy: results from the Reality study. Eye 2021; doi: 10.1038/s41433-021-01535-9. [Google Scholar]
- Newman NJ, Yu-Wai-Man P, Carelli V. Intravitreal gene therapy versus natural history in patients with Leber hereditary optic neuropathy carrying the m.11778G>A ND4 mutation: systematic review and indirect comparison. Front Neurosci 2021; doi: 10.3389/fneur.2021.662838. [Google Scholar]
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Mécanisme d’action de lenadogene nolparvovec. Le vecteur viral lenadonegene nolparvovec (rAAV2/2-ND4) transduit les cellules ganglionnaires de la rétine par endocytose. L’ADN simple brin du vecteur est ensuite transféré dans le noyau cellulaire, où un brin d’ADN complémentaire est synthétisé. L’ADN thérapeutique subsiste alors dans le noyau de la cellule hôte sous forme d’épisome (ADN circulaire), sans s’intégrer à son génome. Le gène thérapeutique est transcrit en ARN messager qui comporte une séquence de ciblage mitochondrial (MTS) à ses deux extrémités. Cette séquence permet d’acheminer l’ARN messager à la surface des mitochondries, où la protéine ND4 thérapeutique est synthétisée, avant d’être importée dans la matrice mitochondriale pour compenser le dysfonctionnement de la chaîne respiratoire. |
| Dans le texte | |
 |
Figure 2. Taux de patients répondeurs dans les études RESCUE et REVERSE. Le taux de patients ayant une réponse visuelle dans au moins un œil, deux ans après l’injection intravitréenne unilatérale de lenadogene nolparvovec (LUMEVOQ®) est présenté pour les réponses suivantes : 1) CRR (clinically relevant recovery), définie comme un gain d’acuité visuelle, par rapport au nadir, d’au moins 10 lettres ETDRS pour les yeux qui pouvaient lire les lettres du tableau ETDRS (on-chart) à leur nadir, ou, pour les yeux qui ne pouvaient plus lire les lettres de ce tableau (off-chart), un passage on-chart avec au moins la première ligne du tableau (5 lettres) lue à 1 mètre ; 2) une amélioration de l’acuité visuelle par rapport au nadir équivalente à au moins 15 lettres ETDRS (-0,3 LogMAR). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




