| Issue |
Med Sci (Paris)
Volume 32, Number 2, Février 2016
|
|
|---|---|---|
| Page(s) | 198 - 203 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20163202014 | |
| Published online | 02 March 2016 | |
Aide à l’activation ovocytaire
Un nouvel atout dans le traitement des infertilités masculines sévères
Assisted oocyte activation: a new tool for severe male factor infertility treatment
1
CHU de Rennes, laboratoire de biologie de la reproduction, 16, boulevard de Bulgarie, F-35033 Rennes, France
2
Université de Rennes1, faculté de médecine, F-35043 Rennes, France
3
Inserm, IRSET U1085, F- 35042 Rennes, France
4
CHU de Rennes, département de gynécologie-obstétrique et reproduction humaine, F-35033 Rennes, France
Pour les cas d’infertilité masculine sévère, la technique de fécondation in vitro (FIV) avec micro-injection intracytoplasmique du spermatozoïde (ICSI) dans l’ovocyte représente le seul recours thérapeutique. Néanmoins, certains couples pris en charge en ICSI présentent des échecs complets de fécondation. Dans de nombreux cas, ces échecs trouvent leur origine dans un défaut d’augmentation du calcium intracellulaire nécessaire à l’activation de l’ovocyte. Depuis une vingtaine d’années, certains laboratoires étrangers d’aide médicale à la procréation proposent l’utilisation d’un ionophore calcique qui permet de rétablir l’activation ovocytaire. Cette revue a pour but de faire un bilan évaluant les progrès et les risques inhérents à cette nouvelle technique d’aide à l’activation ovocytaire.
Abstract
In severe male infertility, in vitro fertilization (IVF) with intra-cytoplasmic sperm injection (ICSI) represents the sole available therapeutic option. However this technique is not always successful in promoting fertilization, as some couples completely and repeatedly fail to obtain any embryo. In many cases, this failure can be attributed to a defective rise in intracellular calcium, which is required to achieve oocyte activation. Over the last twenty years, several laboratories dedicated to assisted reproduction technologies have been using a calcium ionophore to assist oocyte activation. The aim of this review is to give an overview of the advances and consequences associated with this new technique referred to as assisted oocyte activation.
© 2016 médecine/sciences – Inserm
À l’heure actuelle, 1 à 3 % des couples pris en charge pour une fécondation in vitro (FIV) avec micro-injection intracytoplasmique du spermatozoïde (ICSI) n’obtiennent aucun embryon. Cette technique d’aide à la procréation consiste en l’injection d’un seul spermatozoïde dans l’ovocyte. Les échecs complets de fécondation seraient dus à un défaut de signalisation calcique. En effet, l’adjonction in vitro d’un ionophore calcique dans le milieu de culture embryonnaire permet l’activation de l’ovocyte. Cette technique, appelée aide à l’activation avocytaire, reste controversée. Son utilisation en reproduction humaine peut faire craindre des problèmes de sécurité sanitaire. Pourtant à l’étranger, plusieurs laboratoires d’aide médicale à la procréation ont mis en œuvre cette technique depuis plusieurs années et obtiennent la naissance de plusieurs dizaines d’enfants. Cette revue a pour but de faire un bilan évaluant les progrès et les risques inhérents à cette nouvelle technique.
Rôle du calcium dans l’activation ovocytaire
L’activation ovocytaire désigne l’ensemble des modifications moléculaires, structurales et morphologiques qui caractérisent la transition entre ovocyte et embryon. Avant sa fécondation, l’ovocyte mature est bloqué au stade de métaphase de deuxième division méiotique. La sortie de méiose repose en partie sur l’inactivation du MPF (M-phase promoting factor), un hétérodimère protéique constitué de la kinase cycline-dépendante CDK1 (cyclin dependent kinase 1) et de la cycline B. Les études menées utilisant le modèle murin ont montré que l’augmentation de la concentration intracellulaire en ions calciques permet l’activation de la kinase CaMKII (protéine kinase II calmoduline dépendante) qui phosphoryle la protéine Emi2 (early mitotic inhibitor 2), ce qui entraîne sa dégradation. Il y a ainsi levée de l’inhibition exercée par Emi2 sur l’APC (anaphase promoting complex), provoquant la dégradation de ses substrats, sécurine et cycline B. La sécurine se détache de la protéase séparase qui devient ainsi active et clive les cohésines qui maintenaient associées les chromatides maternelles, permettant la séparation des chromatides sœurs (assurant une ploïdie correcte de l’embryon) et l’extrusion du deuxième globule polaire [1] (→). La dégradation de la cycline B permet l’inactivation de la kinase CDK1 qui maintenait l’ovocyte au stade métaphase II. En conséquence, l’ovocyte sort de méiose et forme les pronoyaux femelle et mâle [2]. En addition de son action sur le MPF et la sécurine, le signal calcique de la fécondation permet également l’exocytose des granules corticaux (contribuant à empêcher la polyspermie) et le recrutement des ARN messagers maternels pour leur traduction en protéines nécessaires aux premiers stades du développement embryonnaire [3].
(→) Voir la Synthèse de F. Pellestor, m/s n° 6-7, juin-juillet 2004, page 691
Existence d’un facteur spermatique d’activation ovocytaire
Chez les mammifères, l’augmentation de calcium intracellulaire qui est déclenchée par la fécondation est réalisée par une série d’oscillations calciques survenant dans l’ovocyte juste après la fusion gamétique (Figure 1). Ces oscillations seraient déclenchées par un facteur cytosoluble d’origine spermatique, libéré dans le cytoplasme ovocytaire au moment de la fusion des gamètes. Les Anglo-Saxons utilisent le terme SOAF pour sperm oocyte-activating factor, mais l’identité de ce facteur est restée élusive durant de nombreuses années [4]. En 2002, on a proposé la phospholipase C Zeta (PLCζ), une protéine qui chez les mammifères est exclusivement exprimée dans les spermatozoïdes [5]. Il a ainsi été démontré que l’injection dans l’ovocyte de souris d’ARN complémentaire codant pour la PLCζ générait des oscillations calciques similaires à celles observées lors de la fécondation par un spermatozoïde. Le rôle de la PLCζ a depuis été confirmé par d’autres groupes de recherche indépendants [6] et en particulier par Kouchi et al. [7]. Ces auteurs ont utilisé la protéine PLCζ recombinante pour générer avec succès des oscillations calciques dans des ovocytes murins. La PLCζ appartient à la famille des phospholipases qui hydrolysent le phosphatidylinositol-4,5-diphosphate (PIP2) [8] (→). Le PIP2 est un phospholipide constituant des membranes cellulaires qui joue le rôle de substrat pour plusieurs protéines importantes de la signalisation cellulaire. PIP2 est hydrolysé en diacylglycérol (DAG) et en inositol triphosphate (IP3). Le DAG reste ancré à la membrane ovocytaire tandis que l’IP3 diffuse dans le cytoplasme cellulaire. La liaison de l’IP3 à son récepteur permet la libération d’ions calciques stockés dans le réticulum endoplasmique (Figure 2). Le récepteur de l’IP3 est sensible au calcium et se referme lorsque le calcium intracellulaire est trop élevé [9]. Ainsi, tant que l’IP3 est synthétisé, et jusqu’à ce que les récepteurs soient désensibilisés, le calcium du réticulum sera libéré à chaque baisse de la concentration de calcium intracellulaire, après remplissage des stocks du réticulum, ce qui explique le caractère oscillant du signal calcique.
(→) Voir la Synthèse de J. Viaud et B. Payrastre, m/s n° 11, novembre 2015, page 996
 |
Figure 1. Oscillations calciques enregistrées lors de la fécondation d’un ovocyte de souris. L’indicateur calcique utilisé est le Fura-red (sonde fluorescente dont la longueur d’onde d’excitation change après liaison du calcium permettant ainsi une mesure ratiométrique de la concentration en calcium intracellulaire). Les variations de la concentration en Ca2+ intracellulaire sont exprimées en unités arbitraires de fluorescence (© image : G. Halet). |
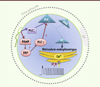 |
Figure 2. Voie de signalisation déclenchant la libération et les oscillations de calcium lors de la fécondation. GP : globule polaire ; PLC : phospholipase C ; PAWP : post-acrosomal WW-domain binding protein ; YAP : yes-associated protein ; PIP2 : phosphatidylinositol 4,5 bisphosphate ; DAG : diacylglycérol ; IP3 : inositol triphosphate ; IP3R : récepteur de l’IP3. |
Le rôle fondamental de la protéine spermatique PLCζ dans la fécondation a été confirmé dans des études cliniques qui rapportent son absence [10] ou l’existence de mutations entraînant sa non fonctionnalité [11] chez des patients infertiles. L’ajout d’ARN complémentaires de PLCζ permet de rétablir les oscillations calciques dans les ovocytes murins injectés avec les spermatozoïdes de patients infertiles qui ne comportent pas de PLCζ [12]. Récemment, un second candidat a été proposé par Aarabi et al. [13]. Le rôle de la protéine spermatique PAWP (post-acrosomal WW-domain binding protein) dans la fécondation avait d’abord été suggéré par Wu et al. [14]. L’étude d’Aarabi et al. [13] a suggéré que PAWP pourrait générer des oscillations calciques par une voie de signalisation qui reste encore à élucider. Une hypothèse reposerait sur la possibilité d’une liaison de la phospholipase C gamma (PLCγ) à une protéine ovocytaire YAP (yes-associated protein) qui interagirait avec le domaine SH3 (SRC homology 3 domain) de la PLCγ, permettant la synthèse d’IP3 (Figure 2). Cependant cette hypothèse reste controversée [4]. En effet, d’autres chercheurs n’arrivent pas à obtenir de telles oscillations calciques avec PAWP [15]. Des études cliniques seront sans doute nécessaires pour confirmer ou infirmer le rôle joué par cette protéine.
Diagnostic étiologique
Un couple sur sept présente une infertilité. Dans la moitié des cas, une cause masculine en est responsable. Le bilan étiologique initial masculin se fait à partir du spermogramme qui évalue le nombre de spermatozoïdes et leur mobilité, ainsi que sur le spermocytogramme qui analyse leur morphologie. En cas d’altération majeure des paramètres spermatiques, tout patient présentant une oligozoospermie importante se verra proposer, dans un second temps, un caryotype. Par leur fréquence, les anomalies du caryotype représentent en effet la cause génétique majeure de défaut de production des spermatozoïdes. Elles peuvent être classées en deux grandes catégories, celles affectant le nombre des chromosomes (ou aneuploïdies), et celles touchant leur structure. Si certaines d’entre elles sont associées à un syndrome clinique particulier, d’autres peuvent se révéler uniquement par un phénotype d’infertilité [16]. De nombreuses mutations géniques, non diagnostiquées par le caryotype, ont été décrites chez des hommes infertiles, mais chaque mutation ne concerne qu’un très faible nombre de patients et leur recherche n’est pas réalisée en routine dans les bilans d’infertilité. Néanmoins, certaines mutations sont recherchées pour des phénotypes spermatiques particuliers ou tératozoospermie1 monomorphe. Ainsi, on recherchera une mutation du gène AURKC (aurora kinase C) en cas de macrocéphalie (tête anormalement grande) des spermatozoïdes [17], ou une mutation dans le gène DNAH5 (dynein, axonemal, heavy chain 5) en cas de dyskinésie flagellaire (anomalie du mouvement des spermatozoïdes) [18]. La globozoospermie (spermatozoïdes à tête ronde) est une forme de tératozoospermie monomorphe relativement rare avec une incidence inférieure à 0,1 % chez les hommes infertiles, essentiellement caractérisée par des spermatozoïdes à tête ronde dépourvus d’acrosome2. Des mutations ou des délétions dans trois gènes, SPATA16 (spermatogenesis-associated protein 16), PICK1 (qui code une protéine interagissant avec la protéine kinase Cα) et DPY19L2 (dpy-19-like 2), ont été retrouvées chez des patients globozoospermiques [19]. De façon intéressante, PLCζ est absente ou très diminuée dans les spermatozoïdes des patients globozoospermiques porteurs d’une anomalie de DPY19L2 [20]. Cette délétion engendrerait un défaut de compaction de la chromatine dans les spermatozoïdes [21]. Les patients porteurs d’une mutation de ce gène pourraient ainsi être candidats à l’ICSI avec aide à l’activation ovocytaire. Mais la question se pose sur les risques associés à cette mutation. L’étude de souris déficientes pour le gène DPY19L2 montre un faible taux de développement embryonnaire associé à un échec d’implantation [21]. Un faible taux de développement et l’absence d’implantation d’embryons humains obtenus par ICSI pour les patients présentant une délétion de DPY19L2 sont également rapportés. L’infertilité masculine liée à l’absence de PLCζ fonctionnelle dans les spermatozoïdes des patients, se traduit donc par un défaut de libération du calcium intracellulaire et, par conséquent, par l’absence d’activation ovocytaire. Ce déficit peut être diagnostiqué cliniquement grâce à un test hétérospécifique « MOAT » (mouse oocyte activation test). Ce test consiste à injecter les spermatozoïdes des patients dans des ovocytes de souris et à mesurer les modifications de calcium intracellulaire dans les 3 heures qui suivent la fécondation hétérospécifique [22].
Implication thérapeutique
Lors de la manipulation de micro-injection, le spermatozoïde introduit dans la pipette est injecté dans l’ovocyte avec une faible quantité de cytoplasme de celui-ci qui a été préalablement aspiré. Pour permettre la libération du SOAF (sperm oocyte-activating factor), l’immobilisation préalable du spermatozoïde, réalisée par le cisaillement de son flagelle afin d’endommager sa membrane plasmique, est nécessaire [23] (→). Une partie des infertilités d’origine masculine pourrait être expliquée par l’absence de SOAF fonctionnel. Elle pourrait entraîner 2 à 3 % d’échec complet de fécondation observés lors d’une prise en charge en ICSI.
(→) Voir la Nouvelle de J.P. Wolf et al., m/s n° 5, mai 2007, page 475
L’adjonction d’un ionophore calcique dans le milieu de culture embryonnaire est une méthode utilisée dans de nombreux essais cliniques qui a démontré son efficacité (Tableau I). Ainsi, l’utilisation transitoire d’A23187 (un antibiotique également connu sous le nom de calcimycine) (Figure 3) provoque une augmentation transitoire de la concentration intracellulaire d’ions calciques (Ca2+) dans les ovocytes, permettant la sortie de méiose de cet ovocyte et la fécondation, induisant l’activation de la transduction du signal et mimant l’action de la PLCζ sur celui-ci. Cette fonction est appelée « déclencheur ». Néanmoins, il existe une différence notable de la signalisation calcique induite par ce procédé comparée au processus physiologique. En effet, l’ionophore calcique provoque une entrée massive de calcium et une augmentation en plateau de la concentration en calcium intracellulaire dans l’ovocyte jusqu’au rinçage de la molécule, contrairement au processus physiologique qui implique l’induction d’oscillations calciques pouvant perdurer après l’expulsion du deuxième globule polaire [24]. Ce signal, induit artificiellement, diffère donc qualitativement de celui observé lors d’une fécondation par FIV (fécondation in vitro) ou ICSI (intracytoplasmic sperm injection). Cette différence de signal pourrait avoir une répercussion sur la régulation génique. Si on ne peut pas envisager d’effet direct sur la transcription pendant les 2 à 3 heures que durent les oscillations calciques (car il n’y a pas de transcription possible dans l’ovocyte bloqué au stade de métaphase de deuxième division), on ne peut toutefois pas exclure un risque d’altérations épigénétiques qui représente un risque qui est bien documenté chez la souris pour la culture in vitro des embryons [25–27].
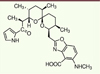 |
Figure 3. Ionophore calcique A23187 également appelé calcimycine. La formule chimique est C29H37N3O6. Il s’agit du 5-(méthylamino)-2-({(2R,3R,6S,8S,9R,11R)-3,9,11-triméthyl-8-[(1S)-1-méthyl-2-oxo-2-(1H-pyrrol-2-yl)éthyl]-1,7-dioxaspiro[5.5]undec-2-yl}méthyl)-1,3-benzoxazole-4-carboxylic acide. Cette molécule forme un complexe avec les ions divalents et en particulier le calcium (Ca2+), permettant ainsi à ces ions de traverser la membrane plasmique et de pénétrer à l’intérieur de l’ovocyte. L’augmentation de la concentration en calcium intracellulaire qui en résulte déclenche l’activation d’un ensemble de processus enzymatiques nécessaires à la fécondation. |
Différents protocoles d’utilisation du ionophore calcique selon les équipes médicales. spz : spermatozoïde ; ICSI : intracytoplasmic sperm injection.
Malgré ces réserves, de nombreuses équipes étrangères proposent déjà aux couples pris en charge dans leur centre d’assistance médicale à la procréation, une assistance à l’activation ovocytaire. Cette aide à l’activation ovocytaire, couplée à l’ICSI, augmente les taux de fécondation de façon significative chez les couples présentant des anomalies de fécondation (Tableau II). L’ionophore calcique A23187 est couramment utilisé depuis les années 1990 pour initier l’activation ovocytaire. Il a déjà permis d’obtenir des grossesses chez des patientes présentant des échecs de fécondation en ICSI ou des taux faibles de fécondation. Tesarik et Testart [28] ont été les premiers à activer des ovocytes humains avec l’ionophore calcique A23187 après ICSI. Hoshi et al. [29] ont rapporté la première grossesse obtenue par ICSI avec l’assistance de cet ionophore calcique. Alternativement, le chlorure de strontium (SrCl2) peut également initier l’activation ovocytaire et plusieurs équipes ont rapporté la naissance d’enfants en bonne santé et présentant un développement normal grâce au SrCl2 [30, 31]. Cependant, le SrCl2 semble moins efficace que l’A23187 et les données actuelles de la littérature recommandent l’utilisation de l’ionophore calcique qui reste la technique donnant des résultats satisfaisants en termes de déclenchement de la fécondation [32]. Cette molécule vient d’être mise sur le marché européen (CultActiv - Gynemed, Allemagne) pour une utilisation autorisée chez l’humain [32].
Indications d’utilisation de l’activation ovocytaire, effectifs traités et résultats des différents pays dans lesquels cette technique est autorisée. Les cas cliniques n’ont pas été inclus dans ce tableau.
Suivi des individus nés par activation ovocytaire assistée
Les conséquences de l’exposition au ionophore calcique au stade zygote sur le développement pré- et post-implantatoire a été d’abord étudié chez la souris. Les données actuelles rapportent un développement normal des portées [32]. Cependant, des études restent nécessaires pour évaluer d’éventuelles modifications épigénétiques liées spécifiquement à l’utilisation du ionophore calcique. En effet, chez la souris, des effets délétères à long terme des techniques d’assistance médicales assistées ont été rapportés, entraînant des dysfonctions vasculaires et une diminution de l’espérance de vie [33]. S’il est difficile de confirmer ces résultats chez l’homme, en raison des contraintes méthodologiques, il n’en demeure pas moins indispensable de suivre au long cours les enfants issus de ces techniques. Yoon et al. [34] rapportent la naissance de 38 enfants en bonne santé. Takisawa et al. [35] ont rapporté la naissance de 22 bébés nés après activation ovocytaire. Dix d’entre eux sont nés après exposition au ionophore A23187 et 12 enfants sont nés après exposition au chlorure de strontium. La croissance et la santé des bébés de ces deux groupes ne seraient pas différentes. Sato et al. [36] ont suivi la croissance de 21 enfants nés après activation ovocytaire. Vanden Meerschaut et al. [37] ont rapporté une autre série de 21 enfants âgés de 3 à 10 ans dont le développement était également normal. Deemeh et al. [38] ont rapporté une cohorte de 79 enfants, nés après ICSI et activation ovocytaire, qui ne présentent pas plus d’anomalies que les enfants issus d’ICSI classique. Seule l’équipe d’Ebner [39] rapporte une malformation anorectale (atrésie anale) dans une cohorte de 35 enfants nés après activation ovocytaire. Les risques d’anomalies seraient donc les mêmes que lors d’une ICSI classique. Cependant, les premiers enfants nés grâce à cette nouvelle technique ont aujourd’hui 20 ans. Seul le suivi prolongé des individus nés par aide à l’activation ovocytaire permettra de confirmer l’absence de complications qui pourraient apparaître plus tardivement à l’âge adulte, voire à la descendance.
Conclusion
À l’heure actuelle, plusieurs dizaines d’enfants sont nés grâce à une FIV/ICSI avec activation ovocytaire par ionophore calcique. Ce nouveau protocole, dont l’utilisation n’est pas autorisée en France, apporte réellement un nouvel espoir thérapeutique aux couples en échec complet de fécondation en ICSI. Aucun problème de santé spécifiquement lié à l’utilisation de cette aide à l’activation ovocytaire n’a été décrit à ce jour. Cependant, plusieurs décennies seront nécessaires pour véritablement évaluer les risques sur la santé des individus nés grâce à cette procédure. Si le bénéfice est immédiat pour les couples en attente d’une grossesse tant désirée, l’utilisation de cette nouvelle technique expose également au risque d’une augmentation future des causes génétiques d’infertilité. En effet, grâce aux techniques d’assistance médicale à la procréation, les hommes infertiles peuvent à présent transmettre une éventuelle anomalie génétique à leur descendance. La sélection naturelle qui prévenait la transmission de ces anomalies en entraînant une infertilité se trouve aujourd’hui court-circuitée par la technologie.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Pellestor F. Âge maternel et anomalies chromosomiques dans les ovocytes humains. Med Sci (Paris) 2004 ; 20 : 691–696. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Jones KT Mammalian egg activation: from Ca2+ spiking to cell cycle progression. Reproduction 2005 ; 130 : 813–823. [CrossRef] [PubMed] [Google Scholar]
- Krauchunas AR, Wolfner MF. Molecular changes during egg activation. Curr Top Dev Biol 2013 ; 102 : 267–292. [CrossRef] [PubMed] [Google Scholar]
- Amdani SN, Yeste M, Jones C, Coward K. Sperm factors and oocyte activation: current controversies and considerations. Biol Reprod 2015 ; 93 : 50. [CrossRef] [PubMed] [Google Scholar]
- Saunders CM, Larman MG, Parrington J, et al. PLC zeta: a sperm-specific trigger of Ca2+ oscillations in eggs and embryo development. Development 2002 ; 129 : 3533–3544. [PubMed] [Google Scholar]
- Yoon SY, Eum JH, Lee JE, et al. Recombinant human phospholipase C zeta 1 induces intracellular calcium oscillations and oocyte activation in mouse and human oocytes. Hum Reprod 2012 ; 27 : 1768–1780. [CrossRef] [PubMed] [Google Scholar]
- Kouchi Z, Fukami K, Shikano T, et al. Recombinant phospholipase C zeta has high Ca2+ sensitivity and induces Ca2+oscillations in mouse eggs. J Biol Chem 2004 ; 279 : 10408–10412. [CrossRef] [PubMed] [Google Scholar]
- Viaud J, Payrastre B. Les phosphoinositides : ces lipides qui coordonnent la dynamique cellulaire. Med Sci (Paris) 2015 ; 31 : 996–1005. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Hajnóczky G, Thomas AP. Minimal requirements for calcium oscillations driven by the IP3 receptor. EMBO J 1997 ; 16 : 3533–3543. [CrossRef] [PubMed] [Google Scholar]
- Yoon SY, Jellerette T, Salicioni AM, et al. Human sperm devoid of PLC Zeta1 fail to induce Ca2+ release and are unable to initiate the first step of embryo development. J Clin Invest 2008 ; 118 : 3671–3681. [CrossRef] [PubMed] [Google Scholar]
- Kashir J, Konstantinidis M, Jones C, et al. A maternally inherited autosomal point mutation in human phospholipase C zeta (PLCζ) leads to male infertility. Hum Reprod 2012 ; 27 : 222–231. [CrossRef] [PubMed] [Google Scholar]
- Yoon HJ, Kim HJ, Bae IH, et al. An effective method for improving outcomes in patients with a fertilization defect. Clin Exp Reprod Med 2014 ; 41 : 137–139. [CrossRef] [PubMed] [Google Scholar]
- Aarabi M, Balakier H, Bashar S, et al. Sperm-derived WW domain-binding protein, PAWP, elicits calcium oscillations and oocyte activation in humans and mice. FASEB J 2014 ; 28 : 4434–4440. [CrossRef] [PubMed] [Google Scholar]
- Wu AT, Sutovsky P, Manandhar G, et al. PAWP, a sperm-specific WW domain-binding protein, promotes meiotic resumption and pronuclear development during fertilization. J Biol Chem 2007 ; 282 : 12164–12175. [CrossRef] [PubMed] [Google Scholar]
- Nomikos M, Sanders JR, Theodoridou M, et al. Sperm-specific post-acrosomal WW-domain binding protein (PAWP) does not cause Ca2+ release in mouse oocytes. Mol Hum Reprod 2014 ; 20 : 938–947. [CrossRef] [PubMed] [Google Scholar]
- Ravel C, Siffroi JP. Y chromosome and spermatogenesis. Gynecol Obstet Fertil 2009 ; 37 : 901–907. [CrossRef] [PubMed] [Google Scholar]
- Chianese C, Fino MG, Riera Escamilla A, et al. Comprehensive investigation in patients affected by sperm macrocephaly and globozoospermia. Andrology 2015 ; 3 : 203–212. [CrossRef] [PubMed] [Google Scholar]
- Ravel C, Chantot-Bastaraud S, Siffroi JP, et al. Tail stump syndrome associated with chromosomal translocation in two brothers attempting intracytoplasmic sperm injection. Fertil Steril 2006 ; 86 : 719.e1-7. [CrossRef] [PubMed] [Google Scholar]
- De Braekeleer M, Nguyen MH, Morel F, Perrin A. Genetic aspects of monomorphic teratozoospermia: a review. J Assist Reprod Genet 2015 ; 32 : 615–623. [CrossRef] [PubMed] [Google Scholar]
- Escoffier J, Yassine S, Lee HC, et al. Subcellular localization of phospholipase Cζ in human sperm and its absence in DPY19L2-deficient sperm are consistent with its role in oocyte activation. Mol Hum Reprod 2015 ; 21 : 157–168. [CrossRef] [PubMed] [Google Scholar]
- Yassine S, Escoffier J, Martinez G, et al. Dpy19l2-deficient globozoospermic sperm display altered genome packaging and DNA damage that compromises the initiation of embryo development. Mol Hum Reprod 2015 ; 21 : 169–185. [CrossRef] [PubMed] [Google Scholar]
- Vanden Meerschaut F, Leybaert L, Nikiforaki D, et al. Diagnostic and prognostic value of calcium oscillatory pattern analysis for patients with ICSI fertilization failure. Hum Reprod 2013 ; 28 : 87–98. [CrossRef] [PubMed] [Google Scholar]
- Wolf JP, Ziyyat A, Ciapa B. ICSI et signalisation calcique. Med Sci (Paris) 2007 ; 23 : 475–477. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Halet G, Marangos P, Fitzharris G, Carroll J. Ca2+ oscillations at fertilization in mammals. Biochem Soc Trans 2003 ; 31 : 907–911. [CrossRef] [PubMed] [Google Scholar]
- Ecker DJ, Stein P, Xu Z, et al. Long-term effects of culture of preimplantation mouse embryos on behavior. Proc Natl Acad Sci USA 2004 ; 101 : 1595–1600. [CrossRef] [Google Scholar]
- Fernandez-Gonzalez R, Moreira PN, Perez-Crespo M, et al. Long-term effects of mouse intracytoplasmic sperm injection with DNA-fragmented sperm on health and behavior of adult offspring. Biol Reprod 2008 ; 78 : 761–772. [CrossRef] [PubMed] [Google Scholar]
- Fernandez-Gonzale R, Ramirez MA, Pericuesta E, et al. Histone modifications at the blastocyst Axin1(Fu) locus mark the heritability of in vitro culture-induced epigenetic alterations in mice. Biol Reprod 2010 ; 83 : 720–727. [CrossRef] [PubMed] [Google Scholar]
- Tesarik J, Testart J. Treatment of sperm-injected human oocytes with Ca2+ ionophore supports the development of Ca2+ oscillations. Biol Reprod 1994 ; 51 : 385–391. [CrossRef] [PubMed] [Google Scholar]
- Hoshi K, Yanagida K, Yazawa H, et al. Intracytoplasmic sperm injection using immobilized or motile human spermatozoon. Fertil Steril 1995 ; 63 : 1241–1245. [PubMed] [Google Scholar]
- Yanagida K, Morozumi K, Katayose H, et al. Successful pregnancy after ICSI with strontium oocyte activation in low rates of fertilization. Reprod Biomed Online 2006 ; 13 : 801–806. [CrossRef] [PubMed] [Google Scholar]
- Kyono K, Kumagai S, Nishinaka C, et al. Birth and follow-up of babies born following ICSI using SrCl2 oocyte activation. Reprod Biomed Online 2008 ; 17 : 53–58. [CrossRef] [PubMed] [Google Scholar]
- Vanden Meerschaut F, Nikiforaki D, Heindryckx B, De Sutter P. Assisted oocyte activation following ICSI fertilization failure. Reprod Biomed Online 2014 ; 28 : 560–571. [CrossRef] [PubMed] [Google Scholar]
- Rexhaj E, Paoloni-Giacobino A, Rimoldi SF, et al. Mice generated by in vitro fertilization exhibit vascular dysfunction and shortened life span. J Clin Invest 2013 ; 123 : 5052–5060. [CrossRef] [PubMed] [Google Scholar]
- Yoon HJ, Bae IH, Kim HJ, et al. Analysis of clinical outcomes with respect to spermatozoan origin after artificial oocyte activation with a calcium ionophore. J Assist Reprod Genet 2013 ; 30 : 1569–1575. [CrossRef] [PubMed] [Google Scholar]
- Takisawa T, Doshida M, Hattori H, et al. Effect of oocyte activation by calcium ionophore A23187 or strontium chloride in patients with low fertilization rates and follow-up of babies. Hum Reprod 2011 ; 26 : P-141. [Google Scholar]
- Sato Y, Nakamura Y, Sakamoto E, et al. Follow up of children following new technology: TESE, IVM, and oocyte activation. Hum Reprod 2011 ; 26 : P-394. [Google Scholar]
- Vanden Meerschaut F, D’Haeseleer E, Gysels H, et al. Neonatal and neurodevelopmental outcome of children aged 3–10 years born following assisted oocyte activation. Reprod Biomed Online 2014 ; 28 : 54–63. [CrossRef] [PubMed] [Google Scholar]
- Deemeh MR, Tavalaee M, Nasr-Esfahani MH. Health of children born through artificial oocyte activation: a pilot study. Reprod Sci 2015 ; 22 : 322–328. [CrossRef] [PubMed] [Google Scholar]
- Ebner T, Montag M; Oocyte Activation Study Group, et al. Live birth after artificial oocyte activation using a ready-to-use ionophore: a prospective multicentre study. Reprod Biomed Monline 2015 ; 30 : 359–365. [CrossRef] [Google Scholar]
- Heindryckx B, Van der Elst J, De Sutter P, Dhont M. Treatment option for sperm- or oocyte-related fertilization failure: assisted oocyte activation following diagnostic heterologous ICSI. Hum Reprod 2005 ; 20 : 2237–2241. [CrossRef] [PubMed] [Google Scholar]
- Moaz MN, Khattab S, Foutouh IA, Mohsen EA. Chemical activation of oocytes in different types of sperm abnormalities in cases of low or failed fertilization after ICSI: a prospective pilot study. Reprod Biomed Online 2006 ; 13 : 791–794. [CrossRef] [PubMed] [Google Scholar]
- Heindryckx B, De Gheselle S, Gerris J, et al. Efficiency of assisted oocyte activation as a solution for failed intracytoplasmic sperm injection. Reprod Biomed Online 2008 ; 17 : 662–668. [CrossRef] [PubMed] [Google Scholar]
- Kyono K, Kumagai S, Nishinaka C, et al. Birth and follow-up of babies born following ICSI using SrCl2 oocyte activation. Reprod Biomed Online 2008 ; 17 : 53–58. [CrossRef] [PubMed] [Google Scholar]
- Borges E Jr, de Almeida Ferreira Braga DP, de Sousa Bonetti TC, et al. Artificial oocyte activation with calcium ionophore A23187 in intracytoplasmic sperm injection cycles using surgically retrieved spermatozoa. Fertil Steril 2009 ; 92 : 131–136. [CrossRef] [PubMed] [Google Scholar]
- Ebner T, Köster M, Shebl O, et al. Application of a ready-to-use calcium ionophore increases rates of fertilization and pregnancy in severe male factor infertility. Fertil Steril 2012 ; 98 : 1432–1437. [CrossRef] [PubMed] [Google Scholar]
- Montag M, Köster M, van der Ven K, et al. The benefit of artificial oocyte activation is dependent on the fertilization rate in a previous treatment cycle. Reprod Biomed Online 2012 ; 24 : 521–526. [CrossRef] [PubMed] [Google Scholar]
- Kuentz P, Vanden Meerschaut F, Elinati E, et al. Assisted oocyte activation overcomes fertilization failure in globozoospermic patients regardless of the DPY19L2 status. Hum Reprod 2013 ; 28 : 1054–1061. [CrossRef] [PubMed] [Google Scholar]
- Ebner T, Oppelt P, Wöber M, et al. Treatment with Ca2+ ionophore improves embryo development and outcome in cases with previous developmental problems: a prospective multicenter study. Hum Reprod 2015 ; 30 : 97–102. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Différents protocoles d’utilisation du ionophore calcique selon les équipes médicales. spz : spermatozoïde ; ICSI : intracytoplasmic sperm injection.
Indications d’utilisation de l’activation ovocytaire, effectifs traités et résultats des différents pays dans lesquels cette technique est autorisée. Les cas cliniques n’ont pas été inclus dans ce tableau.
Liste des figures
 |
Figure 1. Oscillations calciques enregistrées lors de la fécondation d’un ovocyte de souris. L’indicateur calcique utilisé est le Fura-red (sonde fluorescente dont la longueur d’onde d’excitation change après liaison du calcium permettant ainsi une mesure ratiométrique de la concentration en calcium intracellulaire). Les variations de la concentration en Ca2+ intracellulaire sont exprimées en unités arbitraires de fluorescence (© image : G. Halet). |
| Dans le texte | |
 |
Figure 2. Voie de signalisation déclenchant la libération et les oscillations de calcium lors de la fécondation. GP : globule polaire ; PLC : phospholipase C ; PAWP : post-acrosomal WW-domain binding protein ; YAP : yes-associated protein ; PIP2 : phosphatidylinositol 4,5 bisphosphate ; DAG : diacylglycérol ; IP3 : inositol triphosphate ; IP3R : récepteur de l’IP3. |
| Dans le texte | |
 |
Figure 3. Ionophore calcique A23187 également appelé calcimycine. La formule chimique est C29H37N3O6. Il s’agit du 5-(méthylamino)-2-({(2R,3R,6S,8S,9R,11R)-3,9,11-triméthyl-8-[(1S)-1-méthyl-2-oxo-2-(1H-pyrrol-2-yl)éthyl]-1,7-dioxaspiro[5.5]undec-2-yl}méthyl)-1,3-benzoxazole-4-carboxylic acide. Cette molécule forme un complexe avec les ions divalents et en particulier le calcium (Ca2+), permettant ainsi à ces ions de traverser la membrane plasmique et de pénétrer à l’intérieur de l’ovocyte. L’augmentation de la concentration en calcium intracellulaire qui en résulte déclenche l’activation d’un ensemble de processus enzymatiques nécessaires à la fécondation. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




