| Issue |
Med Sci (Paris)
Volume 29, Number 5, Mai 2013
|
|
|---|---|---|
| Page(s) | 515 - 522 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2013295015 | |
| Published online | 28 May 2013 | |
Un complexe moléculaire unique à l’origine de la motilité et de l’invasion des Apicomplexes
The glideosome, a unique machinery that assists the Apicomplexa in gliding into host cells
Département de microbiologie et médecine moléculaire, faculté de médecine, université de Genève, centre médical universitaire, 1 rue Michel Servet, 1211 Genève, Suisse
Le phylum des Apicomplexes comprend des parasites responsables de graves pathologies aussi bien chez l’homme que chez les animaux. Ces protozoaires intracellulaires obligatoires présentent un mode de locomotion unique qui leur permet de franchir des barrières biologiques non permissives et de pénétrer activement dans leurs cellules hôtes. Cette motilité conditionne leur survie et est assurée par le glidéosome, un moteur moléculaire à l’origine des mouvements de glissement du parasite. Les mécanismes impliqués dans la motilité des Apicomplexes, leur attachement et leur invasion de la cellule hôte sont en grande partie conservés à travers les membres du phylum. Cet article décrit l’état actuel de nos connaissances sur le processus d’invasion de deux Apicomplexes : Toxoplasma gondii et Plasmodium falciparum.
Abstract
Protozoan parasites belonging to the phylum Apicomplexa are of considerable medical and veterinary significance. These obligate intracellular parasites use a unique form of locomotion to traverse biological barriers and actively invade in and egress from host cells. An actin-myosin-based complex named “glideosome” drives this unusual substrate-dependent motility, which is essential for the establishment of the infection. The mechanisms involved in motility, invasion and egress are conserved throughout the phylum. This article describes the current knowledge on the invasion process of two experimentally tractable apicomplexan parasites: Toxoplasma gondii and Plasmodium falciparum.
© 2013 médecine/sciences – Inserm
Au sein du phylum des Apicomplexes se trouvent de nombreux pathogènes capables d’infecter aussi bien l’homme que les animaux. Parmi les plus connus, nous pouvons citer Plasmodium, responsable du paludisme (ou malaria) et d’environ un million de morts par an, ou encore le toxoplasme (Toxoplasma gondii), responsable de la toxoplasmose. Cette dernière infection parasitaire est très répandue, un quart de la population mondiale étant infecté de façon chronique. Bien qu’elle soit bénigne et le plus souvent asymptomatique chez les personnes immunocompétentes, la toxoplasmose peut se révéler dangereuse voire fatale en cas d’immunosuppression acquise lors d’une infection virale (Sida, syndrome d’immunodéficience acquise) ou lors de traitements pour un cancer (chimiothérapies) ou une transplantation d’organes (immunosuppresseurs). De plus, la toxoplasmose congénitale (primo-infection chez la femme enceinte), responsable chez le fœtus d’atteintes cérébrales et oculaires importantes, reste encore aujourd’hui une infection sérieuse. Chez les animaux sévissent principalement deux Apicomplexes, avec des conséquences vétérinaires, mais aussi économiques importantes : Eimeria, qui affecte l’industrie de la volaille, et Theileria, qui a des conséquences dévastatrices chez les bovins dans les pays tropicaux et subtropicaux [1].
Les Apicomplexes sont des parasites intracellulaires obligatoires pour lesquels l’entrée dans la cellule hôte est une étape cruciale puisqu’elle va conditionner leur survie. Bien qu’ils aient des cycles de vie complexes et divers alternant entre différents stades et différents hôtes, ces parasites ont en commun d’envahir de façon active leurs cellules cibles en générant eux-mêmes la force motrice nécessaire à leur internalisation. Ils accomplissent cette tâche grâce à un complexe moléculaire appelé glidéosome situé sous leur membrane plasmique et comprenant un moteur de type myosine, dépendant de l’actine, à l’origine de leur mouvement de glissement [2]. Cette machinerie permet au parasite, non seulement d’envahir la cellule hôte, mais aussi d’en ressortir activement après s’y être multiplié. Elle permet aussi au parasite de franchir des barrières biologiques non permissives afin de se disséminer dans les tissus et organes de l’hôte.
Au sein des Apicomplexes, le toxoplasme, et dans une moindre mesure Plasmodium, sont les parasites les plus accessibles génétiquement et expérimentalement, et sont par conséquent les deux organismes les plus étudiés en termes de motilité et d’invasion. Cette revue sera donc centrée sur ces deux parasites et décrira comment la motilité des Apicomplexes leur donne accès à une niche intracellulaire et les prépare à la phase de réplication.
Plusieurs étapes du cycle lytique sont dépendantes de la motilité du parasite
Le cycle lytique du toxoplasme (Figure 1A) et de Plasmodium (cycle intraérythrocytaire) dure environ 48 h. L’étape d’invasion est très rapide. En quelques dizaines de secondes seulement, le parasite s’attache à sa cellule cible par des antigènes de surface, se réoriente de façon à présenter son pôle apical face à la surface de la cellule, et enfin pénètre activement dans celle-ci [3]. Au fur et à mesure de son entrée, le parasite induit la formation d’un nouveau compartiment intracellulaire appelé vacuole parasitophore (VP), dans laquelle il va pouvoir se diviser à l’abri du système immunitaire protégé de la fusion avec les endosomes et lysosomes de la cellule hôte [4]. Cette vacuole est délimitée par une membrane provenant, d’une part de l’invagination de la membrane plasmique de l’hôte et, d’autre part, de la sécrétion active de matériel membranaire parasitaire. Après leur multiplication - par endodyogénie1 pour le toxoplasme et par schizogonie pour Plasmodium [5] -, plusieurs dizaines de parasites vont sortir de la cellule hôte en provoquant sa lyse et se propager dans les cellules voisines, contribuant ainsi à la dissémination de l’infection.
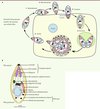 |
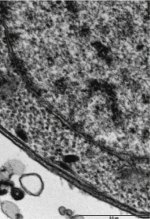
Figure 1. Le cycle lytique des Apicomplexes. A. Cycle lytique du toxoplasme. Ce cycle peut être décomposé en plusieurs étapes : l’attachement du parasite à la surface de la cellule cible (1), sa réorientation (2), son entrée dans la cellule hôte à travers la jonction mobile (3) et la création de la vacuole parasitophore (VP) au sein de laquelle le parasite va se multiplier (4) avant de lyser la membrane de la vacuole puis celle de la cellule (5). Les parasites libérés sont alors capables d’envahir les cellules adjacentes. B. Représentation schématique de l’ultrastructure d’un tachyzoïte de Toxoplasma gondii. |
Chez l’homme, le stade invasif du toxoplasme (tachyzoïte) est capable d’envahir pratiquement tous les types de cellules nucléées, y compris les cellules dendritiques et les macrophages, alors que le sporozoïte et le mérozoïte de Plasmodium infectent, respectivement, les hépatocytes et les globules rouges.
Le cycle lytique du toxoplasme a lieu lors de la primo-infection et constitue la phase aiguë qui est le plus souvent asymptomatique. Rapidement, une réponse spécifique du système immunitaire de l’hôte se développe, induisant la différenciation du parasite en une forme latente enkystée (bradyzoïte) qui persiste durant toute la vie de l’hôte, marquant ainsi la phase chronique et asymptomatique de l’infection toxoplasmique.
Chez Plasmodium, le cycle lytique a lieu d’abord au niveau des cellules hépatiques où il dure sept jours, puis dans les globules rouges dans lesquels le parasite établit un cycle intra-érythrocytaire durant 48 h. Au cours de ce cycle, le parasite modifie la surface de l’érythrocyte pour le rendre capable d’adhérer aux cellules endothéliales vasculaires, ce qui peut perturber le flux sanguin, en particulier dans les capillaires du cerveau, et entraîner des complications comme le paludisme cérébral [6].
Que ce soit pour le toxoplasme ou pour Plasmodium, l’étape d’entrée dans la cellule hôte est fortement dépendante de la motilité du parasite et, par conséquent, déterminante pour la survie du parasite et l’établissement de l’infection. Dans le cas de Plasmodium, cette revue ne traitera que du cycle intra-érythrocytaire.
Des caractéristiques structurales du parasite dédiées à l’invasion
Deux caractéristiques structurales spécifiques des Apicomplexes sont intimement liées à la motilité et à l’invasion. La première est la pellicule qui délimite ces parasites et qui est composée de trois membranes (Figure 1B). Outre la membrane plasmique externe classique, la pellicule comprend un complexe membranaire interne constitué de vésicules aplaties [7]. C’est dans l’espace entre la membrane plasmique et la membrane externe de ce complexe membranaire interne que se trouve le complexe moléculaire qui permet au parasite de se déplacer. De plus, le complexe membranaire interne est relié sur sa face interne aux microtubules du cytosquelette qui permet au parasite de garder une certaine rigidité nécessaire au cours du processus d’invasion (Figure 1B).
La seconde caractéristique structurale des Apicomplexes est la présence d’un complexe apical qui comprend des organites de sécrétion intervenant séquentiellement au cours de l’invasion : les micronèmes, puis les rhoptries (Figure 1B). Les micronèmes sécrètent leur contenu (protéines MIC) en réponse à une augmentation de la concentration cytosolique en calcium du parasite. Ces adhésines vont s’insérer dans la membrane plasmique du parasite et interagir à la fois avec les récepteurs de l’hôte et avec le glidéosome afin de permettre vraisemblablement la réorientation et la motilité du parasite. Durant le processus d’invasion, les rhoptries libèrent des protéines du col (rhoptries neck proteins ou RON) et du bulbe (protéines ROP). Les RON forment un complexe impliqué dans la formation d’une jonction mobile au point de contact des membranes plasmiques du parasite et de la cellule hôte au travers de laquelle le parasite pénètre dans la cellule [3] (Figures 1A et 4).
Les bases moléculaires de la motilité des Apicomplexes
Rôle du cytosquelette d’actine
La contribution de l’actine et d’au moins une myosine dans la motilité du parasite a été suggérée dès les années 1970-1980 [8, 9], mais n’a été confirmée que bien plus tard par l’observation de parasites incapables de bouger et de se propager en présence de composés agissant, soit sur la dynamique de l’actine, soit sur l’activité ATPasique des myosines [10] (Figure 2A).
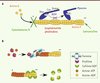 |
Figure 2. Dynamique de l’actine. A. Toxines modulant la dynamique des filaments d’actine et composés agissant sur les myosines. La cytochalasine D se lie aux extrémités barbues (+) et empêche la polymérisation de l’actine ; la jasplakinolide et la phalloïdine peuvent se lier aux filaments d’actine (actine F) et les stabiliser ; la latrunculine favorise la dépolymérisation des filaments en se liant aux monomères d’actine G (globulaire). Toutes ces toxines inhibent la motilité des parasites et par conséquent l’invasion. Le 2,3-butanedione monoxime (BDM) bloque l’activité ATPase des myosines et donc empêche le mouvement des myosines sur les filaments d’actine. L’invasion est alors inhibée. B. Protéines impliquées dans la dynamique de polymérisation et dépolymérisation des filaments d’actine. La profiline se lie aux monomères d’actine-ATP qui peuvent être transférés au filament d’actine naissant à l’extrémité barbue (+). Elle peut aussi favoriser la polymérisation des filaments en se liant au domaine FH1 (formin homology 1) des formines pour délivrer l’actine-ATP globulaire à l’extrémité barbue du filament. Le domaine FH2 des formines initie la polymérisation, puis reste associé à l’extrémité barbue pendant la polymérisation du filament. La cofiline ou ADF (facteur de dépolymérisation de l’actine) dépolymérise les filaments d’actine en se liant aux monomères à l’extrémité pointue (-). |
Contrairement à celle des autres eucaryotes, l’actine des Apicomplexes semble être maintenue principalement sous une forme globulaire. Aucun filament n’est détectable par immunofluorescence ou par ultracentrifugation [11], et les filaments qui ont pu être purifiés chez P. falciparum puis observés par microscopie électronique se sont révélés particulièrement courts [12]. Cette propension à former de courts filaments relativement instables est récemment apparue comme une caractéristique intrinsèque de l’actine des Apicomplexes, car plusieurs résidus contribuant normalement à stabiliser l’interaction entre les monomères chez les eucaryotes ne sont pas conservés [13]. De plus, chez le toxoplasme, les filaments d’actine sont polymérisés au moment même de l’invasion [14], ce qui implique que la dynamique de polymérisation et de dépolymérisation doit être régulée de façon extrêmement précise et locale. Les Apicomplexes possèdent un répertoire de protéines liant l’actine étonnamment restreint comparé aux autres eucaryotes dont l’un des principaux responsables de la « nucléation » des filaments d’actine (c’est-à-dire l’établissement des points d’ancrage de la polymérisation des filaments), le complexe Arp2/3 (actin-related protein 2/3), est notamment absent [15].
Beaucoup d’études tentent de comprendre comment cette régulation a lieu et quels sont les facteurs impliqués. Plusieurs protéines liant l’actine et conservées à travers le phylum ont d’ailleurs récemment été décrites, et leur rôle s’est révélé critique pour la motilité et l’invasion du toxoplasme. Les formines TgFRM1 (Toxoplasma formin 1) et TgFRM2 sont impliquées dans la polymérisation des filaments d’actine [16, 17], alors que la cofiline TgADF (Toxoplasma acting depolymerizing factor) joue un rôle dans leur dépolymérisation [18, 19] et que la profiline TgPRF (Toxoplasma profilin) séquestre les monomères [17, 20] (Figure 2B). Normalement, formine et profiline fonctionnent de façon coopérative afin de stimuler la formation du filament d’actine de part et d’autre du domaine FH2 (formin homology 2 domain) de la formine (Figure 2B). Cependant, chez le toxoplasme, les deux formines sont capables de polymériser l’actine en l’absence de la profiline. De plus, elles fonctionnent de manière coordonnée au niveau de la pellicule pour générer de courts filaments au moment même de la motilité [16]. Par conséquent, en l’absence de complexe Arp2/3, TgFRM1 et TgFRM2 apparaissent comme les principaux facteurs de nucléation des filaments d’actine chez les Apicomplexes, alors que la profiline contribue à maintenir l’actine sous une forme globulaire [17]. Chez Plasmodium, une des formines (PfFRM1) est localisée au niveau du pôle apical du parasite et forme un anneau très précis qui suit la jonction mobile au cours de l’entrée du mérozoïte dans le globule rouge [21]. Récemment, des filaments d’actine ont pu être visualisés par immunofluorescence chez le toxoplasme suite à la délétion conditionnelle du facteur de dépolymérisation des filaments d’actine ADF. Comme attendu, ces parasites se sont révélés incapables d’envahir de façon efficace des cellules hôtes et d’en sortir [19].
Architecture du glidéosome
Le glidéosome est la machinerie moléculaire qui permet au parasite de glisser. Il est composé de six protéines en grande partie conservées au sein du phylum et qui participent au recrutement du complexe, à son ancrage dans la pellicule et à la génération de mouvement (Figure 3). Pour que le complexe puisse assurer un mouvement net du parasite, il est fermement ancré à la fois dans le cytosquelette du parasite, mais aussi indirectement, à la matrice extracellulaire ou aux récepteurs à la surface des cellules hôtes. La nature de ces récepteurs est en partie inconnue, mais la présence d’acide sialique à la surface des cellules s’est révélée particulièrement importante pour l’invasion par le toxoplasme, ce qui pourrait expliquer pourquoi il peut envahir un si large spectre de cellules [22]. En revanche, Plasmodium reconnaît plusieurs récepteurs à la surface des globules rouges, notamment les glycophorines, et peut envahir ces cellules que l’acide sialique soit présent ou absent à la surface de ces dernières [22].
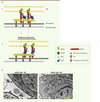 |
Figure 3. Le complexe du glidéosome. A. Schéma du complexe moléculaire à l’origine de la motilité des Apicomplexes (1). Le mouvement de la myosine A (MyoA) sur les filaments d’actine entraîne le parasite vers l’avant, tandis que les adhésines (MIC) sont transloquées vers l’arrière du parasite (2) avant d’être clivées. IMC : complexe membranaire interne ; MP : membrane plasmique. B. Photographie de microscopie électronique montrant la pellicule d’un tachyzoïte (flèche rouge : MP ; pointe de flèche rouge : IMC) de Toxoplasma gondii en présence (-ATC) et en absence (+ATC) de GAP45. cKO : conditional knock-out ; délétion conditionnelle dans laquelle la copie inductible de GAP45 est réprimée en présence d’ATC. ATC : anhydrotétracycline ; N : noyau. |
Ancrage et production du mouvement
Côté parasitaire, le complexe moteur est inséré dans la membrane externe du complexe membranaire interne par les protéines transmembranaires GAP40 (gliding-associated protein) et GAP50 [23, 24] (Figure 3). De l’autre côté, le moteur est connecté, via les filaments d’actine et l’enzyme glycolytique aldolase [25, 26], aux complexes d’adhésines sécrétés par les micronèmes, notamment MIC2 ou son équivalent PfTRAP, et qui interagissent avec des récepteurs de la cellule hôte [27]. Le mouvement net du parasite vers l’avant résulte de la translocation de ce complexe adhésines-aldolase-actine du pôle apical vers le pôle postérieur. Au terme de cette redistribution, MIC2 et sans doute aussi PfTRAP, sont clivées par ROM4, une protéase à sérine de type rhomboïde qui va permettre le désengagement entre le parasite et les récepteurs de l’hôte [28, 29].
Le moteur au centre du glidéosome est la myosine A. Cette dernière est composée d’une chaîne lourde, MyoA, associée à deux chaînes légères, MLC1 (myosin light chain) et ELC1 (essential light chain), et elle est critique pour la motilité et l’invasion du parasite [30–32]. C’est le mouvement de cette myosine sur les filaments d’actine qui propulse le parasite. Comme les myosines musculaires, TgMyoA est capable de générer du mouvement à une vitesse d’environ 5 μm/s, ce qui est compatible avec la vitesse de déplacement des tachyzoïtes [30].
Recrutement du moteur à la pellicule
TgMyoA est une petite myosine sans domaine de queue qui en général se lie au « cargo » et détermine sa localisation. C’est sa chaîne légère MLC1, présentant une extension devant le domaine calmoduline liant MyoA, qui est responsable du recrutement du moteur à la pellicule via son interaction avec la protéine GAP45 (Figure 3A). En effet, quand l’expression de GAP45 est réprimée par manipulation génétique (inactivation conditionnelle) chez le toxoplasme, MLC1 et MyoA ne sont plus recrutées à la membrane et le parasite est incapable d’envahir la cellule hôte [23]. De plus, GAP45, qui est principalement composée d’une longue hélice, a une topologie tout à fait particulière dans la pellicule. Une de ses extrémités est insérée dans la membrane plasmique par deux lipides (myristate et palmitate) attachés de façon covalente à la protéine, alors que l’autre extrémité interagit avec le complexe membranaire interne. Elle semble ainsi agir comme un ressort lorsque le parasite glisse et pénètre dans la cellule hôte, afin de maintenir la cohésion entre les membranes de la pellicule et de permettre au moteur de fonctionner de façon optimale [23]. En l’absence de GAP45, on peut observer que les membranes de la pellicule ne sont plus agencées de façon régulière et que le complexe membranaire interne se détache de la membrane plasmique (Figure 3B).
En plus de son rôle structural au sein du complexe, GAP45 pourrait être un acteur important de la régulation de l’assemblage du glidéosome par ses modifications post-traductionnelles, acylations et phosphorylations, qui semblent réguler l’interaction des composants du complexe moteur dans l’espace et le temps [32–34].
La jonction mobile
Au cours de l’invasion, le parasite pénètre au travers d’une jonction mobile formée au niveau de l’apposition des membranes plasmiques du parasite et de la cellule hôte. Cette jonction sert d’ancrage lors de l’invasion et progresse vers l’arrière du parasite au fur et mesure de sa pénétration dans la cellule (Figure 3). Il y a plus de 30 ans que cette structure a été observée par microscopie électronique en suivant l’entrée de mérozoïtes de P. knowlesi dans les globules rouges [35], mais les détails moléculaires n’ont commencé à émerger que récemment et se sont révélés en grande partie conservés chez les Apicomplexes. La jonction mobile est constituée de quatre protéines d’origine parasitaire : l’antigène de membrane apical AMA1, sécrété par les micronèmes, et trois protéines sécrétées par le col des rhoptries RON2, RON4 et RON5 [36, 37] (Figure 4).
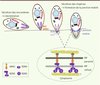 |
Figure 4. Réorientation du parasite et formation de la jonction mobile. Représentation schématique des premières étapes de l’invasion. La sécrétion des protéines des micronèmes (MIC, AMA1) est induite par un signal dépendant du calcium intracellaire. Les adhésines sécrétées au pôle apical du parasite s’insèrent dans sa membrane plasmique et induisent probablement la réorientation du parasite grâce à leur gradient de concentration. La sécrétion des rhoptries libère d’abord le contenu du col (RON), puis le contenu de la partie postérieure (ROP). RON2, RON4 et RON5 s’associent alors avec AMA1 pour former la jonction mobile, tandis que les protéines ROP se trouvent associées avec la vacuole parasitophore, et même au-delà. La figure est adaptée de [36, 39]. |
Une fois sécrétée, AMA1 reste insérée dans la membrane plasmique du parasite et migre au niveau de la jonction mobile durant l’invasion. Cette protéine apparaît comme un anneau à l’intérieur du cercle formé par RON4 lors de l’invasion de mérozoïtes de P. falciparum [38]. Les trois protéines RON sont, elles, localisées au-delà de la membrane plasmique de la cellule hôte où elles pourraient interagir avec le cytosquelette cellulaire [39]. RON2 est insérée dans la membrane plasmique de la cellule hôte et interagit avec AMA1 à la surface du parasite [39] (Figure 4). Chez le toxoplasme, la délétion conditionnelle d’AMA1 a pu être obtenue et entraîne une réduction drastique de l’invasion (10 % d’invasion résiduelle) - indiquant le rôle critique d’AMA1 dans le processus d’invasion -, alors que la motilité de ces parasites n’est pas affectée [40]. Chez Plasmodium, il semble qu’AMA1 soit importante pour l’invasion des érythrocytes par les mérozoïtes, mais pas pour l’invasion des hépatocytes par le sporozoïte. En revanche, RON4 paraît essentielle pour l’invasion par les mérozoïtes et les sporozoïtes [41].
La protéine AMA1 est au centre de nombreuses études à l’heure actuelle, car elle constitue une cible thérapeutique de choix. Des anticorps dirigés contre elle sont capables d’inhiber l’invasion des globules rouges par P. falciparum en empêchant directement l’interaction AMA1-RON2. De même, des peptides correspondants aux séquences de TgRON2 et PfRON2 impliquées dans le site de liaison à AMA1 sont capables de bloquer l’invasion du toxoplasme et de Plasmodium [42]. La résolution de la structure tridimensionnelle de TgAMA1 complexée avec un fragment de TgRON2, puis la modélisation de la même interaction chez P. falciparum, ont permis de mettre en évidence que le mécanisme de reconnaissance est très conservé [43], ce qui ouvre des perspectives thérapeutiques pour la synthèse de composés bloquant spécifiquement cette interaction au sein du phylum.
Régulation de l’invasion et passage au mode réplicatif
Le calcium est un élément crucial de nombreuses fonctions cellulaires et, chez les Apicomplexes, c’est un messager secondaire important dans les voies de signalisation impliquées dans la sécrétion des micronèmes, la motilité et l’invasion [44]. Plusieurs protéines kinases dépendantes du calcium (calcium-dependent protein kinase, CDPK) sont présentes dans le génome des Apicomplexes alors qu’elles sont trouvées spécifiquement chez les plantes. La protéine TgCDPK1, qui est conservée au sein du phylum (CDPK4 chez Plasmodium), joue un rôle clé dans l’exocytose des micronèmes [45]. Quand l’expression de TgCDPK1 est abolie de façon conditionnelle, la sécrétion du contenu des micronèmes est bloquée, illustrant le rôle de TgCDPK1 dans la transduction du signal aboutissant à la décharge des micronèmes.
Finalement, au cours du processus d’invasion, les complexes adhésines-récepteurs ont besoin d’être désengagés pour permettre le développement libre du parasite dans la vacuole parasitophore. Ce processus est assuré par TgROM4, une protéase de type rhomboïde capable de cliver les domaines transmembranaires de TgMIC2, TgAMA1 et TgMIC3. Une diminution de l’expression de TgROM4 entraîne un défaut de motilité et de réorientation des parasites qui ne forment plus de jonction mobile [28].
De façon surprenante, la surexpression d’un mutant non fonctionnel de TgROM4 a montré un effet dominant-négatif chez le parasite avec un défaut de division cellulaire, alors que le processus d’invasion reste normal [46]. De plus, ce défaut de croissance a pu être compensé en complémentant le parasite avec le produit de clivage de TgAMA1, mais pas avec celui de TgMIC2. Cela suggère que ROM4 est à la base d’une cascade de signalisation durant l’invasion, et ultérieurement à l’intérieur de la vacuole, conduisant à la réplication du parasite (détaillé dans [47]). Chez Plasmodium, PfROM4 clive PfEBA-175 (Plasmodium erythrocyte binding antigen 175), un important récepteur qui lie la glycophorine A à la surface du globule rouge pendant l’invasion [48]. Quand ce clivage est inhibé, le cycle intraérythrocytaire du parasite est également altéré, mais il est difficile de déterminer si cela est dû à l’étape d’invasion ou à celle de division [48].
Conclusions et perspectives
Pour assurer leur survie, les Apicomplexes ont développé un mode de locomotion et d’invasion très sophistiqué en se propulsant eux-mêmes dans leur cellule cible, tout en créant un compartiment dans lequel ils vont pouvoir se répliquer en sécurité avant de se disséminer. Bien que cette motilité, à la base de leur processus d’invasion, ait pu être observée depuis des décennies, les détails moléculaires n’ont commencé à émerger que depuis une dizaine d’années et plusieurs questions demeurent. La plupart des acteurs ayant été identifiés chez le parasite, il reste à comprendre comment ces complexes moléculaires se mettent en place de façon aussi précise dans le temps sachant que leurs composants viennent de différents organites, comment leur assemblage et désassemblage sont régulés, mais aussi quelles cibles en aval de RON4 permettent d’enclencher le mode réplicatif.
Une autre voie d’exploration particulièrement intéressante est celle de la contribution de la cellule hôte, et notamment de sa modification par le parasite pendant l’invasion. À la lumière de nouvelles études, la cellule hôte ne paraît pas aussi passive que ce que l’on pensait. L’entrée du parasite induit la formation de filaments d’actine via le rôle de Arp2/3 de la cellule hôte autour de la jonction mobile [49], ce qui pourrait permettre un ancrage très fort de celle-ci. L’hypothèse actuelle est donc que les protéines RON2, RON4 et RON5 sécrétées par les rhoptries et retrouvées sous la membrane plasmique de la cellule hôte, pourraient interagir avec le cytosquelette d’actine corticale et permettre la progression du parasite. L’identification de ces interactions permettrait de compléter la vision encore fragmentaire que nous avons à l’heure actuelle sur le processus d’invasion, un phénomène difficile à capturer et à étudier puisqu’il ne dure que quelques dizaines de secondes.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les auteurs remercient Damien Jacot pour sa lecture critique du manuscrit et le Fonds national suisse de la recherche pour son soutien (FN3100A0-116722).
Références
- Frénal K, Soldati-Favre D. Role of the parasite and host cytoskeleton in apicomplexa parasitism. Cell Host Microbe 2009 ; 5 : 602–611. [CrossRef] [PubMed] [Google Scholar]
- Opitz C, Soldati D. “The glideosome”: a dynamic complex powering gliding motion and host cell invasion by Toxoplasma gondii. Mol Microbiol 2002 ; 45 : 597–604. [CrossRef] [PubMed] [Google Scholar]
- Carruthers V, Boothroyd JC. Pulling together: an integrated model of Toxoplasma cell invasion. Curr Opin Microbiol 2007 ; 10 : 83–89. [CrossRef] [PubMed] [Google Scholar]
- Mordue DG, Sibley LD. Intracellular fate of vacuoles containing Toxoplasma gondii is determined at the time of formation and depends on the mechanism of entry. J Immunol 1997 ; 159 : 4452–4459. [PubMed] [Google Scholar]
- Biot C, Botte CY, Dubar F, Marechal E. Paludisme–Recherche de nouvelles approches thérapeutiques ciblant l’apicoplaste, un organite cellulaire d’origine algale. Med Sci (Paris) 2012 ; 28 : 163–171. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Baunaure F, Langsley G. Trafic protéique dans le globule rouge infecté par Plasmodium. Med Sci (Paris) 2005 ; 21 : 523–529. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Morrissette NS, Murray JM, Roos DS. Subpellicular microtubules associate with an intramembranous particle lattice in the protozoan parasite Toxoplasma gondii. J Cell Sci 1997 ; 110 : 35–42. [PubMed] [Google Scholar]
- King CA. Cell motility of sporozoan protozoa. Parasitol Today 1988 ; 4 : 315–319. [CrossRef] [PubMed] [Google Scholar]
- Vanderberg JP. Studies on the motility of Plasmodium sporozoites. J Protozool 1974 ; 21 : 527–537. [PubMed] [Google Scholar]
- Morrissette NS, Sibley LD. Cytoskeleton of apicomplexan parasites. Microbiol Mol Biol Rev 2002 ; 66 : 21–38. [CrossRef] [PubMed] [Google Scholar]
- Sahoo N, Beatty W, Heuser J, et al. Unusual kinetic and structural properties control rapid assembly and turnover of actin in the parasite Toxoplasma gondii. Mol Biol Cell 2006 ; 17 : 895–906. [CrossRef] [PubMed] [Google Scholar]
- Schmitz S, Grainger M, Howell S, et al. Malaria parasite actin filaments are very short. J Mol Biol 2005 ; 349 : 113–125. [CrossRef] [PubMed] [Google Scholar]
- Skillman KM, Diraviyam K, Khan A, et al. Evolutionarily divergent, unstable filamentous actin is essential for gliding motility in apicomplexan parasites. PLoS Pathog 2011 ; 7 : e1002280. [CrossRef] [PubMed] [Google Scholar]
- Wetzel DM, Hakansson S, Hu K, et al. Actin filament polymerization regulates gliding motility by apicomplexan parasites. Mol Biol Cell 2003 ; 14 : 396–406. [CrossRef] [PubMed] [Google Scholar]
- Gordon JL, Sibley LD. Comparative genome analysis reveals a conserved family of actin-like proteins in apicomplexan parasites. BMC Genomics 2005 ; 6 : 179. [CrossRef] [PubMed] [Google Scholar]
- Daher W, Plattner F, Carlier MF, Soldati-Favre D. Concerted action of two formins in gliding motility, host cell invasion by Toxoplasma gondii. PLoS Pathog 2010 ; 6 : e1001132. [CrossRef] [PubMed] [Google Scholar]
- Skillman KM, Daher W, Ma CI, et al. Toxoplasma gondii profilin acts primarily to sequester G-actin while formins efficiently nucleate actin filament formation in vitro. Biochemistry 2012 ; 51 : 2486–2495. [CrossRef] [PubMed] [Google Scholar]
- Mehta S, Sibley LD. Toxoplasma gondii actin depolymerizing factor acts primarily to sequester G-actin. J Biol Chem 2010 ; 285 : 6835–6847. [CrossRef] [PubMed] [Google Scholar]
- Mehta S, Sibley LD. Actin depolymerizing factor controls actin turnover and gliding motility in Toxoplasma gondii. Mol Biol Cell 2011 ; 22 : 1290–1299. [CrossRef] [PubMed] [Google Scholar]
- Plattner F, Yarovinsky F, Romero S, et al. Toxoplasma profilin is essential for host cell invasion and TLR11-dependent induction of an interleukin-12 response. Cell Host Microbe 2008 ; 3 : 77–87. [Google Scholar]
- Baum J, Tonkin CJ, Paul AS, et al. A malaria parasite formin regulates actin polymerization and localizes to the parasite-erythrocyte moving junction during invasion. Cell Host Microbe 2008 ; 3 : 188–198. [CrossRef] [PubMed] [Google Scholar]
- Friedrich N, Matthews S, Soldati-Favre D. Sialic acids: key determinants for invasion by the Apicomplexa. Int J Parasitol 2010 ; 40 : 1145–1154. [CrossRef] [PubMed] [Google Scholar]
- Frénal K, Polonais V, Marq JB, et al. Functional dissection of the apicomplexan glideosome molecular architecture. Cell Host Microbe 2010 ; 8 : 343–357. [CrossRef] [PubMed] [Google Scholar]
- Gaskins E, Gilk S, DeVore N, et al. Identification of the membrane receptor of a class XIV myosin in Toxoplasma gondii. J Cell Biol 2004 ; 165 : 383–393. [CrossRef] [PubMed] [Google Scholar]
- Buscaglia CA, Coppens I, Hol WG, Nussenzweig V. Sites of interaction between aldolase and thrombospondin-related anonymous protein in Plasmodium. Mol Biol Cell 2003 ; 14 : 4947–4957. [CrossRef] [PubMed] [Google Scholar]
- Jewett TJ, Sibley LD. Aldolase forms a bridge between cell surface adhesins and the actin cytoskeleton in apicomplexan parasites. Mol Cell 2003 ; 11 : 885–894. [CrossRef] [PubMed] [Google Scholar]
- Starnes GL, Jewett TJ, Carruthers VB, Sibley LD. Two separate, conserved acidic amino acid domains within the Toxoplasma gondii MIC2 cytoplasmic tail are required for parasite survival. J Biol Chem 2006 ; 281 : 30745–30754. [CrossRef] [PubMed] [Google Scholar]
- Buguliskis JS, Brossier F, Shuman J, Sibley LD. Rhomboid 4 (ROM4) affects the processing of surface adhesins, facilitates host cell invasion by Toxoplasma gondii. PLoS Pathog 2010 ; 6 : e1000858. [Google Scholar]
- Ejigiri I, Ragheb DR, Pino P, et al. Shedding of TRAP by a rhomboid protease from the malaria sporozoite surface is essential for gliding motility, sporozoite infectivity. PLoS Pathog 2012 ; 8 : e1002725. [CrossRef] [PubMed] [Google Scholar]
- Herm-Gotz A, Weiss S, Stratmann R, et al. Toxoplasma gondii myosin A and its light chain: a fast, single-headed, plus-end-directed motor. EMBO J 2002 ; 21 : 2149–2158. [CrossRef] [PubMed] [Google Scholar]
- Meissner M, Schluter D, Soldati D. Role of Toxoplasma gondii myosin A in powering parasite gliding and host cell invasion. Science 2002 ; 298 : 837–840. [CrossRef] [PubMed] [Google Scholar]
- Nebl T, Prieto JH, Kapp E, et al. Quantitative in vivo analyses reveal calcium-dependent phosphorylation sites, identifies a novel component of the Toxoplasma invasion motor complex. PLoS Pathog 2011 ; 7 : e1002222. [CrossRef] [PubMed] [Google Scholar]
- Gilk SD, Gaskins E, Ward GE, Beckers CJ. GAP45 phosphorylation controls assemblyof the Toxoplasma myosin XIV complex. Eukaryot Cell 2009 ; 8 : 190–196. [CrossRef] [PubMed] [Google Scholar]
- Jones ML, Cottingham C, Rayner JC. Effects of calcium signaling on Plasmodium falciparum erythrocyte invasion and post-translational modification of gliding-associated protein 45 (PfGAP45). Mol Biochem Parasitol 2009 ; 168 : 55–62. [CrossRef] [PubMed] [Google Scholar]
- Aikawa M, Miller LH, Johnson J, Rabbege J. Erythrocyte entry by malarial parasites. A moving junction between erythrocyte and parasite. J Cell Biol 1978 ; 77 : 72–82. [Google Scholar]
- Alexander DL, Mital J, Ward GE, et al. Identification of the moving junction complex of Toxoplasma gondii: a collaboration between distinct secretory organelles. PLoS Pathog 2005 ; 1 : e17. [Google Scholar]
- Lebrun M, Michelin A, El Hajj H, et al. The rhoptry neck protein RON4 re-localizes at the moving junction during Toxoplasma gondii invasion. Cell Microbiol 2005 ; 7 : 1823–1833. [CrossRef] [PubMed] [Google Scholar]
- Riglar DT, Richard D, Wilson DW, et al. Super-resolution dissection of coordinated events during malaria parasite invasion of the human erythrocyte. Cell Host Microbe 2011 ; 9 : 9–20. [CrossRef] [PubMed] [Google Scholar]
- Besteiro S, Michelin A, Poncet J, et al. Export of a Toxoplasma gondii rhoptry neck protein complex at the host cell membrane to form the moving junction during invasion. PLoS Pathog 2009 ; 5 : e1000309. [Google Scholar]
- Mital J, Meissner M, Soldati D, Ward GE. Conditional expression of Toxoplasma gondii apical membrane antigen-1 (TgAMA1) demonstrates that TgAMA1 plays a critical role in host cell invasion. Mol Biol Cell 2005 ; 16 : 4341–4349. [Google Scholar]
- Giovannini D, Spath S, Lacroix C, et al. Independent roles of apical membrane antigen 1 and rhoptry neck proteins during host cell invasion by apicomplexa. Cell Host Microbe 2011 ; 10 : 591–602. [CrossRef] [PubMed] [Google Scholar]
- Lamarque M, Besteiro S, Papoin J, et al. The RON2-AMA1 interaction is a critical step in moving junction-dependent invasion by apicomplexan parasites. PLoS Pathog 2011 ; 7 : e1001276. [CrossRef] [PubMed] [Google Scholar]
- Tonkin ML, Roques M, Lamarque MH, et al. Host cell invasion by apicomplexan parasites: insights from the co-structure of AMA1 with a RON2 peptide. Science 2011 ; 333 : 463–467. [CrossRef] [PubMed] [Google Scholar]
- Nagamune K, Moreno SN, Chini EN, Sibley LD. Calcium regulation and signaling in apicomplexan parasites. Subcell Biochem 2008 ; 47 : 70–81. [CrossRef] [PubMed] [Google Scholar]
- Lourido S, Shuman J, Zhang C, et al. Calcium-dependent protein kinase 1 is an essential regulator of exocytosis in Toxoplasma. Nature 2010 ; 465 : 359–362. [CrossRef] [PubMed] [Google Scholar]
- Santos JM, Ferguson DJ, Blackman MJ, Soldati-Favre D. Intramembrane cleavage of AMA1 triggers Toxoplasma to switch from an invasive to a replicative mode. Science 2011 ; 331 : 473–477. [CrossRef] [PubMed] [Google Scholar]
- Pino P, Soldati-Favre D. Invasion et réplication chez les Apicomplexes–Tous les chemins mènent à ROM. Med Sci (Paris) 2011 ; 27 : 576–578. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- O’Donnell RA, Hackett F, Howell SA, et al. Intramembrane proteolysis mediates shedding of a key adhesin during erythrocyte invasion by the malaria parasite. J Cell Biol 2006 ; 174 : 1023–1033. [CrossRef] [PubMed] [Google Scholar]
- Gonzalez V, Combe A, David V, et al. Host cell entry by apicomplexa parasites requires actin polymerization in the host cell. Cell Host Microbe 2009 ; 5 : 259–272. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Le cycle lytique des Apicomplexes. A. Cycle lytique du toxoplasme. Ce cycle peut être décomposé en plusieurs étapes : l’attachement du parasite à la surface de la cellule cible (1), sa réorientation (2), son entrée dans la cellule hôte à travers la jonction mobile (3) et la création de la vacuole parasitophore (VP) au sein de laquelle le parasite va se multiplier (4) avant de lyser la membrane de la vacuole puis celle de la cellule (5). Les parasites libérés sont alors capables d’envahir les cellules adjacentes. B. Représentation schématique de l’ultrastructure d’un tachyzoïte de Toxoplasma gondii. |
| Dans le texte | |
 |
Figure 2. Dynamique de l’actine. A. Toxines modulant la dynamique des filaments d’actine et composés agissant sur les myosines. La cytochalasine D se lie aux extrémités barbues (+) et empêche la polymérisation de l’actine ; la jasplakinolide et la phalloïdine peuvent se lier aux filaments d’actine (actine F) et les stabiliser ; la latrunculine favorise la dépolymérisation des filaments en se liant aux monomères d’actine G (globulaire). Toutes ces toxines inhibent la motilité des parasites et par conséquent l’invasion. Le 2,3-butanedione monoxime (BDM) bloque l’activité ATPase des myosines et donc empêche le mouvement des myosines sur les filaments d’actine. L’invasion est alors inhibée. B. Protéines impliquées dans la dynamique de polymérisation et dépolymérisation des filaments d’actine. La profiline se lie aux monomères d’actine-ATP qui peuvent être transférés au filament d’actine naissant à l’extrémité barbue (+). Elle peut aussi favoriser la polymérisation des filaments en se liant au domaine FH1 (formin homology 1) des formines pour délivrer l’actine-ATP globulaire à l’extrémité barbue du filament. Le domaine FH2 des formines initie la polymérisation, puis reste associé à l’extrémité barbue pendant la polymérisation du filament. La cofiline ou ADF (facteur de dépolymérisation de l’actine) dépolymérise les filaments d’actine en se liant aux monomères à l’extrémité pointue (-). |
| Dans le texte | |
 |
Figure 3. Le complexe du glidéosome. A. Schéma du complexe moléculaire à l’origine de la motilité des Apicomplexes (1). Le mouvement de la myosine A (MyoA) sur les filaments d’actine entraîne le parasite vers l’avant, tandis que les adhésines (MIC) sont transloquées vers l’arrière du parasite (2) avant d’être clivées. IMC : complexe membranaire interne ; MP : membrane plasmique. B. Photographie de microscopie électronique montrant la pellicule d’un tachyzoïte (flèche rouge : MP ; pointe de flèche rouge : IMC) de Toxoplasma gondii en présence (-ATC) et en absence (+ATC) de GAP45. cKO : conditional knock-out ; délétion conditionnelle dans laquelle la copie inductible de GAP45 est réprimée en présence d’ATC. ATC : anhydrotétracycline ; N : noyau. |
| Dans le texte | |
 |
Figure 4. Réorientation du parasite et formation de la jonction mobile. Représentation schématique des premières étapes de l’invasion. La sécrétion des protéines des micronèmes (MIC, AMA1) est induite par un signal dépendant du calcium intracellaire. Les adhésines sécrétées au pôle apical du parasite s’insèrent dans sa membrane plasmique et induisent probablement la réorientation du parasite grâce à leur gradient de concentration. La sécrétion des rhoptries libère d’abord le contenu du col (RON), puis le contenu de la partie postérieure (ROP). RON2, RON4 et RON5 s’associent alors avec AMA1 pour former la jonction mobile, tandis que les protéines ROP se trouvent associées avec la vacuole parasitophore, et même au-delà. La figure est adaptée de [36, 39]. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




