| Issue |
Med Sci (Paris)
Volume 29, Number 2, Février 2013
|
|
|---|---|---|
| Page(s) | 194 - 199 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2013292018 | |
| Published online | 28 February 2013 | |
Compartimentation et plasticité du réseau microtubulaire
Compartmentalization and plasticity of the microtubule network
1
EA 4530, dynamique des microtubules en physiopathologie, faculté de pharmacie, université Paris-Sud, 5, rue Jean-Baptiste Clément, 92296 Châtenay-Malabry, France
2
Biochimie A, APHP, hôpitaux universitaires de l’est parisien, site St Antoine, 184, rue du Faubourg Saint-Antoine, 75012 Paris, France
3
Laboratoire de biochimie-hormonologie, APHP, hôpitaux universitaires Paris-Sud, site Antoine Béclère, 157, rue de la Porte de Trivaux, 92141 Clamart, France
La structuration du cytoplasme repose en grande partie sur le cytosquelette au sein duquel le réseau de microtubules joue de multiples rôles, notamment dans le trafic intracellulaire et la signalisation. Certaines fonctions cellulaires nécessitent des microtubules hautement dynamiques, alors que d’autres utilisent des microtubules stables où la tubuline peut être fortement modifiée. Des données récentes sur les mécanismes de contrôle de la dynamique des microtubules et de leurs modifications post-traductionnelles, notamment de l’acétylation de la tubuline, révèlent la grande plasticité des microtubules et mettent en lumière l’importance de leur compartimentation structurale et fonctionnelle.
Abstract
Cytoplasm organization greatly depends on the cytoskeleton and especially on microtubules. Their multiple roles comprise for instance long-distance vesicular traffic or the organization of several signalling pathways. A variety of cellular functions require highly dynamic microtubules, which alternate between growing and shrinking phases. Meanwhile, other functions use stable microtubules, in which tubulin often bears multiple post-translational modifications like acetylation. Recent progress has been made in understanding some molecular mechanisms that control microtubule dynamics or tubulin acetylation. These mechanisms reveal the high plasticity of microtubules and point out the importance of their compartmentalization at structural and functional levels.
© 2013 médecine/sciences – Inserm / SRMS
Vignette (Photo © Christian Poüs).
De la tubuline aux domaines fonctionnels et aux régulateurs cytoplasmiques
Organisation et structure des microtubules
Le cytosquelette de microtubules (MT) résulte de l’assemblage de dimères d’α- et β-tubuline. La notion même de squelette est cependant assez peu adaptée à l’image d’éléments en remodelage permanent au sein d’un réservoir soluble (cytoplasme). Cette régulation permet pourtant de modifier localement ou globalement la morphologie cellulaire, ou encore de mettre en place des structures spécifiques comme le fuseau mitotique. Les MT forment des cylindres dont la paroi comporte généralement 13 protofilaments (qui sont des alignements de tubulines [αβ]n), mais elle peut en compter entre 11 et 15 chez certaines espèces, dans des types cellulaires particuliers ou dans des structures comme les axonèmes ou les centrioles. Les deux extrémités des MT diffèrent par leur localisation cellulaire et leurs propriétés. En effet, dans les cellules en interphase, le bout « moins » des MT est ancré au niveau de centres organisateurs (le centrosome, mais aussi l’appareil de Golgi, l’enveloppe nucléaire ou des régions sous-corticales selon les types cellulaires), alors que le bout « plus » est orienté vers la périphérie cellulaire. L’échange de sous-unités de tubuline au bout « plus » s’effectue dans deux conformations différentes. En phase de croissance, la tubuline incorporée forme un feuillet dont les côtés se rapprochent pour fermer le MT à la manière d’une fermeture éclair. En phase de désassemblage, le MT présente une courbure des protofilaments vers l’extérieur de la paroi microtubulaire.
Chaque tubuline possède un site de liaison des nucléotides guanidiques. Le site d’α-tubuline, qui est orienté vers l’interface α/β, reste bloqué sous une forme liant le GTP. À l’inverse, le site de la β-tubuline - dit échangeable - peut lier le GTP ou le GDP. Le passage de l’état GDP à GTP s’effectue par échange nucléotidique et permet l’incorporation de la tubuline dans un MT. Le contact entre la sous-unité α d’un dimère récemment incorporé et la sous-unité β d’un dimère incorporé antérieurement stimule l’activité GTPase de la tubuline (qui se comporte ainsi comme une GTPase-activating protein intrinsèque). Dans un MT en croissance, les dernières sous-unités incorporées lient encore le GTP (c’est la notion de coiffe de tubuline-GTP), tandis que le reste du polymère reste associé au GDP. La structure de la forme GTP étant plus droite que celle de la forme GDP (qui présente une légère angulation entre ses sous-unités a et b), une coiffe de tubuline-GTP à l’extrémité « plus » exerce une contrainte conformationnelle qui stabilise le MT en empêchant les protofilaments d’adopter leur courbure naturelle. Si la coiffe est perdue, la contrainte est levée, les protofilaments se courbent et le MT se dépolymérise, libérant la tubuline-GDP (Figure 1).
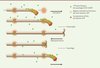 |
Figure 1. Microtubules en croissance. Un microtubule (MT) en croissance s’allonge en incorporant de nouvelles sous-unités de tubuline liées au GTP à son extrémité « plus », hydrolyse le GTP en GDP et change de conformation dans la majorité de sa structure, sauf au niveau de la coiffe (qui contient la tubuline récemment incorporée) et de régions (îlots de conformation tubuline-GTP) qui constituent des sites privilégiés de sauvetage lorsque le MT est en phase de dépolymérisation (après une catastrophe). La conformation tubuline-GTP des îlots pourrait persister lorsque le MT en croissance rencontre des régions discrètes qui restent à identifier, mais dont la fonction pourrait impliquer des MAP (protéines associées aux MT) comme la protéine pVHL. La conformation d’une structure spécifique du MT en croissance et/ou de la tubuline-GTP des îlots pourrait être reconnue par des protéines +TIP, notamment par des protéines comme CLIP-170 ou les CLASP, qui y exerceraient leur fonction de facteur de sauvetage. |
Dynamique des MT et mécanismes de sauvetage
Une des clés de la genèse des MT est leur comportement dynamique. Un MT qui naît au niveau d’un centre organisateur croît de façon continue jusqu’à la périphérie cellulaire. À ce niveau, la perte de la coiffe de tubuline-GTP permet une transition (appelée catastrophe) vers une phase de désassemblage. Une telle phase peut s’interrompre et permettre une nouvelle phase de croissance (transition de type sauvetage). En périphérie cellulaire, les MT alternent fréquemment entre croissance et dépolymérisation. Ce comportement d’instabilité dynamique permet à chaque MT d’explorer une région du cytoplasme [1].
Si les mécanismes moléculaires de perte de la coiffe de tubuline-GTP qui déclenchent les catastrophes sont mal connus, ceux qui gouvernent les sauvetages du point de vue de la structure des MT semblent aujourd’hui plus clairs. La sélection d’un anticorps recombinant reconnaissant la conformation de la tubuline-GTP a permis, d’une part, de visualiser la coiffe GTP des MT en croissance et, d’autre part, de montrer la présence d’îlots tubuline-GTP dans des régions internes des MT. La distribution de ces régions est fortement corrélée avec la localisation des sites de sauvetage, ce qui suggère que les MT « mémorisent » de tels sites de sauvetage potentiels au cours de leur croissance [2]. L’importance de ces îlots de tubuline-GTP dans l’initiation de sauvetages a été confirmée dans un système de dynamique microtubulaire in vitro avec des MT chimériques alternant des régions assemblées avec du GTP ou avec un analogue non hydrolysable, le GMPCPP [3]. Les mécanismes moléculaires permettant l’apparition des îlots de tubuline-GTP sont encore inconnus. Une hypothèse serait que la concentration de certaines protéines associées aux MT (MAP) dans des régions cytoplasmiques et/ou membranaires prédéfinies stimulerait la formation des îlots au passage des MT en croissance.
Il en irait ainsi avec la protéine pVHL (Von Hippel Lindau). Ce suppresseur de tumeur, dont la mutation prédispose à des hémangioblastomes, phéochromocytomes et carcinomes rénaux à cellules claires, fait partie d’un complexe ubiquitine ligase qui possède pour substrats les facteurs de transcription HIF (hypoxia-inducible factor). pVHL s’associe aux MT dont elle régule la dynamique, notamment en inhibant les catastrophes et en stimulant les sauvetages. Le mécanisme d’action proposé est que pVHL, en inhibant l’activité GTPase de la tubuline, favoriserait la persistance d’îlots de conformation GTP dans le MT, notamment en périphérie cellulaire [4]. Cette stimulation reste cependant mystérieuse, car pVHL s’associe aux MT sur toute leur longueur, alors que les îlots tubuline-GTP sont répartis de façon discrète et apparemment stochastique le long des MT. pVHL pourrait alors amplifier une propriété sous-jacente intrinsèque aux MT ou bien une interaction des MT avec des structures discrètes, plutôt périphériques, qui restent encore à identifier (Figure 1). Pour établir les mécanismes moléculaires précis de l’apparition de ces îlots, la connaissance de la structure exacte reconnue par l’anticorps anti-tubuline-GTP sera essentielle. En tant que sites privilégiés de sauvetage, les îlots de conformation tubuline-GTP pourraient aussi recruter des protéines cytoplasmiques déjà connues pour réguler la dynamique des MT. Ce serait le cas du moteur moléculaire kinésine-1 qui participe au transport axonal antérograde [5], ainsi qu’au contrôle de la croissance des MT et de leurs sauvetages [6]. C’est aussi le cas de protéines recrutées au bout « plus » des MT en croissance (+TIP, plus end-tracking proteins) qui reconnaissent plus volontiers la conformation GTP de la tubuline et/ou une conformation particulière du MT, comme les protéines EB1 (end-binding-1) et CLIP-170 (cytoplasmic linker protein-170). Un rôle important d’EB1 est de supprimer les catastrophes en cours de polymérisation, assurant ainsi la croissance persistante des MT jusqu’à la périphérie cellulaire. De façon intéressante, EB1 contrôle à la fois le recrutement microtubulaire et la libération de CLIP-170 qui se comporte, quant à elle, comme un facteur de sauvetage. Les CLASP, des protéines qui sont associées à CLIP-170 mais qui sont aussi recrutées par interaction avec EB1, pourraient se lier au MT de façon indépendante. Elles stimulent aussi fortement les sauvetages (Figure 1). La reconnaissance des îlots tubuline-GTP in vivo par de telles protéines fournirait alors une base moléculaire supplémentaire pour comprendre le mécanisme des sauvetages.
Modifications post-traductionnelles de la tubuline et environnement des microtubules
Modifications post-traductionnelles de la tubuline
Chez tous les eucaryotes, la tubuline incorporée dans les MT peut subir des modifications post-traductionnelles qui sont, pour la plupart, réversibles après dépolymérisation. La possibilité de détecter ces modifications grâce à des anticorps spécifiques a conduit au concept de sous-populations microtubulaires. Le réseau de MT présente ainsi une population très dynamique, et une autre plus stable. À l’exception de l’acétylation de la lysine 40 de l’α-tubuline, les principales modifications de la tubuline portent sur les régions carboxy-terminales d’α et/ou de β qui sont exposées à la surface des MT. C’est ainsi le cas du cycle de détyrosination/retyrosination qui opère sur la tyrosine carboxy-terminale de l’α-tubuline, ou du greffage de chaînes latérales d’acide glutamique qui opère à la fois sur α et β [7] et dont le contrôle de la longueur est important pour la survie neuronale [8, 9]. L’accumulation de telles modifications a longtemps été considérée comme une conséquence de la stabilisation d’un sous-ensemble de MT. Cette vue a changé radicalement avec la démonstration que la détyrosination stabilise indirectement les MT en inhibant le recrutement de moteurs moléculaires dépolymérisants [10].
Importance biologique de l’acétylation de la lysine 40
À l’image du code des histones, il existerait un code de la tubuline capable de modifier subtilement la nature des protéines interagissant avec les MT. À cet égard, l’acétylation de l’α-tubuline sur la lysine 40 reste peut-être la plus mystérieuse de toutes les modifications. Depuis que la structure de la tubuline a été décrite à la fin des années 1990, il est clair que la lysine 40 fait partie d’un domaine exposé à l’intérieur du MT. Il a donc été surprenant de découvrir que cette modification puisse altérer la liaison de protéines à l’extérieur du MT (comme les moteurs moléculaires kinésine et dynéine), et puisse influencer le trafic intracellulaire, seule ou en combinaison avec d’autres modifications post-traductionnelles [11–13]. L’acétylation de la tubuline participe aussi indirectement à la transduction de signaux cellulaires. En effet, les MT sont des plateformes cytoplasmiques de séquestration et d’interaction ou les rails de vectorisation d’un grand nombre de facteurs de signalisation et de transcription (régulant parfois aussi la dynamique des MT) [14, 15]. Il a ainsi été proposé (sans décrire de rôle particulier de l’acétylation) que les MT stables favorisent la séquestration de certaines protéines Smad intervenant dans la signalisation du TGFβ (transforming growth factor β) et des BMP (bone morphogenetic protein) [16]. En revanche, l’acétylation intervient clairement dans l’activation de la NO (nitric oxide)-synthase endothéliale [17], et dans le transport de p53 vers le noyau [18, 19]. Dans ce dernier cas, l’acétylation, qui est rapidement induite sur tout le réseau suite à un stress génotoxique, promeut la liaison de p53 aux MT, probablement en recrutant la chaperone Hsp90 (heat shock protein 90). Ce même mécanisme stimulerait aussi l’activation d’Akt/PKB (protéine kinase B) [19]. Un contrôle rapide de l’acétylation de la tubuline, y compris sur les MT dynamiques, permettrait probablement à la cellule de moduler le fonctionnement d’un nombre considérable de voies de signalisation impliquant les nombreuses protéines d’interaction avec Hsp901. L’impact d’une hyperacétylation sur la signalisation va aussi au-delà de ce mécanisme. Ainsi, en conditions de carence nutritionnelle, le recrutement accru du moteur kinésine-1 transportant la MAP (mitogen activated protein) kinase JNK (Jun N-terminal kinase) stimule la phosphorylation par cette dernière de Bcl-2 et sa dissociation du complexe formé avec Beclin-1, ce qui permet d’enclencher les premières étapes de formation des autophagosomes [20] et favorise la survie cellulaire.
Mécanismes de l’acétylation
La régulation de l’acétylation de la tubuline semble donc importante pour moduler de nombreuses fonctions cellulaires impliquant les MT, mais les enzymes impliquées dans l’acétylation et la désacétylation de la tubuline ont été identifiées tardivement (pour revue, voir [21]). Au moins deux désacétylases ont pour substrat la tubuline : l’histone-désacétylase cytoplasmique HDAC6 et la sirtuine SIRT2. Par ailleurs, de nombreuses enzymes sont capables d’acétyler les MT en diverses circonstances : il s’agit principalement des N-acétyl-transférases NAT1 et NAT10, de GCN5, de la sous-unité ELP3 du complexe Elongator et de la protéine MEC17/ATAT1 (α-tubulin N-acetyltransferase 1) des complexes mécanosenseurs des neurones sensitifs. Cette dernière enzyme semble fortement impliquée dans l’acétylation basale des MT stables et deux articles récents éclairent un peu plus l’impact structural potentiel de MEC-17/ATAT1 [22, 23]. En effet, la présence de l’enzyme sauvage ou rendue inactive par mutation semble requise pour imposer la formation de MT à 15 protofilaments dans les dendrites des neurones sensitifs, alors qu’en l’absence de MEC-17/ATA1, les MT sont beaucoup plus hétérogènes et présentent de nombreux défauts structuraux [22, 23]. Une hypothèse expliquant l’impact conformationnel de l’acétylation sur la tubuline et les MT est que des liaisons salines fortes pourraient se former entre molécules d’α-tubuline acétylées appartenant à des protofilaments voisins, et que ces liaisons imposeraient la formation de MT à 15 protofilaments. En quoi ces structures seraient-elles mieux ou moins bien « lues » par diverses MAP (dont les moteurs moléculaires) restent à établir.
Par ailleurs, l’acétylation étant une modification souvent répartie de façon discontinue le long des MT, il est concevable que les MT acétylés puissent être compartimentés au sein de régions où le nombre de protofilaments varie. Ces variations s’accompagnent d’accidents structuraux où la paroi microtubulaire serait ouverte, ce qui ménagerait des régions d’échange entre le cytosol et la lumière du MT, en plus des extrémités (Figure 2). La démonstration de tels échanges reste cependant un défi important pour l’avenir, tout comme la compréhension d’une éventuelle dynamique des protéines intraluminales. Ce point apparaît aujourd’hui comme l’ultime frontière dans la compréhension d’une compartimentation de plus en plus fine du cytoplasme et de l’impact qu’elle peut avoir sur certaines fonctions biologiques des MT, comme l’organisation de la signalisation. L’impact de l’acétylation de la tubuline sur le comportement dynamique des MT reste encore controversé. Le fait qu’elle puisse être présente sur l’intégralité des MT cellulaires (stables et dynamiques), que sa suppression n’entraîne aucun phénotype particulier, et qu’elle puisse être rapidement stimulée en fait cependant une mauvaise candidate pour stabiliser les MT. En dehors de tout contexte d’adaptation cellulaire, le fait que l’acétylation soit restreinte aux MT les plus stables suggère que les acteurs qui la régulent reconnaissent aussi l’état dynamique d’un MT, sans forcément y entrer par l’extrémité « plus », qui est le siège des échanges moléculaires de tubuline avec le compartiment de tubuline soluble. Il est peu probable que cette reconnaissance se base sur la présence d’autres modifications post-traductionnelles des MT, car l’acétylation semble très précoce, au moins lors d’expériences de recroissance microtubulaire après dépolymérisation [24, 25]. Cette énigme, qui a semblé hors de portée du champ expérimental pendant très longtemps, pourrait être en voie de résolution avec la découverte des tubuline acétyltransférases et d’anciennes observations montrant le rôle majeur joué dans l’assemblage de MT acétylés par l’appareil de Golgi [25], et par des protéines de la matrice golgienne comme GM130 (cis-Golgi matrix protein 130) et GRASP65 [26]. La relation intime entre Golgi et MT est telle que chaque élément influe sur l’organisation de l’autre. Alors que des MT stables acétylés et détyrosinés sont nucléés et organisés par le Golgi [25, 27, 28], la stabilisation des MT semble impliquer l’activité motrice d’une kinésine non identifiée [29], et leur résistance à la dépolymérisation en cours de croissance pourrait impliquer la kinésine-1 [6, 30]. Il est dès lors envisageable que l’adressage de tels moteurs à l’extrémité « plus » de certains MT se fasse dans le cadre d’un trafic vésiculaire d’origine golgienne (Figure 2). Quoi de mieux alors que la reconnaissance des MT stables se fasse à la source, c’est-à-dire au contact du Golgi ? Des transporteurs membranaires circulant à la surface de ces MT et transportant les acétylases de la tubuline seraient alors un moyen pour la cellule de concentrer ces enzymes autour de leurs MT cibles, où ils pourraient pénétrer par des défauts structuraux et ainsi modifier la tubuline.
 |
Figure 2. Les MT acétylés, dynamiques ou stables, présentent une acétylation dans des domaines discontinus. L’acétylation de la tubuline stimule le recrutement sur les MT de moteurs moléculaires (dynéine et kinésine) et de diverses MAP, notamment de facteurs de signalisation qui sont des protéines interagissant avec la chaperone Hsp90 et qui pourraient être recrutées par son intermédiaire. Le contrôle de l’acétylation, qui a lieu à l’intérieur du tube, pourrait s’exercer par l’incorporation de tubuline acétylases et désacétylases au moment de la croissance du MT, mais aussi par échange de ces enzymes entre le cytosol et la lumière du MT au niveau de défauts structuraux (échanges peut-être stimulés par un trafic vésiculaire d’origine golgienne). |
Conclusions
Au total, la compréhension de la dynamique microtubulaire a évolué de manière spectaculaire depuis la découverte de l’instabilité dynamique par Mitchison et Kirschner dans les années 1980, jusqu’aux plus récents développements en matière de compartimentation dynamique des MT en régions de conformation spécifique portant ou non des modifications post-traductionnelles de la tubuline. Ces développements récents s’ajoutent à la longue liste des propriétés de protéines modulatrices de la dynamique des MT qui opèrent à l’extrémité « plus » ou ailleurs le long des polymères. Un des enjeux de la compréhension de plus en plus intégrée, mais aussi de plus en plus détaillée de ces phénomènes sera sans doute à l’avenir de faire émerger des cibles thérapeutiques alternatives ou complémentaires dans des pathologies comme le cancer ou certaines maladies neurodégénératives ou psychiatriques. En effet, alors qu’elle reste l’une des meilleures cibles des thérapies antinéoplasiques, la dynamique des MT est aussi un phénomène que la cellule cancéreuse peut moduler pour compenser les effets délétères de molécules stabilisatrices, et ainsi leur opposer une résistance. Par ailleurs, le contrôle de certaines modifications de la tubuline et, notamment, de l’acétylation pourrait permettre de moduler le transport axonal ou la clairance par autophagie d’agrégats protéiques dans les neurones.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Mitchison T, Kirschner M. Dynamic instability of microtubule growth. Nature 1984 ; 312 : 237–242. [CrossRef] [PubMed] [Google Scholar]
- Dimitrov A, Quesnoit M, Moutel S, et al. Detection of GTP-tubulin conformation in vivo reveals a role for GTP remnants in microtubule rescues. Science 2008 ; 322 : 135–136. [CrossRef] [Google Scholar]
- Tropini C, Roth EA, Zanic M, et al. Islands containing slowly hydrolyzable GTP analogs promote microtubule rescues. PLoS One 2012 ; 17 : e30103. [CrossRef] [Google Scholar]
- Thoma CR, Matov A, Gutbrodt KL, et al. Quantitative image analysis identifies pVHL as a key regulator of microtubule dynamic instability. J Cell Biol 2010 ; 190 : 991–1003. [CrossRef] [PubMed] [Google Scholar]
- Nakata T, Niwa S, Okada Y, et al. Preferential binding of a kinesin-1 motor to GTP-tubulin-rich microtubules underlies polarized vesicle transport. J Cell Biol 2011 ; 194 : 245–255. [CrossRef] [PubMed] [Google Scholar]
- Daire V, Giustiniani J, Leroy-Gori I, et al. Kinesin-1 regulates microtubule dynamics via a c-Jun N-terminal kinase-dependent mechanism. J Biol Chem 2009 ; 284 : 31992–32001. [CrossRef] [PubMed] [Google Scholar]
- Janke C, Chloë Bulinski J. Post-translational regulation of the microtubule cytoskeleton: mechanisms and functions. Nat Rev Mol Cell Biol 2011 ; 12 : 773–786. [CrossRef] [PubMed] [Google Scholar]
- Moutin MJ, Andrieux A, Janke C. Polyglutamylation des microtubules et neurodégénérescence. Med Sci (Paris) 2011 ; 27 : 464–467. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Rogowski K, van Dijk J, Magiera MM, et al. A family of protein-deglutamylating enzymes associated with neurodegeneration. Cell 2010 ; 143 : 564–578. [CrossRef] [PubMed] [Google Scholar]
- Peris L, Wagenbach M, Lafanechère L, et al. Motor-dependent microtubule disassembly driven by tubulin tyrosination. J Cell Biol 2009 ; 185 : 1159–1166. [CrossRef] [PubMed] [Google Scholar]
- Reed NA, Cai D, Blasius TL, et al. Microtubule acetylation promotes kinesin-1 binding and transport. Curr Biol 2006 ; 16 : 2166–2172. [CrossRef] [PubMed] [Google Scholar]
- Dompierre JP, Godin JD, Charrin BC, et al. Histone deacetylase 6 inhibition compensates for the transport deficit in Huntington’s disease by increasing tubulin acetylation. J Neurosci 2007 ; 27 : 3571–3583. [CrossRef] [PubMed] [Google Scholar]
- Cai D, McEwen DP, Martens JR, et al. Single molecule imaging reveals differences in microtubule track selection between kinesin motors. PLoS Biol 2009 ; 7 : e1000216. [CrossRef] [PubMed] [Google Scholar]
- Gundersen GG, Cook TA. Microtubules and signal transduction. Curr Opin Cell Biol 1999 ; 11 : 81–94. [CrossRef] [PubMed] [Google Scholar]
- Etienne-Manneville S. From signaling pathways to microtubule dynamics: the key players. Curr Opin Cell Biol 2009 ; 22 : 104–111. [CrossRef] [PubMed] [Google Scholar]
- Dong C, Li Z, Alvarez RJ, et al. Microtubule binding to Smads may regulate TGF beta activity. Mol Cell 2000 ; 5 : 27–34. [CrossRef] [PubMed] [Google Scholar]
- Giustiniani J, Couloubaly S, Pourci ML, et al. Basal endothelial nicric oxide synthase (eNOS) phosphorylation on Ser 1177 occurs in a stable microtubule- and tubulin acetylation-dependent manner. Exp Cell Res 2009 ; 315 : 3509–3520. [CrossRef] [PubMed] [Google Scholar]
- Giannakakou P, Nakano M, Nicolaou KC, et al. Enhanced microtubule-dependent trafficking and p53 nuclear accumulation by suppression of microtubule dynamics. Proc Natl Acad Sci USA 2002 ; 99 : 10855–10860. [CrossRef] [Google Scholar]
- Giustiniani J, Daire V, Cantaloube I, et al. Tubulin acetylation favors Hsp90 recruitment to microtubules and stimulates the signaling function of the Hsp90 clients Akt/PKB and p53. Cell Signal 2009 ; 21 : 529–539. [CrossRef] [PubMed] [Google Scholar]
- Geeraert C, Ratier A, Pfisterer SG, et al. Starvation-induced hyperacetylation of tubulin is required for the stimulation of autophagy by nutrient deprivation. J Biol Chem 2010 ; 285 : 24184–24194. [CrossRef] [PubMed] [Google Scholar]
- Perdiz D, Mackeh R, Poüs C, Baillet A. The ins and outs of tubulin acetylation: more than just a post-translational modification? Cell Signal 2010 ; 23 : 763–771. [Google Scholar]
- Cueva JG, Hsin J, Huang KC, Goodman MB. Posttranslational acetylation of alpha-tubulin constrains protofilament number in native microtubules. Curr Biol 2012 ; 22 : 1066–1074. [CrossRef] [PubMed] [Google Scholar]
- Topalidou I, Keller C, Kalebic N, et al. Genetically separable functions of the MEC-17 tubulin acetyltransferase affect microtubule organization. Curr Biol 2012 ; 22 : 1057–1065. [CrossRef] [PubMed] [Google Scholar]
- Bulinski JC, Richards JE, Piperno G. Posttranslational modifications of alpha tubulin: detyrosination and acetylation differentiate populations of interphase microtubules in cultured cells. J Cell Biol 1988 ; 106 : 1213–1220. [CrossRef] [PubMed] [Google Scholar]
- Chabin-Brion K, Marceiller J, Perez F, et al. The Golgi complex is a microtubule-organizing organelle. Mol Biol Cell 2001 ; 12 : 2047–2060. [PubMed] [Google Scholar]
- Kodani A, Sütterlin C. The Golgi protein GM130 regulates centrosome morphology and function. Mol Biol Cell 2008 ; 19 : 745–753. [CrossRef] [PubMed] [Google Scholar]
- Efimov A, Kharitonov A, Efimova N, et al. Asymmetric CLASP-dependent nucleation of noncentrosomal microtubules at the trans-Golgi network. Dev Cell 2007 ; 12 : 917–930. [CrossRef] [PubMed] [Google Scholar]
- Miller PM, Folkmann AW, Maia ARR, et al. Golgi-derived CLASP-dependent microtubules control Golgi organization and polarized trafficking in motile cells. Nat Cell Biol 2009 ; 11 : 1069–1080. [CrossRef] [PubMed] [Google Scholar]
- Infante AS, Stein MS, Zhai Y, et al. Detyrosinated (Glu) microtubules are stabilized by an ATP-sensitive plus-end cap. J Cell Sci 2000 ; 113 : 3907–3919. [PubMed] [Google Scholar]
- Marceiller J, Drechou A, Durand G, et al. Kinesin is involved in protecting nascent microtubules from disassembly after recovery from nocodazole treatment. Exp Cell Res 2005 ; 304 : 483–492. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Microtubules en croissance. Un microtubule (MT) en croissance s’allonge en incorporant de nouvelles sous-unités de tubuline liées au GTP à son extrémité « plus », hydrolyse le GTP en GDP et change de conformation dans la majorité de sa structure, sauf au niveau de la coiffe (qui contient la tubuline récemment incorporée) et de régions (îlots de conformation tubuline-GTP) qui constituent des sites privilégiés de sauvetage lorsque le MT est en phase de dépolymérisation (après une catastrophe). La conformation tubuline-GTP des îlots pourrait persister lorsque le MT en croissance rencontre des régions discrètes qui restent à identifier, mais dont la fonction pourrait impliquer des MAP (protéines associées aux MT) comme la protéine pVHL. La conformation d’une structure spécifique du MT en croissance et/ou de la tubuline-GTP des îlots pourrait être reconnue par des protéines +TIP, notamment par des protéines comme CLIP-170 ou les CLASP, qui y exerceraient leur fonction de facteur de sauvetage. |
| Dans le texte | |
 |
Figure 2. Les MT acétylés, dynamiques ou stables, présentent une acétylation dans des domaines discontinus. L’acétylation de la tubuline stimule le recrutement sur les MT de moteurs moléculaires (dynéine et kinésine) et de diverses MAP, notamment de facteurs de signalisation qui sont des protéines interagissant avec la chaperone Hsp90 et qui pourraient être recrutées par son intermédiaire. Le contrôle de l’acétylation, qui a lieu à l’intérieur du tube, pourrait s’exercer par l’incorporation de tubuline acétylases et désacétylases au moment de la croissance du MT, mais aussi par échange de ces enzymes entre le cytosol et la lumière du MT au niveau de défauts structuraux (échanges peut-être stimulés par un trafic vésiculaire d’origine golgienne). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




