| Issue |
Med Sci (Paris)
Volume 27, Number 4, Avril 2011
Imagerie et cognition
|
|
|---|---|---|
| Page(s) | 413 - 420 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2011274018 | |
| Published online | 28 April 2011 | |
Plasticité fonctionnelle du cerveau et apprentissage moteur
Imagerie et cognition (5)
Functional brain plasticity associated with motor learning
1
unité de neuro-imagerie fonctionnelle, centre de recherche, Institut universitaire de gériatrie de Montréal, Université de Montréal, 4545, Queen Mary, Montréal, Québec, H3W 1W5, Canada
2
unité de neuro-imagerie fonctionnelle, centre de recherche, Institut universitaire de gériatrie de Montréal; Centre d’étude du sommeil et des rythmes biologiques, Hôpital du Sacré-Cœur de Montréal, Montréal, Québec, Canada
3
unité de neuro-imageriefonctionnelle, centre de recherche, Institut universitaire de gériatrie de Montréal; unité mixte de recherche - S 678, Institut national de la santé et de la recherche médicale, Université Paris 6, centre hospitalier universitaire Pitié-Salpêtrière, Paris, France
Cet article résume les résultats d’une série d’études effectuées dans notre laboratoire pour élucider les substrats anatomiques impliqués dans l’apprentissage de nouvelles séquences de mouvements via les techniques de neuro-imagerie, particulièrement l’imagerie par résonance magnétique fonctionnelle. Après une brève description du modèle que nous avons mis au point et qui a guidé nos travaux sur la caractérisation de la plasticité cérébrale systémique associée à l’acquisition d’habiletés motrices, nous décrivons les changements fonctionnels dynamiques du cerveau régulièrement observés lors des phases rapide, lente, et d’automatisation de l’apprentissage d’une séquence motrice et nous clarifions le rôle joué par le putamen (qui fait partie des noyaux gris centraux), le cervelet et leurs régions corticales motrices associées, dans ce type de mémoire. Finalement, nous rapportons les données d’autres expériences qui démontrent que, suite à la pratique d’une séquence de mouvements, le sommeil lent (et les fuseaux au stade 2 en particulier) contribue au processus de consolidation de la trace mnésique motrice qui a été formée, et que ce phénomène est dépendant d’une augmentation de l’activité neuronale dans le striatum et l’hippocampe.
Abstract
This review presents the results of studies carried out in our laboratory that aim to investigate, through functional magnetic resonance imaging (fMRI), the brain plasticity associated with motor sequence learning, defined as our ability to integrate simple stereotyped movements into a single motor representation. Following a brief description of Doyon and colleagues’ model (2002, 2005, 2009) of motor skill learning that has guided this work, we then describe the functional changes that occur at the different (rapid, slow, automatization) acquisition phases, and propose specific roles that the putamen, the cerebellum and their motor-related cortical areas, play in this form of motor behavior. Finally, we put forward evidence that post-training, non-REM sleep (and spindles in Stage 2 sleep, in particular) contributes to the consolidation of a motor sequence memory trace, and that increased activity within the striatum and/or the hippocampus mediates this mnemonic process.
© 2011 médecine/sciences – Inserm / SRMS
Grâce à ses propriétés fonctionnelles, le système moteur (dont dépend l’activité d’environ 640 muscles squelettiques) permet de nous adapter et de répondre à une pléthore de situations externes auxquelles nous devons faire face dans un monde en perpétuel changement. L’humain est ainsi capable de réagir rapidement aux diverses stimulations sensorielles qui lui parviennent, qu’elles soient menaçantes (par exemple, réflexe de retrait face à une stimulation douloureuse) ou non, de planifier intentionnellement une action dans un but précis (par exemple, porter un verre d’eau à sa bouche pour boire), de prédire le résultat de gestes produits par autrui (par exemple, lorsqu’une personne s’apprête à ouvrir une porte pour nous), d’exécuter une série de mouvements de façon coordonnée (par exemple, pédaler à bicyclette) ou, enfin, d’apprendre de nouvelles habiletés motrices (par exemple, frapper une balle de tennis avec une raquette). Les comportements moteurs appris que nous adoptons au quotidien sont soit simples ou complexes, automatiques ou contrôlés, indépendants ou coordonnés, uniques ou séquentiels. L’ensemble de ce savoir-faire s’acquiert au fil des ans grâce à l’expérience, à notre sens de l’observation, à notre capacité d’imaginer les mouvements et à la pratique physique répétée. Amorcé dès la naissance, le répertoire des gestes, aptitudes et habiletés motrices qui nous distingue s’accroît rapidement durant l’enfance, l’adolescence et l’âge adulte; il peut même s’étendre lors du vieillissement normal.
Une multitude d’études, tant morphologiques, neurophysiologiques et lésionnelles chez l’animal [1–3] que cliniques chez l’humain [4, 5], ont permis de distinguer certaines structures et certains sous-systèmes du cerveau capables de fonder les « routines motrices » nécessaires à la maîtrise de divers comportements moteurs (retrait devant un danger, coordination de mouvements complexes, etc.). Ces recherches ont notamment établi que le striatum, le cervelet et les régions corticales motrices associées (cortex moteur primaire [M1], cortex pré-moteur dorsal et ventral, cingulum moteur, régions motrices supplémentaires et pré-supplémentaires, ainsi que certains territoires du cortex pariétal) formant les circuits cortico-striatal (CS) et cortico-cérébelleux (CC) contribuent à l’élaboration de l’activité neurale nécessaire à l’apprentissage et à la production de mouvements. Cet énoncé s’appuie sur de nouvelles données anatomiques qui indiquent que les noyaux gris centraux (incluant le striatum) et le cervelet forment un réseau fonctionnel intégré grâce à des voies reliant entre elles ces deux structures via le thalamus [6, 7]. Toutefois, depuis trois décennies environ, plusieurs techniques de pointe en neuro-imagerie telles que la tomographie par émission de positrons (TEP), la magnétoencéphalogaphie (MEG), la stimulation magnétique transcrânienne (SMT) et l’imagerie par résonance magnétique fonctionnelle (IRMf) ont été utilisées dans le but de repérer les réseaux de structures cérébrales et leurs rôles dans la fonction motrice. Ces dernières approches expérimentales nous ont permis de constater que le système moteur fait preuve de considérables capacités de plasticité tout au long de notre vie. Ceci est particulièrement manifeste à la suite de lésions ou de maladies affectant le système nerveux central, pour lesquelles il est fréquent d’observer la mise en place d’un mécanisme de compensation motrice (par exemple, après un accident vasculaire cérébral ou dans la maladie de Parkinson) [4, 5]. Par ailleurs, les méthodes d’imagerie in vivo nous ont aussi donné la possibilité d’observer encore mieux ce phénomène de plasticité cérébrale, notamment lors de l’apprentissage incrémentiel (aussi appelé mémoire procédurale) de tâches motrices de toutes sortes.
La brève discussion que constitue cet article sur la plasticité fonctionnelle du cerveau et l’apprentissage moteur repose essentiellement sur les études menées dans notre laboratoire. Nous discuterons des changements fonctionnels du système moteur associés aux diverses phases (rapide, consolidation, lente, automatisation) de l’apprentissage de séquences motrices à l’aide de la neuro-imagerie et de l’IRMf chez des sujets sains en particulier. Nous nous concentrerons sur la description d’études qui jettent un regard sur les substrats neuronaux en jeu dans une seule forme de mémoire procédurale : l’apprentissage de séquences motrices, qui se définit comme le processus par lequel une combinaison de mouvements distincts arrive à être effectuée avec aisance et fluidité après une pratique répétée (par exemple, jouer une pièce de musique au piano).
Tout d’abord, nous décrirons succinctement le modèle théorique qui a guidé nos recherches. Nous isolerons ensuite les corrélats neuronaux associés à l’apprentissage d’une séquence motrice et de certaines composantes kinématiques acquises lors de sa mise en œuvre. Finalement, nous décrirons aussi le rôle de certaines phases du sommeil, ainsi que les bases neuronales qui soutiennent la consolidation de ce type de traces mnésiques motrices.
Dynamique de la plasticité cérébrale associée à l’apprentissage moteur : un modèle
De nombreux modèles ont été proposés afin de décrire les changements de représentations neuronales qui permettent l’amélioration comportementale observée lors de l’exécution d’une séquence de mouvements [3, 8–12]. Chacun apporte à sa façon une explication incomplète de la complexité du processus physiologique qui se déroule au plan systémique : bien que partielle, il s’agit néanmoins d’une pièce importante de l’ensemble du casse-tête. Comme nous sommes conscients de ces limites, la grande majorité des hypothèses de travail qui ont orienté nos travaux ont été émises à partir d’un modèle de la plasticité cérébrale relié à l’apprentissage d’habiletés motrices (Figure 1), lequel a initialement été développé en collaboration avec Leslie Ungerleider [13] et revisité avec Habib Benali [9]. Brièvement, ce modèle prend en compte des données de neuro-imagerie et de neurophysiologie obtenues tant chez l’animal que chez l’humain, et propose l’idée selon laquelle lors de la phase rapide de l’apprentissage de nouveaux mouvements séquentiels, le plan moteur nécessaire à l’exécution de plus en plus efficace de la séquence est dépendant de l’apport fonctionnel des circuits CS et CC. Durant cette phase, le putamen associatif et une partie du néocervelet joueraient un rôle tout particulier dans l’établissement de transitions optimales entre les mouvements et contribueraient à établir une représentation mnémonique de la séquence plutôt que d’être de simples agents aidant à l’exécution plus rapide des gestes isolés. Toutefois, lorsque le sujet atteint un niveau de performance asymptotique, un début de dissociation fonctionnelle entre les systèmes CS et CC s’observerait de sorte que l’apport fonctionnel du cervelet diminuerait avec la pratique, alors que celui du putamen sensorimoteur et de ses structures associées se maintiendrait au fur et à mesure que les mouvements séquentiels deviennent de plus en plus automatisés. Ceci expliquerait donc pourquoi le striatum et, en particulier, le putamen, sont activés suite à la consolidation d’une telle trace mnésique séquentielle et que ces mêmes structures soient réactivées lors du rappel de cette même habileté motrice. Voici certaines des données qui soutiennent quelques-unes des prédictions de ce modèle.
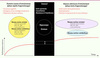 |
Figure 1. Modèle de plasticité cérébrale relié à l’apprentissage d’une séquence de mouvements [9, 13]. Au cours de la première session d’entraînement (soit dans la phase rapide de l’apprentissage), on observe généralement une amélioration importante de la capacité des sujets à exécuter la séquence de mouvements. Les données de neuro-imagerie de notre laboratoire (et celles d’autres groupes de recherche dans le monde) indiquent que ce changement de performance est attribuable à l’émergence d’un plan moteur et d’une stratégie optimale d’exécution de la séquence et est aussi associée à des modifications fonctionnelles dans les régions corticales et sous-corticales formant les circuits cortico-striataux (CS) et cortico-cérébelleux (CC). Le processus de consolidation de la trace mnésique débute après la première séance d’apprentissage. Il est reflété ici par des gains spontanés de performance dépendant du sommeil, mais peut aussi être mesuré par une plus grande résistance à l’interférence. Nos études suggèrent que ce processus est lié à une activité cérébrale impliquant soit le striatum, soit l’hippocampe ou une interaction fonctionnelle entre ces deux structures sous-corticales. Finalement, le système CS et le système CC, dans une bien moindre proportion, seraient en cause dans la stabilisation de la performance durant la phase lente de l’apprentissage, l’automatisation lors d’un entraînement prolongé et le maintien à long terme de cette nouvelle habileté motrice (voir texte pour plus de détails) |
Plasticité cérébrale associée diverses phases d’un apprentissage moteur
De nombreux groupes de chercheurs ont décrit les changements de patrons d’activité du cerveau qui caractérisent chacune des étapes de l’apprentissage d’une nouvelle habileté motrice [3, 8–12]. Globalement, les résultats d’études d’IRMf indiquent que l’apprentissage d’une nouvelle séquence de mouvements, acquise de façon implicite (soit, sans conscience de la présence d’une séquence) ou explicite (soit, avec connaissance préalable de la séquence motrice à exercer), sollicite l’apport fonctionnel des circuits CS et CC au début du processus. Dans cette phase dite rapide de l’apprentissage lors de laquelle les sujets montrent une amélioration importante de leur performance sur une courte période de temps de pratique, l’interaction fonctionnelle de ces sous-systèmes permettrait ainsi d’établir le « plan moteur » nécessaire à l’exécution de plus en plus efficace de la tâche. Par exemple, dans une étude menée en collaboration avec Leslie Ungerleider et d’autres collègues [14], nous avons procédé à l’observation d’images scannées sur trois sessions différentes. Lors de la pratique d’une séquence de 10 mouvements des doigts connus explicitement, nous avons rapporté que l’atteinte d’une performance asymptotique à la session 3 (comparativement à la session 1 d’entraînement) était associée à une augmentation du signal BOLD (blood oxygenated level dependent) dans l’aire sensorimotrice du putamen et dans certaines régions corticales (cortex pariétal inférieur et ventromédial préfrontal, cingulum postérieur, région motrice supplémentaire), ainsi qu’à une diminution de l’activité dans le cervelet, le cingulum antérieur et le cortex prémoteur dorsal. Ces données montrent qu’en lien avec certaines des régions corticales motrices, le putamen et le cervelet jouent un rôle important dans l’élaboration d’une représentation neuronale de la séquence qui facilite ainsi la performance des sujets, mais que leur contribution relative se différencie sur le plan de l’emmagasinage en mémoire de cette séquence. En effet, l’élévation du signal BOLD dans les structures cérébrales du système CS à la fin de l’apprentissage rapide suggère que ce réseau moteur jouerait un rôle dans le maintien à plus long terme de ce type d’habileté motrice. Mais est-ce vraiment le cas ?
Plus récemment, mon laboratoire et celui d’autres groupes de recherche ont utilisé deux stratégies expérimentales afin de répondre à cette question : (1) identifier les patrons d’activité cérébrale avant et après automatisation de la performance des sujets, et (2) comparer l’activité cérébrale d’experts à celle de sujets novices. Premièrement, en collaboration avec des collègues de Paris et de Minneapolis [15], nous avons testé l’apprentissage d’une séquence motrice de 8 mouvements chez un groupe de sujets sains sur une période de 28 jours. Nous avons recueilli des images scannées à trois reprises lors du premier jour de l’apprentissage, puis mené deux autres sessions de scan après 14 et 28 jours de pratique de la séquence motrice. Entre chaque session de scan, les sujets devaient exécuter quotidiennement la séquence connue pendant 15 minutes environ. Les changements de signaux BOLD observés lors du premier jour ont montré une baisse d’activité d’un scan à l’autre dans la région dorsale associative du putamen, laquelle était associée à une augmentation progressive de l’activité cérébrale dans la région ventrale sensorimotrice de cette même structure. De plus, l’activité relative de la région ventrale sensorimotrice du putamen était toujours présente aux jours 14 et 28 tandis qu’une diminution de l’activité dans les régions du cervelet était observée avec l’apprentissage et l’automatisation de la performance des sujets du jour 1 au jour 28 [15].
Dans une seconde étude [10], nous avons comparé les patrons d’activité hémodynamique chez un groupe de femmes qui possédaient de longues années d’expérience du tricot (entre 14 et 58 ans), et avons ainsi pris avantage du fait qu’il existe deux techniques différentes permettant de tricoter une maille à l’endroit, soient la technique nord-américaine (NA : laquelle était parfaitement automatisée chez nos participantes) et la technique européenne (E : qui était inconnue de nos sujets et qui devait donc être apprise de novo). Quoique très simple, un tel schème expérimental comporte de nombreux avantages : il permet de singulariser le circuit neuronal en cause dans l’automatisation (NA) et de le comparer avec le début de l’apprentissage d’une habileté motrice de type séquentiel, en l’occurrence chez un même individu (permettant d’éliminer les effets confondants possibles de différences de groupes) et pour un même but moteur (maille à l’endroit). Comme on s’y attendait (Figure 2), la comparaison du signal BOLD acquis dans la situation nouvelle (E) par rapport à une situation contrôle (mouvements simples de croisement répété des aiguilles à tricoter) a engendré une plus grande activation dans de nombreuses régions motrices corticales (cortex pré-moteur, cingulum antérieur, pariétal, SMA) et sous-corticales incluant le putamen et le cervelet (lobules 5 et 6) de façon bilatérale, montrant encore une fois la nécessité d’une interaction entre les systèmes CS et CC au début de l’apprentissage d’une séquence motrice (Figure 2A). En revanche, lorsque la situation automatisée (NA) fut comparée à celle de la situation nouvelle (E), les résultats montrèrent des activations bilatérales dans les putamen et dans le cortex pré-moteur droit uniquement (Figure 2C), suggérant ainsi que le circuit CS forme le substrat anatomique nécessaire et suffisant à l’emmagasinage à long terme de la représentation neurale d’une habileté motrice bien maîtrisée.
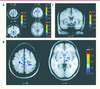 |
Figure 2. Cartes d’activations obtenues lors de l’expérience d’IRMf destinée à étudier les corrélats fonctionnels associés à la technique du tricot. A. Coupes horizontale (Z = 60, 42, 0) et coronale (Y = -44, selon l’atlas stéréotaxique de Talairach et Tournoux) du cerveau démontrant le patron des régions activées des circuits cortico-striataux et cortico-cérébelleux lors du contraste entre la situation de novo (technique européenne) et la situation contrôle. B. Coupes horizontales (Z = 56, 0) démontrant l’activation des aires corticales et régions sous-corticales observée lors du contraste entre la situation automatisée et la situation contrôle. C. Coupe coronale (Y = 2) montrant la région du cortex prémoteur et les régions activées du noyau lenticulaire, et du putamen en particulier, lors du contraste entre la situation automatisée et la situation de novo [10]. Les barres de couleur représentent la distribution des valeurs de tests-T calculés pour chaque voxel. Le côté gauche de l’image correspond au côté gauche du cerveau (d’après [10], © Behavioural Brain Research, Elsevier). |
Création d’une trace mnésique motrice
Bien que les études décrites ci-dessus démontrent que la plasticité cérébrale qui conditionne l’amélioration des performances observée lors de l’apprentissage d’une séquence motrice engage principalement des changements au niveau du putamen, du cervelet et de leurs régions corticales associées, elles ne permettent pas toutefois de spécifier l’apport de ces structures au plan fonctionnel. Par exemple, compte tenu du fait que : (1) l’amélioration des performances mesurée lors de l’acquisition d’une telle habileté s’accompagne généralement d’une augmentation de la rapidité d’exécution de la séquence avec entraînement, et que (2) des altérations de vitesse dans l’exécution de mouvements individuels des doigts peuvent elles-mêmes induire des changements d’amplitude d’activation dans certaines régions motrices (par exemple, M1), il est donc possible que les patrons d’activation dans les circuits CS et CC décrits ci-dessus soient, en partie, expliqués par ce facteur confondant. Afin de vérifier cette hypothèse, Pierre Orban, récemment doctorant dans notre laboratoire, en collaboration avec Philippe Peigneux et Pierre Maquet en Belgique, a effectué une étude d’IRMf dont l’objectif consistait à définir le substrat anatomique qui sous-tend le processus d’apprentissage d’une séquence de mouvements (et qui cause le changement des performances observé) en comparaison avec le processus associé au simple accroissement de la vitesse de production de celle-ci [16]. On a tiré des images scannées lors de l’exercice avec la main gauche d’une séquence complexe connue explicitement comprenant 5 éléments ainsi que dans deux situations contrôles pour lesquelles les sujets étaient contraints de produire une simple séquence de mouvements des doigts (4, 3, 2, 1) déjà automatisée ou des mouvements répétés de chaque doigt. Ces mouvements contrôles étaient produits à trois vitesses (lente, moyenne, rapide) distinctes dans le but de simuler les changements de la performance observés lors de l’apprentissage d’une nouvelle séquence. Les résultats (Figure 3) ont montré que l’augmentation d’activité dans le cervelet spinal (lobules 8, 4-5), ainsi que dans les aires motrices primaires et pré-motrices, était modulée par la performance des sujets obtenue dans les trois situations expérimentales, ce qui suggère que ces dernières contribuent essentiellement à la vitesse d’exécution des mouvements, indépendamment de la présence ou non d’un processus de plasticité cérébrale lié à l’apprentissage d’une séquence motrice. En revanche, comme on s’y attendait, l’activité du putamen et du lobule 6 du cervelet du côté contralatéral aux mouvements était spécifiquement corrélée aux changements des performances observés lors de l’apprentissage proprement dit de la nouvelle séquence motrice, justifiant ainsi la notion selon laquelle ces deux structures jouent des rôles distincts, mais complémentaires, au début du processus d’acquisition d’une telle habileté motrice.
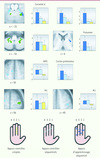 |
Figure 3. Cartes d’activations (quatre premières rangées) et schéma illustratif des conditions expérimentales (rangée du bas) de l’étude d’Orban et al. [16]. Les sujets étaient scannés dans trois situations expérimentales différentes : appuis contrôles simples (gauche), appuis contrôles séquentiels (centre) et appuis d’apprentissage séquentiel (droite). Coupes horizontales (Z = -21 : cervelet lobule 6, -51 : cervelet lobule 8, 52 : aire motrice supplémentaire [AMS] et cortex prémoteur, 56 et 45 : région motrice primaire [M1], 6 : putamen, selon l’atlas stéréotaxique de Talairach et Tournoux) du cerveau démontrant le patron des régions activées en fonction du contexte de production motrice et des différents effets d’activation cérébrale dépendant du niveau de performance. Les barres montrent, pour différentes régions corticales et sous-corticales, la taille de l’effet corrélationnel lors de la production de mouvements simples non séquentiels (jaune), d’un mouvement séquentiel automatisé (bleu clair) ou d’une nouvelle séquence (bleu foncé). Les zones d’activation (en vert) révèlent les régions (cervelet lobules 6 et 8, M1) dont l’activité est corrélée dans toutes les situations, indépendamment de la présence ou non d’un apprentissage. Les patrons d’activation (en bleu clair : cervelet lobule 6, AMS, cortex prémoteur, M1) présentent également une réponse indépendante de l’apprentissage mais spécifique lors de la production d’un mouvement séquentiel. En revanche, les régions (putamen, cervelet lobule 6) dont l’activation est colorée en bleu foncé correspondent à celles dont l’activité augmente en lien avec les changements de performance associés spécifiquement à l’apprentissage d’une séquence motrice, démontrant ainsi leur engagement dans les processus de plasticité cérébrale proprement dits (d’après [16], © Neuroimage, Elsevier). |
Dans une seconde étude d’IRMf, Orban et al. (en préparation) ont aussi tenté de mieux caractériser les déterminants comportementaux de la plasticité cérébrale induite au début de l’apprentissage d’une séquence motrice. Plus particulièrement, nous nous sommes intéressés à mieux comprendre les effets de l’amélioration des performances de deux variables kinématiques, soient la vélocité des mouvements individuels et la transition entre chaque mouvement de la séquence (coarticulation), sur les changements d’activation dans les réseaux CS et CC, sur la base d’un protocole événementiel dans lequel les sujets devaient effectuer 60 séquences de mouvement des doigts de 8 éléments chacune. En employant une boîte d’enregistrement des appuis qui permettait d’obtenir une mesure fiable de ces deux paramètres, les résultats ont montré qu’avec la pratique, les changements de vélocité étaient corrélés à ceux de l’activité des régions spino-cérébelleuses ipsilatérales (lobules 4, 5, 8 et 6 médial) et du cortex moteur primaire controlatéral. En revanche, l’amélioration dans la coarticulation des gestes était associée à une augmentation de l’activité dans les régions du néo-cervelet (lobule 6 bilatéral et lobules 4-5 ipsilatéraux), ainsi que dans le circuit CS incluant le putamen droit et gauche. Ces données indiquent donc que l’amélioration générale des performances dans l’exécution d’une séquence est le produit de changements dans au moins deux variables kinématiques et que l’expression de ces variables n’est possible que grâce à l’apport fonctionnel de réseaux neuronaux partiellement ségrégés.
Consolidation d’une trace mnésique motrice : le sommeil
La consolidation d’une séquence de mouvements nouvellement apprise correspond au processus durant lequel la représentation neurale (trace mnésique) d’une telle habileté est transférée de manière différée off-line en mémoire à long terme grâce à des modifications fonctionnelles, tant sur le plan cellulaire [17, 18] que systémique [9, 10, 13]. Ce phénomène peut notamment être observé lorsque l’individu atteint un niveau de performance asymptotique durant la première session d’entraînement et démontre une amélioration spontanée des performances lors d’une seconde session de test après une période de temps écoulée sans entraînement additionnel. De nombreuses études, celles de mon laboratoire incluses, ont récemment montré que ces gains (qui indiquent que le processus de consolidation a bel et bien eu lieu) sont dépendants du sommeil [19–22]. Ceci est particulièrement vrai lorsque la séquence est connue explicitement au moment de l’acquisition initiale [19, 21], qu’elle est déterministe plutôt que probabiliste [23] et que la représentation acquise est allocentrique (spatiale, extrinsèque) et non egocentrique (motrice, intrinsèque) [24]. De plus, quoiqu’encore controversées, nos données et celles d’autres groupes de recherche semblent indiquer que les mécanismes cérébraux engendrés par les fuseaux au stade 2 du sommeil (correspondant à des bouffées d’activité cellulaire entre 11 et 15 Hz de courte durée [de 0,5 à 2,0 s environ]) jouent un rôle critique dans le processus de consolidation d’une telle trace mnésique. En effet, en collaboration avec Julie Carrier, nous avons montré dans une première étude [25] que l’acquisition d’une séquence motrice en soirée avant le coucher avait pour effet d’augmenter le nombre et la durée des fuseaux de sommeil, tandis que d’autres caractéristiques physiologiques (par exemple, les ondes delta) du sommeil demeuraient stables durant la nuit. Dans une deuxième expérience d’IRMf conduite chez des sujets jeunes qui étaient scannés à deux reprises, soit le soir après avoir acquis une nouvelle séquence et le lendemain matin lors d’une session de retest (groupe nuit), ou le matin et en soirée après une période de 12 heures sans sommeil passée au laboratoire (groupe jour), Karen Debas (doctorante dans notre laboratoire) [26] a décrit une augmentation de l’activité BOLD localisée bilatéralement dans les putamen chez le groupe nuit comparativement au groupe jour (Figure 4). Ensemble ces données soulèvent la possibilité que l’augmentation des fuseaux au stade 2 et celle de l’activité hémodynamique au niveau des putamen soient associées aux gains de performance, et donc au processus off-line de consolidation. Afin de tester cette hypothèse, Marc Barakat (doctorant dans notre laboratoire) (Barakat et al., soumis pour publication) a combiné les données d’EEG et d’IRMf de ces deux expériences et a démontré que les changements d’activité du putamen droit (controlatéral à la main entraînée) et non ceux du putamen gauche, étaient corrélés à l’amplitude des fuseaux détectés avec les dérivées frontales, centrales et pariétales (soient F3, F4, C4 et P3). De plus, l’amplitude des fuseaux sur ces mêmes dérivées était aussi corrélée aux gains spontanés de performance mesurés le lendemain matin, suggérant ainsi que l’activité électrique propre aux fuseaux et l’élévation de l’activité BOLD dans le système cortico-striatal constitueraient des mécanismes physiologiques vraisemblables lors de la consolidation de ce type d’habileté motrice. En revanche, une étude menée récemment par Geneviève Albouy (post-doctorante dans notre laboratoire), en collaboration avec Pierre Maquet et d’autres collègues [27], a élégamment démontré, chez de jeunes participants, que non seulement le striatum mais également l’hippocampe contribueraient au processus de consolidation d’un apprentissage implicite d’une séquence oculomotrice en conditionnant le processus de création de la trace mnésique motrice engendrée durant la période initiale de pratique (Figure 5). De fait, ces auteurs ont établi que le recrutement précoce de l’hippocampe (voir coupe sagitale en haut et graphe de corrélation à droite) et du striatum permettait de prédire le gain de performance observé après une nuit de sommeil. De plus, l’activité dans ces deux régions (voir coupes coronales en bas à droite) était plus importante après une nuit de sommeil que durant la journée après l’apprentissage; ainsi l’interaction compétitive observée entre elles pendant l’entraînement devenait coopératif après la nuit. Ces résultats indiquent que ces régions jouent un rôle primordial dans l’optimisation à long terme des mouvements séquentiels appris. Quoique innovatrice, cette conception qui profile l’hippocampe comme agent promoteur de la genèse d’une trace mnésique, soit seul soit en interaction avec le striatum, n’est assise que sur une petite poignée d’études; de nombreux autres travaux sont donc nécessaires afin de bien cerner la contribution fonctionnelle des systèmes striatal et limbique dans le phénomène de consolidation d’une habileté motrice.
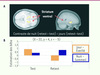 |
Figure 4. Résultats de l’étude de K. Debas et al. [26].A. coupes horizontale et sagittale comparant les données d’IRMf du groupe nuit à celles du groupe jour après une période de 12 heures comprenant soit une nuit de sommeil soit le simple passage du temps dans le laboratoire. Les résultats suggèrent que le groupe nuit présente une plus grande augmentation du signal BOLD dans les striatum ventraux droit et gauche lors du retest que celle du groupe jour. B. graphique illustrant les valeurs bêta (interaction) extraites du putamen droit (contralatéral à la main utilisée pour effectuer la tâche de séquence motrice) et ce pour les deux groupes aux sessions de test et retest (d’après [26]). |
 |
Figure 5. Schéma expérimental et résultats de l’étude de G. Albouy et al. [27]. De jeunes volontaires sains ont été scannés en IRMf lors d’un apprentissage de séquences oculomotrices durant l’entraînement initial et lors de sessions de retest prenant place 30 min, 5 h ou 24 h après la fin de la période d’entraînement. Pendant l’entraînement, les réponses observées dans l’hippocampe (coupe sagittale [X = -32; selon l’atlas stéréotaxique de Talairach et Tournoux, en haut à gauche] et graphe de corrélation à droite) et le striatum sont linéairement reliées aux gains de performance observés après la nuit (retest 24h), mais non au cours de la journée (retests 30 min et 5 h). L’interaction entre ces deux régions devient coopérative après la nuit (voir coupes coronales en bas à droite). Ces résultats mettent en évidence l’importance de ces deux régions dans les processus de consolidation de la mémoire procédurale, et d’une séquence oculomotrice en particulier (d’après [27], © Neuron, Elsevier). |
Conclusion
Depuis plusieurs années maintenant, une grande partie des travaux de notre laboratoire a été consacrée à mieux cerner les déterminants comportementaux et les changements dynamiques de plasticité cérébrale qui soutiennent les améliorations de performance classiquement observées lors de l’acquisition d’une nouvelle séquence de mouvements. Nos études, et celles d’autres groupes de recherche, indiquent ainsi que la représentation neurale d’une telle habileté motrice est en perpétuel changement au cours des diverses phases de l’apprentissage et que cette dernière est grandement dépendante de nombreux facteurs propres à la nature de la tâche, aux situations d’entraînement, à la nature du protocole, ainsi qu’aux processus mnésiques mis à contribution, non seulement durant l’acquisition proprement dite des mouvements séquentiels appris, mais encore de manière différée, comme lors du sommeil. Tous les résultats sont en accord avec le modèle proposé par Doyon et collaborateurs [9] et suggèrent que le système CS joue un rôle, non seulement dans l’acquisition, mais également dans la consolidation et le maintien à long terme de ce type d’habileté motrice.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Références
- GraybielAM. Habits, rituals, and the evaluative brain. Annu Rev Neurosci 2008 ; 31 : 359-387. [CrossRef] [PubMed] [Google Scholar]
- JogMS, KubotaY, ConnollyCI, et al. Building neural representations of habits. Science 1999 ; 286 : 1745-1749. [CrossRef] [PubMed] [Google Scholar]
- HikosakaO, NakamuraK, SakaiK, NakaharaH. Central mechanisms of motor skill learning. Curr Opin Neurobiol 2002 ; 12 : 217-222. [CrossRef] [PubMed] [Google Scholar]
- DoyonJ. Motor sequence learning and movement disorders. Curr Opin Neurol 2008 ; 21 : 478-483. [CrossRef] [PubMed] [Google Scholar]
- NieuwboerA, RochesterL, MuncksL, SwinnenSP. Motor learning in Parkinson’s disease: limitations and potential for rehabilitation. Parkinsonism Relat Disord 2009 ; 15 (suppl 3) : S53-S58. [CrossRef] [Google Scholar]
- HoshiE, SawamuraH, TanjiJ. Neurons in the rostral cingulate motor area monitor multiple phases of visuomotor behavior with modest parametric selectivity. J Neurophysiol 2005 ; 94 : 640-656. [CrossRef] [PubMed] [Google Scholar]
- BostanAC, DumRP, StrickPL. The basal ganglia communicate with the cerebellum. Proc Natl Acad Sci USA 2010 ; 107 : 8452-8456. [CrossRef] [Google Scholar]
- AsheJ, LunguOV, BasfordAT, LuX. Cortical control of motor sequences. Curr Opin Neurobiol 2006 ; 16 : 213-221. [CrossRef] [PubMed] [Google Scholar]
- DoyonJ, BenaliH. Reorganization and plasticity in the adult brain during learning of motor skills. Curr Opin Neurobiol 2005 ; 15 : 161-167. [Google Scholar]
- DoyonJ, BellecP, AmselR, et al. Contributions of the basal ganglia and functionally related brain structures to motor learning. Behav Brain Res 2009 ; 199 : 61-75. [CrossRef] [PubMed] [Google Scholar]
- DoyaK. Complementary roles of basal ganglia and cerebellum in learning and motor control. Curr Opin Neurobiol 2000 ; 10 : 732-739. [CrossRef] [PubMed] [Google Scholar]
- ShadmehrR, KrakauerJW. A computational neuroanatomy for motor control. Exp Brain Res 2008 ; 185 : 359-381. [CrossRef] [PubMed] [Google Scholar]
- DoyonJ, UngerleiderLG. Functional anatomy of motor skill learning. In : SquireLR, SchacterDL. Neuropsychology of memory, 3rd ed.New York : The Guilford Press, 2002: 225-238. [Google Scholar]
- DoyonJ, SongAW, KarniA, et al. Experience-dependent changes in cerebellar contributions to motor sequence learning. Proc Natl Acad Sci USA 2002 ; 99 : 1017-1022. [CrossRef] [Google Scholar]
- LehericyS, BenaliH. van de Moortele PF, et al. Distinct basal ganglia territories are engaged in early and advanced motor sequence learning. Proc Natl Acad Sci USA 2005 ; 102 : 12566-12571. [CrossRef] [Google Scholar]
- OrbanP, PeigneuxP, LunguO, et al. The multifaceted nature of the relationship between performance and brain activity in motor sequence learning. Neuroimage 2010 ; 49 : 694-702. [CrossRef] [PubMed] [Google Scholar]
- DudaiY. The neurobiology of consolidations, or, how stable is the engram?. Annu Rev Psychol 2004 ; 55 : 51-86. [CrossRef] [PubMed] [Google Scholar]
- McGaughJL. Memory: a century of consolidation. Science 2000 ; 287 : 248-251. [CrossRef] [PubMed] [Google Scholar]
- DoyonJ, KormanM, MorinA, et al. Contribution of night and day sleep versus simple passage of time to the consolidation of motor sequence and visuomotor adaptation learning. Exp Brain Res 2009 ; 195 : 15-26. [Google Scholar]
- FischerS, NitschkeMF, MelchertUH, et al. Motor memory consolidation in sleep shapes more effective neuronal representations. J Neurosci 2005 ; 25 : 11248-11255. [Google Scholar]
- RobertsonEM, Pascual-LeoneA, PressDZ. Awareness modifies the skill-learning benefits of sleep. Curr Biol 2004 ; 14 : 208-212. [PubMed] [Google Scholar]
- WalkerMP, BrakefieldT, MorganA, et al. Practice with sleep makes perfect: sleep-dependent motor skill learning. Neuron 2002 ; 35 : 205-211. [CrossRef] [PubMed] [Google Scholar]
- SongS, HowardJHJr., HowardDV. Sleep does not benefit probabilistic motor sequence learning. J Neurosci 2007 ; 27 : 12475-12483. [CrossRef] [PubMed] [Google Scholar]
- CohenDA, Pascual-LeoneA, PressDZ, RobertsonEM. Off-line learning of motor skill memory: a double dissociation of goal and movement. Proc Natl Acad Sci USA 2005 ; 102 : 18237-18241. [Google Scholar]
- MorinA, DoyonJ, DostieV, et al. Motor sequence learning increases sleep spindles and fast frequencies in post-training sleep. sleep 2008 ; 31 : 1149-1156. [Google Scholar]
- DebasK, CarrierJ, OrbanP, et al. Brain plasticity related to the consolidation of motor sequence learning and motor adaptation. Proc Natl Acad Sci USA 2010 ; 107 : 17839-17844. [CrossRef] [Google Scholar]
- AlbouyG, SterpenichV, BalteauE, et al. Both the hippocampus and striatum are involved in consolidation of motor sequence memory. Neuron 2008 ; 58 : 261-272. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Modèle de plasticité cérébrale relié à l’apprentissage d’une séquence de mouvements [9, 13]. Au cours de la première session d’entraînement (soit dans la phase rapide de l’apprentissage), on observe généralement une amélioration importante de la capacité des sujets à exécuter la séquence de mouvements. Les données de neuro-imagerie de notre laboratoire (et celles d’autres groupes de recherche dans le monde) indiquent que ce changement de performance est attribuable à l’émergence d’un plan moteur et d’une stratégie optimale d’exécution de la séquence et est aussi associée à des modifications fonctionnelles dans les régions corticales et sous-corticales formant les circuits cortico-striataux (CS) et cortico-cérébelleux (CC). Le processus de consolidation de la trace mnésique débute après la première séance d’apprentissage. Il est reflété ici par des gains spontanés de performance dépendant du sommeil, mais peut aussi être mesuré par une plus grande résistance à l’interférence. Nos études suggèrent que ce processus est lié à une activité cérébrale impliquant soit le striatum, soit l’hippocampe ou une interaction fonctionnelle entre ces deux structures sous-corticales. Finalement, le système CS et le système CC, dans une bien moindre proportion, seraient en cause dans la stabilisation de la performance durant la phase lente de l’apprentissage, l’automatisation lors d’un entraînement prolongé et le maintien à long terme de cette nouvelle habileté motrice (voir texte pour plus de détails) |
| Dans le texte | |
 |
Figure 2. Cartes d’activations obtenues lors de l’expérience d’IRMf destinée à étudier les corrélats fonctionnels associés à la technique du tricot. A. Coupes horizontale (Z = 60, 42, 0) et coronale (Y = -44, selon l’atlas stéréotaxique de Talairach et Tournoux) du cerveau démontrant le patron des régions activées des circuits cortico-striataux et cortico-cérébelleux lors du contraste entre la situation de novo (technique européenne) et la situation contrôle. B. Coupes horizontales (Z = 56, 0) démontrant l’activation des aires corticales et régions sous-corticales observée lors du contraste entre la situation automatisée et la situation contrôle. C. Coupe coronale (Y = 2) montrant la région du cortex prémoteur et les régions activées du noyau lenticulaire, et du putamen en particulier, lors du contraste entre la situation automatisée et la situation de novo [10]. Les barres de couleur représentent la distribution des valeurs de tests-T calculés pour chaque voxel. Le côté gauche de l’image correspond au côté gauche du cerveau (d’après [10], © Behavioural Brain Research, Elsevier). |
| Dans le texte | |
 |
Figure 3. Cartes d’activations (quatre premières rangées) et schéma illustratif des conditions expérimentales (rangée du bas) de l’étude d’Orban et al. [16]. Les sujets étaient scannés dans trois situations expérimentales différentes : appuis contrôles simples (gauche), appuis contrôles séquentiels (centre) et appuis d’apprentissage séquentiel (droite). Coupes horizontales (Z = -21 : cervelet lobule 6, -51 : cervelet lobule 8, 52 : aire motrice supplémentaire [AMS] et cortex prémoteur, 56 et 45 : région motrice primaire [M1], 6 : putamen, selon l’atlas stéréotaxique de Talairach et Tournoux) du cerveau démontrant le patron des régions activées en fonction du contexte de production motrice et des différents effets d’activation cérébrale dépendant du niveau de performance. Les barres montrent, pour différentes régions corticales et sous-corticales, la taille de l’effet corrélationnel lors de la production de mouvements simples non séquentiels (jaune), d’un mouvement séquentiel automatisé (bleu clair) ou d’une nouvelle séquence (bleu foncé). Les zones d’activation (en vert) révèlent les régions (cervelet lobules 6 et 8, M1) dont l’activité est corrélée dans toutes les situations, indépendamment de la présence ou non d’un apprentissage. Les patrons d’activation (en bleu clair : cervelet lobule 6, AMS, cortex prémoteur, M1) présentent également une réponse indépendante de l’apprentissage mais spécifique lors de la production d’un mouvement séquentiel. En revanche, les régions (putamen, cervelet lobule 6) dont l’activation est colorée en bleu foncé correspondent à celles dont l’activité augmente en lien avec les changements de performance associés spécifiquement à l’apprentissage d’une séquence motrice, démontrant ainsi leur engagement dans les processus de plasticité cérébrale proprement dits (d’après [16], © Neuroimage, Elsevier). |
| Dans le texte | |
 |
Figure 4. Résultats de l’étude de K. Debas et al. [26].A. coupes horizontale et sagittale comparant les données d’IRMf du groupe nuit à celles du groupe jour après une période de 12 heures comprenant soit une nuit de sommeil soit le simple passage du temps dans le laboratoire. Les résultats suggèrent que le groupe nuit présente une plus grande augmentation du signal BOLD dans les striatum ventraux droit et gauche lors du retest que celle du groupe jour. B. graphique illustrant les valeurs bêta (interaction) extraites du putamen droit (contralatéral à la main utilisée pour effectuer la tâche de séquence motrice) et ce pour les deux groupes aux sessions de test et retest (d’après [26]). |
| Dans le texte | |
 |
Figure 5. Schéma expérimental et résultats de l’étude de G. Albouy et al. [27]. De jeunes volontaires sains ont été scannés en IRMf lors d’un apprentissage de séquences oculomotrices durant l’entraînement initial et lors de sessions de retest prenant place 30 min, 5 h ou 24 h après la fin de la période d’entraînement. Pendant l’entraînement, les réponses observées dans l’hippocampe (coupe sagittale [X = -32; selon l’atlas stéréotaxique de Talairach et Tournoux, en haut à gauche] et graphe de corrélation à droite) et le striatum sont linéairement reliées aux gains de performance observés après la nuit (retest 24h), mais non au cours de la journée (retests 30 min et 5 h). L’interaction entre ces deux régions devient coopérative après la nuit (voir coupes coronales en bas à droite). Ces résultats mettent en évidence l’importance de ces deux régions dans les processus de consolidation de la mémoire procédurale, et d’une séquence oculomotrice en particulier (d’après [27], © Neuron, Elsevier). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




