| Issue |
Med Sci (Paris)
Volume 26, Number 8-9, Août-Septembre 2010
|
|
|---|---|---|
| Page(s) | 690 - 693 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2010268-9690 | |
| Published online | 15 August 2010 | |
Spermatogenèse normale chez un homme avec défaut génétique de la LH
Normal spermatogenesis in a patient with mutant luteinizing hormone
1
Laboratoire de génétique moléculaire, Hôpital de Bicêtre, APHP, 94275 Le Kremlin-Bicêtre, France
2
Département d’endocrinologie et maladies de la reproduction, Hôpital Pitié-Salpêtrière, Paris Cedex 13, France
3
Centre des maladies endocriniennes rares de la croissance, Université Paris VI, France
4
Inserm U854, Hôpital de Bicêtre, 94275 Le Kremlin-Bicêtre, France
5
Université Paris Sud-11, France
*
micheline.misrahi@bct.aphp.fr
*
philippe.touraine@psl.aphp.fr
Près de 15 % des couples sont infertiles et l’origine en est masculine dans environ la moitié des cas, ce qui en fait un problème de santé publique. Par ailleurs, une diminution du nombre et de la qualité des spermatozoïdes est retrouvée dans les pays industrialisés. Le plus souvent, aucun traitement de l’infertilité masculine n’est disponible, et pour instituer des thérapies adéquates, il est indispensable d’approfondir les connaissances des mécanismes du déclenchement et du maintien de la spermatogenèse. Or ces mécanismes sont toujours mal compris à l’heure actuelle.
Contrôle hormonal de la spermatogenèse : rôle classique de la LH et de la testostérone
Chez l’homme, la spermatogenèse est déclenchée à la puberté lors de l’activation de la sécrétion pulsatile du peptide hypothalamique GnRH (gonadotropin releasing hormone) qui induit la sécrétion de deux gonadotrophines hypophysaires : la LH (hormone lutéinisante) et la FSH (hormone folliculostimulante) (Figure 1A) [1, 2]. Ces deux hormones comprennent une sous-unité α commune et une sous-unité β spécifique. La LH contrôle la production de la testostérone par les cellules de Leydig, cellules endocrines situées dans l’interstitium du testicule (Figure 1A). Cette hormone est indispensable à la virilisation et, en conjonction avec la FSH, au déclenchement de la spermatogenèse. L’action conjointe de la testostérone et de la FSH s’exerce sur les cellules de Sertoli qui délimitent la paroi des tubes séminifères dans lesquels les cellules germinales vont maturer jusqu’au stade de spermatozoïdes (Figure 1A).
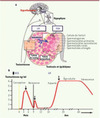 |
Figure 1 Contrôle de la spermatogenèse. A. Contrôle hormonal. La GnRH produite par l’hypothalamus stimule la production des gonadotrophines LH et FSH par l’hypophyse. La LH induit la prolifération et la maturation des cellules de Leydig interstitielles qui vont sécréter la testostérone. La FSH agit sur les cellules de Sertoli des tubes séminifères. En conjonction avec la testostérone, ces deux hormones vont stimuler la prolifération et la maturation des cellules de la lignée germinale dans les tubes séminifères où seront sécrétés les spermatozoïdes matures. B. Vagues de prolifération des cellules de Leydig. Chaque vague s’accompagne d’une élévation du taux de testostérone plasmatique. La première vague (1), anténatale, est induite par l’hCG placentaire. Elle est indispensable au développement et à la masculinisation des organes génitaux internes et externes. Après la naissance, la LH joue un rôle essentiel dans le déclenchement des vagues de prolifération des cellules de Leydig. La vague néonatale (2) ou « minipuberté » et la vague pubertaire chez l’adolescent (3) sont dues à l’activation de l’axe gonadique, c’està-dire la sécrétion de GnRH et donc de LH et FSH hypophysaires. En période néonatale, cette activation est transitoire (adapté de [2]). |
Selon un concept bien établi, le déclenchement et le maintien de la spermatogenèse chez l’homme nécessitent une sécrétion maximale de LH lors de la puberté, aboutissant à la multiplication et à la maturation d’un nombre important de cellules de Leydig, conditions nécessaires pour la sécrétion de fortes concentrations intratesticulaires de testostérone. En effet, des concentrations de testostérone intratesticulaire environ 100 fois supérieures aux concentrations sanguines sont retrouvées chez l’homme normal et sont considérées comme nécessaires à la fois à la virilisation des organes génitaux externes et à la fertilité [1].
Mieux comprendre le rôle des hormones en reproduction humaine grâce aux déficits génétiques de l’axe gonadique
Les actions des gonadotrophines sur la fertilité masculine ont été surtout étudiées à l’aide de modèles de souris chez lesquelles les gènes codant pour l’une ou l’autre des gonadotrophines ou pour leurs récepteurs respectifs étaient inactivés. Cependant, des différences importantes existent entre les modèles animaux qui devraient manifester des phénotypes équivalents, et il n’est pas possible d’extrapoler à l’homme les données obtenues à partir de ces modèles de souris.
L’étude de patients présentant des anomalies génétiques de l’axe gonadique nous offre l’opportunité de mieux comprendre la physiologie humaine. Les répercussions de mutations des récepteurs de la LH (LHR) et de la FSH, ou de leurs ligands hormonaux correspondants, ont permis d’identifier certains syndromes et de mieux comprendre l’action physiologique des hormones sur leurs organes cibles [3]. Des mutations de la LHβ inactivant complètement la fonction de l’hormone ont été retrouvées chez cinq patients [4–7]. Ces individus, normalement masculinisés à la naissance, n’ont pas de développement pubertaire. La testostérone plasmatique est effondrée. Les spermogrammes révèlent une absence de spermatogenèse, et la biopsie testiculaire l’absence des cellules de Leydig ou de très rares cellules de Leydig immatures résiduelles et un blocage de la maturation des cellules germinales.
Ces observations montrent que dans l’espèce humaine, la LH n’est pas nécessaire à la différenciation des organes génitaux dans le sens mâle. En effet, dans cette espèce, l’hCG (human chorionic gonadotropin) produite par le placenta, très homologue à la LH, permettra la masculinisation des organes génitaux avant la naissance en agissant sur le même récepteur LHR. Cependant après la naissance, la LH est indispensable à la maturation testiculaire, en particulier à la prolifération et à la maturation des cellules de Leydig qui vont acquérir la capacité de sécréter de la testostérone, permettant la virilisation pubertaire et le déclenchement de la spermatogenèse.
Cependant, une observation inattendue est faite chez les hommes porteurs d’un défaut génétique de la LH : même après des traitements de plusieurs années par de fortes doses d’hormones (hCG), la spermatogenèse reste effondrée chez ces patients qui restent infertiles, comme si on avait laissé passer une « fenêtre de susceptibilité testiculaire » essentielle, à laquelle il n’est pas possible ensuite de suppléer. La capacité de prolifération et de différenciation des cellules de Leydig est altérée de façon définitive.
Prolifération des cellules testiculaires productrices de testostérone en différentes « vagues »
Il existe en fait, dans l’espèce humaine, trois vagues de prolifération des cellules de Leydig (Figure 1B) [7]. Chacune de ces vagues est caractérisée par la production de testostérone par ces cellules. La première est anténatale : elle survient après 10 semaines de vie fœtale et dépend de l’hCG. La sécrétion de testostérone fœtale atteint son niveau maximal à 14-15 semaines. La testostérone produite par les cellules de Leydig fœtales induit la différenciation des organes génitaux internes et la masculinisation des organes génitaux externes.
Les deux autres vagues de prolifération des cellules de Leydig sont postnatales et la LH a alors un rôle essentiel. Chez les enfants à la fin du deuxième mois de vie, en période périnatale, la sécrétion de GnRH est activée transitoirement. La sécrétion de LH et de FSH hypophysaire provoque le développement d’une deuxième vague de cellules de Leydig et la production d’un pic de testostérone à des taux pubertaires. Cet événement appelé « minipuberté » est de courte durée et son rôle est mal connu. À la fin de la première année, le testicule entre dans un état de quiescence. La troisième vague se produit à la puberté lors de l’activation de l’axe gonadotrope chez l’adolescent. Sous l’action des gonadotrophines, la sécrétion de testostérone est activée, la virilisation se produit et la spermatogenèse est déclenchée et maintenue par une action conjointe de la testostérone et de la FSH.
À ce jour, les traitements des patients adultes présentant un défaut de LH sont inefficaces, mettant en exergue notre méconnaissance des mécanismes de déclenchement et de maintien de la spermatogenèse dans l’espèce humaine. En effet, on ignore les seuils d’hormones (gonadotrophines LH et FSH, testostérone) nécessaires à la fertilité chez l’homme.
Un nouveau concept du rôle de la LH et de la testostérone dans la spermatogenèse
L’étude d’un patient avec un défaut génétique partiel de la LH a donné des informations inattendues [8]. Ce patient, suivi dans le service d’endocrinologie de l’hôpital de la PitiéSalpêtrière, avait une LH indétectable, des taux de testostérone circulante effondrés, une absence de puberté et, par conséquent, une absence de virilisation spontanée à l’âge adulte. La FSH était élevée. Ceci évoquait un tableau de déficit isolé en LH. Cependant, d’une façon très surprenante, plusieurs spermogrammes ont montré chez ce patient une spermatogenèse spontanée quantitativement normale et qualitativement normale à subnormale.
L’étude moléculaire a retrouvé, chez cet individu né de parents consanguins, une délétion homozygote de 9 bases dans le gène codant pour la sous-unité βde la LH, provoquant une délétion des acides aminés 10 à 12 (His, Pro, Ile) localisée dans la partie amino-terminale de l’hormone qui tolère des changements conformationnels.
L’étude in vitro de cette mutation, par cotransfection dans des cellules eucaryotes d’un vecteur d’expression codant la sous-unité β mutée de la LH et la sous-unité α, a montré que l’expression et la sécrétion de l’hormone mutée étaient diminuées. Une hétérodimérisation de cette sous-unité β mutée avec la sous-unité α a été détectée par des études de co-immunoprécipitation des deux sous-unités, mais en quantité très diminuée par rapport à l’hétérodimérisation des sous-unités sauvages. L’hormone dimérique mutée conserve une activité résiduelle et se fixe sur le récepteur de la LH, comme l’objective l’activation de l’adénylate cyclase cellulaire, mais cette activité biologique in vitro est fortement réduite par rapport à celle de l’hormone sauvage (environ 1 %).
L’action de cette LH mutée in vivo a pu être démontrée par l’étude de la biopsie testiculaire du patient. En effet, grâce à des études d’immunocytochimie utilisant des anticorps spécifiques d’enzymes de la voie de biosynthèse de la testostérone, il a été possible de détecter de très rares cellules de Leydig matures, possédant l’équipement enzymatique nécessaire à la production de testostérone (Figure 2). Ceci témoigne de l’action de la LH, seule hormone capable d’induire l’expression de ces enzymes et de stimuler la synthèse de testostérone dans le testicule. Enfin, le dosage de la testostérone intratesticulaire a été réalisé sur un fragment de biopsie testiculaire par spectrométrie de masse. Chez le patient, la concentration de testostérone intratesticulaire est de 20,2 ng/g de tissu, soit 18 fois plus faible que chez un homme normal du même âge (356,6 ng/g de tissu).
 |
Figure 2 Études histologique et immunocytochimique du testicule chez un patient avec un déficit génétique partiel en LHβ. A. Coloration hématoxyline éosine : amas de cellules de Leydig matures avec noyaux ronds et cytoplasme abondant, riche en gouttelettes lipidiques (flèche) entre deux tubules séminifères (x 20). B. Immunomarquage avec un anticorps dirigé contre l’enzyme de la stéroïdogenèse P450c17α hydroxylase-17,20-lyase : les cellules de Leydig matures présentes entre les tubules séminifères (flèches) expriment l’enzyme-clé de la synthèse des androgènes (x 20). C. Coloration hématoxyline éosine : fort grossissement d’une section de tubule séminifère. Dans la lumière sont clairement visibles des cellules germinales à tous les stades de maturation, du stade de spermatogonie (flèche épaisse) au stade de spermatide allongé (flèche) avant leur libération dans la lumière du tube séminifère (LB : lame basale, x 40). D. Immunomarquage avec un anticorps dirigé contre le récepteur des androgènes : les noyaux des cellules de Sertoli à l’intérieur du tubule séminifère sont marqués. Ceci explique l’action paracrine de la testostérone sécrétée par les cellules de Leydig interstitielles qui, en synergie avec la FSH, stimulera la maturation des cellules germinales (x 20). E, F. Les cellules germinales chez le patient expriment deux marqueurs spécifiques : l’histone H1 (E) qui marque les cellules germinales à partir du stade de spermatide, et la proacrosine (F), exprimée par les cellules germinales méiotiques et post-méiotiques, confirmant le stade avancé de maturation de la lignée germinale chez ce patient (respectivement x 20 et x 100). |
La production intratesticulaire de testostérone chez ce patient génère de très faibles taux de testostérone dans le sang, insuffisants pour induire une virilisation périphérique, comme le montre l’absence de développement pubertaire spontané. La petite quantité de testostérone produite dans le testicule est cependant suffisante, en conjonction avec la FSH, pour avoir une action locale et induire le développement des tubes séminifères et une maturation complète de la lignée germinale (Figure 2).
Conclusions et perspectives thérapeutiques
Chez ce patient, on peut donc conclure qu’une activité minimale de la LH entraînant une minime production de testostérone par de très rares cellules de Leydig, d’abord lors de la « minipuberté » en période postnatale puis lors de la puberté, a été suffisante pour déclencher et maintenir une spermatogenèse complète à l’âge adulte, contrairement aux idées reçues.
Cette observation a des conséquences sur la prise en charge de certaines infertilités masculines. En effet, le traitement hormonal substitutif des patients atteints d’hypogonadisme d’origine hypophysaire congénital est actuellement débuté à la puberté. La prise en charge très précoce de ces patients, dès la première année de vie [9], et l’institution d’un traitement transitoire par des gonadotrophines afin de reproduire une « minipuberté » physiologique, pourraient favoriser le déclenchement de la spermatogenèse et le maintien de la fertilité à l’âge adulte. Dans le contexte de l’inquiétude liée à une baisse possible de la fertilité masculine dans l’avenir, le cas de ce patient est remarquable par la persistance de la fertilité potentielle, en dépit de l’effondrement de la fonction de sa LH et du nombre très réduit de cellules de Leydig productrices de testostérone.
La connaissance des variations du microenvironnement hormonal testiculaire tout au long de la vie et de leurs conséquences sur le déclenchement et le maintien de la spermatogenèse chez l’adulte est essentielle. Ceci peut conduire à l’amélioration des stratégies de traitement des infertilités masculines qui tiendraient compte de la physiologie, mais également au développement de méthodes efficaces de contraception masculine dont les échecs actuels sont liés à la difficile maîtrise d’un processus mal compris.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Références
- McLachlan RI, O’Donnell L, Meachem SJ, et al. Identification of specific sites of hormonal regulation in spermatogenesis in rats, monkeys, and man. Recent Prog Horm Res 2002 ; 57 : 149-79. [Google Scholar]
- Kamischke A, Nieschlag E. Progress towards hormonal male contraception. Trends Pharmacol Sci 2004 ; 25 : 49-57. [Google Scholar]
- Meduri G, Bachelot A, Cocca MP, et al. Molecular pathology of the FSH receptor: new insights into FSH physiology. Mol Cell Endocrinol 2008 ; 282 : 130-42. [Google Scholar]
- Weiss J, Axelrod L, Whitcomb RW, et al. Hypogonadism caused by a single amino acid substitution in the β-subunit of luteinizing hormone. N Engl J Med 1992 ; 326 : 179-83. [Google Scholar]
- Axelrod L, Neer RM, Kliman B. Hypogonadism in a male with immunologically active, biologically inactive luteinizing hormone: an exception to a venerable rule. J Clin Endocrinol Metab 1979 ; 48 : 279-87. [Google Scholar]
- Valdes-Socin H, Salvi R, Daly AF, et al. Hypogonadism in a patient with a mutation in the luteinizing β-subunit gene. N Engl J Med 2004 ; 351 : 2619-25. [Google Scholar]
- Lofrano-Porto A, Barra GB, Giacomini LA, et al. Luteinizing hormone β mutation and hypogonadism in men and woman. N Engl J Med 2007 ; 357 : 897-904. [Google Scholar]
- Wu X, Wan S, Lee MM. Key factors in the regulation of fetal and postnatal Leydig cell development. J Cell Physiol 2007 ; 213 : 429-33. [Google Scholar]
- Achard C, Courtillot C, Lahuna O, et al. Quantitatively normal spermatogenesis in familial hypogonadism with mutation of the Beta subunit of luteinizing hormone. N Engl J Med 2009 ; 361 : 1856-63. [Google Scholar]
- Bougneres P, Francois M, Pantalone L, et al. Effects of an early postnatal treatment of hypogonadotropic hypogonadism with a continuous subcutaneous infusion of recombinant follicle-stimulating hormone and luteinizing hormone. J Clin Endocrinol Metab 2008 ; 93 : 2202-5. [Google Scholar]
© 2010 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1 Contrôle de la spermatogenèse. A. Contrôle hormonal. La GnRH produite par l’hypothalamus stimule la production des gonadotrophines LH et FSH par l’hypophyse. La LH induit la prolifération et la maturation des cellules de Leydig interstitielles qui vont sécréter la testostérone. La FSH agit sur les cellules de Sertoli des tubes séminifères. En conjonction avec la testostérone, ces deux hormones vont stimuler la prolifération et la maturation des cellules de la lignée germinale dans les tubes séminifères où seront sécrétés les spermatozoïdes matures. B. Vagues de prolifération des cellules de Leydig. Chaque vague s’accompagne d’une élévation du taux de testostérone plasmatique. La première vague (1), anténatale, est induite par l’hCG placentaire. Elle est indispensable au développement et à la masculinisation des organes génitaux internes et externes. Après la naissance, la LH joue un rôle essentiel dans le déclenchement des vagues de prolifération des cellules de Leydig. La vague néonatale (2) ou « minipuberté » et la vague pubertaire chez l’adolescent (3) sont dues à l’activation de l’axe gonadique, c’està-dire la sécrétion de GnRH et donc de LH et FSH hypophysaires. En période néonatale, cette activation est transitoire (adapté de [2]). |
| Dans le texte | |
 |
Figure 2 Études histologique et immunocytochimique du testicule chez un patient avec un déficit génétique partiel en LHβ. A. Coloration hématoxyline éosine : amas de cellules de Leydig matures avec noyaux ronds et cytoplasme abondant, riche en gouttelettes lipidiques (flèche) entre deux tubules séminifères (x 20). B. Immunomarquage avec un anticorps dirigé contre l’enzyme de la stéroïdogenèse P450c17α hydroxylase-17,20-lyase : les cellules de Leydig matures présentes entre les tubules séminifères (flèches) expriment l’enzyme-clé de la synthèse des androgènes (x 20). C. Coloration hématoxyline éosine : fort grossissement d’une section de tubule séminifère. Dans la lumière sont clairement visibles des cellules germinales à tous les stades de maturation, du stade de spermatogonie (flèche épaisse) au stade de spermatide allongé (flèche) avant leur libération dans la lumière du tube séminifère (LB : lame basale, x 40). D. Immunomarquage avec un anticorps dirigé contre le récepteur des androgènes : les noyaux des cellules de Sertoli à l’intérieur du tubule séminifère sont marqués. Ceci explique l’action paracrine de la testostérone sécrétée par les cellules de Leydig interstitielles qui, en synergie avec la FSH, stimulera la maturation des cellules germinales (x 20). E, F. Les cellules germinales chez le patient expriment deux marqueurs spécifiques : l’histone H1 (E) qui marque les cellules germinales à partir du stade de spermatide, et la proacrosine (F), exprimée par les cellules germinales méiotiques et post-méiotiques, confirmant le stade avancé de maturation de la lignée germinale chez ce patient (respectivement x 20 et x 100). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




