| Issue |
Med Sci (Paris)
Volume 22, Number 10, Octobre 2006
|
|
|---|---|---|
| Page(s) | 804 - 806 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20062210804 | |
| Published online | 15 October 2006 | |
NEDD1 et les complexes de nucléation des microtubules : recruter pour mieux organiser
NEDD1 and microtubule nucleation complexes: to recruit for better organizing
UMR 2587, CNRS-Pierre Fabre, ISTMT, 3, rue des Satellites, 31400 Toulouse, France
Le cytosquelette microtubulaire fournit à la cellule un réseau vital le long duquel se déplacent molécules et organites. Il permet la polarisation de la cellule, son mouvement et la ségrégation des chromosomes lors de la division cellulaire. Les microtubules sont des structures cylindriques formées de dimères de tubulines α/β, de 25 nm de diamètre et pouvant atteindre des dizaines de micromètres. In vitro, leur assemblage commence par une étape limitante appelée « nucléation » [1] : elle correspond à la formation de petites amorces de microtubules suffisamment stables pour permettre une élongation rapide. Dans la cellule, la nucléation est induite par des complexes protéiques spécialisés. Ces complexes sont concentrés au niveau du centrosome, un organite situé au centre de la cellule à partir duquel le réseau de microtubules va s’organiser. Le centrosome est composé de deux centrioles, eux-mêmes constitués de courts microtubules, entourés d’une matrice dense (ou matériel péricentriolaire) où sont ancrés les complexes de nucléation. Le cytosquelette microtubulaire est dynamique et son organisation tridimensionnelle varie au cours de la progression dans le cycle de division (Figure 1). Comme l’ADN, les centrioles se dupliquent en interphase pour former deux centrosomes qui vont se positionner de part et d’autre du cytoplasme lorsque la cellule entre en mitose. Leur capacité à nucléer les microtubules augmente suite à un recrutement intense des complexes de nucléation. Les deux centrosomes « matures » initient alors l’assemblage d’un fuseau mitotique bipolaire, formant deux pôles de nucléation à partir desquels les microtubules croissent en direction des chromosomes. La bipolarité du fuseau mitotique est essentielle pour assurer la capture efficace des chromosomes par les microtubules et leur ségrégation correcte vers chaque pôle de la cellule, puis dans les deux cellules filles. En mitose, les complexes de nucléation sont également recrutés le long des microtubules du fuseau [2–4].
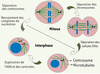 |
Figure 1. Le centrosome : centre organisateur des microtubules cellulaires. Le centrosome est constitué de deux centrioles entourés du matériel péricentriolaire où sont nucléés les microtubules. Le centrosome se dédouble en interphase : les centrioles se dupliquent pour former deux nouveaux centrosomes composés chacun d’un centriole parent et d’un centriole néoformé (en rouge). Dès l’entrée en mitose, les deux centrosomes se séparent et recrutent activement les complexes de nucléation pour former le fuseau mitotique. |
Les complexes de nucléation contiennent une troisième forme de tubuline : la tubuline γ, associée à au moins cinq autres protéines appelées « GCP » (gamma complex proteins). Ils contiennent 10 à 14 molécules de tubuline γ, qui représente presque un tiers de leur masse, et ont, en microscopie électronique, une forme de bague de 25 nm de diamètre, avec une face fermée probablement constituée des GCP et une face ouverte exposant les molécules de tubuline γ (Figure 2). Il est proposé que ces complexes agissent directement comme amorces de nucléation, facilitant l’assemblage des tubulines α/β au niveau des molécules de tubuline γ et imposant la structure cylindrique [5]. En raison de leur forme caractéristique, les complexes de nucléation ont été appelés « γ TuRC » (γ tubulin ring complexes).
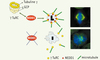 |
Figure 2. Les complexes de nucléation sont recrutés au centrosome via NEDD1. Les γTuRC sont des complexes en forme de bague composés de tubuline γ et de protéines associées ou GCP, dont NEDD1. NEDD1 est nécessaire au recrutement des γTuRC au centrosome : en l’absence de la protéine, les γTuRC sont délocalisés dans le cytoplasme. En conséquence, les cellules se bloquent en mitose. Les centrosomes sont souvent désorganisés avec un seul centriole non dupliqué. Les fuseaux mitotiques sont aberrants, visualisés ici par imunofluorescence : en vert, les microtubules ; en rouge, NEDD1 ; en bleu, les chromosomes. |
Récemment, un nouveau composant du γ TuRC a été identifié chez la drosophile [6, 7]. Nous avons caractérisé son homologue humain : la protéine NEDD1 (neural precursor cell expressed, developmentally downregulated 1) [3]. NEDD1 se distingue des autres GCP par la présence d’un domaine de type WD (domaines d’interactions protéine-protéine). Pour étudier sa fonction, nous avons inhibé l’expression de la protéine dans des lignées cellulaires en culture, par la technique de l’ARN interférence. En l’absence de NEDD1, les microtubules ne sont pas correctement organisés à partir du centrosome. Les γ TuRC sont toujours formés mais ils ne sont plus localisés au centrosome. Au contraire, lorsque la tubuline γ est inhibée, les γ TuRC ne sont plus assemblés mais NEDD1 est toujours localisée au centrosome. Nos résultats montrent que la protéine NEDD1 sert de médiateur pour le recrutement des γ TuRC au centrosome et que ce recrutement est nécessaire pour l’activité de nucléation du centrosome. NEDD1 est elle-même adressée au centrosome via son domaine WD et nous recherchons actuellement des protéines susceptibles d’interagir avec ce domaine. La déplétion de NEDD1, comme celle de la tubuline γ, induit un blocage des cellules en mitose avec des fuseaux mitotiques aberrants. Les microtubules sont fortement désorganisés et les centrosomes ne sont pas correctement séparés, entraînant une perte de la bipolarité (Figure 2). De plus, la structure même des centrosomes est affectée. Ils ne contiennent souvent qu’un seul centriole qui n’a pas été dupliqué en interphase. Ainsi, le recrutement des γ TuRC au centrosome est crucial pour la duplication des centrioles et l’assemblage du fuseau mitotique. Un travail parallèle réalisé par l’équipe de T. Stearns [4] montre que l’organisation du fuseau mitotique dépend également de la présence des γ TuRC le long des microtubules. Celle-ci nécessite la phosphorylation de NEDD1 en début de mitose. Il est fort probable que les complexes de nucléation centrosomiques servent à assembler, ancrer et stabiliser les microtubules du fuseau, tandis qu’une nucléation secondaire le long des microtubules pourrait permettre de former de nouveaux microtubules venant renforcer la structure du fuseau [8]. En l’absence de ces fonctions, une déstabilisation et/ou une perte de microtubules peut expliquer la mauvaise séparation des centrosomes et la désorganisation du fuseau mitotique.
La duplication des centrioles et l’assemblage du fuseau mitotique sont des étapes clés du cycle cellulaire dont les dérégulations sont associées au cancer. Les complexes de nucléation des microtubules sont essentiels pour ces deux processus. De plus, ils constituent des cibles anticancéreuses potentielles : comme on le voit ici, leur inhibition ou leur délocalisation conduit au blocage des cellules en mitose. Les agents antimitotiques utilisés à ce jour en chimiothérapie, comme les taxoïdes ou les alcaloïdes de la vinca, ciblent tous la dynamique des microtubules. Des molécules intervenant différemment sur le cytosquelette microtubulaire pourraient constituer de nouveaux anticancéreux originaux.
Remerciements
Nous remercions Michel Wright et Andreas Merdes pour leur participation à l’étude de NEDD1.
Références
- Job D, Valiron, O, Oakley, B. Microtubule nucleation. Curr Opin Cell Biol 2003; 15 :111–7. [Google Scholar]
- Lajoie-Mazenc I, Tollon, Y, Detraves, C,et al. Recruitment of antigenic gamma-tubulin during mitosis in animal cells: presence of gamma-tubulin in the mitotic spindle. J Cell Sci 1994; 107 : 2825–37. [Google Scholar]
- Haren L, Remy, MH, Bazin, I,et al. NEDD1-dependent recruitment of the gamma-tubulin ring complex to the centrosome is necessary for centriole duplication and spindle assembly. J Cell Biol 2006; 172 : 505–15. [Google Scholar]
- Luders J, Patel, UK, Stearns, T. GCP-WD is a gamma-tubulin targeting factor required for centrosomal and chromatin-mediated microtubule nucleation. Nat Cell Biol 2006; 8 : 137–47. [Google Scholar]
- Moritz M, Braunfeld, MB, Guenebaut, V, et al. Structure of the gamma-tubulin ring complex: a template for microtubule nucleation. Nat Cell Biol 2000; 2 : 365–70. [Google Scholar]
- Gunawardane RN, Martin OC, Zheng Y. Characterization of a new gamma TuRC subunit with WD repeats. Mol Biol Cell 2003; 14 : 1017–26. [Google Scholar]
- Verollet C, Colombie, N, Daubon, T, et al. Drosophila melanogaster gamma-TuRC is dispensable for targeting gamma-tubulin to the centrosome and microtubule nucleation. J Cell Biol 2006; 172 : 517–28. [Google Scholar]
- Mahoney NM, Goshima, G, Douglass, AD, et al. Making microtubules and mitotic spindles in cells without functional centrosomes. Curr Biol 2006; 16 : 564–9. [Google Scholar]
© 2006 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Le centrosome : centre organisateur des microtubules cellulaires. Le centrosome est constitué de deux centrioles entourés du matériel péricentriolaire où sont nucléés les microtubules. Le centrosome se dédouble en interphase : les centrioles se dupliquent pour former deux nouveaux centrosomes composés chacun d’un centriole parent et d’un centriole néoformé (en rouge). Dès l’entrée en mitose, les deux centrosomes se séparent et recrutent activement les complexes de nucléation pour former le fuseau mitotique. |
| Dans le texte | |
 |
Figure 2. Les complexes de nucléation sont recrutés au centrosome via NEDD1. Les γTuRC sont des complexes en forme de bague composés de tubuline γ et de protéines associées ou GCP, dont NEDD1. NEDD1 est nécessaire au recrutement des γTuRC au centrosome : en l’absence de la protéine, les γTuRC sont délocalisés dans le cytoplasme. En conséquence, les cellules se bloquent en mitose. Les centrosomes sont souvent désorganisés avec un seul centriole non dupliqué. Les fuseaux mitotiques sont aberrants, visualisés ici par imunofluorescence : en vert, les microtubules ; en rouge, NEDD1 ; en bleu, les chromosomes. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




