| Issue |
Med Sci (Paris)
Volume 22, Number 10, Octobre 2006
|
|
|---|---|---|
| Page(s) | 801 - 802 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20062210801 | |
| Published online | 15 October 2006 | |
Dissection fonctionnelle d’un nouveau régulateur de l’initiation de la réplication du chromosome bactérien
Functional dissection of a new regulator of DNA replication initiation in bacteria
Unité Génétique Microbienne, Bâtiment 440, Inra, Domaine de Vilvert, 78352 Jouy-en-Josas Cedex, France
Chez tous les organismes vivants, l’initiation de la réplication est une étape centrale du cycle cellulaire. Chez les bactéries, la réplication du chromosome est un processus hautement régulé de telle sorte que chaque origine de réplication n’est initiée qu’une seule fois par cycle cellulaire. Chez la bactérie modèle E. coli, différents mécanismes de contrôle s’exercent sur la protéine initiatrice DnaA [1]. Chez la bactérie à Gram positif B. subtilis, la protéine YabA, premier régulateur potentiel de l’initiation, a été identifiée dans un réseau d’interactions spécifiques généré par double hybride chez la levure, et centré autour de la machinerie de réplication [2]. YabA interagit avec l’initiateur DnaA, et avec DnaN, la sous-unité α de l’ADN polymérase. DnaA, est conservé chez tous les organismes eubactériens. Elle se fixe sur la séquence origine du chromosome (OriC) [3]. DnaN est également présent dans l’ensemble des procaryotes. Il forme un dimère qui encercle l’ADN, maintient un contact entre l’ADN polymérase et sa matrice d’ADN, augmentant ainsi sa processivité [4]. Dans le contexte de ses interactions, la protéine YabA apparaît donc comme un lien fonctionnel entre l’initiation et l’élongation de la réplication. YabA, DnaA et DnaN ont été purifiés in vitro et l’existence des interactions binaires entre YabA/DnaA et YabA/DnaN a été démontrée [5]. Ces trois protéines forment également un complexe tripartite in vitro, en accord avec les observations réalisées chez la levure [2, 5]. Ces résultats ont permis de proposer qu’un tel complexe puisse se former et exercer une fonction dans la cellule de B. subtilis. Cependant, dans le réseau d’interactions, YabA possède trois partenaires supplémentaires qui sont impliqués dans différentes voies métaboliques. YabA interagit avec TlpA et McpA, deux composants du complexe chimiotactique, et avec AcuB, une enzyme du métabolisme de l’acétoïne. Ces observations suggèrent que YabA pourrait assurer d’autres fonctions dans la cellule.
Chez B. subtilis, nous avons montré, par des approches de cytométrie de flux et de visualisation des origines par microscopie à épifluorescence, que la délétion du gène yabA se traduisait par une sur-initiation et par une augmentation du contenu en ADN des nucléotides [5]. Ces phénotypes sont caractéristiques d’une perturbation du contrôle de la réplication. En utilisant un dérivé fonctionnel étiqueté par la GFP (green fluorescent protein), nous avons montré que YabA se localisait au centre de la cellule et était associée à la machinerie de réplication durant une grande partie du cycle cellulaire. Cependant, le contexte des interactions multiples de YabA illustre sa nature multifonctionnelle, et ne permet pas d’établir une relation directe entre une interaction en particulier et son activité biologique. L’étude du rôle de yabA dans le contrôle de l’initiation ne peut pas se faire simplement en étudiant le phénotype associé à la délétion du gène qui aboutit à la rupture de toutes ses interactions dans la cellule.
Pour aborder cette question, nous avons utilisé une approche de dissection fonctionnelle par la rupture sélective des interactions de YabA. L’approche consiste à isoler des mutations dans YabA qui rompent son interaction avec un partenaire en particulier sans affecter les autres, par un test dérivé du double hybride chez la levure. Les mutations sont ensuite transférées dans B. subtilis, afin d’en étudier les effets sur sa localisation subcellulaire et sur les phénotypes liés à l’asynchronie et la sur-initiation de la réplication. L’identification et la cartographie des mutations d’interaction, correspondant au changement d’un seul acide aminé, mettent en évidence les éléments structuraux de YabA qui sont essentiels pour les interactions (Figure 1B). L’analyse de ces mutations sur la fonction de YabA montre que la perte de son interaction avec DnaA ou avec DnaN dans les mutants YabA-Aim et YabA-Nim, respectivement, se traduit par la perte de sa localisation dans la cellule (Figure 2A), et par une sur-initiation et une asynchronie de la réplication [5]. Nous avons montré que les mutants YabA-Aim et -Nim étaient capables de former un hétérocomplexe fonctionnel avec la protéine YabA sauvage, indiquant que les mutations n’affectaient pas la structure globale de la protéine. Enfin, la co-expression dans la cellule des deux mutants Aim et Nim se traduit par leur re-localisation au centre de la cellule, et par le rétablissement du contrôle de l’initiation, illustrant une complémentation fonctionnelle (Figure 2B). L’ensemble de ces résultats indique que YabA agit sur le contrôle négatif de l’initiation de la réplication en formant, avec DnaA et DnaN, un hétérocomplexe fonctionnel associé à la machinerie de réplication. Bien que le mécanisme biochimique de ce contrôle ne soit pas encore élucidé, cette découverte constitue une avancée dans la compréhension des processus qui coordonnent la réplication du chromosome et le cycle cellulaire. YabA est très conservé dans le groupe des bactéries à Gram positif qui inclut des pathogènes majeurs de l’homme comme Staphylococcus aureus et S. pneumoniae.
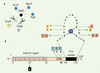 |
Figure 1. Isolement et cartographie de mutants de perte d’interaction de YabA. A. Contexte des inter-actions de YabA et schéma de rupture sélective d’interactions avec DnaA et DnaN. B. YabA (119 aa) est organisé en deux domaines structuraux. La moitié amino-terminale de la protéine comporte une signature de type leucine-zipper. La position des leucines est indiquée par les barres verticales grises. La partie carboxy-terminale de YabA comporte trois cystéines potentiellement impliquées dans une structure de type zinc cluster qui résulterait de la dimérisation de la protéine, et au sein de laquelle deux atomes de zinc seraient coordonnés par six résidus cystéines. Un seul monomère de YabA est ici représenté. Les lettres correspondent aux acides aminés. Les résidus impliqués dans les interactions sont signalés par les flèches et la substitution associée est indiquée par un rectangle et un code couleur jaune (DnaN), bleu clair (DnaA), orange (DnaA et DnaN) et noir (YabA). Les mutations d’interaction à DnaA et à DnaN affectent des résidus localisés à la base et dans la boucle du zinc cluster, respectivement. Les substitutions des résidus cystéines du zinc cluster affectent à la fois l’interaction à DnaA et DnaN, indiquant que cette structure est cruciale pour ces deux interactions. La substitution L27A se traduit par la perte de la capacité de YabA à auto-interagir et à interagir avec l’ensemble de ses partenaires. Ces résultats traduisent l’importance de l’intégrité de la structure du leucine zipper pour la multimérisation de YabA et la formation du zinc cluster, essentiels pour les interactions. |
 |
Figure 2. Effet des mutations de rupture d’interaction sur la localisation subcellulaire de yabA. A. YabA et ses dérivés sont étiquetés par la YFP ou la CFP et exprimés dans B. subtilis. Les observations sont réalisées par microscopie à épifluorescence sur cellules vivantes. YabA localise de façon réplisomale en formant un focus au centre de la cellule. L’introduction des mutations de perte d’interaction à DnaN (Nim) et à DnaA (Aim) se traduit par la perte de la capacité à former des focus et la localisation devient diffuse dans la cellule. B. Restauration de la localisation par complémentation entre yabA Aim et Nim. La co-expression dans la cellule d’un YFP-YabA et d’un mutant CFP-Nim s’accompagne de la re-localisation du mutant Nim, indiquant que ce dérivé muté participe à la formation d’un hétérocomplexe fonctionnel avec la protéine YabA sauvage. La co-expression des deux mutants CFP-Nim et YFP-Aim complémente leur déficience pour la localisation et restaure la formation de focus par le complexe YabA/DnaA/DnaN au centre le la cellule. |
Dans la cellule, la plupart des protéines remplissent leur(s) fonction(s) en interagissant avec d’autres protéines [6–8]. La compréhension du rôle d’une protéine passe donc par l’identification de toutes les interactions qu’elle forme avec ses différents partenaires au cours du cycle cellulaire. Notre stratégie de dissection fonctionnelle de YabA nous a permis d’établir une relation directe entre les interactions présentes dans le complexe YabA/DnaA/DnaN et sa fonction dans la cellule. Cette approche, applicable à tout couple d’interaction, est générique, et permet, en identifiant des mutations de perte d’interaction spécifique, d’appréhender l’ensemble des fonctions exercées par une protéine dans la cellule.
Références
- Boye E, Lobner-Olesen A, Skarstad K. Limiting DNA replication to once and only once. EMBO Rep 2000;1 : 479–83. [Google Scholar]
- Noirot-Gros MF, Dervyn E, Wu LJ, et al. An expanded view of bacterial DNA replication. Proc Natl Acad Sci USA 2002; 99 : 8342–7. [Google Scholar]
- Cunningham EL, Berger JM. Unraveling the early steps of prokaryotic replication. Curr Opin Struct Biol 2005;15 : 68–76. [Google Scholar]
- Johnson A, O’Donnell M. Cellular DNA replicases: components and dynamics at the replication fork. Annu Rev Biochem 2005; 74 : 283–315. [Google Scholar]
- Noirot-Gros MF, Velten M, Yoshimura M, et al. Functional dissection of YabA, a negative regulator of DNA replication initiation in Bacillus subtilis. Proc Natl Acad Sci USA 2006; 103 : 2368–73. [Google Scholar]
- Li S, Armstrong CM, Bertin N, et al. A map of the interactome network of the metazoan C. elegans. Science 2004; 2 : 2. [Google Scholar]
- Noirot P, Noirot-Gros MF. Protein interaction networks in bacteria. Curr Opin Microbiol 2004; 7 : 505–12. [Google Scholar]
- Ito T, Chiba T, Ozawa R, et al. A comprehensive two-hybrid analysis to explore the yeast protein interactome. Proc Natl Acad Sci USA, 2001; 98 : 4569–74. [Google Scholar]
© 2006 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Isolement et cartographie de mutants de perte d’interaction de YabA. A. Contexte des inter-actions de YabA et schéma de rupture sélective d’interactions avec DnaA et DnaN. B. YabA (119 aa) est organisé en deux domaines structuraux. La moitié amino-terminale de la protéine comporte une signature de type leucine-zipper. La position des leucines est indiquée par les barres verticales grises. La partie carboxy-terminale de YabA comporte trois cystéines potentiellement impliquées dans une structure de type zinc cluster qui résulterait de la dimérisation de la protéine, et au sein de laquelle deux atomes de zinc seraient coordonnés par six résidus cystéines. Un seul monomère de YabA est ici représenté. Les lettres correspondent aux acides aminés. Les résidus impliqués dans les interactions sont signalés par les flèches et la substitution associée est indiquée par un rectangle et un code couleur jaune (DnaN), bleu clair (DnaA), orange (DnaA et DnaN) et noir (YabA). Les mutations d’interaction à DnaA et à DnaN affectent des résidus localisés à la base et dans la boucle du zinc cluster, respectivement. Les substitutions des résidus cystéines du zinc cluster affectent à la fois l’interaction à DnaA et DnaN, indiquant que cette structure est cruciale pour ces deux interactions. La substitution L27A se traduit par la perte de la capacité de YabA à auto-interagir et à interagir avec l’ensemble de ses partenaires. Ces résultats traduisent l’importance de l’intégrité de la structure du leucine zipper pour la multimérisation de YabA et la formation du zinc cluster, essentiels pour les interactions. |
| Dans le texte | |
 |
Figure 2. Effet des mutations de rupture d’interaction sur la localisation subcellulaire de yabA. A. YabA et ses dérivés sont étiquetés par la YFP ou la CFP et exprimés dans B. subtilis. Les observations sont réalisées par microscopie à épifluorescence sur cellules vivantes. YabA localise de façon réplisomale en formant un focus au centre de la cellule. L’introduction des mutations de perte d’interaction à DnaN (Nim) et à DnaA (Aim) se traduit par la perte de la capacité à former des focus et la localisation devient diffuse dans la cellule. B. Restauration de la localisation par complémentation entre yabA Aim et Nim. La co-expression dans la cellule d’un YFP-YabA et d’un mutant CFP-Nim s’accompagne de la re-localisation du mutant Nim, indiquant que ce dérivé muté participe à la formation d’un hétérocomplexe fonctionnel avec la protéine YabA sauvage. La co-expression des deux mutants CFP-Nim et YFP-Aim complémente leur déficience pour la localisation et restaure la formation de focus par le complexe YabA/DnaA/DnaN au centre le la cellule. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




